人羊膜上皮细胞外泌体在制备修复卵巢功能药物中的应用的制作方法
本发明涉及生物医药技术领域,具体地说,涉及人羊膜上皮细胞外泌体在制备修复卵巢功能药物中的应用。
背景技术:
人羊膜属于胎儿附属物,是胎盘发育的早期产物,主要由上皮层、基底膜、致密层、纤维母细胞层和海绵层组成。人羊膜上皮细胞(humanamnioticepithelialcells,haecs)来源于上皮层,是由胚泡内细胞团发育而来。近年来研究表明,haecs具有部分胚胎干细胞特性,在特定条件下,可向3个胚层不同类型的细胞分化。而且,haecs具有免疫耐受、低免疫原性和非致瘤性等优良特点,并兼有旁分泌功能,可分泌多种生长因子、神经营养因子和抗炎因子。因此,haecs是干细胞治疗和再生医学领域的理想种子细胞资源。目前在haecs治疗神经系统疾病、心脏疾病、肝脏疾病、肺脏疾病、卵巢早衰以及修复皮肤缺损和抗肿瘤方面均有研究。
外泌体是指包含了复杂rna和蛋白质的小膜泡(30-150nm),现今,其特指直径在40-100nm的盘状囊泡。外泌体的提取主要包括以下几种方式:超速离心法、过滤离心法、密度梯度离心法、免疫磁珠法、ps亲和法和色谱法。人体内多种细胞及体液均可分泌外泌体,包括内皮细胞、免疫细胞、血小板、平滑肌细胞等。外泌体可通过其携带的蛋白质、核酸、脂类等来调节受体细胞的生物学活性。
期刊《中国细胞生物学学报》2018年第08期刊出的论文“人羊膜上皮干细胞来源的外泌体促进小鼠神经干细胞向神经元方向分化”,公开了首次发现haecs能促进小鼠nscs向神经元方向分化。具体地,首先采用超速离心的方法得到了纯度较高的haecs-exos,然后将不同浓度的haecs-exos与mnscs共培养。结果发现,与没有haecs-exos的对照组相比,200ng/mlhaecs-exos能明显促进小鼠nscs向成熟神经元分化,主要表现在neun阳性细胞所占比例明显增高。研究者推测,haecs-exos保留了haecs的一些特性,其含有的神经营养因子、生长因子、mirnas等活性物质可能参与了微环境的调控,从而促进mnscs向神经元方向分化。因此,haecs-exos可能促进内源或外源nscs的神经分化,从而促进损伤或退化神经元的再生。
然而,目前还未见人羊膜上皮细胞外泌体用于修复卵巢功能的报道。
技术实现要素:
本发明针对现有技术中的不足,第一方面提供了人羊膜上皮细胞外泌体在制备修复卵巢功能药物中的应用。
作为一个优选例,所述的修复卵巢功能指修复化疗损伤后的卵巢功能、减轻化疗药物对卵巢的损伤、防治化疗药物引起的卵巢早衰或防治化疗引起的不孕不育。
作为另一优选例,所述的人羊膜上皮细胞外泌体制备方法为:
(1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化10-15min分离出人羊膜上皮细胞,重悬于含有胎牛血清的dmem/f12培养基中,接种于细胞培养皿中后置于含有5%co2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁细胞2-3min并重悬于含有胎牛血清的dmem/f12培养基中,重新调整细胞密度并接种于细胞培养皿中,放置于含有5%co2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80%时,吸出含血清的完全培养基,用pbs缓慢洗涤2-3次后更换无血清的dmem/f12培养基培养;20小时后,缓慢地将培养基吸出,在1500-2500g条件下离心20-40min收集上清,并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基;
(2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。
作为另一优选例,所述的人羊膜上皮细胞外泌体制备方法为:
(1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化12min分离出人羊膜上皮细胞,重悬于含有胎牛血清的dmem/f12培养基中,接种于细胞培养皿中后置于含有5%co2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁细胞2min并重悬于含有胎牛血清的dmem/f12培养基中,重新调整细胞密度并接种于细胞培养皿中,放置于含有5%co2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80%时,吸出含血清的完全培养基,用pbs缓慢洗涤3次后更换无血清的dmem/f12培养基培养;24小时后,缓慢地将培养基吸出,在2000g条件下离心30min收集上清,并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基;
(2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。
本发明第二方面提供了一种人羊膜上皮细胞外泌体,所述的人羊膜上皮细胞外泌体的制备方法为:
(1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化10-15min分离出人羊膜上皮细胞,重悬于含有胎牛血清的dmem/f12培养基中,接种于细胞培养皿中后置于含有5%co2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁细胞2-3min并重悬于含有胎牛血清的dmem/f12培养基中,重新调整细胞密度并接种于细胞培养皿中,放置于含有5%co2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80%时,吸出含血清的完全培养基,用pbs缓慢洗涤2-3次后更换无血清的dmem/f12培养基培养;20小时后,缓慢地将培养基吸出,在1500-2500g条件下离心20-40min收集上清,并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基;
(2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。
作为一个优选例,所述的人羊膜上皮细胞外泌体的制备方法为:
(1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化12min分离出人羊膜上皮细胞,重悬于含有胎牛血清的dmem/f12培养基中,接种于细胞培养皿中后置于含有5%co2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁细胞2min并重悬于含有胎牛血清的dmem/f12培养基中,重新调整细胞密度并接种于细胞培养皿中,放置于含有5%co2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80%时,吸出含血清的完全培养基,用pbs缓慢洗涤3次后更换无血清的dmem/f12培养基培养;24小时后,缓慢地将培养基吸出,在2000g条件下离心30min收集上清,并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基;
(2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。
本发明第三方面提供了一种人羊膜上皮细胞外泌体的制备方法,所述的制备方法包括以下步骤:
(1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化10-15min分离出人羊膜上皮细胞,重悬于含有胎牛血清的dmem/f12培养基中,接种于细胞培养皿中后置于含有5%co2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁细胞2-3min并重悬于含有胎牛血清的dmem/f12培养基中,重新调整细胞密度并接种于细胞培养皿中,放置于含有5%co2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80%时,吸出含血清的完全培养基,用pbs缓慢洗涤2-3次后更换无血清的dmem/f12培养基培养;20小时后,缓慢地将培养基吸出,在1500-2500g条件下离心20-40min收集上清,并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基;
(2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。
作为一个优选例,所述的制备方法包括以下步骤:
(1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化12min分离出人羊膜上皮细胞,重悬于含有胎牛血清的dmem/f12培养基中,接种于细胞培养皿中后置于含有5%co2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁细胞2min并重悬于含有胎牛血清的dmem/f12培养基中,重新调整细胞密度并接种于细胞培养皿中,放置于含有5%co2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80%时,吸出含血清的完全培养基,用pbs缓慢洗涤3次后更换无血清的dmem/f12培养基培养;24小时后,缓慢地将培养基吸出,在2000g条件下离心30min收集上清,并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基;
(2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。
本发明第四方面提供了mir-1246在制备修复卵巢功能药物中的应用。
作为一个优选例,所述的修复卵巢功能指修复化疗损伤后的卵巢功能、减轻化疗药物对卵巢的损伤、防治化疗药物引起的卵巢早衰或防治化疗引起的不孕不育。
本发明优点在于:
1、本发明首次证实人羊膜上皮细胞外泌体具有修复化疗损伤后卵巢功能的作用,能减轻化疗药物对卵巢功能的损坏程度,效果优于人羊膜上皮细胞条件性培养基。
2、本发明优化了人羊膜上皮细胞外泌体的制备方法,获得了显著增加各级卵泡数量的外泌体。
3、本发明证实人羊膜上皮细胞外泌体中mir-1246能够显著抑制化疗药物诱导的颗粒细胞凋亡,具有修复化疗损伤后卵巢功能的作用。
附图说明
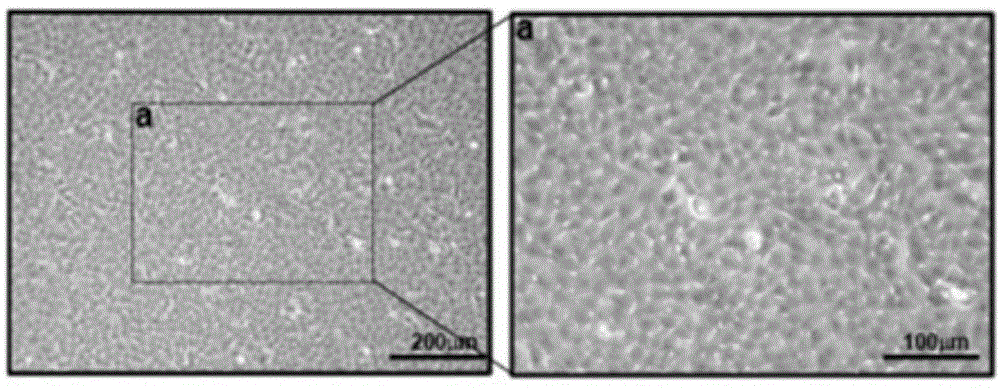
图1-6.人羊膜上皮细胞条件性培养基中外泌体鉴定及动物实验设计。图1:显微镜下人羊膜上皮细胞的形态学观察。图2:流式细胞术对人羊膜上皮细胞表面干细胞特异性蛋白ssea4以及上皮细胞特异性蛋白cd324的表达进行检测。图3:通过电镜对人羊膜上皮细胞来源外泌体的形态学进行观察。图4:westernblot检测人羊膜上皮细胞外泌体中外泌体特异性蛋白cd63及cd9的表达情况。图5:nanosight分析人羊膜上皮细胞外泌体的粒径大小及浓度。图6:人羊膜上皮细胞外泌体提取流程图及后续动物实验设计。
图7-8.人羊膜上皮细胞外泌体移植对化疗诱导的卵巢早衰小鼠卵泡发育及卵巢功能的影响。图7:在移植后第4周,通过苏木素-伊红染色对不同处理组中的卵泡形态学进行观察。图8:不同处理组中各级卵泡计数情况(包括始基卵泡、初级卵泡、次级卵泡、成熟卵泡)。
图9-13.人羊膜上皮细胞外泌体对化疗后卵巢血管及颗粒细胞功能的影响。图9:卵巢切片上细胞增殖标记物edu以及血管内皮特异性标记cd34的免疫荧光染色。图10:不同处理组中edu以及cd34阳性细胞计数。图11:tunel染色检测凋亡细胞的组织定位情况。图12:qrt-pcr检测卵丘扩张基因has2以及ptx3表达水平。图13:westernblot检测损伤卵巢组织中凋亡特异性蛋白caspase3的表达情况。
图14-16.人羊膜上皮细胞外泌体对化疗诱导原始卵泡激活的影响。图14:在人羊膜上皮细胞外泌体移植后第7天,通过苏木素-伊红染色对损伤卵巢切片中的卵泡形态学进行观察。图15:不同处理组中各级卵泡包括原始卵泡、初级卵泡、次级卵泡以及成熟卵泡的计数分析。图16:westernblot检测不同处理组中pi3k/akt/mtor信号通路中关键蛋白的表达情况。
图17-18.人羊膜上皮细胞外泌体中microrna检测。图17:在5例健康足月产妇人羊膜细胞来源外泌体中,表达丰度较高的前50种microrna名称。
图18:qrt-pcr检测人羊膜上皮细胞外泌体中microrna的表达情况。
图19-24.人羊膜上皮细胞外泌体对颗粒细胞凋亡的体外分析。图19:pkh26荧光染料对人羊膜上皮细胞进行标记。图20:提取pkh26标记的人羊膜上皮细胞外泌体,并将其添加到颗粒细胞的培养基中24小时后,颗粒细胞进行actin-tracker及dapi免疫荧光染色,通过激光共聚焦显微镜在颗粒细胞中观察pkh26红色荧光信号。图21:westernblot检测不同处理组中颗粒细胞的增殖蛋白pcna以及凋亡相关蛋白的表达情况。图22:qrt-pcr检测共培养体积中颗粒细胞的mir-1246、mir-197-5p、mir-1290、mir-4516、mir-4281以及mir-21-5p的表达情况。图23:将mir-1246以及mir-21-5p拟似物及抑制剂转染颗粒细胞,通过qrt-pcr对其表达水平进行检测。图24:westernblot方法检测mir-1246或mir-21-5p过表达对颗粒细胞中pcna以及caspase-3蛋白表达的影响。
具体实施方式
下面结合附图对本发明提供的具体实施方式作详细说明。
实施例1
1、人羊膜上皮细胞来源外泌体的收集方法
(1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化12min分离出人羊膜上皮细胞,重悬于含有胎牛血清的dmem/f12培养基中,接种于细胞培养皿中后置于含有5%co2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁细胞2min并重悬于含有胎牛血清的dmem/f12培养基中,重新调整细胞密度为1×105后接种于细胞培养皿中,放置于含有5%co2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80%时,吸出含血清的完全培养基,用pbs缓慢洗涤3次后更换无血清的dmem/f12培养基培养;24小时后,缓慢地将培养基吸出,在2000g条件下离心30min收集上清,并使用滤器(孔径:0.2μm)将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基。
(2)将上述获得的条件性培养基转入浓缩管(3kda,millipore公司)进行体积浓缩,将浓缩后的条件性培养基转移入新的离心管中,向其中添加1/2体积的外泌体抽提试剂(totalexosomeisolation(fromcellculturemedia),invitrogen,4478359)经振荡混匀后2-8℃孵育过夜。第2天,在4℃离心机中10000g,离心1小时,外泌体为微小沉淀附着于管壁底部。去除上清后用pbs对外泌体重悬,通过电镜及nanosight仪器对其形态结构及粒径大小进行分析。同时,westernblot检测外泌体标志性蛋白(cd9及cd63)的表达情况。
2、人羊膜上皮细胞的条件性培养基中含有丰富的外泌体
首先,按照上述步骤1的方法进行人羊膜上皮细胞的体外分离与培养。在显微镜下,人羊膜上皮细胞呈现出鹅卵石样形态,高表达干细胞特异性蛋白ssea4(99.6%)以及上皮细胞特异性蛋白cd324(99.4%)。根据上述步骤1的人羊膜上皮细胞外泌体提取流程:将经鉴定后的人羊膜上皮细胞进行无血清培养24小时,获得条件性培养基进行离心及过滤去除残余细胞碎片。通过外泌体提取试剂对浓缩后的条件性培养基中外泌体进行抽提。经鉴定,人羊膜上皮细胞外泌体在电镜下呈杯状结构,直径约100nm,在人羊膜上皮细胞外泌体中外泌体特异性蛋白cd63及cd9呈现高表达。nanosight检测人羊膜上皮细胞外泌体粒径大小在50-150nm之间且浓度较高。上述实验显示,人羊膜上皮细胞能够分泌大量外泌体,可用于后续卵巢早衰的动物学实验(图1-6)。
3、人羊膜上皮细胞外泌体具有修复化疗损伤后卵巢功能的作用
订购8周龄spf级c57bl/6雌性小鼠,通过单次腹腔注射环磷酰(120mg/kg)联合白消胺(30mg/kg)构建卵巢早衰小鼠动物模型。在化疗后第1周,将2×106人羊膜上皮细胞来源的外泌体(haecs-exosomes)重悬于10μl的pbs中、将同等细胞量来源的条件性培养基(haecs-cm)浓缩至10μl、将用外泌体分泌抑制剂gw4869处理后的同等细胞来源的条件性培养基(haecs-cm(gw4869))浓缩至10μl,通过微玻璃针在显微镜下分别多点注入化疗药物注射后小鼠的卵巢内(同时以同等剂量的pbs作为对照组)。在化疗后第2周,分别将上述提取物(体积100μl)通过尾静脉注射方式注入小鼠体内。在首次移植后第4周,收集小鼠卵巢组织进行4%多聚甲醛固定过夜后,进行石蜡包埋及制备切片,并进行苏木素-伊红染色。结果显示,在注射haecs-exosomes、haecs-cm、haecs-cm(gw4869)的损伤卵巢组织切片中均可见健康的成熟卵泡,同时haecs-exosomes注射显著增加原始卵泡的数量,haecs-exosomes注射组各级卵泡数量总和显著大于其他各组。卵巢组织表达谱芯片结果显示,haecs-exosomes移植明显上调损伤卵巢组织中能量代谢途径、pparg以及ampk信号途径,降低白介素-1(il-1)以及肿瘤坏死因子-a(tnf-a)介导的信号途径(图7-8)。
4、人羊膜上皮细胞外泌体抑制化疗药物诱导的卵巢急性血管损伤及颗粒细胞凋亡
免疫荧光结果显示,在移植后第7天,pbs处理组的小鼠卵巢组织中增殖标记(edu阳性细胞)以及血管内皮细胞(cd34阳性细胞)明显减少。然而,在人羊膜上皮细胞外泌体处理组中cd34的阳性细胞数量显著增加。以上结果表明,人羊膜上皮细胞外泌体移植能够显著抑制化疗药物引起的卵巢急性血管损伤。tunel染色显示大量的凋亡细胞位于成熟卵泡的卵丘卵母细胞复合体的颗粒细胞上。qrt-pcr结果显示,化疗药物引起的卵丘扩张基因has2和ptx3表达显著下调。人羊膜上皮细胞外泌体移植能够抑制颗粒细胞的凋亡主要表现为减少tunel阳性细胞以及cleaved-caspase3蛋白表达,同时上调has2基因的表达(图9-13)。
5、人羊膜上皮细胞外泌体部分抑制化疗药物诱导的原始卵泡激活
在人羊膜上皮细胞外泌体移植第7天,pbs处理的化疗组中卵巢组织结构紊乱,卵泡数量减少,大量卵泡发生凋亡。在人羊膜上皮细胞外泌体处理组中,可见大量健康成熟卵泡。卵泡计数结果显示,人羊膜上皮细胞外泌体显著增加损伤卵巢组织内原始卵泡以及成熟卵泡数量。同时,westernblot结果显示,人羊膜上皮细胞外泌体部分抑制化疗药物引起的p-akt以及p-foxo3a蛋白表达的增加(图14-16)。
6、人羊膜上皮细胞外泌体中microrna检测及靶基因功能富集分析
按上述方法获得5例不同健康足月产妇的人羊膜上皮细胞来源的外泌体,通过芯片检测技术对外泌体中microrna成分进行分析。芯片结果显示在人羊膜上皮细胞外泌体中含有大量microrna,按其表达丰度值对含量较高的前50种microrna进行由高到低排序。同时,根据生物信息学方法对表达量较高的前30种microrna的靶基因进行预测及生物学功能的富集分析。结果显示,大量的microrna靶基因富集于pi3k以及调控细胞凋亡的信号途径中。通过qrt-pcr方法在人羊膜上皮细胞外泌体中检测到含量较高的mir-1246表达(图17-18)。
7、人羊膜上皮细胞外泌体通过传递microrna抑制颗粒细胞凋亡
为了观察人羊膜上皮细胞分泌的外泌体是否能被颗粒细胞摄取,我们通过pkh26荧光染料对人羊膜上皮细胞进行标记,收集其条件性培养基,提取携带pkh26荧光信号的外泌体,并将其添加到颗粒细胞kgn的培养基中。在24小时后,颗粒细胞进行actin-tracker及dapi荧光标记,通过激光共聚焦显微镜可以在颗粒细胞中观察到pkh26的红色荧光信号。实验结果表明,人羊膜上皮细胞分泌的外泌体能够被颗粒细胞摄取。离体实验也证实,人羊膜上皮细胞外泌体能明显上调抗凋亡蛋白bad、bcl2的表达,下调促凋亡蛋白bax、caspase-3蛋白表达。通过qrt-pcr方法对共培养后颗粒细胞中的microrna的表达水平进行检测,结果显示在颗粒细胞中mir-1246的表达具有增加趋势。将体外合成mir-1246(正义链:aauggauuuuuggagcagg(seqidno:1),反义链:ugcuccaaaaauccauuuu(seqidno:2))以及mir-21-5p(已知具有抗凋亡作用)的拟似物以及抑制剂,对颗粒细胞进行转染。qrt-pcr方法对mir-1246以及mir-21-5p的干预水平进行检测,待转染成功后,通过westernblot方法对凋亡水平进行检测,结果显示mir-1246过表达能够显著抑制化疗药物诱导的颗粒细胞凋亡的发生(图19-24)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
sequencelisting
<110>中国福利会国际和平妇幼保健院
<120>人羊膜上皮细胞外泌体在制备修复卵巢功能药物中的应用
<130>/
<160>2
<170>patentinversion3.3
<210>1
<211>19
<212>rna
<213>人工序列
<400>1
aauggauuuuuggagcagg19
<210>2
<211>19
<212>rna
<213>人工序列
<400>2
ugcuccaaaaauccauuuu19
- 还没有人留言评论。精彩留言会获得点赞!