基于夹心法高分辨熔解曲线分析的ALK融合基因检测及分型试剂盒的制作方法
本发明属于体外检测
技术领域:
,具体涉及一种肺癌常见多种类型alk融合基因扩增,检测并分型的试剂盒。
背景技术:
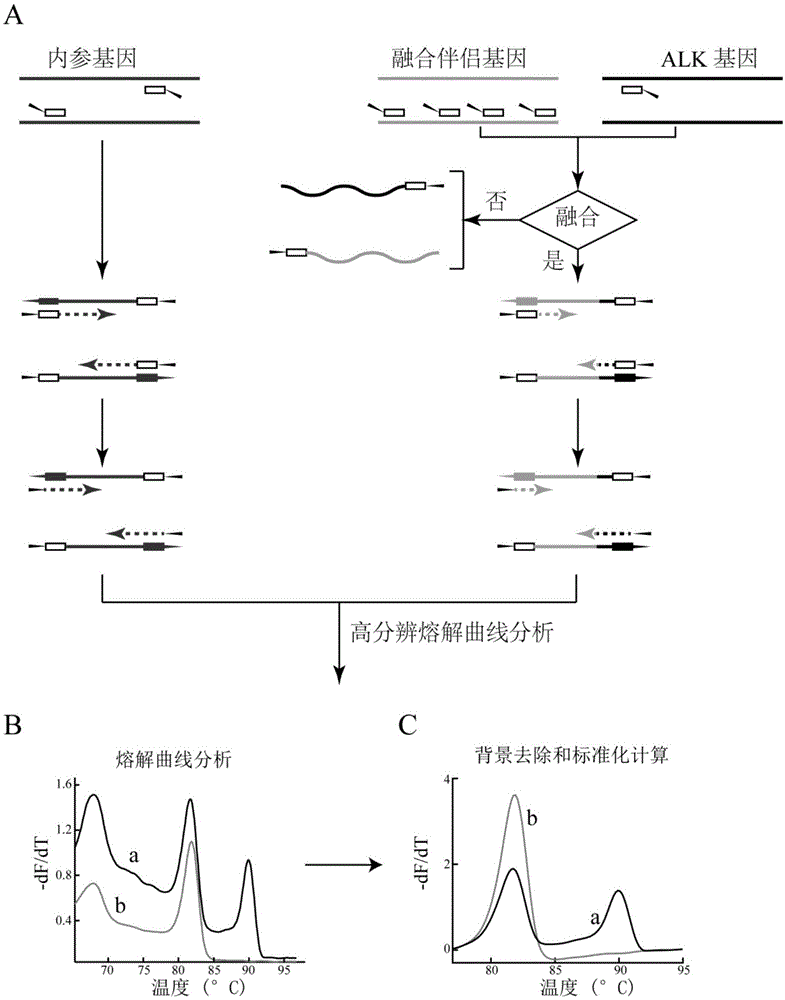
:肺癌是发病率、死亡率较高的恶性肿瘤,且其发病率在我国有逐年增高趋势。个体化分子靶向治疗的出现弥补了手术治疗和传统化疗的不足,这类药物敏感患者的生存质量和生存期都得到明显提高。目前肺癌分子靶向药酪氨酸激酶抑制剂(tki)靶点主要针对两类基因变异,一类是egfr等基因的点突变、缺失突变,另一类是融合基因。基因点突变、缺失突变相对容易检测,但肺癌等实体瘤中的融合基因是基因检测的难点。融合基因是指两个基因断裂后发生重排,拼接在一起,形成新的基因,可以转录翻译出含有两个基因片段部分表达产物融合在一起的融合mrna和融合蛋白产物。alk融合基因是肺癌中主要融合基因类型,表现为alk基因断裂保留其酪氨酸激酶结构域部分,其融合伴侣基因可以有多种如eml4,hip1,kif5b等,相同融合伴侣基因断裂位点可以为1个或多个。另外基因检测所用的组织标本不可避免的混有大量间质细胞等非肿瘤细胞,这就要求检测灵敏度要足够高。检测标本最常见的是石蜡包埋组织,由于标本经过固定、包埋等处理,常有rna的断裂,不完整等状况,这些都增加了肺癌中检测融合基因的难度。目前主要用于检测肺癌alk融合基因的方法有:荧光原位杂交(fish),免疫组织化学法,基于实时荧光定量rt-pcr和数字pcr为基础的方法,二代基因测序(ngs)等。这些方法都存在相应的问题,制约了检测alk融合基因在临床的广泛,有效应用。fish法应用核酸探针分别与融合的基因伴侣杂交,通过荧光显微镜观察杂交的荧光信号判断肿瘤细胞内融合基因的有无。该方法准确率高,可以形态学定位。但是检测程序操作复杂,对标本质量要求高,检测成本高,检测周期长,结果判读需要受过专业训练的病理医生判断,有一定主观性影响,假阴性率高。无法对融合基因类型分型。免疫组织化学法检测结果受标本处理过程影响较大,结果判读受主观因素干扰。虽然经国内外专家共识认可的抗体和免疫组织化学检测系统的使用极大改进了染色标准化和结果判读,假阳性率下降,但仍存在检测成本高,无法对检测到的融合基因进一步分型等问题。基于荧光定量反转录pcr法是公认的检测速度快、准确率高、灵敏度、特异性高的融合基因检测方法。现有应用及报道的这类方法核心都是应用荧光标记探针检测目标扩增的融合基因片段。但因需合成荧光标记探针,检测成本高,也没有实现多种融合基因类型的准确分型。基于二代测序(ngs)的alk融合基因检测法可以检测已知和未知的融合基因类型及具体序列信息。但检测周期长,成本高,仪器价格昂贵,结果分析需要专门从业人员分析处理。尚难以广泛应用于临床。综上,现有肺癌alk融合基因检测常用方法的突出问题是检测成本高,不能实现融合基因的分型。而近年研究表明,alk融合基因融合类型不同(包括融合伴侣基因的不同和相同融合伴侣基因断裂位点的不同)的非小细胞肺癌患者对tki药物治疗疗效、耐药产生情况和预后都有所不同。因此,检测alk融合基因是否存在,并准确分析融合类型对指导非小细胞肺癌的tki类药物合理选择并判断预后有重要意义。高分辨熔解曲线分析(hrma)技术是利用dna双链随温度升高变性解链的特性,以饱和dna双链荧光染料为指示剂,通过记录dna双链解链过程中荧光信号强度变化来标记dna双链特征。这种方法广泛用于基因分型(genotype)和基因突变扫描(mutationscanning)。该方法特点是低成本(商品化饱和荧光染料稳定,价钱低,猝灭速度慢明显优于荧光标记探针)、快速、敏感、闭管操作避免二次污染,主要用于点突变和缺失突变检测,北美和欧洲应用较多。融合基因序列变化多,石蜡包埋组织常有rna降解,间质细胞成分混杂等,同时扩增到多种融合基因类型极为困难。另外,高分辨熔解曲线技术的基因分型主要应用于纯合子、杂合子等基因类型的区分,核酸序列不同的长片段区分目前主要依靠测序,应用hrma进行融合基因检测并分型国内外均未见报道。技术实现要素:鉴于上述现有技术中检测alk融合基因以及其分型中存在的问题,本发明提供一种检测肺癌alk融合基因及其分型的pcr引物组合物以及利用该引物组合物检测alk融合基因及创建荧光强度-温度二阶导数曲线的高分辨熔解曲线分析方法,并将其用于序列差异的融合基因类型区分。根据本发明,在一个反应管内可以同时检测至少20种alk融合基因,并区分各融合基因类型,集中了实时定量pcr技术高敏感度、特异性、准确性特点和高分辨熔解曲线分析技术低成本、快速简便的特点,融合基因扩增和检测在一管内完成,无需开管,避免二次污染。本发明的技术方案如下:本发明的第一方面,提供一种检测肺癌alk融合基因分型的pcr引物组合物,包括alk基因特异性接头引物、alk融合伴侣基因特异性接头引物、接头引物以及内参基因特异性接头引物,所述alk基因特异性接头引物的核苷酸序列如seqidno:1所示,alk融合伴侣基因特异性接头引物的核苷酸序列为seqidno:2~seqidno:16中的一种或多种,所述接头引物的核苷酸序列如seqidno:17和seqidno:18所示,所述内参基因特异性接头引物的核苷酸序列如seqidno:19和seqidno:20所示。本发明的第二方面,提供一种检测肺癌alk融合基因分型的试剂盒,所述试剂盒包括权利要求1所述的pcr引物组合物。所述试剂盒还包括pcr反应试剂,以及饱和双链dna染料。本发明的第三方面,提供一种上述的引物组合物在制备非小细胞肺癌诊断试剂中的应用。本发明的第四方面,提供上述试剂盒的使用方法,即提供一种上述试剂盒按照如下方法用以检测肺癌alk融合基因的方法,包括如下步骤:(1)提取待测样本中的总rna,通过反转录合成cdna;(2)以步骤(1)的合成cdna为模板,以所述alk基因特异性接头引物、alk融合伴侣基因特异性接头引物、接头引物和内参基因特异性接头引物作为组合引物,进行pcr扩增反应;(3)将步骤(2)获得的pcr反应产物用于高分辨熔解曲线分析,根据样品的高分辨熔解曲线峰形判定alk融合基因有无。还有,在上述技术方案中,在步骤(1)中所述的待测样本为石蜡包埋组织、新鲜手术切除、穿刺组织或胸水。还有,在上述技术方案中,在步骤(2)中,所述的pcr扩增反应的反应体系中,所述的alk基因特异性接头引物、alk融合伴侣基因特异性接头引物、接头引物和内参基因特异性接头引物的摩尔浓度比为1~3:1~3:8~20:1,优选为2:2:10:1。在上述技术方案中,所述的步骤(3)中,若判定为融合基因阳性,则应用夹心法荧光强度-温度二阶导数曲线及关键参数判断融合基因类型。所述的应用夹心法荧光强度-温度二阶导数曲线及关键参数判断融合基因类型的步骤包括如下步骤:a)对于权利要求8的步骤(3)中获得的样品的高分辨熔解曲线,通过背景去除和标准化后的高分辨熔解曲线求导获得熔解曲线导数图,对于该导数图进行二次求导,获得二阶导数曲线;b)在熔解曲线导数图的低温内参产物熔解曲线峰和高温熔解曲线峰区间内判断二阶导数曲线是否单调递增;c)当在步骤b)中判定为二阶导数曲线是单调递增时,应用高、低温熔解曲线峰tm值之间的间距δtm和高温荧光释放加速度峰值间温度跨度pts(peaktemperaturespan)的二维坐标系判断样品的融合类型;当在步骤b)中判定为二阶导数曲线不是单调递增时,应用高、低温熔解曲线峰tm值之间的间距δtm和首次达到区间内荧光释放加速度峰值温度跨度its(innertemperaturespan)的二维坐标系判断样品的融合类型。在上述技术方案中,在步骤c)中,根据二维坐标系判断样品的融合类型时,所述判断基于各类型alk融合基因标准品计算的关键参数取值可信区间。在上述技术方案中,所述的关键参数可总结为如下:二阶导数曲线区域内单调;首次达到区间内荧光释放加速度峰值温度跨度(its);高温荧光释放加速度峰值间温度跨度(pts);高低温熔解曲线峰tm值间距(δtm)。在本发明中,应用夹心法荧光强度-温度二阶导数曲线法分析核酸序列特征,用以实现多种目标序列不同片段的区分。所谓夹心法主要体现两方面:一方面目标序列为共有序列夹杂可变序列(图2),另一方面目标序列信息被共有序列低gc含量区和高gc含量区分段,可变区gc含量和长度分布在二者之间或之外,从而在高分辨熔解曲线分析时展示不同二阶导数曲线信息。本发明中,设计扩增一系列融合基因目的“夹心序列”特征除了共有序列夹杂变化序列外,序列gc含量及长度具有“分段”特点,即最外侧接头序列低gc含量短序列,alk部分序列高gc含量长序列,可变序列gc含量及长度可分布上述二者之间或之外。融合基因分型分析在常规高分辨熔解曲线形状分析基础上,应用夹心法高分辨熔解曲线二阶导数曲线分析方法,并结合特征性参数,实现融合基因分型数字化。本发明,通过在基因特异引物5’端添加接头,低引物浓度下富集含有接头序列的目的融合基因片段,再以接头序列做为引物,扩增获得特异性融合基因和内参基因片段,并应用高分辨熔解曲线方法分析扩增产物,判定融合基因的有无并基于荧光强度-温度二阶导数曲线实现数字化分型,解决了目前肺癌alk融合基因检测成本高、周期长、难分型,分型依赖测序的问题,并集中了实时定量反转录pcr和高分辨熔解曲线分析两种技术的优势,保持高灵敏度、特异度、准确率和低成本、低污染风险、检测速度快的优点。本发明的有益效果:1、实现可应用于临床的肺癌alk融合基因检测和融合基因分型;2、操作简便,检测周期短、速度快,检测成本低;3、检测灵敏度高,适用于石蜡包埋组织、新鲜手术切除、穿刺组织、胸水等多种类型临床标本;4、本方法可推广用于其他实体瘤各种难于检测的融合基因;5、荧光强度-温度二阶导数高分辨熔解曲线分析方法突破了原有高分辨溶解曲线分析应用于固定核酸片段单碱基变异、插入/缺失突变检测,单核苷酸多态(snp)基因分型,实现了不同核酸序列片段的区分。而之前,只有测序方法才能实现不同核酸序列片段鉴定。6、荧光强度-温度二阶导数高分辨熔解曲线分析方法还可用于少数最难检测的第四类单核苷酸多态(理论溶解温度tm值之差为零)的分析检测。附图说明图1为本试剂盒检测alk融合基因的原理示意图。图2为夹心法荧光强度-温度二阶导数高分辨熔解曲线分析目标序列设计示意图;图中展示20种alk融合基因序列信息,每条黑色竖线代表一个gc碱基对,白色竖线代表at碱基对,两侧矮竖线区为低gc含量的接头序列区(共有序列区),右侧中等高度竖线区为alk部分高gc含量区(共有序列区),左侧高竖线区为伴侣基因区域(可变区),其长度和gc含量因伴侣基因不同而不同,是高分辨熔解曲线分析融合基因分型的基础。图3为荧光强度-温度二阶导数高分辨熔解曲线分析关键参数说明示意图;图中示2种二阶导数曲线类型,即区间内单调(a、b)和区间内不单调(c、d);区间内单调二阶导数曲线类型主要应用高低温熔解曲线峰tm值间距(δtm)和高温荧光释放加速度峰值间温度跨度(pts)分析(b);区间内不单调二阶导数曲线主要应用高低温熔解曲线峰tm值间距(δtm)和首次达到区间内荧光释放加速度峰值温度跨度(its)分析(d)。图4为20种alk融合基因类型标准品高分辨熔解曲线导数图和二阶导数图;当导数图曲线形状相似,融合类型不好区分时,结合二阶导数图有助于精确分型,另外,根据二阶导数图区间单调性和关键参数,能够实现融合基因分型数字化判断。图5为20种alk融合基因类型标准品和阴性对照品pcr检测产物琼脂糖电泳图;带接头的alk融合基因产物片段大小在184bp-357bp,带接头内参基因产物片段为95bp。图6为融合基因标准品关键参数分布图;将未知样品参数带入坐标系,可根据融合类型标准品对待测样品分型。图7为检测临床石蜡组织标本alk融合基因阳性样本熔解曲线导数和二阶导数图。图8为检测alk阳性样本二阶导数关键参数在标准品坐标系中的分布图;从而判断样品融合类型。图9为接头多重实时定量反转录pcr检测alk融合基因检测限度的测定结果。具体实施方式下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从生物或化学公司购买。本发明的第一方面,提供一种检测肺癌alk融合基因分型的pcr引物组合物,包括alk基因特异性接头引物、alk融合伴侣基因特异性接头引物、接头引物以及内参基因特异性接头引物,所述alk基因特异性接头引物的核苷酸序列如seqidno:1所示,alk融合伴侣基因特异性接头引物的核苷酸序列为seqidno:2~seqidno:16中的一种或多种,所述接头引物的核苷酸序列如seqidno:17和seqidno:18所示,所述内参基因特异性接头引物的核苷酸序列如seqidno:19和seqidno:20所示。核苷酸序列seqidno:1~seqidno:20参见表1。表1.核苷酸序列seqidno:1~seqidno:20表1中,seqidno.2~16所述的alk融合伴侣基因依次为eml4(2)、eml4(5-6)、eml4(10)、eml4(13)、eml4(15)、eml4(17)、eml4(20)、strn(3)、tfg(4)、hip1(20)、hip1(28)、klc1(9)、kif5b(15)、kif5b(17)、kif5b(24);seqidno.19~20所述的内参基因为gapdh。本发明的第二方面,提供一种检测肺癌alk融合基因分型的试剂盒,所述试剂盒包括上述的pcr引物组合物。所述pcr引物组合物,所述alk基因特异性接头引物(seqidno.1)作为通用下游引物,alk融合伴侣基因特异性接头引物(seqidno.2~16)作为上游引物,在一管中可同时富集多种alk融合基因,内参基因特异性接头引物(seqidno.19~20)作为内对照的基因的富集,所述接头引物作为通用引物,扩增所有特征目的片段。上述试剂盒还包括pcr反应试剂,所述pcr反应试剂包括热启动脱氧核糖核酸聚合酶(无5’端外切酶活性)、缓冲液等pcr溶液试剂、dntp以及其他用于pcr扩增反应的试剂。上述试剂盒还包括饱和双链dna染料,所述染料可以采用本领域常规的饱和双链dna染料,如plus(biofirediagnostics)、dye(biotium)等,其使用量不予特别限定,可采用本领域常规用量。本发明第三方面,提供上述试剂盒的使用方法,即上述试剂盒按照如下方法用以检测肺癌alk融合基因并分型:(1)提取待测样本中的总rna,通过反转录合成cdna;(2)以步骤(1)的合成cdna为模板,以所述alk基因特异性接头引物、alk融合伴侣基因特异性接头引物、接头引物和内参基因特异性接头引物作为组合引物,进行pcr扩增反应;(3)pcr反应产物用于高分辨熔解曲线分析,根据熔解曲线峰形判定alk融合基因有无;(4)如果融合基因阳性,应用夹心法荧光强度-温度二阶导数曲线及关键参数判断融合基因类型。下面结合图1具体说明上述试剂盒的使用方法。如上述步骤(1)所述,提取待测样本中的总rna,所述待测样品为来源于非小细胞肺癌患者新鲜手术切除或穿刺组织、石蜡包埋组织或胸水。提取的总rna通过反转录合成cdna,并以该cdna为模板,以上述引物组合物作为引物,进行分段式接头多重反转录pcr扩增反应,该多重反转录pcr反应可分为3阶段:第一阶段:特异性引物反应;第二阶段:接头-基因特异性引物反应;第三阶段:接头引物反应。具体为如下:在pcr反应管中加入上述待测样品的cdna,alk基因特异性接头引物、alk融合伴侣基因特异性接头引物和内参基因的基因特异性接头引物,接头引物以及dna聚合酶、dntp、饱和双链dna荧光染料、缓冲液等pcr反应试剂,进行pcr扩增反应。如图1a所示,以内参基因、alk基因和alk融合伴侣基因的基因特异性接头引物的基因特异性序列部分富集特异性目的片段,包括内参基因片段,(有或无)融合基因片段(即,第一阶段);以内参基因特异性接头引物、alk基因特异性接头引物和alk融合伴侣基因特异性接头引物全序列扩增,扩增产物目的基因片段加入接头序列(即,第二阶段);以接头引物进行目的产物的最终扩增(即,第三阶段)。在上述pcr反应体系中,加入低浓度基因特异性接头引物和高浓度人工设计接头引物,以降低总引物浓度,减少非特异性扩增机会,所述接头引物和所述的alk基因特异性接头引物、alk融合伴侣基因特异性接头引物及内参基因特异性接头引物的加入量的摩尔浓度比为8~20:1~3:1~3:1。上述pcr反应为实时定量反转录pcr,pcr产物用于高分辨熔解曲线分析,分析结果如图1b和图1c表示,其中图1b为仪器(rotorgeneq)熔解曲线分析图,图1c为在图1b的基础上,经去除背景和标准化计算处理后的熔解曲线分析图。根据熔解曲线峰形判定alk融合基因的有无。如图1b和图1c所示,任何待检测样品经上述接头多重反转录pcr扩增后,如果样品有融合基因(曲线a),除了有内参基因产物(低温熔解曲线峰)外,还应有以alk片段熔解曲线峰(高温熔解曲线峰)为主的融合基因扩增产物;如果样品没有融合基因(曲线b),则只有内参基因产物(低温熔解曲线峰)。低温熔解曲线(内参基因扩增产物)tm值和峰形用以判定样品质量,高温熔解曲线(融合基因扩增产物)tm值,峰形和相对于低温熔解峰的相对位置用以判定融合基因的有无和融合基因类型。具体alk融合类型判定过程如下:a)对于获得的样品的高分辨熔解曲线,通过背景去除和标准化后的高分辨熔解曲线求导获得熔解曲线导数图,对于该导数图进行二次求导,获得二阶导数曲线;b)在熔解曲线导数图的低温内参产物熔解曲线峰(tm值在80℃附近)和高温熔解曲线峰(tm值在90℃附近)区间内判断二阶导数曲线是否单调递增;c)当在步骤b)中判定为二阶导数曲线是单调递增时,应用高、低温熔解曲线峰tm值之间的间距δtm和高温荧光释放加速度峰值间温度跨度pts的二维坐标系判断样品的融合类型;当在步骤b)中判定为二阶导数曲线不是单调递增时,应用高、低温熔解曲线峰tm值之间的间距δtm和首次达到低温荧光释放加速度峰值温度跨度its的二维坐标系判断样品的融合类型;其中,根据二维坐标系判断样品的融合类型时,所述判断基于各类型alk融合基因标准品计算的关键参数取值可信区间。图2为夹心法荧光强度-温度二阶导数高分辨熔解曲线分析目标序列设计示意图,图中展示20种alk融合基因序列信息,每条黑色竖线代表一个gc碱基对,白色竖线代表at碱基对,两侧矮竖线区为低gc含量的接头序列区(共有序列区),右侧中等高度竖线区为alk部分高gc含量区(共有序列区),左侧高竖线区为伴侣基因区域(可变区),其长度和gc含量因伴侣基因不同而不同,是高分辨熔解曲线分析融合基因分型的基础;结合图3说明上述步骤(3),图3中示2种二阶导数曲线类型,即区间内单调(a、b)和区间内不单调(c、d)。区间内单调二阶导数曲线类型主要应用高低温熔解曲线峰tm值间距(δtm)和高温荧光释放加速度峰值间温度跨度(pts)分析(b);区间内不单调二阶导数曲线主要应用高低温熔解曲线峰tm值间距(δtm)和首次达到低温荧光释放加速度峰值温度跨度(its)分析(d)。上述pcr反应可以使用带有高分辨熔解曲线分析功能模块的实时定量pcr仪,如rotorgeneq实时定量pcr仪等。实施例1二十种alk融合基因标准品熔解曲线、二阶导数曲线和关键参数取值获取,具体步骤如下:1、不同类型alk融合基因阳性样品制备1.1扩增模板的制备(1)rna提取:应用外周血、培养细胞rna提取试剂盒(罗氏(roche)公司高纯度rna提取试剂盒)分别提取分离肺癌细胞系a549、h1975、h2228、h3122的总rna,其中a549、h1975为alk融合基因阴性细胞系,h2228、h3122为融合基因阳性细胞系,融合类型分别为:eml4(6)-alk(20)和eml4(13)-alk(20);(2)cdna合成:应用分光光度计读取260nm、280nm和230nm吸光度值,判断rna样品浓度、纯度;对于合格的rna样品,用宝生物cdna第一链合成试剂盒,通过反转录合成cdna,全部cdna样品以pcr用水20倍稀释(浓度约200ng/μl),备后续使用。1.2不对称pcr反应单链融合伴侣基因扩增,各alk融合伴侣基因引物序列如表2。表2中引物1和引物2分别为基因特异性引物和基因接合引物。表2.alk融合伴侣基因类型以及引物序列不对称pcr分别扩增上游和下游融合伴侣基因,pcr反应体系如下(应用宝生物primestar热启动dna聚合酶及其缓冲液):pcr反应条件如下:30个循环,98℃,20秒,55℃,15秒,72℃,30秒或80秒。1.3自身退火pcr反应体系(应用宝生物primestar热启动dna聚合酶及其缓冲液):反应条件如下:20个循环,98℃,20秒,70℃,30秒或80秒。1.4巢式pcr纯化alk融合基因阳性标准品上述步骤1.3的pcr产物以pcr用水稀释1000倍做模板,巢式pcr扩增目的融合基因片段。对于eml4(6)-alk和eml4(13)-alk融合基因直接以h2228和h3122细胞cdna为模板扩增获得。巢式pcr引物序列如表3。表3.用于各融合基因的巢式pcr扩增的引物序列番号融合基因类型上游引物(引物1)下游引物(引物2)1eml4(2)-alk(20)aagatcgcctgtcagctcttacctggccttcatacacctc2eml4(3)-alk(20)aagatcgcctgtcagctcttacctggccttcatacacctc3eml4(6)-alk(20)cccaccaaaagcataaaacgacctggccttcatacacctc4eml4(10)-alk(20)tgatgttttgaggcgtcttgacctggccttcatacacctc5eml4(13)-alk(20)tttcacccaacagatgcaaaacctggccttcatacacctc6eml4(14)-alk(20)tttcacccaacagatgcaaaacctggccttcatacacctc7eml4(15)-alk(20)tttcacccaacagatgcaaaacctggccttcatacacctc8eml4(17)-alk(20)tttcacccaacagatgcaaaacctggccttcatacacctc9eml4(18)-alk(20)tttcacccaacagatgcaaaacctggccttcatacacctc10eml4(20)-alk(20)tttcacccaacagatgcaaaacctggccttcatacacctc11strn(3)-alk(20)cccgagcccagtacagtctacctggccttcatacacctc12tfg(4)-alk(20)tgcaacgagttttcagaggaacctggccttcatacacctc13klc1(9)-alk(20)aggttttggggaaggatcacacctggccttcatacacctc14klc1(10)-alk(20)aggttttggggaaggatcacacctggccttcatacacctc15hip1(21)-alk(20)ggtctgcagatcacctcctcacctggccttcatacacctc16hip1(28)-alk(20)ggtctgcagatcacctcctcacctggccttcatacacctc17hip1(30)-alk(20)ggtctgcagatcacctcctcacctggccttcatacacctc18kif5b(15)-alk(20)ggccctagaagaacttgctgacctggccttcatacacctc19kif5b(17)-alk(20)ggccctagaagaacttgctgacctggccttcatacacctc20kif5b(24)-alk(20)ggccctagaagaacttgctgacctggccttcatacacctcpcr反应体系如下(应用宝生物extaq热启动dna聚合酶及其缓冲液):pcr反应条件如下:45个循环,98℃,30秒,56℃,20秒,72℃,40秒或90秒。1.5将步骤1.4得到的各融合基因所对应的pcr产物,用琼脂糖凝胶进行电泳分离,并切胶纯化回收,得alk融合基因阳性标准品。以pcr用水108-109倍稀释各样品(约1017copies/μl),用于以下检测。2、接头多重实时定量反转录pcr和高分辨熔解曲线分析21接头多重实时定量反转录pcr反应体系(应用宝生物热启动dna聚合酶)如下:22上述步骤21所给出的接头多重实时定量反转录pcr体系的反应条件如下:将得到的pcr产物,用于高分辨熔解曲线分析,获得各融合基因的高分辨熔解曲线。高分辨熔解曲线分析荧光信号采集条件:98℃,30秒;65-97℃,0.5℃/step采集荧光信号,在rotorgeneq实时定量pcr仪上完成。2.3数据分析和计算应用rotor-geneq实时定量pcr仪分析软件高分辨熔解曲线分析,以melt分析调出导数图,导出数据,去背景噪声和标准化计算。计算方法参考palaisr,wittwerct.mathematicalalgorithmsforhigh-resolutiondnameltinganalysis.methodsenzymol2009;454:323-43。3、结果如图4所示(每个样品3复孔),20种alk融合基因阳性标准品熔解曲线导数图和二阶导数图。图4中各融合基因类型(e2:a20)、(e3:a20)、(e6:a20)、(e10:a20)、(e13:a20)、(e14:a20)、(e15:a20)、(e17:a20)、(e18:a20)、(e20:a20)、(s3:a20)、(t4:a20)、(h21:a20)、(h28:a20)、(h30:a20)、(kl9:a20)、(kl10:a20)、(ka15:a20)、(ka17:a20)、(ka24:a20)分别代表:eml4(2)-alk(20)eml4(3)-alk(20)、eml4(6)-alk(20)、eml4(10)-alk(20)、eml4(13)-alk(20)、eml4(14)-alk(20)、eml4(15)-alk(20)、eml4(17)-alk(20)、eml4(18)-alk(20)、eml4(20)-alk(20)、strn(3)-alk(20)、tfg(4)-alk(20)、hip1(21)-alk(20)、hip1(28)-alk(20)、hip1(30)-alk(20)、klc1(9)-alk(20)、klc1(10)-alk(20)、kif5b(15)-alk(20)、kif5b(17)-alk(20)、kif5b(24)-alk(20)。黑色(b)和浅灰实线(d)分别表示融合基因阴性的a549细胞cdna样品导数和二阶导数图,次深灰(a)和深灰实线(c)分别表示融合基因阳性标准品与a549细胞cdna的混合样品导数和二阶导数图(以ka15:a20图标注为例)。二十种融合基因阳性标准品与a549细胞cdna混合样品熔解曲线导数图均呈现80℃附近的内参基因产物熔解曲线峰和alk融合基因产物峰。融合基因产物峰依融合类型不同熔解曲线形状各有不同,但在90℃附近都呈现一个熔解曲线峰。20种融合基因类型依据二阶导数曲线分为两大类:区间内单调(包括:e13:a20;e17:a20;e18:a20;kl9:a20;h28:a20;ka17:a20)和区间内不单调(包括剩余类型)。每个样品重复10-13次,计算两类融合基因类型二阶导数曲线参数,结果如表4和表5。表4.区间单调融合类型二阶导数曲线参数表5.区间内不单调融合类型二阶导数曲线参数图5所示为对于上述步骤2.2得到的各样品pcr产物的琼脂糖电泳结果,融合基因pcr产物大小在184-357bp,内参基因产物片段大小为95bp,所有产物均含有接头序列。各标准品参数二维坐标系分布如图6a和6b。实施例2临床非小细胞肺癌患者的石蜡包埋肺癌组织、非小细胞肺癌患者胸水样品中alk融合基因的检测,具体检测步骤如下:1、临床标本:双盲法收集肺腺癌蜡块组织52例,均已应用ventana免疫组织化学检测系统,检测了alk融合基因(alk单克隆抗体克隆号:d5f3,ventana公司)。胸水标本1例,为未经手术治疗和放射、化学治疗的肺腺癌晚期患者抽取的胸水标本。2、rna提取2.1石蜡组织总rna提取:(1)应用alk免疫组织化学检测的蜡块组织,连续切取2-3片10μm厚蜡卷(前2-3片弃掉)置于无rna酶、dna酶、无菌的1.5mlep管中;(2)加入1ml二甲苯,旋涡震荡10秒,12000转/分钟,离心2分钟,小心去除上层残余石蜡;(3)加入1ml无水乙醇,旋涡振荡混匀,12000转/分钟,离心2分钟,小心去除上清液;(4)开盖,室温静置大约10分钟,待管内液体全部挥发,保留细胞组织沉淀;(5)对于细胞组织沉淀,采用按qiagen公司石蜡组织rna提取试剂盒说明书操作,获得总rna。2.2胸水样品rna提取:(1)收集胸水样品,2000转/分钟,离心5分钟,小心去除上清液,保留细胞沉淀;(2)对于细胞沉淀,应用外周血、培养细胞rna提取试剂盒(罗氏(roche)公司高纯度rna提取试剂盒)提取分离,获得总rna。3、rna浓度测定和cdna反转录合成3.1应用分光光度计读取260nm、280nm和230nm吸光度值,判断rna样品浓度、纯度。3.2基于步骤3.1中测定结果,以合格rna为模板,通过发转录合成得到cdna,cdna的合成应用宝生物cdna第一链合成试剂盒,按说明书操作完成;全部cdna样品(包括石蜡包埋组织样品和胸水样品)以pcr用水液稀释成浓度为250ng/μl,备后续使用。4、接头多重实时定量反转录pcr和高分辨熔解曲线分析4.1接头多重实时定量反转录pcr反应体系(应用宝生物热启动dna聚合酶)同实施例1。4.2接头多重实时定量反转录pcr反应条件,高分辨熔解曲线分析荧光信号采集条件同实施例1。4.3数据分析和计算应用rotor-geneq实时定量pcr仪分析软件高分辨熔解曲线分析,以melt分析调出导数图,导出数据,去背景噪声和标准化计算。计算方法同实施例1。5、结果5.1肺腺癌石蜡组织52例,6例无内参基因特异性扩增产物。可检测的标本共46例,其中7例熔解曲线导数图在90℃附近有熔解曲线峰,判定为alk融合基因阳性,其余39例阴性。与免疫组织化学检测结果符合率100%。胸水标本1例,未检测到alk融合基因。5.2融合基因分型分析:计算获得7例(p1~p7)融合基因阳性样品熔解曲线二阶导数图,如图7,黑色线为熔解曲线导数图,灰色线为二阶导数图,可见2例(p1~p2)融合基因阳性样品二阶导数图区间内非单调,另5例(p3~p7)为区间内单调。计算各样品二阶导数曲线关键参数,计算结果如下表6。表6.各样品二阶导数曲线关键参数患者样品参数带入相应标准品参数分布图如图8,图8a表示区间内单调融合类型分布,图8b表示区间内不单调融合类型分布,从图8a和8b中可以判断样品融合类型包括:e6:a20,kl9:a20和e13:a20。测序证实该了结果。实施例3基于高分辨熔解曲线分析的alk融合基因检测方法的检测效能、检测限度和融合基因分型参数稳定性测定:1、应用实施例1已制备的cdna,包括以alk融合基因阴性肺癌细胞系a549和融合基因阳性细胞系h2228、h3122总rna反转录的cdna储存液(1mg/μl),进行连续5次4倍梯度稀释。2、应用内参基因(gapdh)标准曲线法定量并稀释a549,h2228和h3122的cdna样品,使三者内参基因表达量相同。以内参基因表达量相同的a549cdna样品稀释h2228和h3122的cdna样品,混合样品中h2228和h3122的cdna的终质量百分浓度依次为100%、90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、2.5%、1%、0%。3、接头多重实时定量反转录pcr和高分辨熔解曲线分析以上述3种细胞系cdna连续5次4倍梯度稀释液,不同比例混合液分别为模板进行接头多重实时定量反转录pcr和高分辨熔解曲线分析,反应体系,反应条件,荧光数据采集条件和导数曲线去噪声计算同实施例1和2。4、结果4.1如图9,alk融合基因阳性细胞系h2228(a1-a3)和h3122(c1-c3)的cdna分别连续5次4倍梯度稀释后的接头多重实时定量反转录pcr扩增曲线,高分辨熔解曲线分析导数图和二阶导数图。样品浓度相差256倍,扩增曲线ct值接近20时,应用高分辨熔解曲线分析仍可清晰分辨出参考基因峰和融合基因峰。样品浓度降低,扩增曲线ct值接近20时,扩增产物量整体下降但本方法仍可检测出alk融合基因,且融合基因峰形保持不变。二阶导数δtm值分别为(8.333±0.094)和(8.392±0.082),ist值为3.567±0.137,pst值为1.567±0.084,关键参数无明显变化。4.2当融合基因阳性样品中混杂有融合基因阴性细胞成分时,接头多重实时定量反转录pcr方法检测alk融合基因灵敏度测定结果,结果如图9。图9中所示为融合基因阳性h2228细胞系(a1-a3)和h3122细胞系(c1-c3)的cdna倍比梯度稀释的扩增曲线图(图9a),高分辨熔解曲线导数图(图9b的上图)和二阶导数图(图9b的下图);从熔解曲线来看,证明样品浓度差别很大时(本结果显示浓度差为256倍),此方法均能有效扩增,较低样品浓度(ct值近20)时,仍可检测出融合基因,且清楚分型;应用等量内参基因表达量的融合基因阴性样品(a549cdna)和融合基因阳性样品h2228(b1-b3)和h3122(d1-d3)cdna按不同比例混合,融合基因分别占混合样品的0%、1%、2.5%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,进行接头多重反转录pcr扩增后,得扩增曲线图(图9a)、高分辨熔解曲线导数图和二阶倒数图(图9b),可见,随融合基因样品占混合样品比例下降,融合基因熔解曲线峰相对内参基因熔解曲线峰高度逐渐降低,但融合基因仍可检出,且能分型。如图9中所示,随着样品中融合基因阳性细胞h2228(b1-b3)和h3122(d1-d3)成分比例下降(由100%到1%,曲线颜色由黑色变为浅灰色),alk融合基因峰与内参基因峰高度比也逐渐下降,但融合基因峰形和与内参基因峰相对位置不变。融合基因阳性细胞h2228比例为2.5%和1%时,倒数图和二阶导数图融合基因熔解曲线峰难以显现,但二阶导数数据关键参数仍可从原始数据计算出。二阶导数δtm值分别为(8.397±0.100)和(8.468±0.066),ist值为3.753±0.134,pst值为1.596±0.083,关键参数无明显变化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1