一种利用RNA干扰技术提高植物抗虫性的方法及其专用DNA片段与流程
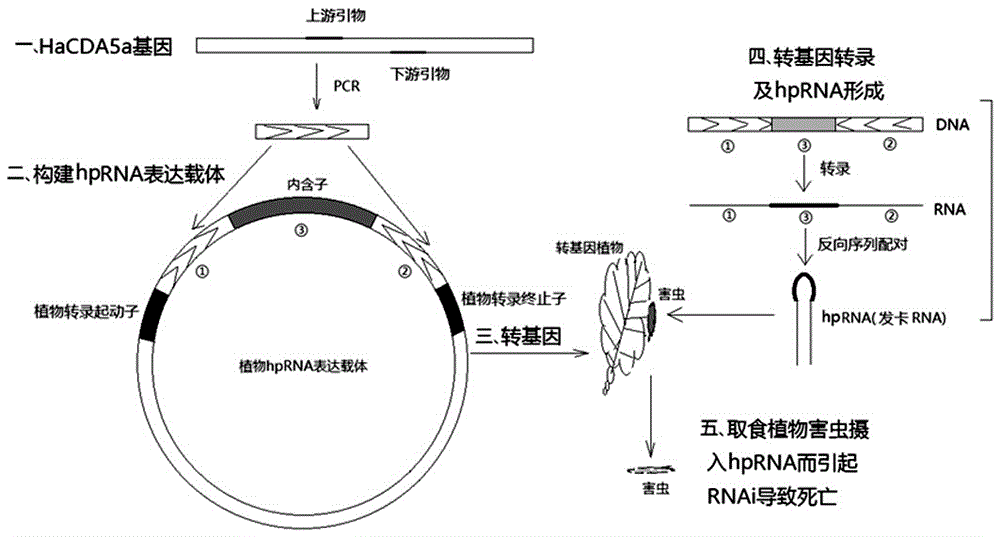
本发明涉及生物技术领域,具体涉及一种利用rna干扰技术提高植物抗虫性的方法及其专用dna片段。
背景技术:
真核细胞摄入dsrna(双链rna),会引起细胞内源同源mrna的降解,从而造成对应基因表达受阻,这种现象被称之为rna干扰(rnainterference,rnai)。植物介导的rnai技术是通过转基因技术,把表达昆虫基因的dsrna(或者hprna,即发夹结构rna)的基因表达盒导入到植物中,害虫取食这种含害虫基因dsrna/hprna植物材料后,摄入的dsrna/hprna会引起害虫的rnai,有可能会起到抑制昆虫生长发育甚至杀死害虫的作用,从而达到保护植物的目的。
2007年,maoyb等在棉花中表达与棉酚解毒代谢直接相关p450基因(cyp6ae14)的dsrna,饲喂棉铃虫后,cyp6ae14基因的表达水平显著降低,同时棉铃虫对棉酚的耐受性减弱,提高了棉酚对棉铃虫的毒性【非专利文献:maoyb,caiwj,wangjw,etal.silencingacottonbollwormp450monooxygenasegenebyplant-mediatedrnaiimpairslarvaltoleranceofgossypol.natbiotechnol,2007,25(11):1307-1313.】。同年,baum等先通过饲喂dsrna试验从玉米根萤叶甲的290个候选靶标基因筛选出液泡atp酶基因(vacuolaratpase,v-atpase),然后将其转入玉米使转基因植株表达dsrna,结果表明在防治玉米根萤叶甲有很好的效果【非专利文献:baumja,bogaertt,clintonwetal.controlofcoleopteraninsectpeststhroughrnainterference.natbiotechnol,2007,25:1322-1326.】。上述奠基性工作开创了植物抗虫基因工程研究领域的一个热点。
植物介导的rnai技术具有抗虫基因来源广、基因特异性强、残留低等优点。然而正是由于基因来源广泛,寻求合适的靶标基因成为该技术的关键点和难点。
几丁质脱乙酰基酶(chitindeacetylase,cda)参与昆虫几丁质的降解与修饰,催化几丁质转化为壳聚糖(其中的n-乙酰基葡糖胺的乙酰基的水解)。cda的对昆虫生长发育的重要作用已经得到证实。
2005年guo等首次在粉纹夜蛾中肠cdna文库中分离到cda的cdna序列,此基因编码的蛋白质能与几丁质相互结合,提出该蛋白的功能可能与围食膜的形成及更新有关。此后,在多种昆虫上进行了cda编码基因的分子克隆及其表达分析研究。
昆虫cda分为五类(group)。第1类和第2类含三个结构域:几丁质结合围食膜a结构域(chitinbindingperitrophin-adomain,chbd),低密度脂蛋白a类受体结构域(low-densitylipoproteinreceptorclassadomain,ldla)和多糖脱乙酰基酶催化结构域(polysaccharidedeacetylasecatalyticdomain,cda);第3类和第4类都没有ldla结构域、有cda与chbd结构域,但二者结构域的位置存在较大差异;第5类cda只具有cda结构域。在此基础上,可将第1类进一步分成两个亚组(ia、ib),还发现在ib亚组存在选择性剪接。五类cda反映了昆虫cda的进化关系,并且在不同物种昆虫生长发育中发挥着重要的作用。
棉铃虫(helicoverpaarmigera)是一种重要的农业害虫,危害棉花、玉米等多种农作物。上世纪90年代棉铃虫大爆发曾给我国棉花生产带来极大损失。转基因抗虫棉及其他措施的应用使得棉花生产得以平稳发展至今。将来源于苏云金芽孢杆菌的杀虫蛋白δ-内毒素编码基因(bt基因)通过转基因技术导入到农作物,使农作物能够表达杀虫蛋白以达到防治害虫的目的。除了bt基因外,一种来自于豇豆的蛋白酶抑制剂(cpti)基因也被用于我国的转基因抗虫棉品种。但是,当前转基因抗虫棉面临着抗虫性不理想、昆虫抗性进化、优良抗虫基因较单一等问题,亟待开发新的抗虫基因及方法。
发明人在棉铃虫转录组数据发掘、基因克隆以及植物介导的rnai研究中发现,棉铃虫的几丁质脱乙酰基酶5a基因可成为植物介导的rnai的理想靶标基因,目前,还没有将棉铃虫几丁质脱乙酰基酶5a基因作为rnai靶标基因来提高植物抗虫性的相关报道。
技术实现要素:
本发明的目的就是提供一种利用rna干扰技术提高植物抗虫性的方法及其专用dna片段,以解决现有转基因植物抗虫性不理想、昆虫抗性进化、优良抗虫基因较单一的问题。
本发明的目的是通过以下技术方案实现的:一个如式(i)所示的dna片段:
seq正向-x-seq反向(i)
其中,seq正向是棉铃虫几丁质脱乙酰基酶5a基因的全长cdna片段中的至少包括21bp的任何一段;seq反向与所述seq正向反向互补;x是seq正向与seq反向之间的间隔序列,x与所述seq正向和seq反向均不互补,且x的长度≥10bp;所述棉铃虫几丁质脱乙酰基酶5a基因的全长cdna如序列表中的序列1所示。
进一步地,所述seq正向的核苷酸序列如序列表中序列2所示。
一种含有上述dna片段的重组载体。
所述重组载体通过如下方法构建:将序列表中序列2所示的dna片段同时以正向和反向的方式插入到prnai-gg上,从而构成植物遗传转化载体。
棉铃虫几丁质脱乙酰基酶5a基因作为rna干扰靶标基因在提高植物抗虫性中的应用。
一种提高植物抗虫性的方法,将上述的dna片段导入目的植物中得到转基因植物,所述转基因植物的抗虫性高于所述目的植物。
进一步地,上述的dna片段是通过所述的重组载体导入目的植物中的。
进一步地,所述抗虫是指抗鳞翅目的昆虫。进一步地,所述抗虫是指抗鳞翅目昆虫的幼虫。更进一步地,所述抗虫是指抗棉铃虫的幼虫。
进一步地,所述目的植物为可以被上述昆虫所取食的植物。更进一步,所述目的植物为陆地棉。
本发明的方法具体包括以下步骤:
1、获取基因序列
通过设计合成引物,然后对棉铃虫mrna进行反转录-多聚酶链式反应(rt-pcr),或者通过化学合成,得到棉铃虫几丁质脱乙酰基酶5a基因序列(hacda5a基因,如序列表中序列1所示)。
2、靶标序列的选取及棉铃虫5a型几丁质脱乙酰基酶特异dsrna表达序列结构的设计
(1)获得上述dna序列后,选取其中的部分序列作为靶标序列,要求长度不短于21碱基对(bp),通过pcr技术扩增得到靶标序列;
(2)利用dna重组技术,将靶标序列构建成植物hprna(发卡rna)表达结构,表达结构如式(i)所示:
seq正向-x-seq反向(i)
其中,所述seq正向的核苷酸序列如序列表中序列2所示,seq反向和seq正向为序列相同、方向相反的序列,x序列为长度不短于10个核苷酸对(bp)且与seq正向和seq反向均不互补的任意dna序列。
3、载体构建及植物转化
将含有上述表达结构的重组表达载体通过农杆菌介导法、基因枪法、花粉管通道法等成熟的植物遗传转化技术导入到目标植物中,从而提高目的植物对有关害虫的抗性。表达载体骨架可为prnai-gg,将序列表中序列2所示的dna片段同时以正向和反向的方式插入到prnai-gg上,从而构建含有上述表达结构的重组表达载体。
4、抗虫性验证试验及适用对象
本发明适用于的植物是能进行转基因操作的任意植物。常见转基因植物对象包括棉花、玉米、水稻、小麦、番茄、马铃薯、大豆、杨树等。防治对象可以是任何取食转基因植物、且能引起rnai效应的害虫。常见的害虫包括来自于鳞翅目、鞘翅目、等翅目、双翅目、膜翅目、直翅目、半翅目、缨翅目等类群的植食性昆虫或农业害虫。本发明的具体流程参见图1所示。
本发明首次将棉铃虫几丁质脱乙酰基酶5a基因作为rna干扰靶标基因,并应用于培育抗虫性提高的转基因植物中。本发明对鳞翅目昆虫的幼虫具有较好的抗虫性,能够大大降低昆虫对植物的侵害,更具针对性。实验证明,接种到野生型烟草上的棉铃虫幼虫生长繁殖正常,而转基因烟草上的棉铃虫幼虫生长发育受到严重抑制,转接后2天到5天棉铃虫幼虫的体重小于对照组体重的1/10;将野生型与转基因烟草叶片混合喂食棉铃虫幼虫,棉铃虫对转基因烟草叶片表现出极强的拒食现象;喂食5天转基因烟草叶片上的幼虫死亡率达到68%,野生型烟草只有21%。
附图说明
图1为本发明方法的流程示意图,图中:①和②为靶标序列,序列相同方向相反,③为起间隔作用的内含子序列。
图2为prnai-gg-hacda5a质粒图谱。
图3为prnai-gg-hacda5a转基因烟草的pcr检测结果,图中:“+”:阳性对照;1-9:待检测植株且为卡那霉素抗性阳性植株;m:markerdl2000;n1:野生型烟草阴性对照;n2:无模板阴性对照。
图4为转基因烟草的rt-pcr检测结果,图中:“+”:阳性对照;1-11:待检测植株且为阳性植株;m:markerdl2000;n1:野生型烟草;n2:无模板。
图5为棉铃虫饲喂实验中咬噬烟草叶片的照片。
图6为饲喂野生烟草与转基因烟草棉铃虫幼虫体重变化图。
图7为连续饲喂5天野生烟草与prnai-gg-hacda5a转基因烟草后棉铃虫死亡率对比图。
图8为野生烟草与转基因烟草对比饲喂试验的照片。其中:左图为转基因(5a,下)与非转基因(wt,上)烟草叶片饲喂棉铃虫幼虫12小时的照片,右图为转基因(5a,下)与非转基因(wt,上)烟草叶片饲喂棉铃虫幼虫60小时的照片。
图9为实施例5中不同时间棉铃虫hacda5a基因的相对表达量对比图。
具体实施方式
下面结合具体实施例对本发明的技术方案进行详细说明。本发明实施例中未提到的试验条件和操作均按本领域常规方法进行,本领域技术人员可参照相关技术书籍实施,如:格林、萨姆布鲁克等著《分子克隆实验指南》第4版(2017),等。
实施例1
采用rt-pcr(反转录-多聚酶链式反应)技术得到基因序列。
1、pcr引物设计
棉铃虫几丁质脱乙酰酶5a基因(hacda5a)pcr引物序列为cda5af:5'-atgaagttgttcgggcttcttg-3',cda5ar:5'-cagttgtagatttattgtccaag-3'。
2、棉铃虫总rna提取及cdna合成及扩增
用trizol试剂提取5龄棉铃虫总rna,用反转录酶合成cdna第一链。pcr反应体系:2μl10×buffer、lμmol/l上/下游引物、0.1mmol/ldntps、1单位taq聚合酶、0.5μlcdna、用ddh2o补足至20μl。pcr反应程序:94℃预变性3min,94℃变性30s,52℃退火30s,72℃延伸2min,35个循环;最终延伸72℃,10min。
3、pcr产物回收、ta克隆及鉴定
采用硅胶柱法分别回收pcr凝胶电泳产物,然后与t载体连接。连接体系为(10μl):1μlt载体、1μlt4dna连接酶、1μl10×t4连接酶buffer、7μl回收产物。将配制好的连接体系放置16℃进行过夜连接后,用热激法转化到大肠杆菌(dh5α)中。用引物cda5af/cda5ar对抗性菌落进行pcr鉴定,将pcr阳性克隆送生物公司测序,即可得到所述的基因序列(如序列表序列1所示)。
实施例2
1、靶标序列的制备
采用pcr技术扩增上述阳性克隆以制备靶标序列,引物序列分别为:
cdai5af:5'-accaggtctcaggagatgaagttgttcgggcttcttg-3',
cdai5ar:5'-accaggtctcatcgttactccaagccatattcctg-3’,
引物5'端15个碱基的小写部分为goldengate克隆技术所需要的部分序列。扩增的靶基因序列大小为578bp(hacda5a,序列表中序列2所示)。
2、pcr扩增获得靶标基因片段
pcr扩增体系均为:质粒模板0.6μl,对应的上、下游引物各2.4μl,2×taqmstermix15μl,ddh2o补足30μl;pcr扩增程序为:95℃,3min;95℃,30s;52℃,30s;72℃,40s,35个循环;72℃,10min。将扩增的pcr产物进行琼脂糖凝胶电泳,按照凝胶回收试剂盒说明书回收符合预期大小的dna电泳条带。
实施例3
植物hprna表达载体的构建
本实施例所用的植物表达载体骨架为prnai-gg,该载体质粒上有一个hprna表达盒:camv35s起动子驱动、nos终止子终止转录;转录区有两个由内含子序列间隔开的细菌ccdb基因;每个ccdb基因序列两端各有两个bsai内切酶(iis类型)识别位点。
采用goldgate技术构建植物表达载体。将靶标序列pcr扩增产物与prnai-gg质粒置于一管中,同时加入bsai和t4dna连接酶(使用t4连接酶反应缓冲液)进行goldengate反应,反应体系为:prnai-gg质粒200ng,靶标序列pcr产物50ng,t4ligase350u(takara公司),t4ligasebuffer1μl(takara公司),bsai5u(neb公司),ddh2o补足10μl。之后经过转化、测序鉴定等步骤,可以构建成靶标序列的hprna表达载体。其中prnai-gg-hacda5a图谱如图2所示。
实施例4
植物表达载体转化烟草
1、采用农杆菌介导的烟草遗传转化技术
利用电激转化法把构建成的质粒载体导入到农杆菌lba4404感受态细胞中,以进行农杆菌介导的烟草遗传转化实验。本实施例所转化的植物为烟草,本发明的转基因对象不限于烟草。
获得烟草无菌苗:取野生型烟草种子置于1.5ml微量离心管中进行消毒处理:首先用体积分数为70%的乙醇溶液清洗30s,然后用无菌水冲洗三次,之后用浓度为10%的次氯酸钠溶液震荡清洗10min,最后用无菌水清洗五次用于培养无菌烟草植株。待无菌烟草植株叶片长至一定大小后,用刀和镊子在超净工作台中切取面积约为1cm2无菌叶片用于组织培养。
取含有prnai-gg-hacda5a质粒的农杆菌(lba4404)菌液进行活化,然后转接入体积为300ml的lb培养基上进行培养,待农杆菌od600=0.8时分装菌液进行离心,富集菌体,将其配制成一定浓度的农杆菌悬浮液用于侵染烟草叶片。经过预培养、暗培养和选择培养阶段,获得了从愈伤组织上分化形成的不定芽,将其移入生根培养基中进行生根培养,待其分化生根且叶片数量长至4-6片的时候移栽入土壤中继续培养用于抗虫试验。
2、转基因烟草的pcr检测
提取转基因烟草植株的基因组dna进行pcr检测。经过pcr鉴定,获得转hacda5a基因阳性植株9株。阳性转基因烟草基因组dna扩增条带大小与阳性质粒扩增条带大小一致,野生型烟草基因组dna和无模板阴性对照均没有出现对应大小的阳性条带。转prnai-gg-hacda5a载体烟草植株检测结果如图3所示,模板依次为阳性质粒(+)、待检测转基因烟草叶片基因组dna(1-11)、野生型烟草叶片基因组dna(n1)和无模板阴性对照(n2)。
3、转基因烟草的rt-pcr检测
取转基因烟草植株和野生型烟草植株的叶片在液氮中充分研磨,按照trizon(北京康为世纪公司)总rna提取试剂说明书提取烟草叶片总rna。进行琼脂糖凝胶(1%)电泳观察rna的质量;用核酸测定仪测定rna在260nm和280nm处的吸光值以及a260/280和a260/230的值。取两种检测方法检测均符合要求的烟草rna合成cdna第一链。以cdna第一链作为模板进行rt-pcr检测(野生型烟草cdna以及无模板体系为阴性对照),所用引物为扩增目的基因的特异性引物,以在转录水平上鉴定转基因烟草植株。转prnai-gg-hacda5a载体烟草植株检测结果如图4所示。
实施例5
1、hacda5ahprna表达植株抗虫性分析
本实施例所涉及害虫为棉铃虫,本发明防治对象不限于棉铃虫。
将转基因烟草植株种子种在含卡那霉素的ms抗性平板上,对发芽率进行统计学分析,筛出转基因单拷贝的t2代转基因烟草植株。随机选择3株长势一致、且为单拷贝插入的转基因烟草植株进行棉铃虫饲喂实验,以野生型烟草植株作为对照株系,一共分为2组(实验组和对照组)。试验中,将棉铃虫卵放于培养条件设置好的人工气候箱中进行避光孵化,待其初孵后按照上述两组不同处理进行虫试分析。
将初孵一龄棉铃虫幼虫接于人工饲料上。待生长至二龄期,选取大小接近的幼虫接于新鲜的转基因、野生型烟草叶片上进行饲喂。叶片置于玻璃培养皿中,每个培养皿接12条,实验组与对照组均分别设三组重复,一共36条。饲喂期间每天更换新鲜烟草叶片并记录棉铃虫幼虫体重变化,同时计算死亡率,饲喂结果如图5所示。实验设置三个生物学重复。实验证明,接种到野生型烟草上的棉铃虫幼虫生长繁殖正常,而转hacda5ahprna基因烟草上的棉铃虫幼虫生长发育受到严重抑制,转接后2天到5天棉铃虫幼虫的体重小于对照组体重的1/10(如图6所示);5天后转基因烟草叶片上的幼虫死亡率达到68%,野生型烟草只有21%(如图7所示);将野生型与转基因烟草叶片混合喂食棉铃虫幼虫,棉铃虫对转基因烟草叶片表现出极强的拒食现象(如图8所示)。
2、棉铃虫幼虫靶标基因的沉默效率检测
将初孵化的一龄期幼虫接于棉铃虫人工饲料上,待幼虫生长至二龄期的时候,选取大小相同的棉铃虫幼虫分别接种于新鲜的转基因、野生型烟草叶片上进行饲喂,每12h更换一次新鲜叶片,收集24h、48h、60h的棉铃虫幼虫,每次收集3只置于离心管中,迅速冻于-80℃冰箱中。设置三个生物学重复。
提取收集的棉铃虫幼虫的rna进行反转录获得棉铃虫的cdna第一链,具体操作步骤参照说明书。用beacondesigner软件设计引物进行荧光定量pcr实验检测饲喂转基因烟草对目的基因的沉默效率,内参基因为β-actin,采用sybrgreen法。荧光pcr引物序列:cda5aqf:5'-agaactcctcaaacctactg-3',cda5aqr:5'-tactccaagccatattcctg-3'。棉铃虫β-actin序列:引物β-actinf:5'-ctgaccgtatgcagaaggag-3',β-actinr:5'-cacaagcgtaatttgagcc-3'。
荧光pcr体系为:10μlsybrgreenmastermix,0.5μmol/l上/下游引物,0.5μlcdna,用ddh2o补足20μl。荧光pcr程序为:5℃预变性5min,95℃变性10s,53℃退火10s,72℃;延伸15s,45个循环。每个样品进行3个生物学重复,用无转录反应模板和无模板作阴性对照。2-△△ct的方法分析不同的棉铃虫hacda5a基因在不同饲喂时间的相对表达量的变化,以最低表达量为1,用microsoftexcel(2007)对实验数据进行处理,spss软件对数据进行显著性分析,p<0.05为显著性差异。靶标基因沉默最大接近55%。结果如图9所示。
对比例1
以hacda1基因为靶标基因,参照实施例1~5的操作步骤获得hacda1hprna表达植株并对其抗虫性进行研究,其中,hacda1基因的cdna合成引物为hacda1基因icd1f:5'-ggttttgttcataatgtc-3';icd1r:5'-atcaacaacaacaacatc-3'。hacda1基因靶标序列合成引物为cdai1f:5'--accaggtctcaggagggttttgttcataatgtc-3',
cdai1r:5'-accaggtctcatcgtatcaacaacaacaacatc-3',所得的靶标序列如序列表序列3所示,扩增的靶基因序列大小为643bp。对最终得到的转hacda1hprna基因烟草进行棉铃虫饲喂实验,结果如图5所示。由对比效果可以看出,转基因植物的抗虫性具有不可预期性,本发明的应用hacda5a基因提高植物抗虫性的方法具有突出的抗虫效果。
sequencelisting
<110>河北大学
<120>一种利用rna干扰技术提高植物抗虫性的方法及其专用dna片段
<130>2-2
<160>3
<170>patentinversion3.3
<210>1
<211>1173
<212>dna
<213>hacda5a
<400>1
atgaagttgttcgggcttcttgctttgttgctggtagcttcggccttcgctgatgactct60
tcgtcttcagaagaagaaaatgagggcctgcctttggcagaggcctgtgaccaggaagct120
tgcagcttgcctgactgcggatgttccagcaccaacattcccggaggattgaacccacga180
gatataccacagttcgtaactgtcaccttcgacgatggtgttaacgtgaacaacattatc240
acttaccgcaacatcctgtacaaccgactgaactccaacggctgtcccgctggagttacc300
ttcttcgtcagccacgagtacaccaactatgctctcatcaacgagctctataaccagggc360
ttcgaaattgccctacactccatcagtcacagaactcctcaaacctactggttcgaagcc420
accaaagaagttatcaaggaagaaattgctgaccagaaagcccagatggctcacttcgct480
aacattcctcccagcgccattaaaggtgttcgcatgcccttcctccaattggctggcaac540
gctagcttcgaagtcatgcaggaatatggcttggagtacgattgcacttggcctacgatc600
gcccacacaaacccaggactatggccttacaccctggactacgcttcgacccaggactgc660
atcattcctccctgcccatctgcctccatccctggagtttgggttaagcctatggttgcc720
tggtctgacctcaacggagttccttgctcaatggttgacgcttgcttcttcatccctgac780
cgcgaaaatgaagaggaatggtacaagttcatcctcagcaacttcgagaggcactacttg840
ggcaaccgtgctcccttcggcttctacgtccacgaggccttcttggctgccaaccctgcc900
gtcaaccgtgcgctagttcgcttcatggatctggtcaacaatctgaatgatgctttcatg960
gtgaacgcccacgaagtcgtcgactgggttaagaacccgaagccactcaatgagtacagg1020
agccaaggctgccgcagcttcagcccttcaacctgcaaccccaacaactgtggtcctctc1080
ttctccacacacaatcaattggcttactacatgcaagtatgcagcgcttgtcctaacaac1140
tacccatgggtcggcaatcctcttggacaataa1173
<210>2
<211>578
<212>dna
<213>hacda5a
<400>2
atgaagttgttcgggcttcttgctttgttgctggtggcttcggtcttcgctgatgactct60
tcgtcgtcagaagaagaaaatgagggcctgcctttggcagaggcctgtgaccaggaagct120
tgcagcttgcctgactgcagatgttccagcaccaatattcccggaggattgaatccacga180
gatgtaccacaattcgtaactgtcaccttcgacgatggtgttaacgtgaacaacattatc240
acttaccgcaacatcctgtacaaccgcttgaactccaacggctgtcctgccggagtcacc300
ttcttcgtcagtcatgagtacaccaactatgctctcatcaacgagctttataaccagggc360
ttcgaaatcgccctgcactccatcagccacagaactcctcaaacctactggtttgaagcc420
accaaagaggttatcaaggaagaaatcgctgaccagaaagcccagatggctcacttcgct480
aacattcctcccagtgccattaagggtgttcgcatgcccttcctccaattggcaggcaac540
gctagcttcgaaatcatgcaggaatatggcttggagta578
<210>3
<211>643
<212>dna
<213>hacda1
<400>3
atcaacaacaacaacatcgaactttacaaagagatcttcaacggaaaacgtaaaaacccc60
aacggttgcgacattaaggccacatactttatttcgcacaagtacaccaactactcggct120
gttcaggaaactcacagaaagggacatgaaatcgctgtacactcaatcacgcacaacgat180
gacgaacgcttctggagcaacgctaccgttgacgactggggcaaggagatggccggtatg240
agagtcatcatcgagaagttctcgaacatcactgacaacagtgtcgtgggtgtgcgagcg300
ccgtacctccgtgtcggtggtaacaaccagttcaccatgatggaagagcaagccttcttg360
tatgacagcaccatcactgctcccctgtccaacccgccgctatggccatacactatgtac420
ttcagaatgcctcaccgttgtcacggaaacctgcagagctgccccaccaggagccacgcc480
gtgtgggagatggtgatgaacgaacttgaccgtcgtgaggaccccaccaacgatgagtac540
ttgcctggatgcgccatggttgactcttgttctaacattttgacaggagatcagttctac600
aacttcctcaaccacaacttcgacagacattatgaacaaaacc643
- 还没有人留言评论。精彩留言会获得点赞!