一种赭曲霉毒素水解酶及其编码基因、重组载体及应用的制作方法
本发明涉及一种赭曲霉毒素水解酶及其编码基因、重组载体及应用,属于酶工程技术领域。
背景技术:
赭曲霉毒素水解酶是可以水解赭曲霉毒素的酶的统称,广泛的存在于真菌、植物、昆虫和细菌中,自发现以来一直是生物、化学和环境科学领域的研究热点。
赭曲霉毒素有多种结构类似物,其中以赭曲霉毒素a(ochratoxina,ota)的毒性最强且在自然界中的分布最广,对人和动植物的影响最大。ota主要是黑曲霉、赭曲霉、炭疽菌和疣状青霉菌产生的一类毒性化合物,广泛存在于各种食品、饲料及其他农副产品中。研究表明,ota的主要靶器官是人和动物的肾脏和肝脏,用酶联免疫吸附法及高效液相色谱法检测发现ota进入小鸡体内后广泛分布于各个器官,并且它还有致畸性、致癌性和致突变的作用,赭曲霉毒素a已被国际癌症机构列为2b类致癌物质(即对人类可能致癌,证据尚不充分,全球已鉴定的有267种)。由此可见,ota的防治与脱毒变得对于食品、环境安全十分重要,开发绿色高效的脱毒方法对于保障人体的健康与安全意义重大。
现阶段常采用的赭曲霉毒素a的脱毒方法包括:物理吸附法和化学分解法,能够有效的降低赭曲霉毒素a在食品及饲料中的污染浓度,但是这些脱毒方法通常仍具有花费昂贵、脱毒难以彻底以及处理过程中会引起食品及饲料的感官变化,导致其营养成分发生流失等问题。
生物脱毒相对于物理和化学脱毒而言,具有经济、安全高效、可持续性、能够将剧毒化合物转化为无毒或低毒化合物,避免造成环境污染等优势,近年来被认为是去除或控制赭曲霉毒素a污染最有前途的方法之一。筛选生物脱毒酶、及其基因,完善脱毒酶的生物学功能,为生物脱毒解毒技术积累关键性的检测评估生物材料及配套技术,将有效地促进我国生物脱毒技术的发展。
技术实现要素:
为解决上述问题,本发明提供一种来源于寡养单胞菌的赭曲霉毒素水解酶,其在原核表达系统中实现了异源高效表达,易于后期的纯化和酶制剂的制备。该酶对底物ota的12小时降解效率可以达到60%,商业化生产成本低。
本发明的第一个目的是提供一种赭曲霉毒素水解酶,编码所述赭曲霉毒素水解酶的基因的核苷酸序列如seqidno.1所示。
进一步地,所述的赭曲霉毒素水解酶来源于寡养单胞菌(stenotrophomonassp.)。
进一步地,所述的赭曲霉毒素水解酶可以是重组蛋白、天然蛋白或合成蛋白,可以是纯天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主中产生。根据重组生产方案所用的宿主,本发明的肽蛋白可以是糖基化的。
本发明的第二个目的是提供编码所述赭曲霉毒素水解酶的基因。
本申请发明人将本发明的赭曲霉毒素水解酶的氨基酸序列和核苷酸序列经蛋白质数据库和核苷酸数据库分别进行搜寻比较发现其属于水解酶的一种,命名为cpna117。
本发明的第三个目的是提供一种携带所述基因的重组载体。
进一步地,所述的载体为细菌质粒、噬菌体、酵母质粒、植物细胞病毒或哺乳动物细胞病毒。
本发明中,编码赭曲霉毒素水解酶的核苷酸序列可插入到载体中,以构成含有本发明所述多核苷酸的重组载体。“载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其它载体。在本发明中适用的载体还包括但不限于:在细菌中表达的基于t7启动子的表达载体;在哺乳动物细胞中表达的pcdna3.1载体和在昆虫细胞中表达的来源于杆状病毒的载体。总之,只要能在宿主体内复制和稳定,任何质粒和载体都可以用于构建重组表达载体,优选pet载体系列以及其它原核表达载体系列。
本领域的技术人员熟知的方法能用于构建含编码赭曲霉毒素水解酶的dna序列和合适的转录/翻译调控元件的表达载体。这些方法包括体外重组dna序列、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna的合成。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;噬菌体的pl启动子;真核启动子包括cmv早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、反转录病毒的ltrs和其它一些已知的可控制基因在原核细胞或真核细胞或其病毒中表达的启动子。表达载体还包括翻译起始用的核糖体结合位点和转录终止子等。在载体中插入增强子序列将会使其在高等真核细胞中的转录得到增强。增强子是dna表达顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。可举的例子包括在复制起始点晚期一侧的100到270个碱基对的sv40增强子、在复制起始点晚期一侧的多瘤增强子以及腺病毒增强子等。
此外,表达载体优选包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白,或用于大肠杆菌的卡那霉素或氨苄青霉素等。
本发明的第四个目的是提供一种表达所述赭曲霉毒素水解酶的重组菌。
进一步地,是以细菌、真菌、植物、昆虫或动物细胞为宿主细胞。
本发明中,编码赭曲霉毒素水解酶的多核苷酸或含有该多核苷酸的重组载体可转化或转导入宿主细胞,以构成含有该核苷酸或重组载体的基因工程化宿主细胞。“宿主细胞”指原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表例子有:大肠杆菌,链霉菌属;细菌细胞如鼠伤寒沙门氏菌;真菌细胞如酵母;植物细胞;昆虫细胞如果蝇s2或sf9;动物细胞如cho、cos或bowes黑素瘤细胞等。
用本发明所述的dna序列或含有所述dna序列的重组载体转化宿主细胞可用本领域技术熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的本领域众所周知,可供选择的是用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,或者常规机械方法如显微注射、电穿孔、脂质体包装等。
通过常规的重组dna技术,利用本发明的多核苷酸序列可用来表达或生产重组的赭曲霉毒素水解酶。一般来说有以下步骤:
(1)用本发明的编码赭曲霉毒素水解酶的多核苷酸,或用含有该多核苷酸的重组表达载体转化或转染合适的宿主细胞;
(2)在合适的培养基中培养宿主细胞;
(3)从培养基或细胞中分离、纯化蛋白质。
在步骤(2)中,根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞的条件下进行培养。当宿主细胞生长在适当的细胞密度后,用合适的方法诱导选择的启动子,将细胞再培养一段时间。
在步骤(3)中,重组酶可包被于细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法包括但不限于:常规的复性处理、蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超声波处理、超离心、亲和层析、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
本发明的第五个目的是提供所述的赭曲霉毒素水解酶在降解赭曲霉毒素中的应用。
进一步地,所述的应用包括降解粮食或茶叶中的赭曲霉毒素。
本发明的第六个目的是提供一种包含所述赭曲霉毒素水解酶的酶制剂。
本发明的有益效果是:
本发明提供了一种赭曲霉毒素水解酶及其编码基因,还提供了该赭曲霉毒素水解酶在水解赭曲霉毒素、粮食和农副产品赭曲霉毒素生物脱毒中的应用。该赭曲霉毒素水解酶在温和条件下处理赭曲霉毒素12小时,ota的降解率达到60%,这个降解效率在本领域具有较好的应用前景。
附图说明
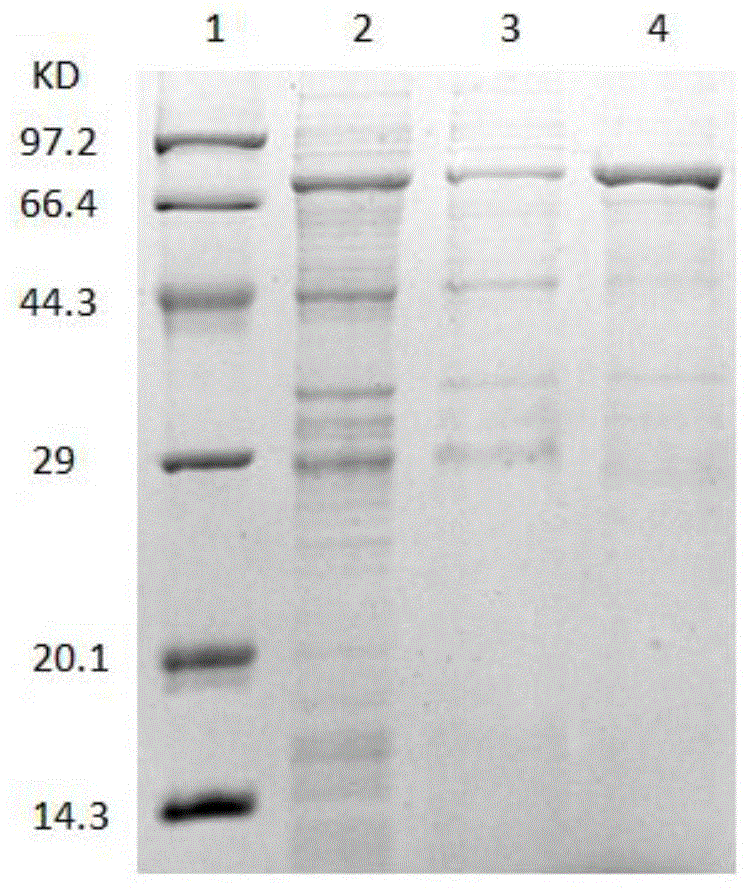
图1为原核表达的赭曲霉毒素水解酶蛋白纯化后的sds-page图;其中,1蛋白marker;2rcpna2穿透峰样液;3rcpna2淋洗流出液;4洗脱蛋白(纯化蛋白);
图2为原核表达的赭曲霉毒素水解酶细菌破碎后的上清液对ota的降解效果;
图3为赭曲霉毒素水解酶对小麦粉中赭曲霉毒素a的降解效果;
图4为赭曲霉毒素水解酶对茯砖茶中赭曲霉毒素a的降解效果。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
赭曲霉毒素水解酶的氧化活性鉴定方法和降解afb1活性测定方法如下:
赭曲霉毒素水解酶活性测定方法如下:
含有pgex-4t-1/cpna117表达载体的转化株e.colibl21(de3)在最适条件下进行表达,取10μl表达菌液的破碎后上清液置于2ml离心管中,加入至490μl赭曲霉毒素a标准缓冲液(使用1*pbs配置ph7.3),赭曲霉毒素a的终浓度约为15μg/l,反应12h,向反应体系中加入1.5ml的乙腈停止反应。使用高效液相色谱检测ota的残留量,实验结果表明,反应12h后,该重组酶粗酶液对ota的降解率达到60%。空白对照组为含有pgex-4t-1空质粒的e.colibl21(de3)破碎后上清液,对照组破碎后粗酶液并无赭曲霉毒素a水解活性。
实施例1:赭曲霉毒素水解酶基因的cdna合成与克隆
菌株来源于实验室前期得到的寡养单胞菌,通过基因序列测定,分析得到赭曲霉毒素水解酶基因的开放式阅读框核苷酸序列,设计扩增出完整编码阅读框的引物上游引物(cpna117-f)(seqidno.2):5’-cgcggatccatgatccgcaagaccgttctgt-3’;下游引物(cpna117-r)(seqidno.3):5’-ccgctcgagtcagccggcgccgccgt-3’,在上游和下游引物上分别引入限制性内切酶位点(可视选用的载体而定,本发明中添加了bamhi和xhoi酶切位点,已用下划线标出,斜体序列为保护碱基)。通过体外扩增技术获得编码赭曲霉毒素水解酶的基因,其核苷酸序列如seqidno.1所示。在保证阅读框架正确的前提下构建好表达重组质粒pgex-4t-1/cpna117,再将其转入e.coilbl21(de3)中。序列分析得出,该cpna117酶的理论等电点6.12,理论分子量为46.39kda。
实施例2:寡养单胞菌赭曲霉毒素水解酶基因的异源表达
将实施例1中获得的e.coilbl21(de3)/pgex-4t-1/cpna117转化株在100ml含100μg/ml氨苄青霉素的lb液体培养基中摇床过夜培养。吸取1.0ml种子菌液接种于新鲜的100mllb液体培养基(含有100μg/ml氨苄青霉素)中,37℃温度下,180r/min震荡培养。当菌液od600达到0.6时,加入0.2mmol/ml的iptg在16℃条件下诱导表达4h。在7000r/min的转速下冷冻离心10min,弃尽上清。用10ml的1×磷酸盐缓冲液(pbs)悬浮菌体,在冰浴条件下超声波破碎菌体。离心,取上清。sds-page电泳结果显示菌体破碎后的上清液中含有该酶,其(包含gst标签26kda)表观分子量约为73kda(图1),与理论分子量相符。
实施例3:异源重组水解酶在赭曲霉毒素a生物脱毒中的应用
1、实验材料
酶制剂为pgex-4t-1/cpna117转化株表达后的破碎后上清液粗酶液,其他试剂均为分析纯化学试剂。
2、实验方法
取10μlpgex-4t-1/cpna117转化株表达后的破碎上清液置于2ml离心管中,加入至490μl赭曲霉毒素a标准缓冲液(使用1*pbs配置ph7.3),赭曲霉毒素a的终浓度约为15μg/l,在35℃条件下,反应12h,以空质粒pgex-4t-1作为对照,每组设三个平行。向反应体系中加入1.5ml的乙腈停止反应。使用高效液相色谱检测ota的残留量,实验结果表明,反应12h后,该破碎后的上清液将ota降解率达到60%(图2)。
实施例4:异源重组水解酶在赭曲霉毒素污染粮食生物脱毒中的应用
1、实验材料
酶制剂为pgex-4t-1/cpna117转化株表达后的破碎上清液粗酶液,实验材料为小麦粉。其他试剂均为分析纯化学试剂。
2、实验方法
向50ml磷酸盐缓冲液中加入适量ota标准储备液,混匀后立即倾注于500g已粉碎好的小麦粉样品中,搅拌均匀,使ota的终浓度达到80.0μg/kg,于阴凉通风处晾干待用。取200ml酶制剂与200g预制备好的毒素污染小麦粉混合均匀,将配制好的样品在37℃条件下培养,于0h、6h、12h、24h取样,每个降解实验设置3个重复。同时,以200ml新鲜缓冲液与200g预制备好的毒素污染小麦粉混合均匀混合作为阴性对照处理。处理组和空白对照组每次取样20g,立即依据赭曲霉毒素标准检测方法进行提取、净化和分析。
毒素的提取与纯化。准确称取10g培养后的样品于150ml具塞三角瓶内,加入1gnacl和20ml甲醇-水混合液(体积比4:1),常温震荡提取30min,取下瓶塞经曹纹滤纸过滤于干净的杯子中(或在3000r/min下常温离心5min),准确移取5.0ml上清液并加入20ml纯水稀释混匀,经玻璃纤维滤纸过滤1-2次至滤液澄清,进行免疫亲和柱纯化操作。
准确移取10.0ml(代表1.0g样品)上述澄清滤液,注入玻璃注射器中,调节压力使溶液以1-2滴/秒的流速缓慢通过免疫亲和柱,直至有部分空气通过柱体,以10ml纯水淋洗柱子(重复一次),弃去全部流出液并使部分空气通过柱体。准确加入1.5ml甲醇洗脱,流速为1滴/秒,收集洗脱液于玻璃进样瓶中,进行hplc-fld检测。
赭曲霉毒素水解酶对赭曲霉毒素的动态降解曲线如图3所示,实验结果表明,赭曲霉毒素水解酶处理毒素污染的小麦粉(终浓度40μg/kg),24h对ota降解率接近46.3%。说明该赭曲霉毒素水解酶对小麦粉中赭曲霉毒素a有较好的降解效果。
实施例5:异源重组水解酶在赭曲霉毒素污染黑茶中脱毒的应用
1、实验材料
酶制剂为pgex-4t-1/cpna117转化株表达后的破碎后上清液粗酶液,实验材料为茯砖茶。其他试剂均为分析纯化学试剂。
2、实验方法
向50ml磷酸盐缓冲液中加入适量ota标准储备液,混匀后立即倾注于500g已粉碎好的茶粉样品中,搅拌均匀,使ota的终浓度达到80.0μg/kg,于阴凉通风处晾干待用。取200ml酶制剂与200g预制备好的毒素污染茶粉混合均匀,将配制好的样品在37℃条件下培养,于0h、24h、48h、72h取样,每个降解实验设置3个重复。同时,以200ml新鲜缓冲液与200g预制备好的毒素污染茶粉混合均匀混合作为阴性对照处理。处理组和空白对照组每次取样20g,立即依据赭曲霉毒素标准检测方法进行提取、净化和分析。
毒素的提取与纯化。准确称取10g培养后的样品于150ml具塞三角瓶内,加入1gnacl和20ml甲醇-水混合液(体积比4:1),常温震荡提取30min,取下瓶塞经曹纹滤纸过滤于干净的杯子中(或在3000r/min下常温离心5min),准确移取5.0ml上清液并加入20ml纯水稀释混匀,经玻璃纤维滤纸过滤1-2次至滤液澄清,进行免疫亲和柱纯化操作。
准确移取10.0ml(代表1.0g样品)上述澄清滤液,注入玻璃注射器中,调节压力使溶液以1-2滴/秒的流速缓慢通过免疫亲和柱,直至有部分空气通过柱体,以10ml纯水淋洗柱子(重复一次),弃去全部流出液并使部分空气通过柱体。准确加入1.5ml甲醇洗脱,流速为1滴/秒,收集洗脱液于玻璃进样瓶中,进行hplc-fld检测。
赭曲霉毒素水解酶对茶粉中的赭曲霉毒素动态降解曲线如图4所示,实验结果表明,该水解酶处理毒素污染的茶粉(终浓度40μg/kg)72h的降解率接近为54.5%。说明该水解酶对茶粉中赭曲霉毒素a具有高效的降解能力。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
序列表
<110>安徽农业大学
<120>一种赭曲霉毒素水解酶及其编码基因、重组载体及应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>1317
<212>dna
<213>(人工序列)
<400>1
atgatccgcaagaccgttctgttgaccgcgctgtcgtgcgccctggcccccgcggccgcg60
ctggccgccgacgcccagcgcccggaggtcgaggccgccgccgcgcgcctgcagcaccag120
gtggtggagtggcgccgcgacttccaccagcatccggagctgtccaaccgcgaggcgcgc180
accgccgccaaggtcgccgagcgcctgcgcgcgatgggcctgcagccgaagaccggggtg240
gccgtgcacggcgtggtggcggtcatcaagggcggcctgccgggcccgaagatcgccctg300
cgcgcggacatggacgcgttgccggtgaccgagcagaccgggctgccgttcgcctccacc360
gccaccgccgagtaccgcggcgagaaggtcggggtgatgcatgcctgcggccacgacgcc420
cacaccgccaccctgctcggcgtggccgatgcgctgatggcgatgcgcgacaagctgccg480
ggcgaggtgatgctgatcttccagccggccgaggagggcgcgccgccgccggagcagggc540
ggcgccgagctgatgctcaaggaagggctgttcaaggacttcaagccggaggcggtgttc600
ggcctgcatgtgttctccagcgtccaggccgggcagatcgccgtgcgcggcggcccgctg660
atggccgcctccgaccgcttctccatcaccgtcaacggccgccagacccatggttcggcg720
ccatggaacggcatcgacccgatcgtcgccgcctccgacctgatcgggaccgcgcagacc780
atcgtcagccgccgcgccaacctgtccaggcagccggcggttctgaccttcggcgcgatc840
aagggcggcatccgctacaacatcatccccgacgcggtggagatggtcggcaccatccgc900
accttcgacccggacatgcgccggcagatcttcgccgacctgcgcaacgtcgccgagcac960
accgccgccgcgcacggcgccaccgccaccaccgacatctacgagaaggacggcaacccg1020
gccacggtcaacgacccggcgctgaccgcgcgcatgctgcccagcctgcaggcggtggtc1080
ggcaaggacaacgtctacgagccgccgctgcagatgggctcggaggacttctcgctgtat1140
gcgcagcaggtgccggcgatgttcttcttcgtcggctccaccggcgccggcatcgacccg1200
gccaccgcgcccagcaaccactcgccgaagttcctgctcgacgagaaggcgctggacgtg1260
gggctgcgcgcgctgctgcaggtgtcgctggactacctgcacggcggcgccggctga1317
<210>2
<211>31
<212>dna
<213>(人工序列)
<400>2
cgcggatccatgatccgcaagaccgttctgt31
<210>3
<211>26
<212>dna
<213>(人工序列)
<400>3
ccgctcgagtcagccggcgccgccgt26
- 还没有人留言评论。精彩留言会获得点赞!