一株以甘油为底物生产丁二酸的重组菌及其构建方法与应用与流程
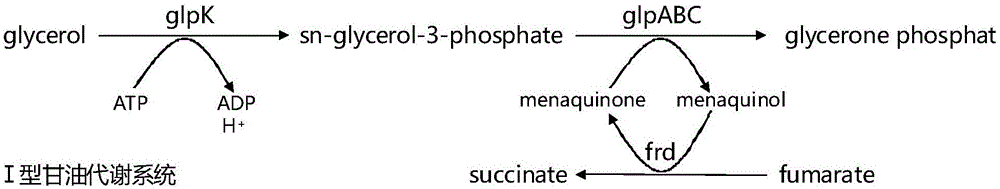
本发明属于生物技术领域,具体涉及一株以甘油为底物生产丁二酸的重组菌及其构建方法与应用。
背景技术:
丁二酸是一种重要的有机化工原料,广泛应用于农业、食品、药品工业中,是美国能源部认定的12种最具价值的大宗化学品之一。作为一种优秀的c4平台化合物,丁二酸可以用于合成环保溶剂、药剂制品和可降解塑料等多种化工产品。传统的生产丁二酸的方法是以顺丁烯二酸酐为底物通过石化法来生产,但石油价格波动、环境污染大、生产工艺复杂、生产成本高,导致丁二酸的应用受到严重限制。利用微生物发酵生产丁二酸,具有成本低、污染小、环境友好的优势,因此开发高效的生物法生产丁二酸策略具有十分重要的经济和环境效益。
到目前为止,科学家们已经构建出了许多能够高效生产丁二酸的菌株,例如经过基因工程改造的大肠杆菌escherichiacoli(tanz,zhux,chenj,etal.activatingphosphoenolpyruvatecarboxylaseandphosphoenolpyruvatecarboxykinaseincombinationforimprovementofsuccinateproduction[j].applied&environmentalmicrobiology,2013,79(16):4838-4844.)和曼海姆产琥珀酸菌mannheimiasucciniciproducens(ahnjh,jangys,sangyl.productionofsuccinicacidbymetabolicallyengineeredmicroorganisms[j].currentopinioninbiotechnology,2016,42:54-66.),但这些菌都是以葡萄糖为碳源进行琥珀酸的发酵生产。
甘油是一种在生物柴油生产过程中产生的副产物,每生产9吨生物柴油就会产生约1吨的粗甘油。随着生物柴油产量的不断增加,副产物甘油的产量也迅速增加,由于生产生物柴油时产生的粗甘油中含有盐类、甲醇、皂等杂质,所以必须精制后才能利用,但其精制成本高,在经济上并不可行。如何对副产物粗甘油进行开发利用,已成为生物柴油产业可持续发展的关键和保障。如果可以将副产物甘油通过发酵生产转化为高附加值的丁二酸,就能有效降低生物柴油的生产成本,同时也能降低丁二酸的生产成本,提升生物柴油的整体技术水平和效益。
一些瘤胃细菌如产琥珀酸放线杆菌actinobacillussuccinogenes就能够在厌氧条件下利用甘油生产丁二酸。但是以甘油为底物在厌氧条件下进行发酵时,生物质的合成会造成氧化还原的不平衡,进而抑制细胞生长(carvalhom,matosm,rocac,etal.succinicacidproductionfromglycerolbyactinobacillussuccinogenesusingdimethylsulfoxideaselectronacceptor[j].newbiotechnology,2014,31(1):133-139.)。所以产琥珀酸放线杆菌a.succinogenes和其他的一些巴斯德氏菌在以甘油为底物厌氧发酵时,都必须添加酵母提取物或者电子受体来提供细胞生长所需的物质或消耗过剩的还原力(schindlerbd,joshirv,vieillec.respiratoryglycerolmetabolismofactinobacillussuccinogenes130zforsuccinateproduction[j].journalofindustrialmicrobiology&biotechnology,2014,41(9):1339-1352.)。
即便如此,在厌氧条件下甘油产丁二酸的产量也不高,a.succinogenes生产丁二酸的产量仅有29.3g/l,生产速度为0.27g/l/h。但是甘油的还原力比葡萄糖要高,以甘油为底物产丁二酸的氧化还原是平衡的,不需要还原力回补。而以葡萄糖为底物生产丁二酸则需要进行代谢调控,从磷酸戊糖途径回补还原力来解决氧化还原不平衡的问题。目前关于甘油产丁二酸的研究都集中在两步法发酵(liq,wuh,liz,etal.enhancedsuccinateproductionfromglycerolbyengineeredescherichiacolistrains[j].bioresourcetechnology,2016,218:217-223.)、添加电子受体(schindlerbd,joshirv,vieillec.respiratoryglycerolmetabolismofactinobacillussuccinogenes130zforsuccinateproduction[j].journalofindustrialmicrobiology&biotechnology,2014,41(9):1339-1352.)或是微氧发酵(wangc,caih,chenz,etal.engineeringaglycerolutilizationpathwayincorynebacteriumglutamicumforsuccinateproductionundero2deprivtion[j].biotechnologyletters,2016,38(10):1791-1797.)等方面。但这些方法会对产量、转化率等造成一定的负面影响。
产琥珀酸放线杆菌a.succinogenes和大肠杆菌escherichiacoli中原有的代谢甘油产丁二酸的代谢通路能量供应水平低,所以菌体在厌氧发酵时生长极差,或者需要产甲酸、乙醇等杂质来供应生长代谢所需的能量。
技术实现要素:
本发明要解决的技术问题是如何提高丁二酸产量。
为了解决上述技术问题,本发明首先提供了一种重组菌的构建方法。
本发明提供的重组菌的构建方法包括如下步骤:对受体菌进行如下(1)-(3)所述的改造:
(1)抑制或降低所述受体菌中甘油激酶glpk的表达量和/或活性,或抑制所述受体菌中甘油激酶基因glpk的表达,或敲除所述受体菌中的甘油激酶基因glpk;
(2)抑制或降低所述受体菌中磷酸烯醇式丙酮酸依赖型二羟基丙酮激酶dhaklm的表达量和/或活性,或抑制所述受体菌中dhaklm基因簇的表达,或敲除所述受体菌中的dhaklm基因簇;
(3)提高所述受体菌中atp依赖型二羟基丙酮激酶dhak的表达量和/或活性,或增强所述受体菌中atp依赖型二羟基丙酮激酶基因dhak的表达;
所述受体菌为可以甘油为底物在厌氧条件下发酵生产丁二酸的菌。
上述重组菌的构建方法中,所述甘油激酶glpk为如下a1)或a2)所示的蛋白质:
a1)由genbank号为aca79690.1所示的氨基酸序列组成的蛋白质;
a2)将genbank号为aca79690.1所示的氨基酸序列经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有甘油激酶glpk活性的由a1)衍生的蛋白质;
所述磷酸烯醇式丙酮酸依赖型二羟基丙酮激酶dhaklm由dhak亚基、dhal亚基和dham亚基组成;
所述dhak亚基为如下b1)或b2)所示的蛋白质:
b1)由genbank号为ayb98152.1所示的氨基酸序列组成的蛋白质;
b2)将genbank号为ayb98152.1所示的氨基酸序列经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有dhak亚基活性的由b1)衍生的蛋白质;
所述dhal亚基为如下c1)或c2)所示的蛋白质:
c1)由genbank号为ayb98153.1所示的氨基酸序列组成的蛋白质;
c2)将genbank号为ayb98153.1所示的氨基酸序列经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有dhal亚基活性的由c1)衍生的蛋白质;
所述dham亚基为如下d1)或d2)所示的蛋白质:
d1)由genbank号为ayb98154.1所示的氨基酸序列组成的蛋白质;
d2)将genbank号为ayb98154.1所示的氨基酸序列经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有dham亚基活性的由d1)衍生的蛋白质;
所述atp依赖型二羟基丙酮激酶dhak为如下e1)或e2)所示的蛋白质:
e1)由genbank号为ari10515.1所示的氨基酸序列组成的蛋白质;
e2)将genbank号为ari10515.1所示的氨基酸序列经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有atp依赖型二羟基丙酮激酶dhak活性的由e1)衍生的蛋白质。
进一步的,所述甘油激酶基因glpk为如下f1)-f3)中任一种dna分子:
f1)序列1所示的cnda分子或基因组dna分子;
f2)在严格条件下与f1)限定的dna分子杂交且编码所述甘油激酶glpk的cdna分子或基因组dna分子;
f3)与f1)或f2)限定的dna分子具有90%以上的同一性且编码所述甘油激酶glpk的cdna分子或基因组dna分子;
所述dhaklm基因簇为如下g1)-g3)中任一种dna分子:
g1)序列2所示的cnda分子或基因组dna分子;
g2)在严格条件下与g1)限定的dna分子杂交且编码所述磷酸烯醇式丙酮酸依赖型二羟基丙酮激酶dhaklm的cdna分子或基因组dna分子;
g3)与g1)或gf2)限定的dna分子具有90%以上的同一性且编码所述磷酸烯醇式丙酮酸依赖型二羟基丙酮激酶dhaklm的cdna分子或基因组dna分子;
所述atp依赖型二羟基丙酮激酶基因dhak为如下h1)-h3)中任一种dna分子:
h1)序列3所示的cnda分子或基因组dna分子;
h2)在严格条件下与h1)限定的dna分子杂交且编码所述atp依赖型二羟基丙酮激酶dhak的cdna分子或基因组dna分子;
h3)与h1)或h2)限定的dna分子具有90%以上的同一性且编码所述atp依赖型二羟基丙酮激酶dhak的cdna分子或基因组dna分子。
上述重组菌的构建方法中,抑制(完全抑制或部分抑制)或降低所述受体菌中甘油激酶glpk和磷酸烯醇式丙酮酸依赖型二羟基丙酮激酶dhaklm的表达量和/或活性、或抑制所述受体菌中甘油激酶基因glpk和dhaklm基因簇的表达、或敲除所述受体菌中的甘油激酶基因glpk和dhaklm基因簇、或提高所述受体菌中atp依赖型二羟基丙酮激酶dhak的表达量和/或活性、或增强所述受体菌中atp依赖型二羟基丙酮激酶基因dhak的表达均可通过本领域技术人员利用本领域熟知的手段实现,也可以是通过花费创造性劳动实现。
进一步的,所述(1)为敲除所述受体菌中的甘油激酶基因glpk;
所述(2)为敲除所述受体菌中的dhaklm基因簇;
所述(3)为在所述受体菌中过表达atp依赖型二羟基丙酮激酶基因dhak。
更进一步的,所述“敲除所述受体菌中的dhaklm基因簇”和“在所述受体菌中过表达atp依赖型二羟基丙酮激酶基因dhak”的方法为用依次由用于启动atp依赖型二羟基丙酮激酶基因dhak表达的启动子和atp依赖型二羟基丙酮激酶基因dhak组成的dna片段替换所述受体菌中的dhaklm基因簇。所述启动子具体可为序列4所示的dna分子。
所述敲除和所述替换均可通过同源重组的方式实现。
上述重组菌的构建方法中所涉及的步骤(1)-(3)的改造方法没有顺序要求,只要对受体菌完成(1)-(3)的改造即可得到本发明的高产丁二酸的重组菌。
上述重组菌的构建方法中,所述受体菌为可以甘油为底物在厌氧条件下发酵生产丁二酸的大肠杆菌或其它菌株,如产琥珀酸放线杆菌、产琥珀酸厌氧螺菌。只要是具有厌氧产丁二酸代谢途径的菌,或是具有如下与厌氧产丁二酸代谢途径相关基因:磷酸烯醇式丙酮酸羧化激酶基因(pck)、苹果酸脱氢酶基因(mdh)、富马酸酶基因(fum)和富马酸还原酶基因(frd)的菌均属于本发明的保护范围。进一步的,所述受体菌为可以甘油为底物在厌氧条件下发酵生产丁二酸的大肠杆菌。更进一步的,所述受体菌为suc-t110。
为了解决上述技术问题,本发明还提供了按照上述构建方法构建得到的重组菌。
本发明构建得到的重组菌可以甘油为底物利用ⅱ型甘油代谢系统生产丁二酸,且相对于现有技术来说,产量显著提高。所述ⅱ型甘油代谢系统是指甘油首先被nadh型甘油脱氢酶催化为二羟基丙酮,所得的二羟基丙酮再经atp型二羟基丙酮激酶催化为磷酸二羟基丙酮,所得的磷酸二羟基丙酮再经糖酵解途径继续代谢的一种甘油代谢途径(图2)。
为了解决上述技术问题,本发明还提供了上述重组菌的新用途。
本发明提供了上述重组菌在生产丁二酸中的应用。
本发明还提供了上述重组菌在以甘油为底物生产丁二酸中的应用。
本发明还提供了上述重组菌在提高丁二酸产量中的应用。
为了解决上述技术问题,本发明最后提供了一种生产丁二酸的方法。
本发明提供的生产丁二酸的方法包括如下步骤:以甘油为底物,将按照上述构建方法构建得到的重组菌进行发酵培养,得到发酵产物,所述发酵产物中含有丁二酸。
上述生产丁二酸的方法中,所述方法可包括如下步骤:
b1)将按照上述构建方法构建得到的重组菌在种子培养基中发酵培养,得到种子液;
b2)将所述种子液在发酵培养基中发酵培养,得到发酵产物。
进一步的,所述种子培养基和所述发酵培养基均包括大量元素、微量元素和丰富培养基成分;所述大量元素可包括如下组分:甘油、碳酸盐、k2hpo4、kh2po4、(nh4)2hpo4、nh4h2po4、mgso4·7h2o;所述碳酸盐可为khco3、nahco3或nh4hco3。所述微量元素可包括如下组分:fecl3·6h2o、cocl2·6h2o、cucl2·2h2o、zncl2、na2moo4·2h2o、h3bo3和mncl2·4h2o。所述丰富培养基成分可包括如下组分:酵母粉、蛋白胨、玉米浆粉。
更进一步的,以上组分在培养基中的浓度分别如下:甘油(浓度可为10g/l-100g/l或10g/l或20g/l或50g/l或100g/l)、碳酸盐(浓度可为1g/l-20g/l或1g/l或7.9g/l或8.4g/l或10g/l或20g/l)、k2hpo4(浓度可为4g/l-8g/l或4g/l或6g/l或8g/l)、kh2po4(浓度可为2g/l-5g/l或2g/l或3g/l或5g/l)、(nh4)2hpo4(浓度可为1g/l-10g/l或1g/l或3g/l或10g/l)、nh4h2po4(浓度可为0.5g/l-5g/l或0.5g/l或1g/l或5g/l)、mgso4·7h2o(浓度可为0.1g/l-5g/l或0.1g/l或1g/l或5g/l)、fecl3·6h2o(浓度可为0.2μg/l-5μg/或0.2μg/l或1.5μg/l或5μg/l)、cocl2·6h2o(0.05μg/l-5μg/l或0.05μg/l或0.1μg/l或5μg/l)、cucl2·2h2o(浓度可为0.05μg/l-5μg/l或0.05μg/l或0.1μg/l或5μg/l)、zncl2(浓度可为0.05μg/l-5μg/l或0.05μg/l或0.1μg/l或5μg/l)、na2moo4·2h2o(浓度可为0.05μg/l-5μg/l或0.05μg/l或0.1μg/l或5μg/l)、h3bo3(浓度可为0.01μg/l-1μg/l或0.01μg/l或0.1μg/l或1μg/l)和mncl2·4h2o(浓度可为0.05μg/l-5μg/l或0.05μg/l或0.2μg/l或5μg/l)、酵母粉(浓度可为0.5g/l-50g/l或2g/l或5g/l或20g/l或50g/l)、蛋白胨(浓度可为1g/l-100g/l或5g/l或10g/l或20g/l或50g/l或100g/l)、玉米浆粉(浓度可为1.5g/l-150g/l或5g/l或15g/l或50g/l或100g/l或150g/l)。
在本发明的具体实施例中,所述种子培养基的溶剂为水,溶质及其浓度分别如下:甘油50g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、酵母粉5g/l、蛋白胨10g/l;或,所述种子培养基的溶剂为水,溶质及其浓度分别如下:甘油50g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、玉米浆粉5g/l。
所述发酵培养基的溶剂为水,溶质及其浓度分别如下:甘油50g/l、nahco34.2g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、酵母粉5g/l、蛋白胨10g/l;或所述发酵培养基的溶剂为水,溶质及其浓度分别如下:甘油50g/l、nahco34.2g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、玉米浆粉5g/l。
上述生产丁二酸的方法中,所述b2)中,所述发酵培养的方法可为如下b2-1)或b2-2):
b2-1)将所述种子液在厌氧条件下进行发酵培养,得到发酵产物;
b2-2)将所述种子液依次进行好氧发酵培养和厌氧发酵培养,得到发酵产物。
进一步的,所述b2-1)中,所述发酵培养的条件可为(25-39)℃培养(24-120)h,具体可为37℃、150rpm条件下发酵培养96h。
所述b2-2)中,所述好氧发酵培养的条件可为:(25-39)℃,(0.5-2.5)vvm通气量,(5-50)%溶氧发酵培养(5-15)h;具体可为37℃,1vvm通气量,25%溶氧条件下发酵培养10h。
所述厌氧发酵培养的条件可为:(25-39)℃发酵培养(24-96)h;具体可为37℃,200rpm条件下发酵培养48h。
更进一步的,所述b2-2)中,所述厌氧发酵培养开始时加入50mm的nahco3。发酵过程中随时检测发酵体系中的甘油浓度,当甘油浓度小于15g/l时补加10g/l的甘油。
在大肠杆菌中,天然存在的甘油代谢系统是ⅰ型和ⅴ型,分别如图1和图3所示。其中ⅴ型甘油代谢系统依赖磷酸烯醇式丙酮酸对二羟基丙酮进行磷酸化,但磷酸烯醇式丙酮酸是合成丁二酸的重要前体,故此该代谢途径并不适用于丁二酸的发酵。由ⅰ、ⅱ型甘油代谢系统(图1和图2)的对比可以发现,ⅱ型甘油代谢系统由于比ⅰ型甘油代谢系统多了一个nadh向menaquinone传递电子的过程,可以向胞外转运4个h+,胞外h+是一种重要的能量形式,可作为驱动atp合成及物质转运的能量。所以,以ⅱ型甘油代谢系统进行甘油到丁二酸的厌氧发酵的话,每合成一分子丁二酸能够多产生4个胞外h+的能量,更有利于促进细胞生长和丁二酸的生产。
本发明为了减少杂质的生成并提高丁二酸的产量,在大肠杆菌中引入了ⅱ型甘油代谢系统,构建了在厌氧条件下工作的电子传递链,提高了能量的供应能力,进而提高了丁二酸的产量。本发明通过对重组菌suc-t11进行分子改造,获得重组菌yy-gs004。重组菌yy-gs004在批式发酵中,其丁二酸产量达到了482.5mm,是其亲本的3.82倍,转化率达到了0.92mol丁二酸/mol甘油,达到理论值的92%,接近理论转化率。重组菌yy-gs004在好氧-厌氧两步法的补料发酵中,丁二酸的产量达到了565.3mm。本发明构建得到的重组菌在丁二酸生产中具有重大意义。
附图说明
图1为ⅰ型甘油代谢系统。
图2为ⅱ型甘油代谢系统。
图3为ⅴ型甘油代谢系统。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中的pxz-cs质粒和重组菌zt-005均记载于文献“张学礼,谭在高,朱欣娜,等等.提高丁二酸产量的重组菌及构建方法:中国,201310072083.0[p].2013-06-05.”中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的pkd46质粒记载于文献“datsenkoka,wannerbl.one-stepinactivationofchromosomalgenesinescherichiacolik-12usingpcrproducts[j].procnatlacadsciusa,2000,97(12):6640-6645.”中,公众可从美国耶鲁大学大肠杆菌保藏中心cgsc购买获得,也可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
本发明所使用的引物序列如表1所示。
表1、本发明中使用的引物
实施例1、重组大肠杆菌yy-gs004的构建
一、甘油激酶基因glpk的敲除
1、底盘菌的选取
以授权公告号为cn104178443b,发明名称为“生产丁二酸的重组大肠杆菌及其应用”的发明专利中所构建的重组菌suc-t110为出发菌。
2、重组大肠杆菌yy-gs002的构建
从重组菌suc-t110出发,采用两步同源重组的方法敲除重组菌suc-t110中的glpk基因,获得重组大肠杆菌yy-gs002,具体包括以下四步:
第一步,重组菌suc-t110中甘油激酶基因glpk的敲除的基础基因片段的扩增
以大肠杆菌atcc8739(购自美国菌种保藏中心,atcc编号为8739)基因组为模板,使用引物8739δglpkuparmup和8739δglpkuparmdown进行pcr扩增,得到dna片段a。该dna片段a大小为534bp,其包含大肠杆菌atcc8739的甘油激酶编码基因glpk起始密码子上游125bp(不包含起始密码子)和起始密码子下游409bp(包含起始密码子),并将该片段命名为δglpk1。
以大肠杆菌atcc8739基因组为模板,使用引物8739δglpkdownarmup和8739δglpkdownarmdown进行pcr扩增,得到dna片段b。该dna片段b大小为595bp,其包含大肠杆菌atcc8739的甘油激酶编码基因glpk终止密码子上游276bp(包含终止密码子)和终止密码子下游319bp(不包含终止密码子),并将该片段命名为δglpk2。
以pxz-cs为模板,使用引物8739δglpkcatup和8739δglpksacbdown进行扩增,得到dna片段c。该dna片段c大小为2658bp,其含有氯霉素基因(cat)、果聚糖蔗糖转移酶基因(sacb)和片段δglpk1下游20bp及δglpk2上游20bp重叠区的片段,并将该片段命名为δglpk3。
以大肠杆菌atcc8739基因组为模板,使用引物8739δglpk二步up和8739δglpkdownarmdown进行pcr扩增,得到dna片段d。该dna片段d大小为615bp,其包含大肠杆菌atcc8739的甘油激酶编码基因glpk终止密码子上游276bp(包含终止密码子)和终止密码子下游319bp(不包含终止密码子)及片段δglpk1下游20bp重叠区,并将该片段命名为δglpk4。
第二步,大肠杆菌中敲除甘油激酶基因glpk的两步同源重组片段构建
以片段δglpk1、δglpk2、δglpk3等摩尔混合物为模板,使用引物8739δglpkuparmup和8739δglpkdownarmdown进行pcr扩增,得到dna片段e。该dna片段e大小为3747bp,其为δglpk1、δglpk2、δglpk3三个片段的拼接产物,是含有氯霉素基因(cat)和果聚糖蔗糖转移酶基因(sacb)及上下游同源臂的dna片段,并将该片段命名为δglpkⅰ。
以片段δglpk1、δglpk4等摩尔混合物为模板,使用引物8739δglpkuparmup和8739δglpkdownarmdown进行pcr扩增,得到dna片段f。该dna片段f大小为1129bp,其为δglpk1、δglpk4两个片段的拼接产物,是含有上下游同源臂的dna片段,并将该片段命名为δglpkⅱ。
第三步,重组菌yy-gs001的构建
将片段δglpkⅰ用于第一次同源重组:首先将pkd46质粒通过氯化钙转化法转化至重组菌suc-t110,然后将dna片段电转至带有pkd46的重组菌suc-t110。具体转化步骤如下:
首先准备带有pkd46质粒的大肠杆菌suc-t110的电转化感受态细胞;将50μl感受态细胞置于冰上,加入50ngdna片段δglpkⅰ,冰上放置2分钟,转移至0.2cm的bio-rad电击杯。使用micropulser(bio-rad公司)电穿孔仪,电击参数为电压2.5kv。电击后迅速将1ml的lb培养基转移至电击杯中,吹打5次后转移至试管中,75rpm,30℃孵育2h。取200μl菌液涂在含有氯霉素(终浓度为34μg/ml)的lb平板上,37℃过夜培养后,挑选8个单菌落使用引物8739δglpkuparmup/8739δglpkdownarmdown进行pcr验证,正确的菌落扩增产物大小为3747bp,挑选一个正确的单菌落,并将其命名为yy-gs001。
第四步,重组菌yy-gs002的构建
将片段δglpkⅱ用于第二次同源重组:将dna片段δglpkⅱ电转至菌株yy-gs001中。具体转化步骤如下:
首先准备带有pkd46质粒的yy-gs001的电转化感受态细胞(感受态细胞的具体制备步骤参见文献“dowerwj,millerjf,ragsdalecw.highefficiencytransformationofe.colibyhighvoltageelectroporation[j].nucleicacidsres,1998,16(13):6127-6145.”中的方法);将50μl感受态细胞置于冰上,加入50ng的dna片段δglpkⅱ,冰上放置2分钟,转移至0.2cm的bio-rad电击杯。使用micropulser(bio-rad公司)电穿孔仪,点击参数为电压2.5kv。点击后迅速将1ml的lb培养基转移至电击杯中,吹打5次后转移至试管中,75转,30℃孵育4h,去除pkd46质粒。将菌液转移至含有10%蔗糖的没有氯化钠的lb液体培养基(250ml三角瓶中装50ml培养基),培养24h后在含有6%蔗糖的没有氯化钠的lb固体培养基上划线培养。挑选单菌落使用引物8739δglpkuparmup/8739δglpkdownarmdown进行pcr验证,正确的菌落扩增产物大小为1129bp,挑选一个正确的单菌落,并将其命名为yy-gs002。
二、磷酸烯醇式丙酮酸依赖型二羟基丙酮激酶基因dhaklm的敲除
从步骤一构建的重组菌yy-gs002出发,采用两步同源重组的方法中的第一步敲除dhaklm基因,具体包括以下三步:
第一步,重组菌yy-gs002中磷酸烯醇式丙酮酸依赖型二羟基丙酮激酶dhaklm的敲除的基础基因片段的扩增
以大肠杆菌atcc8739基因组为模板,使用引物8739dhaklm::dhakuparmup和8739dhaklm::dhakuparmdown进行pcr扩增,得到dna片段g。该dna片段g大小为523bp,其包含大肠杆菌atcc8739的dhaklm基因簇的dhak基因的起始密码子上游333bp(不包含起始密码子)和起始密码子下游190bp(包含起始密码子),并将该片段命名为δdhaklm1。
以大肠杆菌atcc8739基因组为模板,使用引物8739dhaklm::dhakdownarmup和8739dhaklm::dhakdownarmdown进行pcr扩增,得到dna片段h。该dna片段h大小为537bp,其包含大肠杆菌atcc8739的dhaklm基因簇的dham基因的下游537bp,并将该片段命名为δdhaklm2。
以pxz-cs为模板,使用引物8739dhaklm::dhakcatup和8739dhaklm::dhaksacbdown进行pcr扩增,得到dna片段i。该dna片段i大小为2658bp,其为含有氯霉素基因(cat)、果聚糖蔗糖转移酶基因(sacb)和片段δdhaklm1下游20bp及δdhaklm2上游20bp重叠区的片段,并将该片段命名为δdhaklm3。
第二步,大肠杆菌中敲除磷酸烯醇式丙酮酸依赖型二羟基丙酮激酶dhaklm的两步同源重组片段中第一步同源重组片段的构建
以片段δdhaklm1、δdhaklm2、δdhaklm3等摩尔混合物为模板,使用引物8739dhaklm::dhakuparmup和8739dhaklm::dhakdownarmdown进行pcr扩增,得到dna片段j。该dna片段j大小为3678bp,其为δdhaklm1、δdhaklm2、δdhaklm3三个片段的拼接产物,是含有氯霉素基因(cat)和果聚糖蔗糖转移酶基因(sacb)及上下游同源臂的dna片段,并将该片段命名为δdhaklmⅰ。
第三步,重组菌yy-gs003的构建
将片段δdhaklmⅰ用于第一次同源重组:首先将pkd46质粒通过氯化钙转化法转化至步骤一构建的重组菌yy-gs002,然后将dna片段电转至带有pkd46的重组菌yy-gs002。具体转化步骤如下:
首先准备带有pkd46质粒的大肠杆菌yy-gs002的电转化感受态细胞;将50μl感受态细胞置于冰上,加入50ngdna片段δdhaklmⅰ,冰上放置2分钟,转移至0.2cm的bio-rad电击杯。使用micropulser(bio-rad公司)电穿孔仪,电击参数为电压2.5kv。电击后迅速将1ml的lb培养基转移至电击杯中,吹打5次后转移至试管中,75rpm,30℃孵育2h。取200μl菌液涂在含有氯霉素(终浓度为34μg/ml)的lb平板上,37℃过夜培养后,挑选8个单菌落使用引物8739dhaklm::dhakuparmup、8739dhaklm::dhakdownarmdown进行pcr验证,正确的菌落扩增产物大小为3678bp,挑选一个正确的单菌落,并将其命名为yy-gs003。
三、atp依赖型二羟基丙酮激酶dhak的整合和调控
从重组菌yy-gs003出发,采用两步同源重组的方法中的第二步整合并调控dhak基因,包括以下几步:
第一步,重组菌yy-gs003中atp依赖型二羟基丙酮激酶基因dhak的整合的基础基因片段的扩增
以产酸克雷伯氏菌atccbaa-1236(购自美国菌种保藏中心,atcc编号为baa-1236)基因组为模板,使用引物8739dhaklm::dhakdhakup和8739dhaklm::dhakdhakdown进行pcr扩增,得到dna片段k。该dna片段k大小为1670bp,其包含dhak基因编码区1650bp(序列3)和片段δdhaklm2上游同源区20bp,并将该片段命名为dhak1。
以重组菌zt-005(cn103131663a)基因组为模板,使用引物dhaklm::dhakm1-93up和dhaklm::dhakm1-93down进行pcr扩增,得到dna片段l。该dna片段l大小为135bp,其包含δdhaklm1下游同源区20bp,启动子dhak-m1-93-rbsl8区域(序列4)89bp和片段dhak1上游同源区26bp,并将该片段命名为dhak2。
第二步,大肠杆菌中atp依赖型的二羟基丙酮激酶的整合的两步同源重组片段中第二步同源重组片段的构建
以片段δdhaklm1、δdhaklm2、dhak1、dhak2等摩尔混合物为模板,使用引物8739dhaklm::dhakuparmup和8739dhaklm::dhakdownarmdown进行pcr扩增,得到dna片段m。该dna片段m大小为2799bp,其为δdhaklm1、δdhaklm2、dhak1、dhak2四个片段的拼接产物,是含有启动子dhak-m1-93-rbsl8、dhak基因及上下游同源臂的dna片段,并将该片段命名为dhakⅰ。
第三步,重组菌yy-gs004的构建
将片段dhakⅰ用于第二次同源重组:将dna片段dhakⅰ电转至菌株yy-gs003中。具体转化条件如下:
首先准备带有pkd46质粒的yy-gs003的电转化感受态细胞;将50μl感受态细胞置于冰上,加入50ng的dna片段dhakⅰ,冰上放置2分钟,转移至0.2cm的bio-rad点击杯。使用micropulser(bio-rad公司)电穿孔仪,点击参数为电压2.5kv。点击后迅速将1ml的lb培养基转移至电击杯中,吹打5次后转移至试管中,75转,30℃孵育4h,去除pkd46质粒。将菌液转移至含有10%蔗糖的没有氯化钠的lb液体培养基(250ml三角瓶中装50ml培养基),培养24h后在含有6%蔗糖的没有氯化钠的lb固体培养基上划线培养。挑取单克隆使用引物dhaklm::dhakuparmup、8739dhaklm::dhakdownarmdown进行pcr验证,正确的菌落扩增产物大小为2799bp,挑选一个正确的单菌落,将其命名为yy-gs004。
重组菌yy-gs004为将suc-t110菌株中的甘油激酶基因glpk敲除,且用依次由序列4所示的用于启动atp依赖型二羟基丙酮激酶基因dhak表达的启动子dhak-m1-93-rbsl8和序列3所示的atp依赖型二羟基丙酮激酶基因dhak组成的dna片段替换所述suc-t110菌株中的dhaklm基因簇后得到的菌。
实施例2、重组大肠杆菌yy-gs004生产丁二酸
一、重组大肠杆菌yy-gs004以酵母粉和蛋白胨为丰富培养基成分厌氧发酵生产丁二酸
重组大肠杆菌yy-gs004厌氧发酵生产丁二酸的具体方法如下:
1、种子培养
将装有50ml种子培养基的250ml三角瓶115℃灭菌15min,冷却后将实施例1构建的重组大肠杆菌yy-gs004按照1%(v/v)的接种量接种于种子培养基中,在ph值为7.0、37℃和250rpm的条件下培养16h,得到种子液。
上述种子培养基的溶剂为水,溶质及其浓度分别如下(种子液培养时培养基中不添加nahco3):甘油50g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、酵母粉5g/l、蛋白胨10g/l。
2、发酵培养
将步骤1获得的种子液接种于发酵罐(发酵罐中含有250ml发酵培养基)中,使发酵培养体系的od550=0.1,37℃,150rpm的条件下培养96h,每隔24h取样得到发酵液,发酵液为发酵罐内所有物质,中和剂为na2co3。同时以菌株suc-t110为对照。
上述发酵培养基的溶剂为水,溶质及其浓度分别如下:甘油50g/l、nahco34.2g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、酵母粉5g/l、蛋白胨10g/l。
3、分析方法
使用安捷伦(agilent-1200)高效液相色谱仪对步骤2获得的发酵液中的组分进行测定。采用伯乐公司(biorad)的aminexhpx-87h有机酸分析柱测定发酵液中的甘油、丁二酸和其它有机酸浓度,条件为0.5ml/min,35℃,30min。丁二酸标准品购自sigma公司,产品目录号为w327700。丁二酸标准品的保留时间为14.25min。
4、分析结果
重组菌yy-gs004厌氧发酵96小时生产了482.5mm的丁二酸(保留时间为14.25min),丁二酸/甘油转化率为0.92mol丁二酸/mol甘油。而suc-t110厌氧发酵96小时生产了126.2mm的丁二酸,丁二酸/甘油转化率为0.93mol丁二酸/mol甘油。经改造后的重组菌yy-gs004丁二酸产量显著提高,为出发菌suc-t110的3.82倍。
二、重组大肠杆菌yy-gs004以玉米浆粉为丰富培养基成分厌氧发酵生产丁二酸重组大肠杆菌yy-gs004厌氧发酵生产丁二酸的具体方法如下:
1、种子培养
将装有50ml种子培养基的250ml三角瓶115℃灭菌15min,冷却后将实施例1构建的重组大肠杆菌yy-gs004按照1%(v/v)的接种量接种于种子培养基中,在ph值为7.0、37℃和250rpm的条件下培养16h,得到种子液。
上述种子培养基的溶剂为水,溶质及其浓度分别如下(种子液培养时培养基中不添加nahco3):甘油50g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、玉米浆粉5g/l。
2、发酵培养
将步骤1获得的种子液接种于发酵罐(发酵罐中含有250ml发酵培养基)中,使发酵培养体系的od550=0.1。37℃,150rpm的条件下培养96h,每隔24h取样得到发酵液,发酵液为发酵罐内所有物质,中和剂为na2co3。
上述发酵培养基的溶剂为水,溶质及其浓度分别如下:甘油50g/l、nahco34.2g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、玉米浆粉5g/l。
3、分析方法
使用安捷伦(agilent-1200)高效液相色谱仪对步骤2获得的发酵液中的组分进行测定。采用伯乐公司(biorad)的aminexhpx-87h有机酸分析柱测定发酵液中的甘油、丁二酸和其它有机酸浓度,条件为0.5ml/min,35℃,30min。丁二酸标准品购自sigma公司,产品目录号为w327700。丁二酸标准品的保留时间为14.25min。
4、分析结果
重组菌yy-gs004厌氧发酵96小时生产了452.1mm的丁二酸(保留时间为14.25min),丁二酸/甘油转化率为0.92mol丁二酸/mol甘油。
三、重组大肠杆菌yy-gs004好氧-厌氧两步法发酵生产丁二酸
重组大肠杆菌yy-gs004好氧-厌氧两步法发酵生产丁二酸的具体方法如下:
1、种子培养
将装有50ml种子培养基的250ml三角瓶115℃灭菌15min,冷却后将实施例1构建的重组大肠杆菌yy-gs004按照1%(v/v)的接种量接种于种子培养基中,在ph值为7.0、37℃和250rpm的条件下培养16h,得到种子液。
上述种子培养基的溶剂为水,溶质及其浓度分别如下(种子液培养时培养基中不添加nahco3):甘油30g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、玉米浆粉5g/l。
2、发酵培养
将步骤1获得的种子液接种于5l发酵罐(发酵罐中含有3l发酵培养基)中,使发酵培养体系的od550=0.1。
第一步进行好氧发酵,条件如下:37℃,1vvm通气量,25%溶氧发酵培养10h。
第二步进行厌氧发酵,条件如下:37℃,200rpm发酵培养48h。
厌氧发酵开始时加入50mm的nahco3。发酵过程中随时检测发酵体系中的甘油浓度,当甘油浓度小于15g/l时补加10g/l的甘油。
上述发酵培养基的溶剂为水,溶质及其浓度分别如下:甘油30g/l、nh4h2po41g/l、(nh4)2hpo43g/l、mgso4·7h2o1g/l、fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、h3bo30.1μg/l、mncl2·4h2o0.2μg/l、玉米浆粉5g/l。
3、分析方法
使用安捷伦(agilent-1200)高效液相色谱仪对步骤2获得的发酵液中的组分进行测定。采用伯乐公司(biorad)的aminexhpx-87h有机酸分析柱测定发酵液中的甘油、丁二酸和其它有机酸浓度,条件为0.5ml/min,35℃,30min。丁二酸标准品购自sigma公司,产品目录号为w327700。丁二酸标准品的保留时间为14.25min。
4、分析结果
重组菌yy-gs004厌氧发酵48小时生产了565.3mm的丁二酸(保留时间为14.25min),丁二酸/甘油转化率为0.92mol丁二酸/mol甘油。
序列表
<110>中国科学院天津工业生物技术研究所
<120>一株以甘油为底物生产丁二酸的重组大肠杆菌及其构建方法与应用
<160>4
<170>patentinversion3.5
<210>1
<211>1509
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgactgaaaaaaaatatatcgttgcgctcgaccagggcaccaccagctcccgcgcggtc60
gtaatggatcacgatgccaatatcattagcgtgtcgcagcgcgaatttgagcaaatctac120
ccaaaaccaggttgggtagaacacgacccaatggaaatctgggccacccaaagctccacg180
ctggtagaagtgctggcgaaagccgatatcagttccgatcaaattgcagctatcggtatt240
acgaaccagcgtgaaaccactattgtctgggaaaaagaaaccggcaagcctatctataac300
gccattgtctggcagtgccgtcgtaccgcagaaatctgcgagcatttaaaacgtgacggt360
ttagaagattatatccgcagcaataccggtctggtgattgacccgtacttttctggcacc420
aaagtgaagtggatcctcgaccatgtggaaggctctcgcgagcgtgcacgtcgtggtgaa480
ttgctgtttggtacggttgatacgtggcttatctggaaaatgactcagggccgtgtccat540
gtgaccgattacaccaacgcctctcgtaccatgttgttcaacatccataccctggactgg600
gacgacaaaatgctggaagtgctggatattccgcgcgagatgctgccagaagtgcgtcgt660
tcttccgaagtatacggtcagactaacattggcggcaaaggcggcacgcgtattccaatc720
tccgggatcgccggtgaccagcaggccgcgctgtttggtcagttgtgcgtgaaagaaggg780
atggcgaagaacacctatggcactggctgctttatgctgatgaacactggcgagaaagcg840
gtgaaatcagaaaacggcctgctgaccaccatcgcctgcggcccgactggcgaagtgaac900
tatgcgttggaaggtgcggtgtttatggcaggcgcatccattcagtggctgcgcgatgaa960
atgaagttgattaacgacgcctacgattccgaatatttcgccaccaaagtgcaaaacacc1020
aatggtgtgtatgtggttccggcatttaccgggctgggtgcgccgtactgggacccgtat1080
gcgcgcggggcgattttcggtctgactcgtggggtgaacgctaaccacattatacgcgcg1140
acgctggagtctattgcttatcagacgcgtgacgtgctggaagcgatgcaggccgactct1200
ggtatccgtctgcacgccctgcgcgtggatggtggcgcagtagcaaacaatttcctgatg1260
cagttccagtccgatattctcggcacccgcgttgagcgcccggaagtgcgcgaagtcacc1320
gcattgggtgcggcctatctcgcaggcctggcggttggcttctggcagaacctcgacgag1380
ctgcaagagaaagcggtgattgagcgcgagttccgtccaggcatcgaaaccactgagcgt1440
aattaccgttacgcaggctggaaaaaagcggttaaacgcgcgatggcgtgggaagaacac1500
gacgaataa1509
<210>2
<211>3143
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgaaaaaattgatcaatgatgtgcaagacgtactggacgaacaactggcaggactggcg60
aaagcgcatccatcgctgacactgcatcaggatccggtgtatgtcacccgagctgatgcc120
cctgttgcaggaaaagtcgccctgctgtcgggtggcggcagcggacacgagccgatgcac180
tgtggttatatcggtcaggggatgctttcgggggcctgtccgggcgaaattttcacctca240
ccgacgcccgataaaatctttgaatgcgccatgcaagttgatggcggcgaaggtgtactg300
ttgattatcaaaaattacaccggcgatattcttaactttgaaacagcgaccgagttactg360
cacgatagcggcgtaaaagtgaccactgtggtcattgatgacgacgttgcggtaaaagac420
agtctttatactgccgggcgacgcggcgttgccaacaccgtattaattgaaaaactcgta480
ggcgcagcggcggagcgtggcgactcactggacgcctgtgcggaactggggcgtaagctg540
aataatcaaggccactcaataggtatcgctctcggtgcctgtaccgttcctgccgcgggc600
aaaccttcttttaccctggcggataatgagatggagtttggcgtcggcattcatggtgag660
ccgggtattgaccgccgccccttctcttcccttgatcaaaccgtcgatgaaatgttcgac720
accctgctggtaaatggctcataccatcgcactttgcgtttctgggattatcaacaaggc780
agttggcaggaagaacaacaaaccaaacaaccgctccagtctggcgatcgggtgattgcg840
ctggttaacaatcttggcgcaactccgctttctgagctgtacggcgtctataaccgcctg900
accacacgttgccagcaagcgggattgactatcgaacgtaatttaattggcgcgtactgc960
acctcactggatatgaccggtttctcaatcaccttactgaaagttgatgacgaaacgctg1020
gcactctgggacgccccggtccacaccccggcccttaactggggtaaataaggagaaagc1080
aatgtcactgagcagaactcaaattgttaactggctcactcgttgtggcgatattttcag1140
caccgagagcgagtatcttaccggactggatcgcgaaattggcgatgctgaccacgggct1200
aaatatgaaccgaggctttagcaaagtggtggaaaaactccctgctatcgcagataaaga1260
tatcggtttcattctcaagaataccggtatgacgctgctttccagcgtcggtggtgccag1320
tggtccgctgttcggtaccttctttatccgcgccgcacaggcgacccaggcacggcaaag1380
cctgacactggaagagctttatcagatgttccgcgatggcgcggacggcgtaatcagtcg1440
cgggaaagccgaacctggcgataaaaccatgtgtgatgtgtgggtgccggtggtggaatc1500
gttacgtcagtccagcgagcaaaatctctctgttccggtggcgctcgaagctgccagtag1560
catcgccgaatccgctgcacaaagtacgattacgatgcaagcccgcaaaggccgcgccag1620
ttatctcggtgaacgcagtattggtcaccaggatcccggcgcgacctcggtgatgtttat1680
gatgcaaatgttggcgttagccgcaaaagagtaaggaattggtgatggtaaacctggtca1740
tagtttcacatagcagccgactgggagaaggtgtcggtgaattagcccgtcagatgttaa1800
tgagtgatagttgtaaaatcgccattgccgcgggaattgacgatccacaaaatcccattg1860
gtaccgatgccgtcaaagtgatggaggccatcgaatctgttgctgatgccgaccatgtgc1920
tggtcatgatggatatgggtagcgcattattgagtgctgaaactgcgctggaattgctgg1980
ctcccgagatcgccgcaaaagtacgtttgtgtgctgcgccgttggtcgaaggtacactgg2040
cagcaacggtcagcgcggcctcgggggcggatatcgacaaagttatctttgacgccatgc2100
atgcgctggaagccaaacgtgaacaactgggtttaccgtcctccgacactgaaatctctg2160
acacatgtcctgcgtacgatgaagaagcccgttctctggcggtggtcataaaaaaccgta2220
acggcctgcatgtacgtccggcctcccggctggtttataccttatcgacatttaatgccg2280
atatgttgctggaaaaaaacggcaaatgcgtcacaccagagagtattaaccagattgcgt2340
tactacaagttcgctataacgatacgctgcgcctgattgcgaaagggccagaagctgaag2400
aggcactgatcgctttccgtcagctggctgaagataactttggtgaaacggaggaagtcg2460
ctccacctactctgcgtcccgttccgcctgtttcgggtaaagccttttattatcaaccag2520
ttttatgtacggtacaggcaaaatcaaccctgaccgtggaagaagaacaagatcgattac2580
gccaggctattgacttcacgttattagatctgatgacgttaacagcgaaagcagaagcca2640
gcgggcttgacgatattgccgcaatcttttctggtcaccatacactgttagatgatccgg2700
aactgctggcggcggcaagcgaactccttcagcatgaacattgcacggcagaatatgcct2760
ggcagcaagttcttaaagaacttagccagcaataccagcaactggatgatgaatatctac2820
aagctcgctatattgatgtggacgatcttctgcatcgcaccctggtccacctgacccaaa2880
cgaaagaagaactcccgcagtttaactcgccaactattctactggcggagaacatttatc2940
cttccacagtactgcaactggatccggcggttgtaaaaggtatctgccttagcgccggaa3000
gtccggtatcccacagcgccctaatcgcccgtgaactggggattggctggatttgccagc3060
agggtgagaaactgtatgcgatacaaccagaagaaacgctaacgctggacgttaaaacgc3120
aacgtttcaaccgtcagggttaa3143
<210>3
<211>1650
<212>dna
<213>人工序列(artificialsequence)
<400>3
atgtctcaattcttttttaatcaacgcgccaacctcgtcaacgacgtgattgaaggaacc60
attatcgccagcccgtggaataacctggcgcggctggagagcgatcccgccattcgcgtg120
gtggtgcgtcgcgatctcgacaaaaacaacgtggcggtgatctccggtggcggttccggt180
cacgagccggcccacgcgggctttgtcggcaaaggcatgctgaccgccgccgtctgcggc240
gatctgtttgcctcgccgagcgtcgatgcggtgctgaccgccatccaggcggtaaccggc300
gacgcgggctgtctgctgatcgtcaagaactataccggcgatcgcctgaacttcggcctc360
gcggcggagaaggcgcgccgcatgggctataacgttgaaatgctgatcgttggcgatgat420
atttcgctgccggacaacaaacatccgcgcggcatcgccgggacgattctggtgcataaa480
gtggcaggctacttcgccgaacgcggacacaatctggcgaccgtgctgcgcgaagcgcag540
tatgccgccggacataccttcagcctcgggctggcccttgccagctgtcatctgccgcag600
gatgcggaaacggccccgcgccatcacgcggaccaggccgagctgggcatggggatccac660
ggcgaaccgggcgcatcggtcatcgcgacccagaacagcgcggaaatcgttacgctgatg720
gcggagaagctcagcgccgccctgccggaaaccggtcgtctggcggtgatgatcaataat780
ctcggcggcgtatcgattgccgaaatggcgattttgacccgcgagctggcgcatacgccg840
ctgcaacagcgtatcgactggctgattggcccggcttcgctggtgaccgcgctggatatg900
aaaggcttctccctcaccgccatcgtgctggaagagagtattgagaaggcgctgctttcc960
gcggtagaaaccgccggctggcagacgccggtgcagccgcgcgaaatcagcgtgatgccg1020
tcgtcgctgcgcagcacccgggtagagtttgagccctcggagaatagcgtggttgcggac1080
tacgtcgagcgggtgaccggcacgctgtccgatcttgaagcagatctcaacgcgctggat1140
gccaaagtcggcgacggcgataccggctccaccttcgccgccggcgcgcgcgacatcgcc1200
gacttgctacagcgtcgccagctgccgttggctaacctcgctacgctattggcgctgatt1260
ggcgagcgtctgacggtggtgatgggcggctccagcggcgtgctgatgtcaattttcttt1320
accgccgccgggcagaagctggaacagggggcaagcgtcgccgaagcgctaaacgccggg1380
ctggcgcagatgaagttttacggcggcgccgatgaaggcgatcggaccatgattgatgcc1440
ctgcagccggcactggcggcgctggcggccgagccggaaaatctgcaggccgctttcgcg1500
gcggcacaggcgggcgcggatcgtacgcttcacgccagcaaagccaacgccgggcgcgcg1560
tcgtatctcaacagcgatagcctgcgcggcaatatggaccccggcgcccatgcggtggcg1620
atggtgtttaaagcgctggcgcagaaataa1650
<210>4
<211>89
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttatctctggcggtgttgacaagagataacaacgttgatataattgagcccgtattgtta60
gcatgtacgtttaaaccaggagtacagag89
- 还没有人留言评论。精彩留言会获得点赞!