蛋白GmHSFB2b在调控植物黄酮类化合物积累中应用的制作方法
本发明涉及生物技术领域,尤其涉及一种蛋白gmhsfb2b在调控植物黄酮类化合物积累中应用。
背景技术:
大豆黄酮类化合物是大豆生长中形成的一类次生代谢产物,他们的结构与雌激素相似,具有很强的生物活性,如类雌激素和抗雌激素活性、抗氧化活性、酶抑制剂活性,因此,与人类的健康密切相关。天然存在的大豆异黄酮共有12种,其中97%~98%是以β-葡萄糖苷的形式存在的糖苷型大豆异黄酮或其衍生物,只有2%~3%左右为游离性甙元。大豆发酵食品中大豆黄酮类化合物如异黄酮是以游离型甙元存在,易被人体消化吸收,可以起到很好的保健作用。大豆异黄酮因其独特性具有多种生理功能,例如,预防心血管病、乳腺癌、前列腺癌、潮热症和骨质疏松等。因此培育高异黄酮大豆是大豆育种中的目标之一。
1962年rittossa在研究果蝇唾液腺在热环境下的蛋白质时发现了热激蛋白。之后发现热激蛋白家族广泛存在于微生物、植物和动物中,其成员,例如,hsp60、hsp70及hsp90作为分子伴侣,帮助其它蛋白正确折叠及胞内分布等,以维持该蛋白的正常功能。热激蛋白参与多种生物学过程。自1982年在冷泉港召开了第一次热激蛋白研讨会之后,对于热激蛋白的研究越来越受到关注。热激蛋白的表达受热激转录因子的调控,热激转录因子是一个保守的家族,可以和热激蛋白基因中的特异热激元件结合,调控其转录。
根据基本结构的差异,热激因子可分为三类,hsfa、hsfb和hsfc。热激因子在拟南芥中研究的较详尽。拟南芥热激因子所参与的调控网络是多变而复杂的,已经初步阐明了21个热激因子所参与的调控网络。早先的研究表明编码热激蛋白和热激因子的基因均受高温诱导,与耐高温相关。随着大豆基因组测序的完成,在栽培大豆基因组中聚类了25个热激因子,鉴定了与耐非生物胁迫相关和与抗生物胁迫相关的成员。尚未发现调控大豆品质如黄酮类化合物的热激因子。
技术实现要素:
本发明的目的是提供蛋白gmhsfb2b在调控植物黄酮类化合物积累中应用。
第一方面,本发明要求保护gmhsfb2b蛋白或其相关生物材料在调控植物黄酮类化合物积累中的应用。
所述相关生物材料可为能够表达所述gmhsfb2b蛋白的核酸分子或含有所述核酸分子的表达盒、重组载体、重组菌或转基因细胞系;
所述gmhsfb2b蛋白为如下任一所示蛋白质:
(a1)氨基酸序列为seqidno.1的蛋白质;
(a2)将seqidno.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
(a3)与(a1)-(a2)中任一所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
(a4)在(a1)-(a3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
在(a2)中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加是指不多于十个氨基酸残基的取代和/或缺失和/或添加。
seqidno.1由355个氨基酸残基组成。
第二方面,本发明要求保护gmhsfb2b蛋白或其相关生物材料在如下(a)或(b)中的应用:
(a)调控植物组织中黄酮类化合物含量;
(b)调控整株植物体内黄酮类化合物含量;
所述相关生物材料为能够表达所述gmhsfb2b蛋白的核酸分子或含有所述核酸分子的表达盒、重组载体、重组菌或转基因细胞系。所述gmhsfb2b蛋白为前文(a1)-(a4)中任一所示蛋白质。
在前文第一方面所述的应用中,所述gmhsfb2b蛋白或其编码基因在所述植物中的活性和/或表达量提高,植物黄酮类化合物积累增加;所述gmhsfb2b蛋白或其编码基因在所述植物中的活性和/或表达量降低,植物黄酮类化合物积累减少。
在上述(a)所述的应用中,所述gmhsfb2b蛋白或其编码基因在所述植物中的活性和/或表达量提高,植物组织中的黄酮类化合物含量提高;所述gmhsfb2b蛋白或其编码基因在所述植物中的活性和/或表达量降低,植物组织中的黄酮类化合物含量降低。
在上述(b)所述的应用中,所述gmhsfb2b蛋白或其编码基因在所述植物中的活性和/或表达量提高,整株植物体内的黄酮类化合物含量提高;所述gmhsfb2b蛋白或其编码基因在所述植物中的活性和/或表达量降低,整株植物体内的黄酮类化合物含量降低。
第三方面,本发明要求保护一种培育黄酮类化合物含量提高的植物品种的方法。
本发明所提供的培育黄酮类化合物含量提高的植物品种的方法,可包括使受体植物中gmhsfb2b蛋白的表达量和/或活性提高的步骤。所gmhsfb2b蛋白为前文(a1)-(a4)中任一所示蛋白质。
进一步地,本发明提供一种培育黄酮类化合物含量提高的转基因植物的方法。
本发明所提供的培育黄酮类化合物含量提高的转基因植物的方法,可包括如下步骤:向受体植物中导入能够表达gmhsfb2b蛋白的核酸分子,得到转基因植物;所述转基因植物与所述受体植物相比黄酮类化合物含量提高。所gmhsfb2b蛋白为前文(a1)-(a4)中任一所示蛋白质。
所述“向受体植物中导入能够表达所述gmhsfb2b蛋白的核酸分子”可通过向向所述受体植物中导入含有所述gmhsfb2b蛋白的编码基因的重组表达载体实现。
所述重组表达载体可用现有的植物表达载体构建。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。所述植物表达载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3’端,如农杆菌冠瘿瘤诱导(ti)质粒基因(如胭脂合成酶nos基因)、植物基因(如大豆贮存蛋白基因)3’端转录的非翻译区均具有类似功能。
使用gmhsfb2b构建重组植物表达载体时,在其转录起始核苷酸前可加上任何一种增强型启动子或组成型启动子(如花椰菜花叶病毒(camv)35s启动子、玉米的泛素启动子(ubiquitin)),或组织特异表达启动子(如种子特异表达的启动子),它们可单独使用或与其它植物启动子结合使用。此外,使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。
为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(gus基因、萤光素酶基因等)、具有抗性的抗生素标记物(庆大霉素标记物、卡那霉素标记物等)或是抗化学试剂标记基因(如抗除莠剂基因)等。
在本发明中,所述重组载体中启动所述gmhsfb2b蛋白的编码基因转录的启动子为35s启动子。
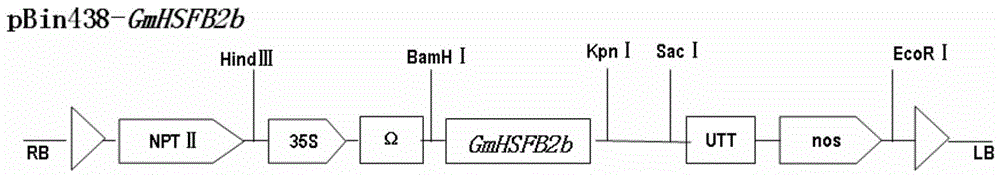
更加具体的,所述重组载体为将所述gmhsfb2b蛋白的编码基因插入到pbin438载体的多克隆位点(如bamhi和kpni)后得到的重组质粒(命名为pbin438-gmhsfb2b)。
在上述方法中,将携带有所述gmhsfb2b蛋白的编码基因的所述重组表达载体导入所述受体植物,具体可为:通过使用ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物组织培育成植株。
转化的细胞、组织或植物理解为不仅包含转化过程的最终产物,也包含其转基因子代。
在上述方法中,所述黄酮类化合物含量提高可体现为植物组织中的黄酮类化合物含量提高,或整株植物体内的黄酮类化合物含量提高。
在上述各方面中,所述“能够表达所述gmhsfb2b蛋白的核酸分子”为所述gmhsfb2b蛋白的编码基因。
进一步地,所述gmhsfb2b蛋白的编码基因可为如下任一所述的dna分子:
(b1)seqidno.2所示的dna分子;
(b2)在严格条件下与(b1)限定的dna分子杂交且编码所述gmhsfb2b蛋白的dna分子;
(b3)与(b1)或(b2)限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码所述gmhsfb2b蛋白的dna分子。
上述基因中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5mnapo4和1mmedta的混合溶液中杂交,在50℃,2×ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5mnapo4和1mmedta的混合溶液中杂交,在50℃,1×ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5mnapo4和1mmedta的混合溶液中杂交,在50℃,0.5×ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5mnapo4和1mmedta的混合溶液中杂交,在50℃,0.1×ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5mnapo4和1mmedta的混合溶液中杂交,在65℃,0.1×ssc,0.1%sds中漂洗;也可为:在6×ssc,0.5%sds的溶液中,在65℃下杂交,然后用2×ssc,0.1%sds和1×ssc,0.1%sds各洗膜一次。
在上述各方面中,所述组织具体为种子、叶片或根。
在上述各方面中,所述植物均可为双子叶植物,也可为单子叶植物。
进一步地,所述双子叶植物可为豆科植物。
更进一步地,所述豆科植物可为大豆。
在本发明的具体实施方式中,所述植物为大豆(g.max),具体为glycinemax(l.)merr.cvjack。
在本发明中,所述黄酮类化合物具有本领域公认的定义。黄酮类化合物(flavonoids)是一类存在于自然界的、具有2-苯基色原酮(flavone)结构的化合物。
更加具体的,本发明中的所述黄酮类化合物为如下中的全部或部分:7,4’-二羟基异黄酮daidzein、异黄酮苷葡萄糖苷芹菜糖daidzeinglucosideapioside、异黄酮苷daidzin、5,7,4’-三羟异黄酮genistein、5,7,4’-三羟异黄酮葡萄糖苷芹菜糖genisteinapiosideglucoside、5,7,4‘-三羟异黄酮葡萄糖苷genisteinglucoside、染料木苷genistin、黄豆黄素glycitein、黄豆黄素苷glycitin、丙二酰异黄酮苷malonyldaidzin。
实验证明,本发明提供了一种与植物组织黄酮类化合物含量相关的蛋白gmhsfb2b及其编码基因gmhsfb2b(glyma11g02800.1),将该编码基因gmhsfb2b转入大豆中,得到转基因大豆,该转基因大豆与野生型相比,其种子、叶和根中的黄酮类化合物含量提高。说明gmhsfb2b及其编码基因可以调控植物种子、叶和根中黄酮类化合物含量,gmhsfb2b过表达后提高植物种子、叶和根中黄酮类化合物含量。该基因对提高作物异黄酮成份、特别是对于提高大豆等植物籽粒中黄酮类化合物成份,培育高黄酮类化合物品种具有重要的理论和现实意义。
附图说明
图1为gmhsfb2b的植物表达载体示意图。
图2为gmhsfb2b过表达大豆转基因株系分子检测。
图3为gmhsfb2b过表达大豆株系的表型。
图4为gmhsfb2b过表达株系百粒重检测。
图5为gmhsfb2b过表达株系黄酮类化合物含量检测。图中,*表示与受体jack和转空载体null相比均在p<0.05水平上差异显著;**表示与与受体jack和转空载体null相比均在p<0.01水平上差异极显著。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的%,如无特殊说明,均为质量百分含量。以下实施例中的定量试验,均设置三次重复实验,数据为三次重复实验的平均值或平均值±标准差。
所有植物材料均生长于25℃,每天的光照为16h/8h(光照/黑暗)。
下述实施例中的大豆黑农44(hn44)记载在如下文献中:满为群等,大豆新品种黑农44的选育及不同种植方式对其产量和品种的影响,黑龙江农业科学2004年5期,1-5;公众可从中国科学院遗传与发育生物学研究所获得;该大豆2006年获自黑龙江农业科学院大豆研究所;由黑龙江农业科学院大豆研究所2002年经黑龙江省农作物品种审定委员会审定的大豆品种,第一育成人为杜维广研究员,专利号为:cna20020216.2,审定号为:黑审豆2002003。公众经相关人员同意后可从申请人处获得,仅可用于重复本发明实验使用。
下述实施例中的大豆glycinemax(l.)merr.cvjack,记载在如下文献中:thibaud-nissenf,shealyrt,khannaa,vodkinlo,clusteringofmicroarraydatarevealstranscriptpatternsassociatedwithsomaticembryogenesisinsoybean,plantphysiol.,2003may;132(1):118-36.;公众可从中国科学院遗传与发育生物学研究所获得。公众经相关人员同意后可从申请人处获得,仅可用于重复本发明实验使用。
植物双元表达载体pbin438记载在:李太元,田颖川,秦晓峰,等.高效抗虫转基因烟草的研究[j].中国科学(b辑),1994,24(3):276-282中,由中科院微生物研究所方荣祥院士提供。公众获得方荣祥院士同意后可从中国科学院遗传与发育生物学研究所获得。
农杆菌gv3101可从中国科学院遗传与发育生物学研究所获得。
实施例1、大豆转录因子gshsfb2b基因的克隆及植物表达载体构建
一、转录因子gshsfb2b基因的获得
提取大豆黑农44幼苗的总rna,用逆转录酶反转录合成cdna。,用如下带bamhi酶切位点的上游引物和带kpni酶切位点的下游引物进行pcr扩增,得到约1068bp的pcr产物。
带bamhi酶切位点的上游引物:
primer-f(bamhi):5’-cgggatccatggcgccgttaccggcg-3’;
带kpni酶切位点的下游引物:
primer-r(kpni):5’-ggggtaccctatagctccaaccaatgagg-3’。
经过测序,该pcr产物大小约1068bp,具有seqidno.2所示的核苷酸,即为gmhsfb2b,其编码的蛋白为gmhsfb2b,其氨基酸序列为seqidno.1。
二、过表达重组表达载体的获得
过表达重组表达载体pbin438-gmhsfb2b的构建
用限制性内切酶bamhⅰ和kpnⅰ双酶切由上述步骤一得到的1068bp的pcr产物,回收酶切产物,将该酶切产物与经过同样酶切载体pgem-teasy(promega)连接,将连接产物转化大肠杆菌dh5α感受态细胞,根据pgem-teasy载体上的羧卞青霉素抗性标记筛选阳性克隆,得到含有回收片段的重组质粒pgem-teasy-gmhsfb2b。以该重组质粒上的t7和sp6启动子序列为引物对其进行核苷酸序列测定,测序结果表明该pcr产物具有seqidno.2所示的核苷酸,为gmhsfb2b,由1068bp组成,该重组质粒pgem-teasy-gmhsfb2b为将seqidno.2所示的核苷酸插入pgem-teasy中得到。
以上述重组质粒pgem-teasy-gmhsfb2b为模板,用上述步骤一的带bamhi酶切位点的上游引物和带kpni酶切位点的下游引物进行pcr扩增,得到的1068bp的pcr产物,回收酶切产物,将该酶切产物与经过同样酶切植物双元表达载体pbin438的12.9kb载体骨架连接,得到重组质粒。经过测序,该重组质粒为将seqidno.2插入pbin438的bamhi和kpnⅰ酶切位点之间得到的载体,将该质粒命名为pbin438-gmhsfb2b,且seqidno.2位于camv35s启动子之后,即为重组表达载体。该重组表达载体pbin438-gmhsfb2b部分结构示意图如图1。
实施例2过表达gmhsfb2b转基因大豆的获得及鉴定
一、重组农杆菌的获得
将实施例1的步骤二中的重组载体pbin438-gmhsfb2b用电击法导入农杆菌gv3101,得到重组菌。
提取重组菌的质粒,经过测序,该质粒为pbin438-gmhsfb2b,将含有该质粒的重组菌命名为gv3101/gmhsfb2b,即为重组农杆菌。同时将空载体pbin438以同样方法转化gv3101,获得对照农杆菌gv3101/pbin438。
二、过表达gmhsfb2b大豆植株的获得及鉴定
将重组农杆菌gv3101/gmhsfb2b培养至对数期,然后用子叶节转化法将其转化大豆受体glycinemax(l.)merr.cvjack品种(jack)。经培育后收获种子。将种子播于中蛭石生长,用含有0.1%农达(草甘膦)涂抹大豆叶片,3d后无黄化反应的为转基因阳性植株。
按照上述方法,将重组农杆菌gv3101/gmhsfb2b替换为对照农杆菌gv3101/pbin438,获得转空载体大豆。
对上述阳性植株进行分子检测。具体步骤如下:提取转基因植株苗rna,反转录得到cdna作为模板,引物为:primer-f(bamhi):5’-cgggatccatggcgccgttaccggcg-3’,primer-r(kpni):5’-ggggtaccctatagctccaaccaatgagg-3’。进行realtime-pcr鉴定。大豆gmtubulin基因为内标,所用引物为primer-tf和primer-tr。primer-tf:5’-aactccatttcgtccattccttc-3’,和primer-tr:5’-ttgagtggattcccaacaacg-3’。同时以受体jack和转空载体大豆为对照。实验重复三次,结果取平均值±标准差。从中选取gmhsfb2b表达量不同的4个株系:转gmhsfb2b大豆株系oe-2、oe-26、oe-49和oe-53作进一步表型分析。图2显示转基因植株中gmhsfb2b的相对转录率:转基因受体对照(jack)、转空载体对照(null),oe-2、oe-26、oe-49和oe-53分别为1、1、18±2、68±6、43±7和14±3%。转基因大豆的4个株系中gmhsfb2b的表达量显著高于2个对照。
实施例3、gmhsfb2b过表达转基因大豆的表型鉴定
一、正常生长下对照和转基因大豆的表型检测
转基因大豆往往在获得了某一个优异性状的同时,影响了其它农艺性状,这样的案例难以在育种中应用。为此,我们观察了转基因株系生长。图3显示,正常情况下,4个转基因株系与两个对照没有显著差异。
产量与种子百粒重相关,转基因受体对照(jack)、转空载体对照(null),oe-2、oe-26、oe-49和oe-53的百粒重分别为:14.2±2.1、12.8±5.5、15.9±6.0、12.1±3.9、18.3±6.9和14.8±3.9克。pbin438-gmhsfb2b转基因株系的百粒重与对照无显著差异(图4)。
二、对照及转基因株系中黄酮类化合物含量检测
取大豆的第一片复叶或干净的根,迅速放入液氮中。在液氮中研磨叶片或根至粉末,将研磨好的粉末收集到10ml冻存管中,将冻存管管口用封口膜覆盖,在低温冷冻干燥仪中过夜干燥。将干燥的粉末过200目的筛子。或者干燥的大豆种子用粉碎机(fritschpulverisette14)研磨成粉末。称取粉末40mg(误差小于0.5mg)至2mlep管中,加入体积比为4:1的甲醇:水溶液(其中含有10μmol/l的内标异黄酮苷)超声提取20min,之后3000rpm离心10min,将上清液用0.22μm的滤油器过滤之后用液相色谱-质谱分析。液相色谱中使用的流动相包括洗脱液a(溶于水的体积比为0.1%的蚁酸)和洗脱液b(溶于乙腈的体积比为0.1%的蚁酸),干燥气流速度设置为4l/min,气体温度设置为300℃,毛细管的电压为1900v,扫描范围在质核比100到1000范围内,在质心模式下记录数据。下机数据中根据样品干重、目的峰面积以及提取时外源添加的内标异黄酮苷(daidzin)峰面积计算已知的黄酮类化合物(7,4’-二羟基异黄酮daidzein、异黄酮苷葡萄糖苷芹菜糖daidzeinglucosideapioside、异黄酮苷daidzin、5,7,4’-三羟异黄酮genistein、5,7,4’-三羟异黄酮葡萄糖苷芹菜糖genisteinapiosideglucoside、5,7,4‘-三羟异黄酮葡萄糖苷genisteinglucoside、染料木苷genistin、黄豆黄素glycitein、黄豆黄素苷glycitin、丙二酰异黄酮苷malonyldaidzin)的总含量。
对照及转基因株系中黄酮类化合物含量检测结果如图5所示,结果显示:
根中,转基因受体对照(jack)、转空载体对照(null),oe-2、oe-26、oe-49和oe-53的黄酮类化合物分别为:72±3.9、60±4.5、96±8.1、148±3.9、111±10.1和143±4.8nmol/mg。
叶中,转基因受体对照(jack)、转空载体对照(null),oe-2、oe-26、oe-49和oe-53的黄酮类化合物分别为:0.6±0.04、0.75±0.11、1.05±0.13、1.68±0.04、1.25±0.1和1.33±0.18nmol/mg。
种子中,转基因受体对照(jack)、转空载体对照(null),oe-2、oe-26、oe-49和oe-53的黄酮类化合物分别为:1.28±0.34、1.27±0.23、1.58±0.71、2.26±0.49、1.58±0.43和1.73±0.61nmol/mg。
上述结果表明,gmhsfb2b基因在大豆中过表达,也即gmhsfb2b在植株中的积累提高了转基因植株叶、根和种子中的黄酮类化合物的积累,与对照比较,基本达到显著或极显著差异。其中,根中提高最多,种子中次之,叶中积累最少。
综上所述,gmhsfb2b调控植物中黄酮类化合物的积累,其过表达未见影响其它农艺性状,因此,gmhsfb2b对于提高大豆品质育种,特别是培育高黄酮类化合物含量品种具有应用前景。
<110>中国科学院遗传与发育生物学研究所
<120>蛋白gmhsfb2b在调控植物黄酮类化合物积累中应用
<130>gncln190296
<160>2
<170>patentinversion3.5
<210>1
<211>355
<212>prt
<213>glycinemax(l.)merrill
<400>1
metalaproleuproalagluglnthrglygluseralaprothrglu
151015
leuglnargserileprothrpropheleuthrlysthrtyrglnleu
202530
valaspaspproseralaaspaspleuilesertrpasngluaspgly
354045
thrserpheilevaltrpargproalagluphealaargaspleuleu
505560
prolystyrphelyshisasnasnpheserserphevalargglnleu
65707580
asnthrtyrglyphearglysvalvalproaspargtrpglupheala
859095
asnaspcyspheargargglygluargalaleuleuargaspilegln
100105110
argarglysleuleuprovalproproalaalaalaalaproalaala
115120125
valthralaasnthrvalthrvalalavalalaalaproalavalarg
130135140
thrvalserprothrthrserglyaspgluglnvalleuserserasn
145150155160
serserproilealaglyasnasnasnasnasnthrvalhisargthr
165170175
thrsercysthrthralaprogluleuleuglugluasngluargleu
180185190
arglysgluasnileglnleuserasngluleuserglnleulysgly
195200205
leucysasnasnileleuserleumetthrasntyralaserglyphe
210215220
serargglnglnleugluserserthrseralavalargthrvalpro
225230235240
valproaspglylysalaproleugluleuleuproalalyshisval
245250255
serseralaaspaspalaleuhisvalglyglyalaalaglyalaala
260265270
alacysalathrglyasnalaalaglualagluvalprolysleuphe
275280285
glyvalserileglyleulysargcysargthrglucysglualaglu
290295300
progluglygluaspglnasnglnmetglnthrargalaglnthrgln
305310315320
serglnserserglngluproasphisglyseraspvallysserglu
325330335
proleuaspglyaspaspserasptyrglnasphisaspprohistrp
340345350
leugluleu
355
<210>2
<211>1068
<212>dna
<213>glycinemax(l.)merrill
<400>1
atggcgccgttaccggcggagcaaaccggtgaatcagcgccgacggagttgcagagatcc60
attccgacgccgtttctgaccaagacgtaccagctcgtcgatgatccctccgcggatgac120
ctaatttcctggaacgaagacggcaccagcttcattgtatggcgacccgcggaatttgca180
agggatttgcttcctaagtacttcaaacacaacaacttttccagtttcgtccgtcaactt240
aacacctatgggttccggaaggttgtccctgaccgttgggaattcgccaacgactgtttc300
cggcgaggcgagagagctcttcttcgcgacatacagcgccggaaattactgccggttccg360
cctgcagccgcggcaccggcagcagtcacagccaatacggtgacggtggctgtggcagca420
ccggcggtgagaactgtgtctccaacgacttccggcgacgaacaggtactatcttcgaac480
tcatctccgattgctgggaataataataataatacagtacaccgcaccacaagttgcacc540
actgcgcccgagctgttagaagagaatgaaaggcttaggaaagagaacatacaactgagt600
aacgagttgagtcaattgaagggtttgtgtaataacatactctctttgatgaccaattat660
gcttctggttttagccgccagcagttagaatcctccacaagcgctgtgaggaccgtgccg720
gtgccggacgggaaggcgccgctggagcttttgcccgcgaaacatgtttcatcggctgat780
gacgccctgcatgtcggtggcgccgccggtgccgcggcgtgcgcgacggggaacgcggcg840
gaagcagaggttccgaagctgtttggggtttcgattggactgaaacgatgtaggacagag900
tgcgaggccgaaccagaaggagaagatcagaatcagatgcaaacgcgagcacaaacacaa960
tcacaatcgtcgcaagaaccagatcacggttcagatgtgaaatctgaaccgcttgatggt1020
gatgattcggattatcaggatcatgaccctcattggttggagctatag1068
- 还没有人留言评论。精彩留言会获得点赞!