一种外周血高分子量基因组DNA的提取方法与流程
本发明属于生物技术领域,尤其涉及一种外周血高分子量基因组dna的提取方法。
背景技术:
dna提取是分子生物学实验中非常重要的环节,而提取的基因组dna的分子量大小直接影响到后续实验操作能否顺利进行。随着测序技术的发展,构建单体型技术对于无创检测胎儿的遗传信息具有重要的意义。而在构建单体型的实验过程中,往往遇到由于基因组dna完整性不好,进而带来单体型构建困难,或判断不准确的现象。所以从血液样本中提取得到高分子量的基因组dna对于单倍体分型至关重要。
目前所存在的各种血液样本高分子量基因组dna的提取方法主要是传统的酚氯仿抽提法,其他的方法还有:1、物理方式:玻璃珠法、超声法、冻融法;2、化学方式:异硫氰酸胍法、碱裂解法;3、生物方式:酶法等。根据分离纯化方式的不同又可分为依赖于硅脂材料分离(磁珠富集)和阴离子交换树脂法等。对于物理方式获得的基因组dna,由于在操作过程中的剧烈震荡、研磨等,使得dna的分子量大大的降低;而对于化学的方式,虽然得到了少量的高分子量的dna片段,但由于化学物质的存在对后续的实验造成了一定程度的影响。
目前市面上大部分的血液提取试剂盒虽然提取操作简单,但很难获得大片段的dna或不能对得到的基因组dna进行片段的筛选,只保留高分子量的dna。无法满足后续的单体型构建的实验要求,或无法分析获得正确的单体型。
综上所述,寻找一种对血液高分子量dna提取方法对于单倍体分型检测遗传信息有着重要的生物学意义。
技术实现要素:
为了能够提取高质量的大片段血液基因组dna,以满足高通量测序技术为基础的单倍体分型要求,解决目前市场试剂盒提取dna完整性不够的难题。本发明提供了如下技术方案:
本发明提供了一种哺乳动物或人的离体血液基因组dna提取方法,包括如下步骤:
1)裂解哺乳动物或人的离体血液中红细胞,收集沉淀;
2)用白细胞裂解液裂解1)得到的沉淀,收集沉淀;
所述白细胞裂解液包括如下组分:edta、nacl、kcl、tritonx-100和蔗糖;
3)用蛋白酶和核糖核酸酶消化2)得到的沉淀,即得到基因组dna。
在本发明的实施例中,裂解哺乳动物或人的离体血液中红细胞为向哺乳动物或人的离体血液中加入红细胞裂解液,具体用的红细胞裂解液是acklysisingbuffer(购自lifetechnologiesa10492-01),步骤具体如下:
取8ml的acklysisingbuffer加入到上述装有血液的15ml离心管中,上下颠倒3次,静置3min以裂解红细胞;4℃离心,300g,5min,倾倒去上清,留管底沉淀。
上述方法中,所述白细胞裂解液中如下组分的配比为0.5-2mmol/ledta:130-150mmol/lnacl:2-4mmol/lkcl:体积百分含量0.5%-2%tritonx-100:250-450mmo/l蔗糖。
上述方法中,所述白细胞裂解液中还包括tris;
所述白细胞裂解液中各个组分的配比为0.5-2mmol/ledta:130-150mmol/lnacl:2-4mmol/lkcl:体积百分含量0.5%-2%tritonx-100:250-450mmo/l蔗糖:12-14mmol/ltris。
在本发明的实施例中,所述白细胞裂解液中各个组分的配比具体为1.0mmol/ledta:140mmol/lnacl:3mmol/lkcl:体积百分含量1%tritonx-100:350mmo/l蔗糖:13mmol/ltris。
上述方法中,所述白细胞裂解液中除去上述各个组分,余量为水;
或,所述白细胞裂解液的ph值为8-8.5;
或,所述白细胞裂解液的ph值具体为8.3;
在本发明的实施例中,所述白细胞裂解液lysisbuffer的制备方法如下:13mmol/ltris、1.0mmol/ledta、140mmol/lnacl、3mmol/lkcl、1%tritonx-100(体积百分含量)、350mmo/l蔗糖,使用双蒸水定容至1l,用盐酸溶液(购自东江试剂)调节lysisbuffer的ph值为8.3,滤膜过滤除菌或高温高压灭菌。
或,所述白细胞裂解液的加入体积为所述离体血液的7-9倍;
或,所述白细胞裂解液的加入体积具体为所述离体血液的8倍。
上述方法中,步骤3)为向所述2)得到的沉淀中加入蛋白酶消化液和核糖核酸酶消化液;
或,所述核糖核酸酶消化液由核糖核酸酶和核糖核酸酶消化缓冲液组成;
上述核糖核酸酶和核糖核酸酶消化缓冲液的体积比为1:50;
上述核糖核酸酶,为agilent的rnase-itribonucleasecocktail,酶活为6000u/ml。
或,所述核糖核酸酶消化缓冲液包括如下组分:na2hpo4、nacl、kcl和kh2po4。
上述方法中,所述核糖核酸酶消化缓冲液中如下组分的配比为1.5-2g/lna2hpo4:7-9g/lnacl:0.1-0.3g/lkcl:0.1-0.3g/lkh2po4。
上述方法中,所述核糖核酸酶消化缓冲液还包括edta溶液;
所述核糖核酸酶消化缓冲液中各个组分的配比为1.5-2g/lna2hpo4:7-9g/lnacl:0.1-0.3g/lkcl:0.1-0.3g/lkh2po4:0.01medta溶液中的edta;
在本发明的实施例中,所述核糖核酸酶消化缓冲液中各个组分的配比具体为1.75g/lna2hpo4:8.0g/lnacl:0.2g/lkcl:0.2g/lkh2po4:0.01medta溶液中的edta。
在本发明的实施例中,用于配制核糖核酸酶消化缓冲液的edta溶液采用的是ph8.0的0.5medta溶液(edtabuffer购自lonza)。
0.01medta溶液中的edta为edta溶液中的edta在核糖核酸酶消化缓冲液中的浓度。
上述方法中,所述核糖核酸酶消化缓冲液中除去上述各个组分,余量为水;
或,所述核糖核酸酶消化缓冲液的ph值为7.5-8.5;
或,所述核糖核酸酶消化缓冲液的ph值具体为8。
在本发明的实施例中,所述核糖核酸酶消化液由5ulrnase-itribonucleasecocktail(核糖核酸酶,购自agilent,酶活为6000u/ml)和250uldigestionbuffer(核糖核酸酶消化缓冲液)组成;
上述核糖核酸酶消化缓冲液按照如下方法制备:将1.75gna2hpo4、8.0gnacl、0.2gkcl、0.2gkh2po4、20mlph8.0的0.5medta溶液(购自lonza)混匀,使用naoh溶液(购自sigma)调ph到8.0,然后加水定容至1l,滤膜过滤除菌或高温高压灭菌。
或,所述核糖核酸酶消化液按照每1ml离体血液加入25-35u核糖核酸酶的量进行消化;
或,所述核糖核酸酶消化液具体按照每1ml离体血液加入29.4u核糖核酸酶的量进行消化。
上述方法中,所述蛋白酶消化液包括如下组分:质量体积百分含量(g/ml)0.8-1.2%sds、体积百分含量8-12%proteinksolution;
或,所述蛋白酶消化液具体包括质量体积百分含量1%sds和体积百分含量10%proteinksolution;
或,所述蛋白酶消化液的余量为ph为8-9的1xtebuffer(该buffer由10mmtris、1mmedta和水组成);
或,所述蛋白酶消化液的ph值为8.0;
或,所述蛋白酶消化液按照每1ml离体血液加入200-300ul蛋白酶消化液的量进行消化,
或,所述蛋白酶消化液具体按照每1ml离体血液加入250ul蛋白酶消化液的量进行消化。
上述方法中,在步骤3)中,在所述消化的步骤后还包括如下步骤:
3)-a、透析所述消化的产物,收集透析产物;
或所述透析的截留分子量大于20kb;
3)-b、所述透析产物打断至得到呈现一次滴下一个液滴的状态的dna。
上述的方法制备的基因组dna也是本发明保护的范围;
上述的方法制备的基因组dna采用脉冲场电泳检测,检测条件为电泳缓冲液为0.5xtbe,脉冲场电泳条件为电压6.5v/cm,脉冲转化时间1-20s,电泳时间为16-20小时。
或,所述基因组dna在单倍体分型分析中的应用也是本发明保护的范围;
或,上述的方法在单倍体分型分析中的应用也是本发明保护的范围;
或,本发明还提供了一种试剂盒,包括上述的方法中的所述白细胞裂解液、所述蛋白酶和所述核糖核酸酶;
或,本发明还提供了一种试剂盒,包括上述的方法中的所述白细胞裂解液、上述方法中的蛋白酶消化液和核糖核酸酶消化液。
上述方法或产品中,获得的基因组dna为大片段dna;具体为大于200k的片段。
本发明提供的方法及试剂在提取血液高分子量基因组dna方面,操作简单,成本低,可以有效的做到片段筛选分离,进而得到所需大片段dna,与传统的方法以及市面上购得的提取试剂盒相比,提取量大,片段完整性好,且经过透析处理,去除掉了小分子dna,有利于单倍体分型分析,成本低,容易实现。
利用本发明可以制备长片段dna分子提取试剂盒,同样利用本产品也可以作为三代测序文库构建的dna提取的组分。单倍体型在人类基因组连锁分析,关联分析,群体遗传学和临床诊疗中均有非常重要的应用,随着个人基因组成本降到1000美金,人基因组的单倍体型信息尤为重要,单倍体型获得对于dna分子片段的长度有非常高的要求,理论上投入三代测序或者利用标签关联分析的ngs测序(目前两种主要的解决个体单倍体型构建的技术)的dna分子片段越长对个体单倍体型定向的长度起着至关重要的作用,因此个体单倍体构建应用也是本发明后续的一个非常重要的应用场景。随着测序成本的进一步的降低,市场占有率会呈指数式增长。
附图说明
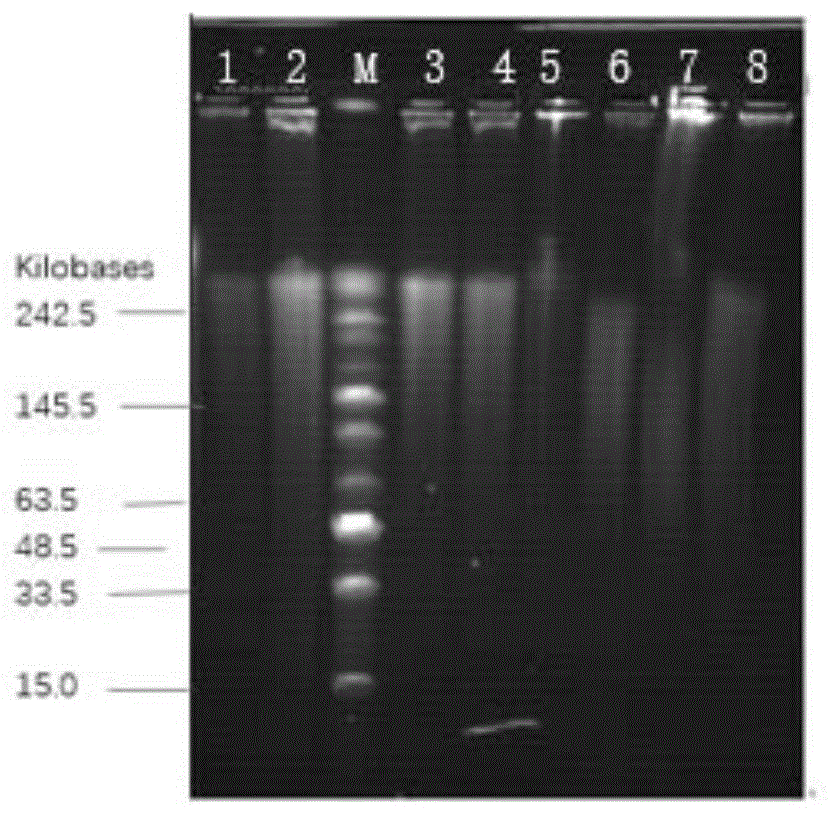
图1为本发明的方法提取的基因组dna,其中1-8分别为8个血液样本。
图2为对比例的方法提取的基因组dna,其中1-8分别为8个血液样。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下面通过实施例结合附图来对本发明的技术方案作进一步阐述。
实施例1、人血液高分子量基因组dna的提取方法
1、血液样本解冻
8个-80℃冻存的血液样本放于常温化冻,期间不断上下颠覆混匀。待样本全部化冻后,分别取1ml血液分别加入到8个15ml的离心管中。
2、裂解红细胞
向上述1得到的装有1ml血液(全血)的15ml离心管中,加入8ml的红细胞裂解液acklysisingbuffer(购自lifetechnologiesa10492-01)上下颠倒3次,静置3min以裂解红细胞;4℃离心,300g,5min,倾倒去上清液,留管底沉淀。
再加入5ml冰上预冷的pbs(购自gibco),轻轻弹动离心管使沉淀漂浮;4℃、300g离心5min;倾倒去除上清,不要搅动管底的沉淀,留管底沉淀。
3、白细胞裂解
向2处理后的沉淀中加入8ml白细胞裂解液lysisbuffer,涡旋3-5秒,然后将15ml离心管置于冰上10min;4℃、1100g离心15min;倾倒去除上清,注意不要搅动管底的沉淀,留管底沉淀。将离心管倒置放于纸巾上1min沥干多余水分,使用无尘纸尽量擦干离心管底的液体,注意不要触动沉淀部分。
上述lysisbuffer配方如下:1.0mmol/ledta、140mmol/lnacl、3mmol/lkcl、体积百分含量1%tritonx-100、350mmo/l蔗糖、13mmol/ltris,余量为水,ph值为8.3。
上述lysisbuffer按照如下方法制备:将13mmol/ltris、1.0mmol/ledta,140mmol/lnacl,3mmol/lkcl,1%tritonx-100(体积百分含量),350mmo/l蔗糖,使用双蒸水定容至1l,用盐酸溶液(购自东江试剂)调节lysisbuffer的ph值为8.3,滤膜过滤除菌或高温高压灭菌。
4、蛋白酶和核糖核酸酶消化其他大分子
向上述3处理的沉淀中加入250ul蛋白酶消化液(按照1ml全血对应250ul蛋白酶消化液加入)和250ul核糖核酸酶消化液(按照1ml全血对应29.4u核糖核酸加入),50℃过夜消化去除蛋白等大分子物质。
蛋白酶消化液配方:1%(质量体积百分含量g/ml)sds(购自ambion)、10%(体积百分含量)proteinksolution(购自roche)和80%(体积百分含量)1x的tebuffer(缓冲液,其中包括10mmtris和1mmedta)(购自ambion)。
蛋白酶消化液制备方法如下:将25ul10%sds(质量体积百分含量g/ml,购自ambion)、25ulproteinksolution(购自roche)、200ul1xte(ph8.0)buffer(购自ambion)混匀,得到。
蛋白酶消化液的ph值为8.0。
核糖核酸酶消化液由5ulrnase-itribonucleasecocktail(核糖核酸酶,购自agilent,酶活为6000u/ml)和250uldigestionbuffer(核糖核酸酶消化缓冲液)组成;
digestionbuffer配方为:1.75gna2hpo4、8.0gnacl、0.2gkcl、0.2gkh2po4、20mlph8.0的0.5medta溶液(edtabuffer购自lonza),余量为水,定容至1l。
digestionbuffer按照如下方法制备:将1.75gna2hpo4、8.0gnacl、0.2gkcl、0.2gkh2po4、20mlph8.0的0.5medta溶液(购自lonza),使用naoh溶液(购自sigma)调ph到8.0,然后加水定容至1l,滤膜过滤除菌或高温高压灭菌。
5、透析纯化
在烧杯中倒入至少500ml1xte(ph8.0)buffer,再将烧杯置于磁力搅拌器上,将上述过夜消化的溶液用广口枪头转移至透析膜杯中(permeablemembrancecup购自thermo,截留分子量为>20kb),将透析膜杯放到浮漂上置于装有tebuffer的烧杯中,调节磁力搅拌器,中速混匀,透析16-48小时,如果透析超过24小时,需要更换tebuffer。
6、dna打断
透析结束后用广口枪头将透析膜杯中的液体全部转移至1.5ml的ep管中,此时可观察到相对团状的dna。
用1ml广口枪头转移透析膜杯内的dna溶液到1.5ml离心管中,取最粘稠的部分150-200ul,加入等体积的无核酸酶水,反复轻柔吹打15-20次。
使用200ul的移液器,量程调至150ul,用200ul未剪切的枪头对上述已经吹打过一次的dna进一步吹打,直到打断后的dna呈现一次滴下一个液滴的状态,得到待检样本dna。
二、脉冲场电泳检测
将待检样本dna和lamadapfgmarker(购自neb)加入制备好的含有核酸染料的8%琼脂糖凝胶中,电泳缓冲液为0.5xtbe,脉冲场电泳条件为电压6.5v/cm,脉冲转化时间1-20s,电泳时间为16-20小时。
电泳结束后用凝胶成像仪拍摄结果并记录。
用qubitdsdnahs检测dna的浓度,并用琼脂糖凝胶脉冲电泳检测提取得到的dna的分子量大小。
结果如图1所示,可以看出,提取得到的dna的片段大小集中于50k以上,且大部分dna的片段大小超过了200k,符合单倍体分型的实验要求。
对比例:
同时使用商业的试剂盒提取做对照(按试剂盒qiagenmagattracthmwdnakit说明书操作)。
结果如图2所示,采用商业的试剂盒提取的血液高分子量dna,大部分样品片段大小小于50k,无法满足后续的实验要求。
- 还没有人留言评论。精彩留言会获得点赞!