一种姜花倍半萜合成酶基因HcTPS12及其应用的制作方法
本发明涉及基因工程技术领域,更具体地,涉及一种姜花倍半萜合成酶基因hctps12及其应用。
背景技术:
姜花是姜科姜花属多年生草本植物,在印度地区是一种传统的药用植物(ray,etal.,2016)。从姜花根茎、花瓣和叶片中可以提取出大量精油,研究表明姜花精油具有抗菌、抗氧化及消炎等药用特性,同时广泛应用于护肤品、香精香料等行业,并且主要成分为萜烯类化合物(santos,etal.,2010;dixit,2018)。萜类物质是一类由数个异戊二烯(isoprene,c5)结构单位构成的化合物的统称,根据其结构单位数目的不同,可分为单萜(monoterpene,c10)、倍半萜(sesquiterpene,c15)和二萜(diterpene,c20)等(martinetal.,2015)。其中倍半萜是重要的药用成分,同时还是重要的香精成分。据报道,倍半萜紫杉醇可以用来治疗肿瘤(吴娜等,2016),倍半萜青蒿素是治疗疟疾的特效药(mann,etal.,2000)。倍半萜红没药烯具有抗痒、消炎和抗癌等作用,同时是重要食用香精(庞亚如和胡智慧等,2018)。
萜类合成酶(tps)是萜类物质生物合成的末端关键酶,它直接决定萜类产物的种类、数量和产量。根据tps催化形成的产物的不同,将tps分为单萜合成酶(monotps)、倍半萜合成酶(sesquitps)和二萜合成酶(ditps),它们分别催化底物gpp、fpp和ggpp形成相应的单萜、倍半萜和二萜产物。
萜类合成酶是萜类化合物生物合成的关键酶,因此也成了萜类生物合成过程中研究最多和最深入的酶类,自1992年在烟草中克隆了两个倍半萜合成酶基因(facchiniandchappell,1992)以来,科学家已在40多种植物中克隆了200多个单萜和倍半萜合成酶基因(degenhardtetal.,2009),涉及农作物(chenetal.,1995;kollneretal.,2008;yuanetal.,2008;chenetal.,2014)、针叶类植物(bohlmannetal.,1999;martinetal.,2004)、药用植物(deguerryetal.,2006)、香料植物和观赏植物以及拟南芥(chenetal.,2003)等模式植物。
目前,国内对姜花萜类合成酶的研究主要集中在单萜合成酶基因上,然而对姜花倍半萜合成酶基因却鲜有报道。克隆倍半萜合成酶基因是对姜花倍半萜成分形成机理研究的前提,为以后全面阐述姜花倍半萜成分形成和调控机理及通过基因工程手段提高姜花倍半萜成分的含量奠定理论基础。
红没药烯是一种植物来源的倍半萜烯天然活性化合物,它在自然界中分布也较为广泛,主要存在于天然的植物精油中。根据双键位置的不同可分为3种同分异构体:α-红没药烯、β-红没药烯和γ-红没药烯;红没药烯有类似果香和香脂的气味,其中β-红没药烯有类似香油的气味,可以作为食用香精及日化香精;红没药烯也是极具潜力的新型生物燃料;β-红没药烯和γ-红没药烯还具有抗痒、消炎的功能和抗癌活性。此外,红没药烯也是多种高附加值工业产品合成的前体物质,如生物燃料、生物塑料、化妆品、保健品及药品等。
目前红没药烯的工业生产主要是通过植物提取法实现的,但从植物组织中提红没药烯存在着产物含量低和分离纯化困难等缺点。微生物代谢工程的快速发展为这些植物天然产物的生产提供了一条更具潜力的生物合成路线。利用微生物代谢工程技术构建生产这些有价值的植物天然产物的微生物细胞工厂具有绿色清洁、可持续发展和经济效益好等独特优势。
技术实现要素:
本发明所要解决的技术问题是克服姜花萜类合成酶基因研究及红没药烯制备方面存在的缺陷和不足,提供一种姜花中控制倍半萜成分红没药烯的单功能酶基因hctps12。
本发明的第一个目的是提供一种姜花倍半萜合成酶基因hctps12。
本发明的第二个目的是提供一种姜花倍半萜合成酶hctps12。
本发明的第三个目的是提供所述姜花倍半萜合成酶基因hctps12和/或姜花倍半萜合成酶hctps12在制备红没药烯中的应用。
本发明的上述目的是通过以下技术方案给予实现的:
一种姜花倍半萜合成酶基因hctps12,所述基因的全长cdna序列如seqidno:1所示,所述基因可赋予姜花叶片倍半萜红没药烯成分。本发明所示姜花基因hctps12在叶组织中表达量较高,并且其表达与叶发育进程有关。hctps12基因cdna全长为1823bp,其核苷酸序列如seqidno:1所示;基因编码区(cds)共1653bp,其核苷酸序列如seqidno:2所示;推测编码550个氨基酸,其氨基酸序列如seqidno:3所示,推测蛋白分子量为64.2kda。该基因序列包含ddxxd保守序列,对其进行基因系统进化树分析表明,属于植物萜类合成酶基因家族tps-a亚族。
因此,本发明还请求保护一种姜花倍半萜合成酶hctps12,其氨基酸序列如seqidno:3所示。
根据本发明提供的hctps12基因序列信息,本领域技术人员可以通过以下方法容易地获得与hctps12等同的基因:(1)通过数据库检索获得;(2)以hctps12基因片段为探针筛选姜花或其它植物的基因组文库或cdna文库获得;(3)根据hctps12基因序列信息设计寡核苷酸引物,用pcr扩增的方法从姜花或其它植物的基因组、mrna和cdna中获取;(4)在hctps12基因序列的基础上用基因工程方法改造获得;(5)用化学合成的方法获得该基因。
本发明还提供一种用于扩增姜花倍半萜合成酶基因hctps12的引物对,所述引物对的核苷酸序列如seqidno:4~5所示。
同时,本发明还提供一种包含上述姜花倍半萜合成酶基因hctps12的重组载体。
一种包含上述重组载体的重组菌。
一种包含上述重组菌的细胞系。
本发明通过将姜花倍半萜合成酶基因hctps12的全长cdna序列连接到原核表达载体上,经过体外诱导得到高纯度的体外重组蛋白。通过给予反应底物fpp对上述体外重组蛋白进行体外酶活实验。结果显示hctps12蛋白催化fpp生成倍半萜成分红没药烯,占反应总产物的100%。红没药烯为姜花精油组成成分之一。表明本发明的hctps12蛋白是具有单一催化功能的倍半萜合成酶,同时可利用姜花倍半萜合成酶基因hctps12通过微生物代谢工程来制备红没药烯,进而制备植物精油或药物。
因此,本发明所述姜花倍半萜合成酶基因hctps12和/或姜花倍半萜合成酶hctps12在制备红没药烯,或在制备香料、精油或药物中的应用也在本发明保护范围内。
具体地,所述应用为以法呢基焦磷酸(fpp)为底物,经姜花倍半萜合成酶hctps12催化产生红没药烯。
本发明提供的姜花倍半萜合成酶基因hctps12具有重要的应用价值。应用之一是将所述的hctps12基因序列连接到任何一种植物转化载体,用任何一种转化方法将hctps12基因导入姜花或其他植物细胞,可获得表达所述基因的转基因植株,从而应用于生产。本发明所述的基因构建到植物转化载体中时,可以对所述基因或其调控序列适当修饰,也可以在其转录起始密码子前用其它启动子取代所述基因原有的启动子,从而拓宽和增强植物产生倍半萜红没药烯和增强抗性的能力。
本发明提供的倍半萜合成酶基因hctps12的再一个应用是根据所述基因序列信息产生特异性的分子标记,包括但不限于snp(单核苷酸多态)、ssr(简单序列重复多态)、rflp(限制性内切酶长度多态)、cap(切割扩增片段多态)。用这些标记可鉴定姜花或其它植物的倍半萜红没药烯合成酶基因,用于分子标记辅助选择育种,从而提高育种的选择效率。
与现有技术相比,本发明具有以下有益效果:
本发明提供了一种新的倍半萜合成酶基因hctps12,所述基因可以催化fpp形成倍半萜类化合物红没药烯,在提高植物萜类成分含量和抗性方面都发挥着重要作用;所述半萜合成酶基因hctps12可用于制备红没药烯及进一步制备精油、香精和药物。将本发明的基因片段构建在植物表达载体上,可以外源转化其他植物材料,从而获得含有倍半萜红没药烯合成酶基因的转基因材料,对培育药用植物提供了一种有效地方法。倍半萜合成酶基因的克隆是克服传统育种中不能在植物种间转移基因问题的前提。另外,本发明能够进一步提供或应用利用上述dna片段获得的具有药用价值的转基因植株和相应的种子,以及用本发明的基因或基于该基因的重组体转化的植株或由这类植株获得的种子。可以用有性杂交的方式将本发明的基因转入其他的植株。
附图说明
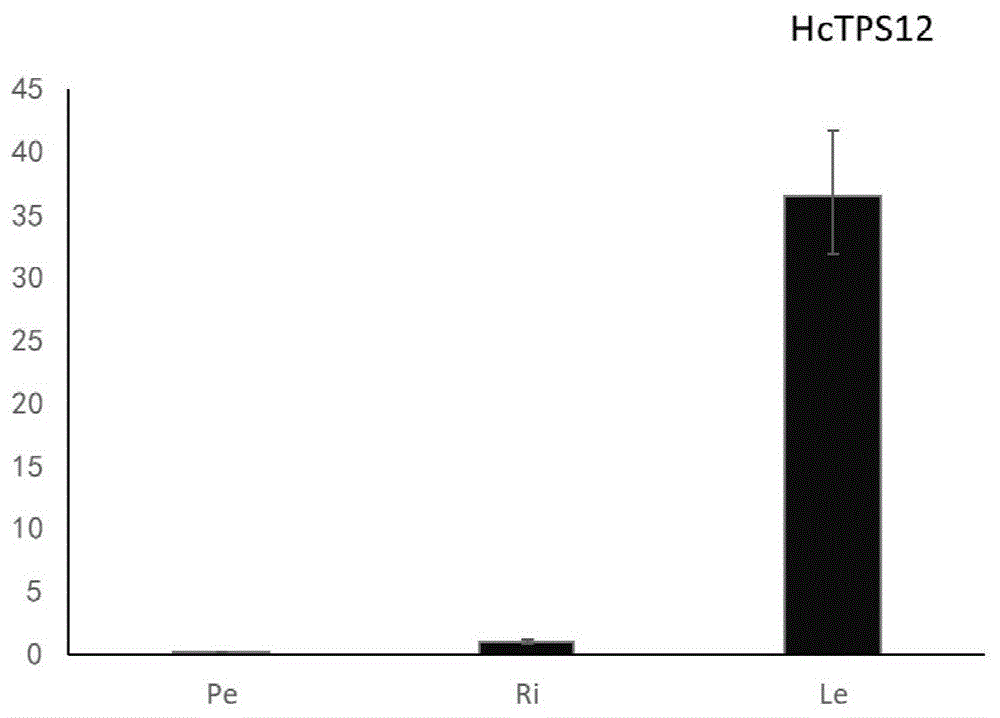
图1为本发明hctps12基因在姜花不同组织中表达特异性情况;pe:花瓣;ri:根茎;le:叶片。
图2为本发明hctps12基因在姜花叶器官不同发育时期的表达情况。
图3为本发明hctps12重组蛋白以fpp为底物体外酶催化反应。
具体实施方式
下面结合附图和具体实施例进一步详细说明本发明。除非特别说明,实施例中采用的试剂和方法均为本领域常规使用的试剂和方法。
实施例1hctps12基因cdna全长的获得
s1.姜花叶片rna的提取:以超低温冰箱保存的姜花叶片作为提取rna的材料。rna提取所用的枪头、eppendorf管用0.1%的depc于37℃浸泡过夜后121℃高温灭菌25min,玻璃器皿,研钵用铝箔包好后于180℃下干热处理3h,冷却后备用。采用trizol法按照trizol(takara)的说明书提取姜花叶片总rna。用1%琼脂糖凝胶电泳检测rna的完整性,利用微量分光光度计法测定其浓度和纯度。放于-80℃保存备用。
s2.姜花叶片总rna作为模板,用生工m-mulvfirstcdnasynthesiskit合成第一链cdna。据姜花转录组数据库相关注释基因序列,设计引物,上游引物f1:5’-gtcatggagcttgctggtact-3’(如seqidno:4所示)。下游引物r1:5’-ggcttcaacaatattaacaagacc-3’(如seqidno:5所示)。并交由上海生物工程公司合成。以上述合成的cdna为模板采用takarapcramplificationkit进行pcr扩增反应,具体方法按照说明书进行。pcr程序为:94℃预变性4min;94℃变性30s、56℃复性30s、72℃延伸2min,35个循环;然后72℃延伸10min。在-20℃下保存备用。pcr反应结束后,用1.0%琼脂糖凝胶电泳初步检测pcr产物中是否含有目的片段条带。pcr扩增产物经1%琼脂糖凝胶电泳检测后,用手术刀在紫外灯下切出含有目的片段的胶块,用dna凝胶回收试剂盒(agarosegeldnapurificationkit,takara)进行回收,回收方法基本参照试剂盒说明书。之后要对回收产物进行1%琼脂糖电泳检测,看其回收效果及大致浓度,以便保证后续试验的进行。根据回收的目的片段大小及其有效浓度,取适量回收纯化的产物与克隆载体连接,载体选用takarapmd19-t载体,目的dna与克隆载体的摩尔比控制在3:1左右,具体操作按说明书进行。在16℃下恒温连接3~6h,连接时间的长短视目的片段的长度而定。提前将感受态细胞dh5α(takara)从-80℃冰箱取出,并置于冰盒中待其自然融化,将10μl连接液全量加入感受态细胞的离心管中,冰浴30min后,42℃水浴热激50s,迅速冰上放置2~5min,然后加入37℃预温的soc液体培养基890μl补足到1ml,混匀后37℃下180rpm振荡培养1h。在含100μg/ml氨苄青霉素的lb固体培养基平板表面上涂30μl的x-gal(20mg/ml)和30μliptg(20mg/ml),然后涂布适量转化液,待转化液完全被吸收后倒置于37℃恒温箱中过夜培养,约16h后观察结果,通过x-gal/iptg蓝白斑筛选白色菌落,并初步鉴定重组质粒,平板置于4℃保存。通过蓝白斑初步筛选后,通常选6个菌斑摇菌后提取质粒,用于进一步鉴定。用灭菌的牙签从lb平板培养基上挑取白色单菌落接种于含有100μg/ml氨苄青霉素的lb液体培养基中,于控温震荡水浴摇床上37℃、240rpm振荡过夜培养,用质粒dna小抽试剂盒(上海博亚生物有限公司)提取质粒,步骤按说明书上方法进行。对所提质粒进行1.0%琼脂糖凝胶电泳检测,比较质粒大小并将明显滞后的质粒进行双酶切(ecori/hindiii,takara)分析。在37℃下酶切1h后,对酶切产物进行1.0%琼脂糖凝胶电泳检测。随意选送酶切鉴定后含目的片段的重组质粒进行dna序列测定。测序工作交由上海生工生物技术有限公司完成,采用美国abi377序列分析仪。所得的序列和转录组原有序列信息进行比对,在ncbi进行比对和同源性分析,确定获得的基因序列为tps家族的完整全长序列,同时根据cdna序列推测出其蛋白序列。
结果所示hctps12基因的全长cdna序列如seqidno:1所示,cdna全长为1823bp;基因编码区(cds)如seqidno:2所示,共1653bp;推测其氨基酸序列如seqidno:3所示。
实施例2hctps12基因的表达分析
1、选取姜花不同组织部位及不同发育时期叶片提取rna,其rna提取均使用trizol法(takara),荧光定量pcr采用sybrgreen(taraka)法,染料法的具体原理见说明书。利用primerpremier5.0软件设计实时荧光定量pcr引物,按荧光定量pcr引物设计原则,用primerpremier5.0分别设计引物,通过荧光定量pcr检测其是否有错配或引物二聚体及其扩增效率,从中选择一对最佳引物,p1:5’-tggaaggcgtggttgttgat-3’(如seqidno:6所示)。p2:5’-agaccgtgatttctgatttgt-3’(如seqidno:7所示)。内参基因rps根据real-timepcr引物的设计原则,用primerpremier5.0设计引物,rps-p1:5’-ttagtagcatcggctgcaataag-3’(如seqidno:8所示),rps-p2:5’-ctcaaccgtcttcccaaaagag-3’(如seqidno:9所示)。通过real-timepcr进行检测,并制作标准曲线,以检测其扩增效率(e)是否在90~110%范围内进行筛选。以各样品的cdna为模板,在abi荧光定量pcr仪上进行荧光定量pcr反应。每个样品设3个重复,以ddh2o为阴性对照。反应体系为sybrpremixextaq(takara)10.0μl,上游引物(10μm)0.4μl,下游引物(10μm)0.4μl,cdna2.0μl,ddh2o7.2μl。反应程序为94℃,30s;94℃,15s;55℃,30s;72℃,30min;40个循环,94℃,15s;72℃,30s;0.4℃/s融解曲线分析。反应结束后确认扩增曲线和融解曲线,采用2-△△ct法(livaketal.,2001)进行数据分析,计算姜花hctps12在不同样品中的表达情况。
2、结果
基因表达分析结果见图1,2所示。从图1中可以看出:hctps12在叶组织中表达量较高,在根茎和叶等营养器官几乎不表达。图2表明:该基因的表达量受叶片发育的调控,在老叶中表达量更高,与姜花精油中倍半萜红没药烯含量的变化趋势一致,说明hctps12是参与调控姜花萜类物质合成的相关基因。
实施例3hctps12基因原核表达
s1.载体构建:根据所得到hctps12基因的编码区,用包含kpni和ecori酶切位点的特异引物f:5’-gatctgggtaccatggagcttgctggtactcc-3’(如seqidno:10所示);r:5’-gagctcgaattcaatagggataggatgaacaa-3’(如seqidno:11)所示。进行pcr扩增。pcr产物用takara回收试剂盒回收,回收产物直接用kpni和ecori限制性内切酶进行双酶切,1%琼脂糖凝胶回收目的片段。pet-30a原核表达载体用kpni和ecori限制酶进行双酶切1%琼脂糖凝胶回收大片段。于16℃连接过夜,将连接产物转化大肠杆菌(e.coli)dh5α感受态细胞;提取质粒经酶切和测序鉴定后,获得重组原核表达载体。
s2.重组蛋白表达:用经鉴定的重组质粒dna转化bl21(de3)感受态细胞,挑取单菌落接种于5mllb(含25mg/lkan,34mg/lchl)培养基中,37℃震荡培养过夜。转接100μl种子液于新鲜的100ml(含25mg/lkan,34mg/lchl)的lb培养基中,37℃180rpm培养4~6h,测od值至0.4~0.6后用一定量的iptg(0.1~0.2mm)在14~18℃诱导14~16h。同时取另一对照组其中未加iptg诱导。离心收集菌体,用5ml裂解buffer(50mm磷酸bufferph8.0)悬浮细胞,将菌体冷却,置于冰上超声波破碎细胞。12000rpm,4℃离心10min,将上清移至新的离心管中,用双蒸水清洗沉淀一次,再用5ml裂解buffer悬浮沉淀。分别取上清和沉淀各50μl,保存与-20℃,进行sds-page电泳分析。配制12.5%sds聚丙烯酰胺凝胶,按照顺序上样。分别用60v和120v的电压对浓缩胶和分离胶的进行电泳。电泳完毕,考马斯亮蓝染色30min,再用脱色液脱色1~8h,观察并记录试验结果。
s3.重组蛋白的纯化:挑取单菌落接种于5ml的液体lb培养基中,37℃,180rpm,培养过夜,后全部转接至500ml的新鲜液体lb培养集中,37℃,180rpm,培养4h,用iptg(0.1~0.2mm),18℃条件下诱导16h后,收集菌体。取200μl菌体于离心管中,4℃保存,进行sds-page电泳分析。用5ml的裂解buffer悬浮细胞并转移至离心管内,置于冰上使菌体始终保持冷却,超声波破碎细胞。10,000g,4℃离心20~30min,收集上清液。取20μl的上清于-20℃保存,进行sds-page分析。向5ml细胞裂解液中加入1~2ml的ni-ntaresin(镍--次氮基三乙酸树脂填料)混匀,并低速在4℃摇床上结合60min。将结合完全的细胞裂解液和树脂混合物装入层析柱中,移走底部盖帽收集流出液部分(flow-throughfraction,f),取20μl的流出液,于-20℃保存,进行sds-page分析。用4ml的洗涤buffer洗脱层析柱两次,收集每部分的洗脱液(washfraction,w),各取20μl保存于-20℃冰箱中作sds-page分析。用0.5ml的洗脱buffer洗柱四次,分别用不同的收集管依次收集每部分的洗脱液(elutionfraction,e),分别标记为e1,e2,e3,e4,各取20μl进行sds-page分析。根据sds-page的检测结果,集中含有目标蛋白洗脱部分于一个离心管中,用移液器转移至透析袋中,4℃透析过夜。收集透析后的溶液,加入甘油使蛋白溶液中甘油总含量为20%,并且以200μl/管的量进行分装,取微量进行sds-page蛋白浓度检测,其余的放于-80℃超低温冰箱进行保存备用。
s4.酶催化功能鉴定:将30mmhepes,100μlph7.5,5mmdtt,20mmmgcl2各100μl,以及蛋白提取液100μl,2μlgpp或者fpp,加ddh2o588μl,使终体积为1ml,加入样品瓶中密封,30℃水浴1h,将75μm聚二甲基氧烷(pmds)萃取纤维头插入玻璃瓶中,顶空固相微萃取1h,反应结束后将萃取纤维头放至气相色谱-质谱连用仪中进行分析,气相色谱条件为:色谱柱为hp-1nnowax柱(30m×0.25mm);载气为高纯氦气,分流比20:1,柱前压50pa,流量1ml/min;取样时间2min;程序升温:柱起始温度45℃,保持2min,以5℃/min的速度升至80℃保持1min,然后以10℃/min的速度升至250℃保持5min。质谱条件为:gc-ms的接口温度220℃,电子轰击源ei、350v;离子源温度170℃;电子能量70ev;扫描质量范围35~335amu,采集到的质谱图用willey/mainlib库进行分析。
hctps12基因原核表达结果见图3。图3所示:以fpp为底物时,pet-30a-hctps12体外酶催化反应产物经质谱鉴定为倍半萜类物质红没药烯。说明hctps12基因编码生成的酶是一种可以催化fpp的生成半萜类物质红没药烯的单功能酶基因。
序列表
<120>一种姜花倍半萜合成酶基因hctps12及其应用
<141>2019-02-28
<160>11
<170>siposequencelisting1.0
<210>1
<211>1823
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>1
caagtcatggagcttgctggtactccatcagtcgaggttttggaaggcgtggttgttgat60
cgtcagttggcaggcttcgatcccagctcttggggtgaatactttattacaaatcagaaa120
tcacggtctgaggcatggatgaacgaaagagctgaagagctcaagaatgaagtaaggagc180
atgttccaaaacgtgactggcgtcctacaaaccatgaatctaattgatacaattcaactc240
ctcggacttgattaccatttcatggaggaaatagacagagctttagatcatctcaaggat300
gttgacatgagcaaaaacgggctctatgaggttgctcttcattttcgactgcttagacaa360
aaaggagtcaacatttcttcagatgtatttaaaaaatacatggataaagagggaaaattt420
atagaagaactaaaagatgatgctaaggggctcctgagcttatataatgcggcttacctc480
ggaaccaaaaaagagactatactcgacgaagccatttcttttactagagataaccttaca540
tctttgttaaaagatctaaatcctacatttgcaaagttagtgtctctcactctaaagaca600
cctattccacgaagcatgaaacgacttttcacaagatgctacatctctatttaccaagat660
gaaccgactcgaaatgaaacaatatttgagcttgcaaaattggacttcaacatactacaa720
tgtctccaccaggaggagctcaagaaactaagcatgtggtggaagcagttgaatttagac780
atcatgcatctaaattttgttcgagatcgagtggtggaatgtttctgttggtcgatggag840
atacgccatgaacccagttgttctcgtgctcgactgatagcgtctaagctacttatgttc900
attactgtcttggatgacttctatgatagctacagcacattagaagagagtcgactactt960
acagatgcaatcgaaaggtggagtcctgatgcagtagatcaactaccagaatacctgagg1020
gagttctttctcaaaatgttgaacatttttcaagaatttgaagatgaacttgcaccggaa1080
gagaagtttcgaatattgtacttcaaggaagaatggaaaactcaagctcaaagttacttc1140
aaggaatgccaatggagggatgacaattatgtgcccaagttagaagagcacatgcgtgtt1200
tcaatcataagtgtgggatttgtcttgttttattgcggatttttgagtggcatggaggag1260
acagtggccacaaaggatgcatttgaatggttcgcaagcttccccaagatcatagaagct1320
tgtgcaacaattcttcgtatcactaatgacataacttcaaaggagcgagaacaaaagagg1380
gcacatgttgcctcgacggtagattgctatatgaaggaatatggaacatcaaaagatgtt1440
gcatgcgagaagctcctaggctttgttgaagatgcatggaagactatcaacgaggagctc1500
cttactgcaactggattgtcgagggaagtaattgaactatcactccactgtgcgcaaact1560
acagaatttgtatacaaggatgtcgacgcattcacagaacctaatacctcgatgaaggaa1620
agcatctttttcctacttgttcatcctatccctatttgatgacagtagtgctacaatcat1680
gtactatttggtatctcatatggttgtgtgcttaagttattattatagaaataaaagggg1740
ggagaaagagagaaataacttggtcttgttaatattgttgaagccaaataagcttatatg1800
tacaagttgtttaccagttgtac1823
<210>2
<211>1653
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>2
atggagcttgctggtactccatcagtcgaggttttggaaggcgtggttgttgatcgtcag60
ttggcaggcttcgatcccagctcttggggtgaatactttattacaaatcagaaatcacgg120
tctgaggcatggatgaacgaaagagctgaagagctcaagaatgaagtaaggagcatgttc180
caaaacgtgactggcgtcctacaaaccatgaatctaattgatacaattcaactcctcgga240
cttgattaccatttcatggaggaaatagacagagctttagatcatctcaaggatgttgac300
atgagcaaaaacgggctctatgaggttgctcttcattttcgactgcttagacaaaaagga360
gtcaacatttcttcagatgtatttaaaaaatacatggataaagagggaaaatttatagaa420
gaactaaaagatgatgctaaggggctcctgagcttatataatgcggcttacctcggaacc480
aaaaaagagactatactcgacgaagccatttcttttactagagataaccttacatctttg540
ttaaaagatctaaatcctacatttgcaaagttagtgtctctcactctaaagacacctatt600
ccacgaagcatgaaacgacttttcacaagatgctacatctctatttaccaagatgaaccg660
actcgaaatgaaacaatatttgagcttgcaaaattggacttcaacatactacaatgtctc720
caccaggaggagctcaagaaactaagcatgtggtggaagcagttgaatttagacatcatg780
catctaaattttgttcgagatcgagtggtggaatgtttctgttggtcgatggagatacgc840
catgaacccagttgttctcgtgctcgactgatagcgtctaagctacttatgttcattact900
gtcttggatgacttctatgatagctacagcacattagaagagagtcgactacttacagat960
gcaatcgaaaggtggagtcctgatgcagtagatcaactaccagaatacctgagggagttc1020
tttctcaaaatgttgaacatttttcaagaatttgaagatgaacttgcaccggaagagaag1080
tttcgaatattgtacttcaaggaagaatggaaaactcaagctcaaagttacttcaaggaa1140
tgccaatggagggatgacaattatgtgcccaagttagaagagcacatgcgtgtttcaatc1200
ataagtgtgggatttgtcttgttttattgcggatttttgagtggcatggaggagacagtg1260
gccacaaaggatgcatttgaatggttcgcaagcttccccaagatcatagaagcttgtgca1320
acaattcttcgtatcactaatgacataacttcaaaggagcgagaacaaaagagggcacat1380
gttgcctcgacggtagattgctatatgaaggaatatggaacatcaaaagatgttgcatgc1440
gagaagctcctaggctttgttgaagatgcatggaagactatcaacgaggagctccttact1500
gcaactggattgtcgagggaagtaattgaactatcactccactgtgcgcaaactacagaa1560
tttgtatacaaggatgtcgacgcattcacagaacctaatacctcgatgaaggaaagcatc1620
tttttcctacttgttcatcctatccctatttga1653
<210>3
<211>550
<212>prt
<213>姜花(hedychiumcoronariumkoen)
<400>3
metgluleualaglythrproservalgluvalleugluglyvalval
151015
valaspargglnleualaglypheaspprosersertrpglyglutyr
202530
pheilethrasnglnlysserargserglualatrpmetasngluarg
354045
alaglugluleulysasngluvalargsermetpheglnasnvalthr
505560
glyvalleuglnthrmetasnleuileaspthrileglnleuleugly
65707580
leuasptyrhisphemetglugluileaspargalaleuasphisleu
859095
lysaspvalaspmetserlysasnglyleutyrgluvalalaleuhis
100105110
pheargleuleuargglnlysglyvalasnileserseraspvalphe
115120125
lyslystyrmetasplysgluglylyspheileglugluleulysasp
130135140
aspalalysglyleuleuserleutyrasnalaalatyrleuglythr
145150155160
lyslysgluthrileleuaspglualaileserphethrargaspasn
165170175
leuthrserleuleulysaspleuasnprothrphealalysleuval
180185190
serleuthrleulysthrproileproargsermetlysargleuphe
195200205
thrargcystyrileseriletyrglnaspgluprothrargasnglu
210215220
thrilephegluleualalysleuasppheasnileleuglncysleu
225230235240
hisglnglugluleulyslysleusermettrptrplysglnleuasn
245250255
leuaspilemethisleuasnphevalargaspargvalvalglucys
260265270
phecystrpsermetgluilearghisgluprosercysserargala
275280285
argleuilealaserlysleuleumetpheilethrvalleuaspasp
290295300
phetyraspsertyrserthrleuglugluserargleuleuthrasp
305310315320
alailegluargtrpserproaspalavalaspglnleuproglutyr
325330335
leuarggluphepheleulysmetleuasnilepheglnglupheglu
340345350
aspgluleualaprogluglulyspheargileleutyrphelysglu
355360365
glutrplysthrglnalaglnsertyrphelysglucysglntrparg
370375380
aspaspasntyrvalprolysleuglugluhismetargvalserile
385390395400
ileservalglyphevalleuphetyrcysglypheleuserglymet
405410415
glugluthrvalalathrlysaspalapheglutrpphealaserphe
420425430
prolysileileglualacysalathrileleuargilethrasnasp
435440445
ilethrserlysgluarggluglnlysargalahisvalalaserthr
450455460
valaspcystyrmetlysglutyrglythrserlysaspvalalacys
465470475480
glulysleuleuglyphevalgluaspalatrplysthrileasnglu
485490495
gluleuleuthralathrglyleuserarggluvalilegluleuser
500505510
leuhiscysalaglnthrthrgluphevaltyrlysaspvalaspala
515520525
phethrgluproasnthrsermetlysgluserilephepheleuleu
530535540
valhisproileproile
545550
<210>4
<211>21
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>4
gtcatggagcttgctggtact21
<210>5
<211>24
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>5
ggcttcaacaatattaacaagacc24
<210>6
<211>20
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>6
tggaaggcgtggttgttgat20
<210>7
<211>21
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>7
agaccgtgatttctgatttgt21
<210>8
<211>23
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>8
ttagtagcatcggctgcaataag23
<210>9
<211>22
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>9
ctcaaccgtcttcccaaaagag22
<210>10
<211>32
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>10
gatctgggtaccatggagcttgctggtactcc32
<210>11
<211>32
<212>dna
<213>姜花(hedychiumcoronariumkoen)
<400>11
gagctcgaattcaatagggataggatgaacaa32
- 还没有人留言评论。精彩留言会获得点赞!