利用可编程核酸探针的高通量且高度多路复用的成像的制作方法
相关申请
本申请要求2014年3月11日提交的美国临时申请号61/951,461的权益,其全部内容通过引用结合在此。
发明领域
本发明总体上涉及检测和量化分析物(例如,靶标)的领域。
发明背景
荧光显微镜检术是一种用于探索在例如生物系统中的分子的有力工具。然而,可以被区别地且同时地可视化的不同物种的数目(即多路复用能力)受到荧光团之间的光谱重叠的限制。
发明概述
本发明尤其提供了用于检测、成像并且/或者量化感兴趣的靶标(例如,生物分子)的方法和组合物。在此提供的方法中的一些包括(1)使一个有待分析的样品(例如,一个疑似含有一个或多个感兴趣的靶标的样品)与特异性结合这些靶标的部分(每个部分是一个给定靶标的结合配偶体)接触,其中每个部分偶联至一个核酸(在此称为对接链)并且其中具有不同特异性的结合配偶体偶联至不同对接链,(2)任选地去除未结合的结合配偶体,(3)使该样品与经标记的(例如,荧光标记的)核酸接触,这些核酸具有互补于并且因此特异于一个对接链的核苷酸序列(此类标记核酸在此称为经标记的成像链),(4)任选地去除未结合的成像链,(5)将样品整体或部分成像以便检测经结合的成像链的位置和数目,(6)猝灭来自样品的经标记成像链的信号(例如,通过漂白,包括光漂白),并且(7)重复步骤(3)-(6),每次使用一个相对于本方法中所用的全部其他成像链来说具有独特核苷酸序列的成像链。
成像链可以被相同地标记,包括被相同地进行荧光标记。在其他实施例中,具有一个相同序列的成像链可以被相同地标记。第一种方法可能是更方便的,因为它需要单一的激发波长和检测器。
用这样的方式,可以检测、成像并且/或者量化一个样品中的两个或更多个靶标,无论它们在该样品中的位置如何,包括无论它们在样品中的位置是否非常接近,以致于如果同时观察来自这两个或更多个靶标的信号则是不能区别的。因此,两个或更多个靶标之间的距离可小于用于检测靶标的成像系统的分辨距离,并且仍然使用在此提供的方法,可以将两个或更多个靶标彼此区别开,由此促进对此类靶标的更准确且稳健的检测和量化。在一些情况下,该分辨距离可以为约50nm,作为一个实例。
应当理解,在进行该方法之前,一个样品的“靶标内容”可能是已知或怀疑的、或未知和不受怀疑的。接触样品的结合配偶体可结合或不可结合到该样品上,这取决于靶标是否存在(例如,当靶标存在时,该结合配偶体可结合到该样品上)。接触样品的成像链可结合或不可结合到该样品上,这取决于靶标是否存在(例如,当靶标存在时,该成像链可结合一个结合到靶标上的相应的对接链)。“结合到样品上”意指结合配偶体或成像链被结合到其对应的靶标或对接链上。
结合配偶体可以是天然存在的蛋白质,诸如抗体或抗体片段。在结合配偶体是一种抗体或抗体片段的情况下,对接链可以在一个恒定区偶联到其上。结合配偶体可以是一种诸如单克隆抗体的抗体,或者它可以是抗原结合抗体片段,诸如来自单克隆抗体的抗原结合片段。在一些实施例中,结合配偶体是一种受体。
结合配偶体可以通过一个中间接头连接至对接链。在一些实施例中,一个中间接头包含生物素和/或链霉抗生物素蛋白。
可以对成像链进行荧光标记(即,将它们偶联至一个荧光团)。偶联至具有不同核苷酸序列的成像链的荧光团可以是彼此相同的,或者它们可具有与其他荧光团重叠或不重叠的发射分布图。荧光标记的成像链可包括至少一个荧光团。
在一些情况下,诸如成像链的荧光标记的成像核酸可包括1、2、3、或更多个荧光团。
该样品可以是细胞、细胞群、或者来自细胞或细胞群的细胞裂解物。该靶标可以是蛋白质。
因此将了解到,本发明提供一种用于检测分析物的方法,该方法是通过将分析物结合到其对应的结合配偶体上并且顺序地确定此类结合配偶体的存在,通过重复地结合、检测并且猝灭(例如,漂白,诸如光漂白)任选地被相同地标记(例如,相同地荧光标记)的成像链。
因此,本披露提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标特异性结合配偶体接触,其中每个靶标特异性结合配偶体连接至一个对接链,并且其中具有不同特异性的靶标特异性结合配偶体连接至不同对接链,(2)任选地去除未结合的靶标特异性结合配偶体,(3)使该样品与具有互补于一个对接链的核苷酸序列的经标记成像链接触,(4)任选地去除未结合的成像链,(5)将该样品成像以便检测结合的经标记成像链的位置和数目,(6)猝灭来自结合的经标记成像链的信号,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像链来说具有独特核苷酸序列的经标记成像链。
在一些实施例中,该样品在步骤(1)中与多于一个的靶标特异性结合配偶体接触。
在一些实施例中,该靶标特异性结合配偶体是一种抗体或抗体片段。
在一些实施例中,这些经标记成像链被相同地标记。在一些实施例中,这些经标记成像链各自包括一个不同的标记。在一些实施例中,这些经标记成像链是荧光标记的成像链。
在一些实施例中,该一个或多个靶标是蛋白质。在一些实施例中,该样品是细胞、细胞裂解物或组织裂解物。
在一些实施例中,使用共聚焦或落射荧光显微镜检术在步骤(5)中将该样品成像。
在一些实施例中,步骤(6)中的猝灭信号包括光漂白。
本披露进一步提供一种包含结合到多于一个的靶标识别部分(诸如靶标特异性结合配偶体)上的样品的组合物,每个靶标识别部分结合到一个对接核酸(诸如对接链)上,并且至少一个对接核酸稳定地结合到经标记成像核酸(诸如成像链)上。
本披露进一步提供一种组合物,该组合物包含结合到多于一个的靶标特异性结合配偶体上的一个样品,每个结合配偶体结合到一个对接链上;以及至少一个稳定地结合到经标记成像链上的对接链。
本披露进一步提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标识别部分(诸如靶标特异性结合配偶体)接触,其中每个靶标识别部分连接至一个对接核酸(诸如对接链),并且其中具有不同特异性的靶标识别部分连接至不同对接核酸,(2)任选地去除未结合的靶标识别部分,(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸(诸如成像链)接触,(4)任选地去除未结合的经标记成像核酸,(5)将样品成像以便检测结合的经标记成像核酸的位置和数目,(6)通过改变温度和/或缓冲条件将结合的经标记成像核酸从对接核酸去除,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。在此类条件下,该成像核酸自发地从对接核酸解离。
本披露进一步提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标特异性结合配偶体接触,其中每个靶标特异性结合配偶体连接至一个对接核酸,并且其中具有不同特异性的靶标特异性结合配偶体连接至不同对接核酸,(2)任选地去除未结合的靶标特异性结合配偶体,(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸接触,(4)任选地去除未结合的经标记成像核酸,(5)将样品成像以便检测结合的经标记成像核酸的位置和数目,(6)通过改变温度和/或缓冲条件将结合的经标记成像核酸从对接核酸去除,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。在此类条件下,该成像核酸自发地从对接核酸解离。
在一些实施例中,通过减小盐浓度、添加变性剂、或提高温度将经标记成像核酸从对接核酸去除。在一些实施例中,该盐是mg++。在一些实施例中,该变性剂是甲酰胺、尿素或dmso。
本披露进一步提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标识别部分(诸如靶标特异性结合配偶体)接触,其中每个靶标识别部分连接至一个对接核酸(诸如对接链),并且其中具有不同特异性的靶标识别部分连接至不同对接核酸,(2)任选地去除未结合的靶标识别部分,(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸(诸如成像链)接触,(4)任选地去除未结合的经标记成像核酸,(5)将样品成像以便检测结合的经标记成像核酸的位置和数目,(6)将结合的经标记成像核酸从对接核酸去除,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。
本披露进一步提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标特异性结合配偶体接触,其中每个靶标特异性结合配偶体连接至一个对接核酸,并且其中具有不同特异性的靶标特异性结合配偶体连接至不同对接核酸,(2)任选地去除未结合的靶标特异性结合配偶体,(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸接触,(4)任选地去除未结合的经标记成像核酸,(5)将样品成像以便检测结合的经标记成像核酸的位置和数目,(6)将结合的经标记成像核酸从对接核酸去除,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。
在一些实施例中,在步骤(6)中,在一个竞争核酸的存在下,不通过链置换将经标记成像核酸从对接核酸去除。
在一些实施例中,在步骤(6)中,通过化学法、光化学法或酶促法裂解、修饰或降解经标记成像核酸,将经标记成像核酸从对接核酸去除。
在一些实施例中,当经标记成像核酸结合到其对应的对接核酸上时,在成像核酸或对接核酸上不存在单链区。在一些实施例中,该对接核酸不具有立足点序列(toeholdsequence)。在一些实施例中,该成像核酸不具有立足点序列。
在一些实施例中,该经标记成像核酸不是自淬灭的。
本披露进一步提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标识别部分(诸如靶标特异性结合配偶体)接触,其中每个靶标识别部分连接至一个对接核酸(诸如对接链),并且其中具有不同特异性的靶标识别部分连接至不同对接核酸,(2)任选地去除未结合的靶标识别部分,(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸(诸如成像链)接触,(4)任选地去除未结合的经标记成像核酸,(5)将样品成像以便检测结合的经标记成像核酸的位置和数目,(6)通过去除或修饰它们的信号发射部分而不完全去除成像核酸来灭活结合的经标记成像核酸,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。
本披露进一步提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标特异性结合配偶体接触,其中每个靶标特异性结合配偶体连接至一个对接核酸,并且其中具有不同特异性的靶标特异性结合配偶体连接至不同对接核酸,(2)任选地去除未结合的靶标特异性结合配偶体,(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸接触,(4)任选地去除未结合的经标记成像核酸,(5)将样品成像以便检测结合的经标记成像核酸的位置和数目,(6)通过去除或修饰它们的信号发射部分而不完全去除成像核酸来灭活结合的经标记成像核酸,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。
不同实施例同样适用于前述方法。这些实施例如下:
在一些实施例中,该样品在步骤(1)中与多于一个的靶标特异性结合配偶体接触。在一些实施例中,该靶标特异性结合配偶体是一种抗体或抗体片段。在一些实施例中,该靶标特异性结合配偶体是天然或工程化的配体、小分子、适体、肽、或寡核苷酸。
在一些实施例中,这些经标记成像核酸被相同地标记。在一些实施例中,这些经标记成像核酸各自包括一个不同的标记。在一些实施例中,这些经标记成像核酸是荧光标记的成像核酸。
在一些实施例中,该一个或多个靶标是蛋白质。在一些实施例中,该样品是细胞、细胞裂解物或组织裂解物。
在一些实施例中,使用共聚焦或落射荧光显微镜检术在步骤(5)中将该样品成像。
在一些实施例中,该未结合的对接核酸是部分双链的。在一些实施例中,该未结合的成像核酸是部分双链的。
在一些实施例中,该成像核酸是一个分子信标或者包括一个发夹二级结构。在一些实施例中,该成像核酸是一个分子信标或者包括一个自淬灭的发夹二级结构。在一些实施例中,该成像核酸是一个半双链体(hemiduplex)。在一些实施例中,该半双链体是自淬灭的。在一些实施例中,该成像核酸通过一个树枝状结构或一个聚合结构结合到多个信号发射部分上。该成像核酸可以是直链或支链的。
在一些实施例中,该对接核酸包括一个发夹二级结构。
这些和其他实施例将在此更详细地进行说明。
附图简述
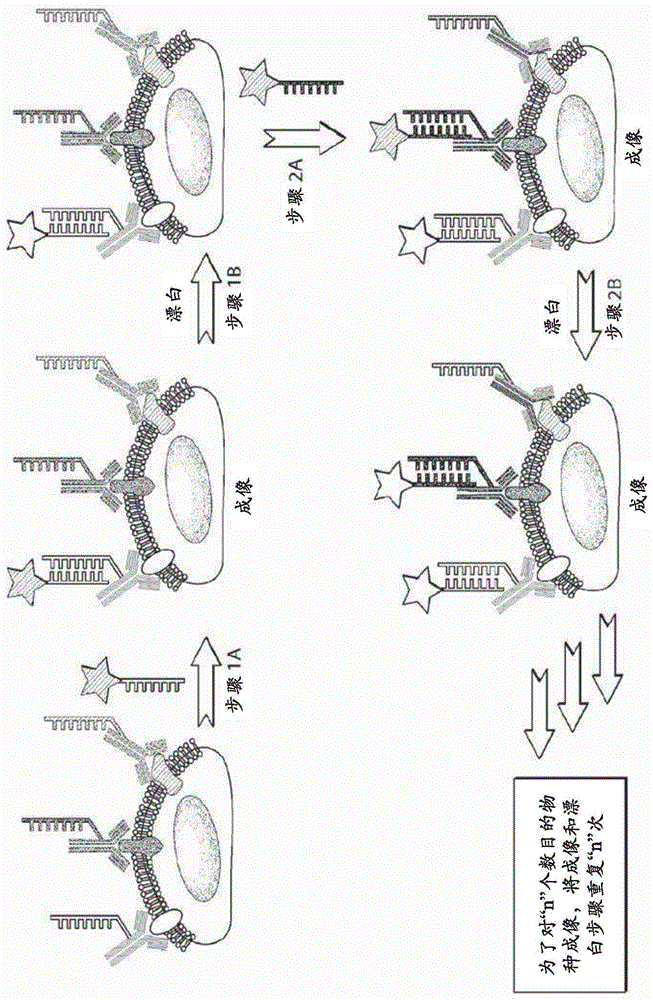
图1是在本披露中提供的一种高通量和本质上可缩放的多路复用成像方法的一个实施例的示意图。在探针杂交后将细胞成像并且然后在随后轮次的成像之前进行光漂白。
图2是一种基于缓冲液更换的高通量和本质上可缩放的多路复用成像方法的一个实施例的示意图,该缓冲液更换使用具有轻微变性特征的溶液,诸如减小的盐浓度、增加的甲酰胺浓度、或更高的温度。
图3是通过使用在本披露中提供的方法去除成像链来灭活该成像链的一个实施例的示意图。
图4是通过灭活荧光团而不去除成像链的核酸部分来灭活该成像链的一个实施例的示意图。
图5是一个分子信标样的自淬灭成像链的一个实施例的示意图。
图6是一个半双链体自淬灭成像链的一个实施例的示意图。
图7是一个非单链对接链的一个实施例的示意图。
图8是一个成像链的一个实施例的示意图,该成像链募集多个信号发射部分拷贝至对接链。
图9是一个非单链成像链的一个实施例的示意图。
图10是示出在3种不同条件下具有对应的反向互补链的10个不同寡核苷酸的预测解离常数的图。序列a1:5’-catctaaagcc-3’(seqidno:1);序列a2:5’-gaatttcctcg-3’(seqidno:2);序列a3:5’-gtttaattgcg-3’(seqidno:3);序列a4:5’-acaattcttcg-3’(seqidno:4);序列a5:5’-tttcttgcttc-3’(seqidno:5);序列a6:5’-gcattgttact-3’(seqidno:6);序列a7:5’-atatacaagcg-3’(seqidno:7);序列a8:5’-gctgtctattg-3’(seqidno:8);序列a9:5’-tctttatgctg-3’(seqidno:9);序列a10:5’-caatctcatcc-3’(seqidno:10)。
发明说明
本发明尤其提供了例如,在使用基于核酸的成像探针(例如,基于dna的成像探针)的细胞环境中用于多路复用荧光成像的组合物和方法。在此提供的方法是部分地基于核酸对接链和成像链的可编程性。也就是说,例如,对接链和成像链可以被设计,从而使得它们在某些条件下彼此结合一定的时间。这种可编程性允许成像链稳定结合到对接链,如在此提供的。总体上,在此提供的方法涉及鉴定一个特定样品(例如,生物样品)中的一个或多个靶标(例如,诸如蛋白质或核酸的一个或多个生物分子)。在一些情况下,一个或多个靶标是否存在于样品中是未知的。因此,本披露的方法可用于确定在一个疑似含有一个或多个靶标的样品中是否存在该一个或多个靶标。在在此提供的方面和实施例的任一个中,一个样品可含有或可疑似含有一个或多个靶标。
因此,本发明提供用于基于可编程核酸(例如,dna)探针进行高通量且高度多路复用的成像以及分析物/靶标检测的方法。这些方法依赖于一种采用正交成像链的顺序成像方法,这些正交成像链可以稳定地附接至一个固定在结合配偶体(诸如抗体)上的互补对接链(图1)。在与一个成像链杂交且成像后,进行一个猝灭步骤(诸如一个光漂白步骤)以便消除和/或减少来自杂交(结合)的成像链的荧光。
在另一个实施例中,这些方法利用对接链与成像链之间的较弱结合以便去除信号。例如,杂交条件可改变,这样使得在对接链或成像链之间形成的双链体的熔点略高于室温(例如,25℃)或成像温度。如上所述地进行标记步骤(即,其中成像链结合到其对应的对接链上的步骤)和成像步骤。作为一个实例,在对第一个靶标进行成像后,使该样品经受一个变性条件。可使用一种具有例如较低盐浓度,存在或增加变性剂(诸如甲酰胺)的浓度,或增加的温度的溶液,在缓冲液更换步骤中提供该变性条件(图2)。该样品可以可替代地或另外地暴露于增加的温度。上述的增加或减小是相对于在标记步骤中存在的条件(即,当成像链结合到对接链上时)。在缓冲液更换的情况下,可洗涤该样品,可重复该缓冲液更换,可再次洗涤该样品,并且然后将下一个成像链添加到该样品。
对于多路复用,在例如用于猝灭信号的光漂白或其他方法或者成像链灭活或去除的每个步骤之后顺序地向相同样品施用正交成像链的不同储库,以便潜在地成像无限数目的靶标。不同于传统的成像方法中多路复用受到颜色通道之间的光谱重叠限制,在此提供的方法仅受到(对接链或可替代地成像链的)可能的正交核苷酸序列数目的限制。由于可以容易地设计较大量的正交核苷酸序列,此方法具有仅通过使用单个荧光团就达到的本质上可缩放的多路复用能力。此方法可以容易地与标准显微镜检术设置(例如,共聚焦或落射荧光显微镜检术)整合,从而允许高通量地分析该样品。
这些方法具有在例如高通量筛选测定(诸如药物筛选测定)中的适用性。此成像方法允许在使用标准共聚焦或落射荧光显微镜检术成像的同时,以一种超多路复用格式分析大的细胞群(~1,000-10,000)或组织样品。以一种高通量的方式从相同样品中筛选大量靶标(诸如蛋白质)将提供关于新药或调节剂的信息,同时提供细胞异质性信息。具有高通量且超多路复用的成像能力的组织样品的大规模筛选将适用于病理学分析,例如,在医院或其他服务提供商设置中。
在此提供的方法还可以用于鉴定一个单一靶标(例如,诸如例如,一种特定的蛋白质)的绝对量,或一个单一靶标相对于一个或多个其他靶标而言的量。
另外,在此提供的方法可用于鉴定一个靶标在一个样品中或相对于样品中的其他靶标的位置。
因此,本披露提供一种方法,包括(1)使一个样品同时与多个序列标记的靶标识别部分接触,(2)引入成像核酸(诸如成像链),这些成像核酸通过序列互补性识别序列标记的靶标识别部分中的对接核酸(诸如对接链)亚组,(3)去除或灭活成像核酸或者猝灭来自成像核酸的信号,并且(4)至少一次重复步骤(2)和任选地步骤(3)以便成像并且检测一个或多个另外的对接核酸。
该方法可任选地包括用对接核酸(诸如对接链)来标记多个靶标识别部分以便形成序列标记的靶标识别部分。
本披露提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标特异性结合配偶体接触,其中每个靶标特异性结合配偶体连接至一个对接链,并且其中具有不同特异性的靶标特异性结合配偶体连接至不同对接链,(2)任选地去除未结合的靶标特异性结合配偶体,(3)使该样品与具有互补于一个对接链的核苷酸序列的经标记成像链接触,(4)任选地去除未结合的成像链,(5)将该样品成像以便检测结合的经标记成像链的位置和数目,(6)猝灭来自结合的经标记成像链的信号,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像链来说具有独特核苷酸序列的经标记成像链。
步骤(3)-(6)可重复一次或多次。例如,步骤(3)-(6)可重复1-10次或更多次。在一些实施例中,步骤(3)-(6)重复1、2、3、4、5、6、7、8、9或10次。
本披露进一步提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标识别部分(诸如靶标特异性结合配偶体)接触,其中每个靶标识别部分连接至一个对接核酸,并且其中具有不同特异性的靶标识别部分连接至不同对接核酸,(2)任选地去除未结合的靶标识别部分,(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸(诸如成像链)接触,(4)任选地去除未结合的经标记成像核酸,(5)将样品成像以便检测结合的经标记成像核酸的位置和数目,(6)将结合的经标记成像核酸从对接核酸去除,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。
步骤(3)-(6)可重复一次或多次。例如,步骤(3)-(6)可重复1-10次或更多次。在一些实施例中,步骤(3)-(6)重复1、2、3、4、5、6、7、8、9或10次。
本披露进一步提供一种方法,包括(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标识别部分(诸如靶标特异性结合配偶体)接触,其中每个靶标识别部分连接至一个对接核酸(诸如对接链),并且其中具有不同特异性的靶标识别部分连接至不同对接核酸,(2)任选地去除未结合的靶标识别部分,(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸(诸如成像链)接触,(4)任选地去除未结合的经标记成像核酸,(5)将样品成像以便检测结合的经标记成像核酸的位置和数目,(6)通过去除或修饰它们的信号发射部分而不完全去除成像核酸来灭活结合的经标记成像核酸,并且(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。
步骤(3)-(6)可重复一次或多次。例如,步骤(3)-(6)可重复1-10次或更多次。在一些实施例中,步骤(3)-(6)重复1、2、3、4、5、6、7、8、9或10次。
在一些实施例中,在此提供的方法包括一个以下步骤:使用一种除了链置换之外的方法来去除结合到对接核酸(诸如对接链)上的成像核酸(诸如成像链)。
在一些实施例中,在此提供的方法包括一个去除结合到对接核酸(诸如对接链)上的成像核酸(诸如成像链)的步骤,其中该成像核酸在结合到对接核酸上之前发射信号(即,这种信号未淬灭)。
在一些实施例中,在此提供的方法包括一个去除结合到对接核酸(诸如对接链)上的成像核酸(诸如成像链)的步骤,其中使用不包含淬灭剂的核酸去除该成像核酸。
在每个前述方法中,对接核酸(包括对接链)可以是单链对接核酸或对接链,或者它可以是双链对接核酸或对接链,或者它可以是部分双链对接核酸或对接链(例如,含有一个单链和一个双链区)。
在一些实施例中,在使用多个靶标识别部分(包括多个结合配偶体)的情况下,该多个可同时与样品接触并且因此与感兴趣的靶标接触。靶标识别部分(诸如结合配偶体)不需要顺序地与样品接触,虽然它们是可以的。
这些不同方法促进用旋转盘共聚焦显微镜进行高通量成像。据估计,一次一种颜色的全细胞3d成像过程将平均需要约30秒。此方法允许用兼容的10x或20x物镜对大面积(例如,高达mm规模)进行成像。可实现约30-50微米的成像深度。在此提供的方法已被用于染色肌动蛋白、ki-67、网格蛋白、细胞角蛋白等等(数据未示出)。
结合配偶体
这些方法采用偶联至核酸(例如,对接核酸(诸如对接链))的结合配偶体。这些可以在此称为结合配偶体-核酸偶联物(“bp-na偶联物”)。它们还可被称为序列标记的靶标识别部分。如在此所使用的,“结合配偶体-核酸偶联物,”或“bp-na偶联物,”是指一种连接(例如,通过一种n-羟基琥珀酰亚胺(nhs)接头)至一个单链核酸(例如,dna)对接链的分子。
偶联物的结合配偶体可以是对于一个感兴趣的靶标(诸如,生物分子(例如,蛋白质或核酸))具有亲和力的任何部分(例如,抗体或适体)。在一些实施例中,结合配偶体是一种蛋白质。包含一种连接至对接链的蛋白质(或肽)的bp-na-偶联物可以在此称为“蛋白质-核酸偶联物”或“蛋白质-na偶联物。”用于本发明偶联物的蛋白质的实例包括但不限于:抗体(例如,单克隆抗体)、抗原结合抗体片段(例如,fab片段)、受体、肽以及肽适体。其他结合配偶体可根据本发明进行使用。例如,在此设想通过静电(例如,静电颗粒)、疏水性或磁性(例如,磁性颗粒)相互作用结合到靶标上的结合配偶体。
如在此所使用的,“抗体”包括全长抗体和它的任何抗原结合片段(例如,“抗原结合部分”)或单链。术语“抗体”包括但不限于一种包含通过二硫键相互连接的至少两个重(h)链和两个轻(l)链的糖蛋白,或其抗原结合部分。抗体可以是多克隆或单克隆的;异种(xenogeneic)、同种异体(allogeneic)、或同基因的(syngeneic);或其修饰形式(例如,人源化的、嵌合的)。
如在此所使用的,一个抗体的“抗原结合部分”是指抗体的保留特异性结合到抗原上的能力的一个或多个片段。抗体的抗原结合功能可以由全长抗体的片段执行。涵盖于术语抗体的“抗原结合部分”中的结合片段的实例包括(i)fab片段,一种由vh、vl、cl以及ch1结构域组成的单价片段;(ii)f(ab')2片段,一种包含通过二硫桥在铰链区处连接的两个fab片段的二价片段;(iii)一种由vh和ch1结构域组成的fd片段;(iv)一种由抗体的单臂的vh和vl结构域组成的fv片段,(v)一种由vh结构域组成的dab片段(沃德(ward)等人,自然(nature)341:544546,1989);以及(vi)一个分离的互补性决定区(cdr),或(vii)可任选地通过合成接头连接的两个或更多个分离的cdr的一个组合。此外,虽然fv片段的两个结构域vh和vl是通过独立的基因编码的,但是这两个结构域可以使用重组方法通过合成接头接合,该合成接头能够使其制成其中vh和vl区配对以形成单价分子的单蛋白质链(称为单链fv(scfv);参见,例如伯德(bird)等人,科学(science)242:423426,1988;和休斯顿(huston)等人,美国国家科学院院刊(proc.natl.acad.sci.usa)85:5879-5883,1988)。这类单链抗体也涵盖于术语抗体的“抗原结合部分”范围内。使用本领域技术人员已知的常规技术,获得这些抗体片段,并且按照与完整抗体相同的方式筛选所述片段的有用性。
如在此所使用的,“受体”是指结合到配体(诸如,例如,肽或小分子(例如,低分子量(<900道尔顿)的有机或无机化合物))上的细胞来源的分子(例如,蛋白质)。
如在此所使用的,“肽适体”是指一种具有插入恒定支架蛋白质的可变肽序列的分子(参见例如,贝恩斯(baines)ic等人,今日药物发现(drugdiscov.today)11:334–341,2006)。
在一些实施例中,bp-na偶联物的分子是一种核酸(诸如,例如,一种核酸适体)。如在此所使用的,“核酸适体”是指一种可以形成能够特异性结合到蛋白质或其他细胞靶标上的二级和三级结构的小rna或dna分子(参见例如,倪(ni)x等人,当今医药化学(currmedchem)18(27):4206–4214,2011)。因此,在一些实施例中,bp-na偶联物可以是一种适体-核酸偶联物。
本发明的一些实施例使用靶标识别部分来鉴定和标记靶标。靶标识别部分是特异性识别样品中感兴趣的靶标的试剂。靶标识别部分的实例包括诸如在此列举的那些的结合配偶体。靶标识别部分包括抗体、抗体片段以及诸如单链抗体、单链fv结构域、fab结构域、纳米抗体等的抗体衍生物、肽、适体、以及寡核苷酸(例如,以便在诸如荧光原位杂交或fish的过程中检测感兴趣的核酸)。
诸如对接链的对接核酸
本发明的某些实施例可涉及对接核酸。对接核酸包括如在此描述的对接链。对接核酸是能够结合到具有互补序列的核酸(诸如,成像核酸)上的线性核酸。对接核酸可包含或可由dna、rna或具有其他磷酸酯-糖主链(例如2’-o-甲基rna、2’-氟(2’-fluoral)rna、lna、xna)或包含非磷酸酯-糖部分的主链(例如,肽核酸和吗啉代)的核酸样结构构成。核碱基可包括天然发生的核碱基,诸如腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶、肌苷以及它们的衍生物,以及非天然发生的核碱基,诸如isoc、isog、dp以及dz。当未结合到它的互补成像核酸上时,对接核酸可以是单链而没有稳定的二级结构。可替代地,对接核酸可包括诸如发夹环的二级结构(图7,顶部)。对接核酸可以是多链复合物的一部分(图7,底部)。
如在此所使用的,“对接链”是指一种能够稳定地结合到它的互补成像链上的单链核酸(例如,dna)。稳定的结合可以是对接链(以及相反的成像链)的长度的结果,或者它可以是在其下发生杂交的具体条件(例如,盐浓度、温度等)的结果。在一些实施例中,对接链的长度为约20至60个,或更多个核苷酸。对接链可以能够结合到(具有相同序列和相同地标记的)一个或多个相同的成像链上。
诸如成像链的成像核酸
本发明的某些实施例可涉及成像核酸。成像核酸包括如在此描述的成像链。成像核酸是可以(1)经由序列特异的互补性与对接核酸相互作用,并且(2)通过共价或非共价相互作用募集一个信号发射部分或多个信号发射部分拷贝的核酸。如在此说明的,成像核酸可以是直链或支链的。一个成像核酸可经由一个聚合结构(图8,顶部)或树枝状结构(图8,底部)募集多个信号发射部分拷贝。例如,可以使用诸如在纳泽米(nazemi)a.等人,生物偶联物的化学:合成、表征与生物医学应用(chemistryofbioconjugates:synthesis,characterization,andbiomedicalapplications),在线发布:2014年2月13日)中讨论的方法以及其中提供的参考来化学合成聚合或树枝状结构。可替代地,可以通过如例如在德克斯(dirks)r.等人,美国国家科学院院刊,2004;1010(43):15275-78;以及在乌姆(um)s.h.等人,自然研究步骤(nat.protocols)2006;1:995-1000(所述参考各自通过引用结合在此)中示出的dna杂交来形成聚合或树枝状结构。
成像核酸可包含或可由dna、rna或具有其他磷酸酯-糖主链(例如2’-o-甲基rna、2’-氟(2’-fluoral)rna、lna、xna)或包含非磷酸酯-糖部分的主链(例如,肽核酸和吗啉代)的核酸样结构构成。核碱基可包括天然发生的核碱基,诸如腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶、肌苷以及它们的衍生物,以及非天然发生的核碱基,诸如isoc、isog、dp以及dz。
在一些实施例中,成像核酸的长度为约30至约60个,或更多个核苷酸,包括30、35、40、45、50、55或60核苷酸的长度。在一些实施例中,成像核酸的长度为30至40、30至50、40至50、40至60、或50至60个核苷酸。
当未结合到它的互补对接核酸上时,成像核酸可以是单链而没有稳定的二级结构。可替代地,成像核酸可包括诸如发夹环的二级结构(图9,顶部)。成像核酸可以是多链复合物的一部分(图9,底部)。
在一些实施例中,成像链可以是自淬灭的,这表明未结合的成像核酸可携带与信号发射部分(诸如,荧光团)极为接近的淬灭剂部分。为了实现这个目的,成像核酸可以被设计为采取一个分子信标样的结构(图5)或一个半双链体的结构(图6)。
这种自淬灭变化可以用于简化背景并且/或者避免洗涤步骤。另外地或可替代地,结合与成像缓冲液可含有常规用于fish、rna印迹法以及dna印迹法中的添加剂(例如,带负电荷的聚合物(诸如葡聚糖硫酸盐和肝素))以便减少非特异性结合。
如在此所使用的“信号发射部分”是一个在某些条件下发射可检测信号(诸如光子、辐射、正电子、电磁波、以及磁核共振)的部分。
如在此所使用的,“成像链”是一种长度为约30至约60个,或更多个核苷酸的单链核酸(例如,dna)。本发明的成像链互补于对接链并且稳定地结合到对接链上。稳定的结合表明,成像链和对接链在测定的时长内、或者至少30分钟、或至少60分钟、或至少2小时、或更久保持彼此结合。这种结合可以是或不是可逆的或不可逆的。
在一些实施例中,如果核酸保持彼此结合(或至少)30、35、40、45、50、55或60分钟(min),则认为对接核酸稳定地结合到成像核酸(诸如成像链)上。在一些实施例中,如果核酸保持彼此结合(或至少)30至60min、30至120min、40至60min、40至120min、或60至120min,则认为对接核酸稳定地结合到成像核酸上。这种结合可以是或不是可逆的,或者可以是或不是不可逆的。
如在此所使用的,“结合”是指至少两个分子之间归因于例如静电、疏水性、离子和/或氢键相互作用,任选地在生理条件下的一种缔合。
如果两个核酸或核酸结构域彼此碱基配对或结合以便经由沃森-克里克(watson-crick)相互作用形成一种双链核酸,则它们是彼此“互补的”。
在一些实施例中,本发明的核酸(诸如对接核酸和成像核酸)以“完美互补”彼此结合,“完美互补”指的是100%互补(例如,5’–attcgc–3’完美互补于5’gcgaat–3’)。
本发明的成像链可用一种可检测的标记(例如,一个荧光标记,并且因此被认为是“荧光标记的”)来进行标记。例如,在一些实施例中,成像链可包含至少一个(即,一个或多个)荧光团。根据本发明使用的荧光团的实例包括但不限于:呫吨衍生物(例如,荧光黄素、罗丹明、俄勒冈绿、伊红以及得克萨斯红)、花青衍生物(例如,花青、吲哚碳菁、氧杂碳菁、硫杂碳菁以及部花青)、萘衍生物(例如,丹磺酰和普罗丹(prodan)衍生物)、香豆素衍生物、噁二唑衍生物(例如,吡啶基噁唑、硝基苯并噁二唑以及苯并噁二唑)、芘衍生物(例如,瀑布蓝)、噁嗪衍生物(例如,尼罗红、尼罗蓝、甲酚紫以及噁嗪170)、吖啶衍生物(例如,原黄素、吖啶橙以及吖啶黄)、芳基次甲基(arylmethine)衍生物(例如,金胺、结晶紫以及孔雀绿)、以及四吡咯衍生物(例如,卟吩、酞菁以及胆红素)。
可用诸如在此列举或本领域已知的那些的一种可检测标记来共价地标记包括成像链的成像核酸。在一些情况下,包括成像链的成像核酸可包括2、3、4、或更多个可检测的标记(诸如荧光团)。
包括成像链的正交成像核酸可包含一个不同的标记(例如,红色荧光团、蓝色荧光团、或绿色荧光团),或者它们可以全部包含相同的标记(例如,红色荧光团),即使它们的核苷酸序列不同。
诸如结合配偶体和对接链偶联物的序列标记的靶标识别部分
在一些实施例中,本发明的bp-na偶联物(例如,蛋白质-核酸偶联物)可包含一个(例如,共价或非共价)将结合配偶体连接至对接链的中间接头。该中间接头可包含生物素和/或链霉抗生物素蛋白。例如,在一些实施例中,一个抗体和一个对接链可各自被生物素化(即,连接至少一个生物素分子)并且通过生物素结合至一个中间链霉抗生物素蛋白分子来彼此连接。其他中间接头可根据本发明进行使用。在一些实施例中,诸如其中分子是核酸的那些实施例中,可能不需要中间接头。例如,bp-na偶联物的对接链可以是一个核酸分子(诸如,例如,一个核酸适体)的延伸(例如,5′或3′延伸)。类似的方法可用于产生如在此提供的序列标记的靶标识别部分。
在此提供多个bp-na偶联物(例如,蛋白质-核酸偶联物)和成像链。多个可以是相同物种或不同物种的一个群体。相同物种的多个bp-na偶联物可包括全部结合到相同靶标(例如,生物分子)(例如,相同表位或区域/结构域)上的偶联物。相反地,不同物种的多个bp-na偶联物可包括偶联物、或偶联物的亚组,每个偶联物或偶联物的亚组结合到相同靶标上的不同表位上或结合到不同靶标上。相同物种的多个成像链可包括具有相同核苷酸序列和相同荧光标记(例如,cy2、cy3或cy4)的成像链。相反地,不同物种的多个成像链可包括具有不同核苷酸序列(例如,dna序列)和不同荧光标记(例如,cy2、cy3或cy4),或者具有不同核苷酸序列和相同荧光标记(例如,都是cy2)的成像链。在一个给定的多个bp-na偶联物中的不同物种的数目受到结合配偶体(例如,抗体)的数目和具有不同核苷酸序列的对接链(并且因此互补成像链)的数目的限制。在一些实施例中,多个bp-na偶联物(例如,蛋白质-核酸偶联物)包含至少10、50、100、500、1000、2000、3000、4000、5000、104、50000、105、105、106、107、108、109、1010、1011个bp-na偶联物。类似地,在一些实施例中,多个荧光标记的成像链包含至少10、50、100、500、1000、2000、3000、4000、5000、104、50000、105、105、106、107、108、109、1010、1011个荧光标记的成像链。在一些实施例中,多个可含有1至约200个或更多个不同物种的bp-na偶联物和/或成像链。例如,多个可以含有至少1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200或更多个不同的物种。在一些实施例中,多个可含有少于约5至约200个不同物种的bp-na偶联物和/或成像链。例如,多个可以含有小于5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175或200个不同的物种。这些实施例适用于如在此提供的序列标记的靶标识别部分。
信号或成像核酸灭活
为了在在此提供的方法的一些中实现成像核酸灭活,可通过诸如但不限于升高温度;减小反离子(例如,游离mg++)的浓度;引入或增大变性剂(例如甲酰胺、尿素、dmso等)的浓度;以及化学地、光化学地或酶促地裂解、修饰或降解成像链,或它们的任意组合的手段,来将成像核酸(包括成像链)从靶标识别部分(包括结合配偶体)中去除(图3)。
为了在在此提供的方法的一些中实现成像核酸灭活,可通过去除并且/或者修饰该信号发射部分而不将成像核酸的全部核酸部分从对接链去除来灭活这些成像核酸(包括成像链)。(图4.)
作为一个实例,可通过将成像链裂解成多个部分来促进成像核酸的去除。在一些实施例中,成像核酸包含一个化学可裂解部分,该化学可裂解部分可以通过引入作用于这种可裂解部分上的化合物而裂解。此类化学可裂解部分的实例包括但不限于可以由某些基于pd的试剂裂解的烯丙基基团(周(ju)j.等人,美国科学院院报,2006年12月26日;103(52):19635-40,该参考通过引用结合在此);可以由某些基于磷的试剂(诸如tcep)裂解的叠氮基基团,(郭(guo)j等人,美国科学院院报,2008年7月8日;105(27):9145-50,该参考通过引用结合在此);可以由基于银的试剂裂解的桥接硫代磷酸酯(玛格(mag)m.等人,核酸研究(nucleicacidsres),1991年4月11日;19(7):1437-41,该参考通过引用结合在此);可由诸如dtt和tcep的还原剂裂解的二硫键;以及可由诸如氢氧化物和咪唑的各种亲核试剂裂解的核糖。
在一些实施例中,该成像核酸包含一种可以光化学地(例如,通过uv暴露)裂解的可光裂解接头。在一些实施例中,该成像核酸含有一个可以由一种酶裂解的部分。此类酶促可裂解部分的实例包括但不限于可以由各种核糖核酸酶裂解的核糖核苷酸;可以由诸如user(新英格兰生物实验室(newenglandbiolabs))的酶组合裂解的脱氧尿苷;以及可以由序列特异性切口酶或限制性内切酶裂解的限制性酶切位点。在一些实施例中,该限制性内切酶可裂解成像核酸和对接核酸两者。在仍然其他实施例中,可通过将成像核酸修饰成一种使对接核酸结合以便形成一个具有降低的稳定性(或降低的溶解温度)的双链体的形式来促进成像核酸的去除。
作为一个实例,该成像核酸包含可以光异构化的偶氮苯,其中不同异构体不同地影响成像核酸对于对接核酸的结合强度(浅沼(asanuma)h.等人,应用化学英语国际版(angewchemintedengl),2001年7月16日;40(14):2671-2673,该参考通过引用结合在此)。在一些实施例中,该成像核酸包含一种脱氧尿苷,其中尿嘧啶基团可由尿嘧啶-dna糖基化酶裂解。在去除尿嘧啶后,成像链的结合强度减弱。
可替代地,可以通过将成像核酸与信号发射部分之间的接头(如果存在这样的接头)裂解来实现信号发射部分的去除。在此描述的化学物质也可以用于此目的。
可以通过化学地或光化学地修饰信号发射部分来实现该信号发射部分的灭活。例如,当该信号发射部分是一个荧光团时,可以通过化学试剂(诸如例如过氧化氢,格迪斯(gerdes)m.等人,美国科学院院报2013年7月16日;110(29):11982-87,该参考通过引用结合在此)来将其漂白或对其进行光漂白(例如,使用如在舒伯特(schubert)w.等人,自然生物技术(nat.biotech.)2006;24:1270-78中描述的软多波长激发,该参考通过引用结合在此)。
如在本领域中将理解的,“光漂白”是指一个染料或荧光团分子的光化学改变,从而使得它不能发出荧光。这是由荧光团与周围分子之间的共价键裂解或非特异性反应而导致的。在一些实施例中,可以通过降低曝光的强度或时间间隔,通过增大荧光团的浓度,通过降低输入光的频率并因此降低其光子能量,或者通过采用不太容易漂白的更加牢固的荧光团(例如alexafluors或dylightfluors),来控制由光漂白导致的活性损失。参见,例如,ghauharalir.等人,显微镜学杂志(journalofmicroscopy)2001;198:88-100;和格林(eggeling)c.等人,分析化学(analyticalchemistry)1998;70:2651-59。
因此,光漂白可用于去除、修饰或在一些情况下消灭来自信号发射部分的信号。可通过将荧光团暴露于具有适合波长、能量和持续时间的光的波长来进行光漂白,以便永久且不可逆地消灭荧光团进一步发射信号的能力。光漂白技术是本领域中已知的。
还发现,与通常能够在低于生理温度的宽范围温度(即,0℃至37℃)下结合到它们的靶标上并且可以忍受盐浓度的轻微变化(即,从10mm至1m的单价阳离子浓度;从0至10mm的二价阳离子浓度)的抗体不同,短核酸杂交的亲和力取决于温度和盐浓度。例如,在23℃下,在具有500mm[na+]和10mm[mg++]浓度下,ssdna5’-catctaaagcc-3’与它的反向互补链5’-ggctttagatg-3’之间的预测解离常数(使用参考pmid15139820概述的参数集)是~90pm。换句话说,在此条件下,该结合是非常强的。在37℃下,在具有150mm[na+]和0mm[mg++]下,此ssdna对的预测解离常数高达~500nm。换句话说,在此条件下,该结合是相当弱的。这两种条件的解离常数改变近4个数量级,尽管预期大多数抗体在两种条件下都强力地结合到它们的靶标上。针对其他dna序列观察到类似的趋势(图10)。作为一个另外的实例,成像条件可以是23℃、具有500mm[na+]和10mm[mg++],并且染料灭活条件可以是37℃、具有150mm[na+]和0mm[mg++]。
在一些实施例中,被分析的样品是培养的细胞、组织切片、或来自活生物体的其他样品。
在一些实施例中,该样品是固定(包括单独固定)在一个固体表面(例如,玻璃载片或盖玻片)上的解离细胞。例如,样品可以是血液中的细胞。例如,样品可含有在血液中循环的癌细胞(也称为循环肿瘤细胞,或ctc)。样品可以是在悬浮液中生长的细胞。样品可以是从一个固体组织散播的细胞。
样品
“样品”可包括细胞(或一个细胞)、组织、或诸如血液(血清和/或血浆)、尿液、精液、淋巴液、脑脊髓液或羊水的体液。样品可得自(或来源于)任何来源,包括但不限于人类、动物、细菌、病毒、微生物以及植物。在一些实施例中,样品是细胞裂解物或组织裂解物。样品还可含有来自一个来源或不同来源的材料的混合物。样品可以是一个空间区域或体积(例如,一个阵列上的网格、或一个板或盘中的孔)。在一些实施例中,样品包括一个或多个靶标、一个或多个bp-na偶联物、以及一个或多个成像链。这些细胞可以是散播的(或解离的)细胞。
靶标
“靶标”是希望观察或量化并且存在其结合配偶体的任何部分。在一些实施例中,靶标可以是非天然存在的。在一些实施例中,靶标可以是一种生物分子。如在此所使用的,“生物分子”是可由一个活生物体产生的任何分子,包括大的大分子,诸如蛋白质、多糖、脂质以及核酸(例如,dna和rna(诸如mrna)),以及小分子,诸如初级代谢产物、次级代谢产物、以及天然产物。生物分子的实例包括但不限于:dna、rna、cdna、或经受逆转录的rna的dna产物、a23187(卡西霉素、钙离子载体)、阿维菌素、松香酸、醋酸、乙酰胆碱、肌动蛋白、放线菌素d、腺苷、腺苷二磷酸(adp)、腺苷一磷酸(amp)、腺苷三磷酸(atp)、腺苷酸环化酶、侧金盏花醇、肾上腺素(adrenaline)、肾上腺素(epinephrine)、促肾上腺皮质激素(acth)、水母发光蛋白(aequorin)、黄曲霉毒素、琼脂、丙甲菌素、丙氨酸、白蛋白、醛固酮、糊粉(aleurone)、α-毒蕈环肽、尿囊素、丙烯菊酯、α-鹅膏蕈碱(α-amanatin)、氨基酸、淀粉酶、促蛋白合成类固醇(anabolicsteroid)、茴香脑、血管紧张素原、茴香霉素、抗利尿素(adh)、阿拉伯糖、精氨酸、子囊霉素、抗坏血酸(维生素c)、天冬酰胺、天冬氨酸、不对称二甲基精氨酸、心房钠尿肽(anp)、生长素、抗生物素蛋白、印楝素a–c35h44o16、细菌素、白僵菌素、荷苞牡丹碱、胆红素、生物聚合物、生物素(维生素h)、布雷菲德菌素a、布拉西诺内酯、马钱子碱、尸胺、咖啡因、钙化醇(维生素d)、降钙素、钙调蛋白、钙调蛋白、钙网蛋白、樟脑-(c10h16o)、大麻酚、辣椒素、糖酶、碳水化合物、肉毒碱、角叉菜胶、酪蛋白、半胱天冬酶、纤维素酶、纤维素-(c6h10o5)、浅蓝菌素、西曲溴铵(cetrimide)-c19h42brn、白屈菜赤碱、色霉素a3、伴侣蛋白、甲壳质、α-氯醛糖、叶绿素、缩胆囊素(cck)、胆固醇、胆碱、硫酸软骨素、肉桂醛、柠檬醛、柠檬酸、橘霉素、香茅醛、香茅醇、瓜氨酸、钴胺素(维生素b12)、辅酶、辅酶q、秋水仙碱、胶原质、毒芹碱、皮质类固醇、皮质酮、促肾上腺皮质素释放激素(crh)、皮质醇、肌酸、肌酸激酶、晶状体蛋白、α-环糊精、环糊精糖基转移酶、环巴胺、环匹阿尼酸、半胱氨酸、胱氨酸、胞啶、细胞松弛素、细胞松弛素e、细胞色素、细胞色素c、细胞色素c氧化酶、细胞色素c过氧化物酶、细胞因子、胞嘧啶–c4h5n3o、脱氧胆酸、don(脱氧雪腐镰刀菌烯醇)、脱氧呋喃核糖、脱氧核糖、脱氧核糖核酸(dna)、右旋糖酐、糊精、dna、多巴胺、酶、麻黄素、肾上腺素–c9h13no3、芥酸–ch3(ch2)7ch=ch(ch2)11cooh、赤藓糖醇、促红细胞生成素(epo)、雌二醇、丁子香酚、脂肪酸、纤维蛋白、纤连蛋白、叶酸(维生素m)、促卵泡激素(fsh)、甲醛、甲酸、formnoci、果糖、伏马菌素b1、丙种球蛋白、半乳糖、丙种球蛋白、γ-氨基丁酸、γ-丁内酯、γ-羟基丁酸酯(ghb)、胃泌素、明胶、香叶醇、球蛋白、胰高血糖素、葡萄糖胺、葡萄糖–c6h12o6、葡糖氧化酶、谷蛋白、谷氨酸、谷氨酰胺、谷胱甘肽、谷蛋白、甘油(丙三醇)、甘氨酸、糖原、乙醇酸、糖蛋白、促性腺激素释放激素(gnrh)、粒酶、绿色荧光蛋白质、生长激素、生长激素释放激素(ghrh)、gtp酶、鸟嘌呤、鸟苷、鸟苷三磷酸(+gtp)、触珠蛋白、苏木精、血红素、蚯蚓血红蛋白、血蓝蛋白、血红蛋白、血红素蛋白、硫酸乙酰肝素、高密度脂蛋白、hdl、组胺、组氨酸、组蛋白、组蛋白甲基转移酶、hla抗原、高半胱氨酸、激素、绒毛膜促性腺激素(hcg)、人类生长激素、透明质酸盐、透明质酸酶、过氧化氢、5-羟甲基胞嘧啶、羟基脯氨酸、5-羟色胺、靛蓝染料、吲哚、肌苷、肌醇、胰岛素、胰岛素样生长因子、膜内在蛋白、整合酶、整合蛋白、内含肽、干扰素、菊粉、离子霉素、紫罗酮、异亮氨酸、铁硫簇、k252a、k252b、kt5720、kt5823、角蛋白、激酶、乳糖酶、乳酸、乳糖、羊毛脂、月桂酸、瘦素、来普霉素b、亮氨酸、木质素、柠檬烯、芳樟醇、亚油酸、亚麻酸、脂肪酶、脂质、脂质锚定蛋白、硫辛酰胺、脂蛋白、低密度脂蛋白ldl、促黄体生成素(lh)、番茄红素、赖氨酸、溶菌酶、苹果酸、麦芽糖、褪黑激素、膜蛋白、金属蛋白、金属硫蛋白、蛋氨酸、含羞草氨酸、光神霉素a、丝裂霉素c、单体、霉酚酸、肌红蛋白、肌球蛋白、天然酚类、核酸、赭曲霉毒素a、雌激素、寡肽、寡霉素、地衣酚、阿立新素、鸟氨酸、草酸、氧化酶、催产素、p53、paba、紫杉醇、棕榈酸、泛酸(维生素b5)、甲状旁腺激素(pth)、副蛋白、摩西鱼毒肽、小白菊内酯、展青霉素、蕈青霉素、青霉酸、盘尼西林、青霉震颤素a、肽酶、胃蛋白酶、肽、表霉素、外周膜蛋白、perosamine、苯乙胺、苯丙氨酸、磷酸肌酸、磷酸酶、磷脂、苯丙氨酸、植酸、植物激素、多肽、多酚、多糖、卟啉、朊病毒、黄体酮、促乳素(prl)、脯氨酸、丙酸、鱼精蛋白、蛋白酶、蛋白质、类蛋白、腐胺、除虫菊酯、吡哆醇或吡哆胺(维生素b6)、吡咯赖氨酸、丙酮酸、醌、根赤壳菌素、棉子糖、肾素、视黄醛、视黄醇(维生素a)、视紫红(视紫红质)、核黄素(维生素b2)、呋喃核糖、核糖、核酶、蓖麻毒蛋白、rna-核糖核酸、rubisco、黄樟素、水杨醛、水杨酸、丹酚-a(salvinorin-a)–c23h28o8、皂苷、分泌素、硒代半胱氨酸、硒代蛋氨酸、含硒蛋白质、丝氨酸、丝氨酸激酶、血清素、粪臭素、信号识别颗粒、生长抑素、山梨酸、角鲨烯、星形孢菌素、硬脂酸、杂色曲霉素、甾醇、番木鳖碱(strychnine)、蔗糖(糖)、糖类(一般来说)、超氧化物、t2毒素、鞣酸、丹宁酸、酒石酸、牛磺酸、河豚毒素、奇甜蛋白、拓扑异构酶、酪氨酸激酶、牛磺酸、睾酮、四氢大麻酚(thc)、河豚毒素、毒胡萝卜素、奇甜蛋白、硫胺素(维生素b1)–c12h17cln4os·hcl、苏氨酸、促血小板生成素、胸苷、胸腺嘧啶、三氮菌素c、促甲状腺激素(tsh)、促甲状腺素释放激素(trh)、甲状腺素(t4)、生育酚(维生素e)、拓扑异构酶、三碘甲腺原氨酸(t3)、跨膜受体、曲古抑菌素a、促激素、胰蛋白酶、色氨酸、微管蛋白、衣霉素、酪氨酸、泛激素、尿嘧啶、尿素、脲酶、尿酸–c5h4n4o3、尿苷、缬氨酸、缬氨霉素、钒绑定蛋白(vanabins)、加压素、震颤真菌毒素(verruculogen)、维生素(一般来说)、维生素a(视黄醇)、维生素b、维生素b1(硫胺素)、维生素b2(核黄素)、维生素b3(烟酸或尼克酸)、维生素b4(腺嘌呤)、维生素b5(泛酸)、维生素b6(吡哆醇或吡哆胺)、维生素b12(钴胺素)、维生素c(抗坏血酸)、维生素d(钙化醇)、维生素e(生育酚)、维生素f、维生素h(生物素)、维生素k(萘醌)、维生素m(叶酸)、渥曼青霉素以及木糖。
在一些实施例中,一个靶标可以是一个蛋白质靶标,诸如例如,一种细胞环境的蛋白质(例如,细胞内的或膜蛋白)。蛋白质的实例包括但不限于:纤维状蛋白质,诸如细胞支架蛋白质(例如,肌动蛋白、arp2/3、冠蛋白、肌养蛋白、ftsz、角蛋白、肌球蛋白、伴肌动蛋白、血影蛋白、tau蛋白、肌联蛋白、原肌球蛋白、微管蛋白以及胶原质),以及细胞外基质蛋白(例如,胶原质、弹性蛋白、底板反应蛋白(f-spondin)、皮卡丘素(pikachurin)、以及纤连蛋白);球状蛋白质,诸如血浆蛋白质(例如,血清淀粉样蛋白p成分和血清白蛋白)、凝血因子(例如,补体蛋白质、c1-抑制剂以及c3-转化酶、因子viii、因子xiii、纤维蛋白、蛋白质c、蛋白质s、蛋白质z、蛋白质z相关蛋白酶抑制剂、凝血酶、血管假性血友病因子),以及急性期蛋白质,诸如c反应蛋白质;血红素蛋白;细胞粘附蛋白(例如,钙粘蛋白、室管膜蛋白(ependymin)、整合蛋白、ncam以及选择蛋白);跨膜运输蛋白质(例如,cftr、血型糖蛋白d和混杂酶(scramblase)),诸如离子通道(例如,配体门控离子通道,诸如烟碱型乙酰胆碱受体和gabaa受体,以及电压门控离子通道,诸如钾、钙和钠通道),同向运输/反向运输蛋白质(例如,葡萄糖转运蛋白);激素和生长因子(例如,表皮生长因子(egf)、成纤维细胞生长因子(fgf)、血管内皮生长因子(vegf)、肽类激素(诸如胰岛素、胰岛素样生长因子以及催产素)以及类固醇激素(诸如雄激素、雌激素和黄体酮);受体,诸如跨膜受体(例如,g蛋白偶联受体、视紫红)和细胞内受体(例如,雌激素受体);dna结合蛋白质(例如,组蛋白、鱼精蛋白、ci蛋白);转录调节物(例如,c-myc、foxp2、foxp3、myod以及p53);免疫系统蛋白质(例如,免疫球蛋白、主要组织相容性抗原以及t细胞受体);营养物储存/转运蛋白质(例如,铁蛋白);伴侣蛋白;以及酶。
在一些实施例中,靶标可以是一种核酸靶标,诸如,例如,细胞环境的核酸。如关于靶标、对接链、以及成像链在此使用的,“核酸”是指具有任何长度的核苷酸的聚合物形式,诸如脱氧核糖核苷酸或核糖核苷酸,或它们的类似物。例如,核酸可以是dna、rna、或经受逆转录的rna的dna产物。核酸的非限制性实例包括:基因或基因片段的编码或非编码区、由连锁分析限定的基因座、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、核酶、cdna、重组核酸、支化核酸、质粒、载体、具有任何序列的分离dna、具有任何序列的分离rna、核酸探针、以及引物。核酸的其他实例包括但不限于:cdna、适体、肽核酸(“pna”)、2'-5'dna(一种具有缩短主链的合成材料,该主链具有匹配dna的a构象的碱基间隔;2'-5'dna通常将不会与为b形式的dna杂交,但它将容易地与rna杂交)、锁核酸(“lna”)、以及具有修饰主链的核酸(例如,天然存在的核酸的碱基修饰或糖修饰形式)。核酸可包含修饰的核苷酸,诸如甲基化的核苷酸和核苷酸类似物(嘌呤和嘧啶的“类似”形式在本领域中是熟知的)。如果存在对核苷酸结构的修饰,那么在组装聚合物之前或之后进行。核酸可以是一种单链、双链、部分单链、或部分双链的dna或rna。
在一些实施例中,核酸(例如,核酸靶标)是天然存在的。如在此所使用的,“天然存在”是指一种在没有人为干预的情况下,存在于在自然界中存在的生物体或病毒中的核酸。在一些实施例中,核酸天然存在于一种生物体或病毒中。在一些实施例中,核酸是基因组dna、信使rna、核糖体rna、微小rna、前微小rna(pre-micro-rna)、原微小rna(pro-micro-rna)、病毒dna、病毒rna或piwi-rna。在一些实施例中,核酸靶标不是一种合成dna纳米结构(例如,包含通过沃森-克里克相互作用彼此杂交以形成2-d或3-d纳米结构的两个或更多个核酸的二维(2-d)或三维(3-d)dna纳米结构)。
在此描述的核酸对接链和成像链可以是以上描述的核酸(例如,dna、rna、修饰核酸、核酸类似物、天然存在的核酸、合成核酸)中的任意一种。
组合物
在此提供的组合物包含至少一个或至少两个(例如,多个)本发明的bp-na偶联物(例如,蛋白质-核酸偶联物)。bp-na偶联物可结合到一个感兴趣的靶标(例如,生物分子)上并且/或者稳定结合到一个互补的荧光标记的成像链上。组合物可包含多个相同物种或不同物种的bp-na偶联物。在一些实施例中,一种组合物可包含至少10、50、100、500、1000、2000、3000、4000、5000、104、50000、105、105、106、107、108、109、1010、1011个bp-na偶联物。在一些实施例中,一种组合物可包含至少10、50、100、500、1000、2000、3000、4000、5000、104、50000、105、105、106、107、108、109、1010、1011个互补的荧光标记的成像链。在一些实施例中,一种组合物可含有1至约200个或更多个不同物种的bp-na偶联物和/或成像链。例如,一种组合物可以含有至少1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200或更多个不同的物种。在一些实施例中,一种组合物可含有少于约5至约200个不同物种的bp-na偶联物和/或成像链。例如,一种组合物可以含有小于5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175或200个不同的物种。
应当理解,组合物中的互补的荧光标记的成像链的数目可小于、等于或大于组合物中bp-na偶联物的数目。
试剂盒
本发明进一步提供包括一种或多种本发明组分的试剂盒。试剂盒可包括,例如,bp-na偶联物和/或荧光标记的成像链。试剂盒还可包括用于产生bp-na偶联物或用于标记成像链的组分。例如,试剂盒可包括结合配偶体(例如,抗体)、对接链和中间接头(诸如,例如,生物素和链霉抗生物素蛋白分子)、和/或成像链。试剂盒可以用于本领域技术人员明显知晓的目的,包括以上描述的那些。
试剂盒可包括其他试剂,以及例如,用于进行杂交反应的缓冲液。试剂盒还可包括用于使用试剂盒组分、和/或用于制作和/或使用bp-na偶联物和/或经标记成像链的说明书。
应用
本发明的bp-na偶联物(例如,蛋白质-核酸偶联物或抗体-核酸偶联物)可以尤其在其中使用现有的靶标检测技术的任何测定中使用。
典型地,测定包括以下检测测定:包括诊断测定、预后测定、患者监测测定、筛选测定、生物战测定、法医分析测定、产前基因诊断测定等。该测定可以是一种体外测定或一种体内测定。本发明提供以下优势:可以使用本发明的方法从一个单一样品同时分析许多不同的靶标,即使是当其中此类靶标使用现有技术成像方法在空间上不可分辨(并且因此空间上难辨认的)时。这允许例如在一个样品上进行几个诊断试验。
bp-na偶联物还可以用于简单地观察一个区域或区。
可将本发明的方法应用于分析得自或来源于患者的样品,以便确定一个病变的细胞类型是否存在于该样品中并且/或者对该疾病进行分期。例如,可以根据在此描述的任何方法来测定一个血液样品,以便确定样品中一个癌变细胞类型的标记物的存在和/或量,由此对该癌症进行诊断或分期。
可替代地,在此描述的这些方法可以用于通过分别确定样品中细菌或病毒的标记物的存在和/或量来诊断病原体感染,例如,由细胞内细菌和病毒引起的感染。因此,使用本发明的组合物和方法检测的靶标可以是患者标记物(诸如一种癌症标记物)或被一种外部试剂感染的标记物,诸如细菌或病毒标记物。
本发明的定量成像方法可用于例如,量化其丰度指示生理状态或疾病病状的靶标(例如,靶标生物分子)(例如,被上调或下调作为一种疾病状态的结果的血液标记物)。
另外,本发明的组合物和方法可用于提供有助于确定患者疗程的预后信息。例如,可以从来自患者的甚至一个小的样品来准确地量化用于肿瘤的一个具体标记物的量。对于某些疾病(像乳腺癌),某些蛋白质(诸如her2-neu)的过量表达表明将需要一种更加积极的疗程。
本发明的方法还可以用于确定扰动(包括化合物、突变、温度改变、生长激素、生长因子、疾病、或培养条件的改变)对于不同靶标的影响,由此鉴定其存在、缺乏或水平指示具体生物学状态的靶标。在一些实施例中,本发明用于阐明和发现疾病状态的组分和通路。例如,存在于一个疾病组织与“正常”组织中的靶标的量的比较允许说明涉及疾病的重要靶标,由此鉴定用于发现/筛选可以用于治疗疾病的新型药物候选物的靶标。
所分析的样品可以是一个生物样品,诸如血液、唾液、淋巴、粘液、粪便、尿液等。该样品可以是一种环境样品,诸如水样品、空气样品、食物样品等。可以使用结合反应的被固定的一种或多种组分进行该测定。因此,靶标或bp-na偶联物可以是固定的。可以使用结合反应的非固定的一种或多种组分进行该测定。鉴于由本发明的bp-na偶联物和荧光标记的成像链所提供的多路复用潜力,这些测定可涉及基本上同时检测一个样品中的多个靶标。作为一个实例,一种测定可用于检测一种具体细胞类型(例如,基于一种特定的细胞表面受体)和在该具体细胞类型中的一种具体基因突变。以此方式,作为一个实例,最终用户可以能够确定一种具体类型的多少细胞携带感兴趣的突变。
不同实施例
本披露提供包括但不限于以下编号实施例的多个实施例:
1.一种方法,包括
(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标特异性结合配偶体接触,其中每个靶标特异性结合配偶体连接至一个对接链,并且其中具有不同特异性的靶标特异性结合配偶体连接至不同对接核链,
(2)任选地去除未结合的靶标特异性结合配偶体,
(3)使该样品与具有互补于一个对接链的核苷酸序列的经标记成像链接触,
(4)任选地去除未结合的经标记成像链,
(5)将该样品成像以便检测结合的经标记成像链的位置和数目,
(6)猝灭来自结合的经标记成像链的信号,以及
(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像链来说具有独特核苷酸序列的经标记成像链。
2.如实施例1所述的方法,其中该样品在步骤(1)中与多于一个的靶标特异性结合配偶体接触。
3.如实施例1或2所述的方法,其中该靶标特异性结合配偶体是一种抗体或抗体片段。
4.如实施例1-3中任一项所述的方法,其中这些经标记成像链是被相同地标记的。
5.如实施例1-3中任一项所述的方法,其中这些经标记成像链各自包含一个不同的标记。
6.如实施例1-5中任一项所述的方法,其中这些经标记成像链是荧光标记的成像链。
7.如实施例1-6中任一项所述的方法,其中该一个或多个靶标是蛋白质。
8.如实施例1-7中任一项所述的方法,其中该样品是细胞、细胞裂解物或组织裂解物。
9.如实施例1-8中任一项所述的方法,其中使用共聚焦或落射荧光显微镜检术在步骤(5)中将该样品成像。
10.如实施例1-9中任一项所述的方法,其中步骤(6)中的猝灭信号包括光漂白。
11.一种组合物,包含:
结合到多于一个的靶标特异性结合配偶体上的一个样品,每个结合配偶体结合到一个对接链上,以及
至少一个稳定地结合到一个经标记成像链上的对接链。
12.一种方法,包括
(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标特异性结合配偶体接触,其中每个靶标特异性结合配偶体连接至一个对接核酸,并且其中具有不同特异性的靶标特异性结合配偶体连接至不同对接核酸,
(2)任选地去除未结合的靶标特异性结合配偶体,
(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸接触,
(4)任选地去除未结合的经标记成像核酸,
(5)将该样品成像以便检测结合的经标记成像核酸的位置和数目,
(6)将结合的经标记成像核酸从对接核酸去除,并且
(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。
13.如实施例12所述的方法,其中该样品在步骤(1)中与多于一个的靶标特异性结合配偶体接触。
14.如实施例12或13所述的方法,其中该靶标特异性结合配偶体是一种抗体或抗体片段。
15.如实施例12或13所述的方法,其中该靶标特异性结合配偶体是天然或工程化的配体、小分子、适体、肽或寡核苷酸。
16.如实施例12-15中任一项所述的方法,其中这些经标记成像核酸是被相同地标记的。
17.如实施例12-15中任一项所述的方法,其中这些经标记成像核酸各自包含一个不同的标记。
18.如实施例12-17中任一项所述的方法,其中这些经标记成像核酸是荧光标记的成像核酸。
19.如实施例12-18中任一项所述的方法,其中该一个或多个靶标是蛋白质。
20.如实施例12-19中任一项所述的方法,其中该样品是细胞、细胞裂解物或组织裂解物。
21.如实施例12-20中任一项所述的方法,其中使用共聚焦或落射荧光显微镜检术在步骤(5)中将该样品成像。
22.如实施例12-21中任一项所述的方法,其中这些经标记成像核酸是通过减小盐浓度、添加变性剂、或提高温度从对接核酸去除的。
23.如实施例22所述的方法,其中该盐是mg++。
24.如实施例22所述的方法,其中该变性剂是甲酰胺、尿素或dmso。
25.如实施例12-21中任一项所述的方法,其中在一个竞争核酸的存在下,不通过链置换将经标记成像核酸从对接核酸去除。
26.如实施例12-21中任一项所述的方法,其中通过化学法、光化学法或酶促法裂解、修饰或降解经标记成像核酸,将经标记成像核酸从对接核酸去除。
27.如实施例12-21中任一项所述的方法,其中当经标记成像核酸结合到其对应的对接核酸上时,在成像核酸或对接核酸上不存在单链区。
28.如实施例12-21中任一项所述的方法,其中该经标记成像核酸不是自淬灭的。
29.如实施例12-28中任一项所述的方法,其中该未结合的对接核酸是部分双链的。
30.如实施例12-28中任一项所述的方法,其中该未结合的成像核酸是部分双链的。
31.如实施例12-28中任一项所述的方法,其中该成像核酸是一个分子信标或者包括一个发夹二级结构。
32.如实施例12-27和29-31中任一项所述的方法,其中该成像核酸是一个分子信标或者包括一个自淬灭的发夹二级结构。
33.如实施例12-28中任一项所述的方法,其中该成像核酸是一个半双链体。
34.如实施例33所述的方法,其中该半双链体是自淬灭的。
35.如实施例12-34中任一项所述的方法,其中该对接核酸包括一个发夹二级结构。
36.如实施例12-35中任一项所述的方法,其中该成像核酸是通过一个树枝状结构或一个聚合结构结合到多个信号发射部分上。
34.一种方法,包括
(1)使一个有待针对一个或多个靶标的存在进行测试的样品与一个或多个靶标特异性结合配偶体接触,其中每个靶标特异性结合配偶体连接至一个对接核酸,并且其中具有不同特异性的靶标特异性结合配偶体连接至不同对接核酸,
(2)任选地去除未结合的靶标特异性结合配偶体,
(3)使该样品与具有互补于一个对接核酸的核苷酸序列的经标记成像核酸接触,
(4)任选地去除未结合的经标记成像核酸,
(5)将该样品成像以便检测结合的经标记成像核酸的位置和数目,
(6)通过去除或修饰它们的信号发射部分而不完全去除成像核酸来灭活结合的经标记成像核酸,并且
(7)重复步骤(3)-(6),每次使用一个相对于全部其他经标记成像核酸来说具有独特核苷酸序列的经标记成像核酸。
35.如实施例34所述的方法,其中该样品在步骤(1)中与多于一个的靶标特异性结合配偶体接触。
36.如实施例34或35所述的方法,其中该靶标特异性结合配偶体是一种抗体或抗体片段。
37.如实施例34或35所述的方法,其中该靶标特异性结合配偶体是天然或工程化的配体、小分子、适体、肽或寡核苷酸。
38.如实施例34-37中任一项所述的方法,其中这些经标记成像核酸是被相同地标记的。
39.如实施例34-37中任一项所述的方法,其中这些经标记成像核酸各自包含一个不同的标记。
40.如实施例34-39中任一项所述的方法,其中这些经标记成像核酸是荧光标记的成像核酸。
41.如实施例34-40中任一项所述的方法,其中该一个或多个靶标是蛋白质。
42.如权利要求34-41中任一项所述的方法,其中该样品是细胞、细胞裂解物或组织裂解物。
43.如实施例34-42中任一项所述的方法,其中使用共聚焦或落射荧光显微镜检术在步骤(5)中将该样品成像。
44.如实施例34-43中任一项所述的方法,其中该未结合的对接核酸是部分双链的。
45.如实施例34-43中任一项所述的方法,其中该未结合的成像核酸是部分双链的。
46.如实施例34-45中任一项所述的方法,其中该成像核酸是一个分子信标或者包括一个发夹二级结构。
47.如实施例34-45中任一项所述的方法,其中该成像核酸是一个分子信标或者包括一个自淬灭的发夹二级结构。
48.如实施例34-45中任一项所述的方法,其中该成像核酸是一个半双链体。
49.如实施例48所述的方法,其中该半双链体是自淬灭的。
50.如实施例34-49中任一项所述的方法,其中该对接核酸包括一个发夹二级结构。
51.如实施例34-50中任一项所述的方法,其中该成像核酸是通过一个树枝状结构或一个聚合结构结合到多个信号发射部分上。
等效形式
尽管已经在此描述并展示几个发明实施例,但本领域普通技术人员将容易想象用于执行功能和/或获得结果和/或在此描述的优点中的一个或多个的多种其他装置和/或结构,并且此类变型和/或修改中的每一个被视为是在在此描述的发明实施例的范围内。更一般地说,本领域的技术人员将容易理解,在此描述的所有参数、尺寸、材料以及配置意味着为示例性的,并且实际参数、尺寸、材料和/或配置将取决于发明传授内容所用于的一种或多种具体应用。本领域的技术人员仅仅使用常规实验将认识到或能够确认在此描述的具体发明实施例的许多等效物。因此,应了解,前述实施方案是仅藉助于实例来呈现,并且在所附权利要求书和其相等形式的范围内,发明实施例可以按与具体地描述和要求不同的方式实践。本披露的发明实施例涉及在此描述的每个单独特征、系统、物品、材料、套件和/或方法。此外,如果此类特征、系统、物品、材料、套件和/或方法并不相互矛盾,两个或更多个此类特征、系统、物品、材料、套件和/或方法的任意组合包括在本披露的发明范围内。在此限定并使用的所有定义应当被理解成凌驾于所限定术语的字典定义、通过引用而结合的文件中的定义、和/或一般含义。
在此披露的所有参考文献、专利和专利申请都相对于每个被引用的主题通过引用而结合,这在某些情况下可以包括文件的全部内容。
除非清楚地作相反指示,否则在说明书中和在权利要求中,如在此使用的不定冠词“一个/种)”(a/an)应当理解为意思指“至少一个(种)”。
在说明书中和在权利要求中,如在此使用的短语“和/或”应当理解为意思指如此联在一起的要素中的“任何一个或两个”,即,要素在一些情形中联合地存在并且在其他情形中分离性地存在。用“和/或”列出的多个元素应当以相同的方式来解释,即,这样结合的元素中的“一个或多个”。除了由“和/或”从句具体识别的元素,其他元素可以任选地存在,无论是与具体识别的那些元素相关还是不相关。因此,作为非限制性实例,当结合开放式语言诸如“包括”使用时,对“a和/或b”的提及可以在一个实施例中仅指a(任选地包括除了b的元素);在另一个实施例中,仅指b(任选地包括除了a的元素);在又一个实施例中,指a和b(任选地包括其他元素);等等。
在说明书中和在权利要求中,如在此使用的“或”应理解为具有与如以上所定义的“和/或”相同的含义。例如,当分隔一个清单中的项目时,“或”或“和/或”应当解释为包容性的,即,包括多个元素或元素清单中的至少一个,而且包括其中的多于一个,以及任选地,另外的未列出的项目。仅相反地清楚指示的术语,诸如“……中的仅一个”或“……中的恰好一个”,或者当用于权利要求中时,“由……组成”将指恰好包括一些或一列元素中的一个元素。总体而言,如在此使用的术语“或”当前面加有排他性的术语,诸如“任何一个”、“……中一个”、“……中仅一个”或“……中只有一个”时,应当仅解释为指示排他性的替代形式(即,“一个或另一个,但非两者”)。“主要由……组成”当用于权利要求中时,应具有如在专利法领域中所用的其普通含义。
在说明书中和在权利要求中,如在此所使用,关于具有一个或多个要素的清单的短语“至少一个”应理解为意思指选自该要素清单中的任一个或多个要素的至少一个要素,但未必包括在该要素清单内具体地列出的每一个要素中的至少一个,并且不排除该要素清单中多个要素的任何组合。这一定义还允许,可以任选地存在除该短语“至少一个”所指元素清单内具体地鉴别出的元素外的元素,无论是与具体地鉴别出的那些元素相关还是不相关。因此,作为非限制性实例,“a和b中的至少一个”(或等效地,“a或b中的至少一个”,或等效地“a和/或b中的至少一个”)在一个实施例中可以是指至少一个、任选地包括多于一个a,而不存在b(并且任选地包括除了b的元素);在另一个实施例中,可以是指至少一个、任选地包括多于一个b,而不存在a(并且任选地包括除了a的元素);在又一个实施例中,可以是指至少一个、任选地包括多于一个a,以及至少一个、任选地包括多于一个b(并且任选地包括其他元素);等等。
还应当理解,除非明确指出相反,在包括多于一个步骤或动作的在此所要求保护的任何方法中,方法的步骤或动作的顺序不一定限于其中方法的步骤或动作被列举的顺序。
在权利要求中,以及在以上说明书中,所有过渡性短语,如“包含”、“包括”、“携带”、“具有”、“含”、“涉及”、“持有”、“由……构成”等应理解为开放性的,即,意思指包括但不限于。只有过渡性短语“由……组成”和“主要由……组成”应当各自地为封闭或半封闭式过渡性短语,如美国专利局专利审查程序手册(unitedstatespatentofficemanualofpatentexaminingprocedures),第2111.03节中所述。
序列表
<110>哈佛学院的校长和同事
<120>利用可编程核酸探针的高通量且高度多路复用的成像
<130>h0498.70501wo00
<140>tbd
<141>2015-03-11
<150>us61/951,461
<151>2014-03-11
<160>10
<170>patentin版本3.5
<210>1
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>1
catctaaagcc11
<210>2
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>2
gaatttcctcg11
<210>3
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>3
gtttaattgcg11
<210>4
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>4
acaattcttcg11
<210>5
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>5
tttcttgcttc11
<210>6
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>6
gcattgttact11
<210>7
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>7
atatacaagcg11
<210>8
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>8
gctgtctattg11
<210>9
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>9
tctttatgctg11
<210>10
<211>11
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>10
caatctcatcc11
- 还没有人留言评论。精彩留言会获得点赞!