利用二苄基二硫代氨基甲酸钾制备镍配合物缓蚀剂的方法及其应用与流程
本发明涉及化合物合成领域,具体涉及一种利用二苄基二硫代氨基甲酸钾制备镍配合物缓蚀剂的方法及其应用。
背景技术:
铜因其具有良好的机械性能和优越的耐腐蚀性能而被广泛应用于各种工业领域当中。然而,在某些特殊条件下,比如在氧化酸性溶液当中,铜经常会受到严重腐蚀。铜材料的腐蚀是一个严重的问题,造成的经济损失表现在金属设备的维护、维修和更换上。
镍的配合物ni(dbtc)2是氯磺化聚乙烯生产过程中的热稳定剂,其分子中具有一些π共轭体系(苯环)和多个硫原子以及氮原子,通常含有这些杂原子或杂环和π共轭体系的分子是有效的缓蚀剂,故其常被用作铜在酸性环境下的高效缓蚀剂。但它的合成过程却鲜有报道,已知的合成过程存在收率低,反应速率慢,选择性差等缺点。所以开发出高效,简易,环保的合成方法具有极其重要的意义。
谢木标[1]等人采用溶剂热合成的方法制备了金属配合物ni(dbtc)2。其合成方法是将二苄基二硫代氨基甲酸钠nadbtc(0.120g,0.40mmol)、niso4·2h2o(0.038g,0.20mmol)及无水乙醇(8ml)混合在15ml聚四氟乙烯内衬不锈钢反应釜中,升温至90℃后保温反应12h,自然冷却到室温即可得到适于晶体结构分析的黑色晶体,所得产率为50%。在brukersmartapexiiccd衍射仪上用石墨单色化得mo-kα射线(=0.071073nm),ω/2θ扫描方式收集晶体的衍射数据(t=293k)。使用shelxs-97程序对衍射数据进行lp因子和multi-scan吸收校正。由直接法解析晶体结构,其他非氢原子坐标通过差值fourier合成并各向异性修正,氢原子为理论加氢,最终由全矩阵最小二乘法对结构精修至收敛,最终得到产物得晶体结构。加上红外光谱和热重分析的结果,表明所合成产物为准确的ni(dbtc)2配合物。该工艺需要升温到90℃反应,能耗高,反应时间长,且得到的黑色晶体未经重结晶收率才50%,收率低。
技术实现要素:
针对上述现有技术的不足,本发明提供一种利用二苄基二硫代氨基甲酸钾制备镍配合物缓蚀剂的方法。收率高、能耗低、反应时间短,且无需复杂的设备。本发明还提供了镍配合物缓蚀剂的应用。
为了解决上述技术问题,本发明采用了如下的技术方案:一种利用二苄基二硫代氨基甲酸钾制备镍配合物缓蚀剂的方法,其特征在于:以nicl2·6h2o和二苄基二硫代氨基甲酸钾为原料,室温搅拌反应,反应完后过滤得到固体产物。
上述方案中:具体反应步骤为将nicl2·6h2o配制成水溶液,将二苄基二硫代氨基甲酸钾配制成甲醇溶液,将nicl2·6h2o水溶液逐渐加入二苄基二硫代氨基甲酸钾的甲醇溶液中。
上述方案中:反应时间为5-7h。
上述方案中:nicl2·6h2o水溶液的浓度为0.05mol/l,二苄基二硫代氨基甲酸钾的甲醇溶液的浓度为0.05mol/l,所述nicl2·6h2o与二苄基二硫代氨基甲酸钾的mol比为1:2。
上述方案中:将过滤所得的固体产物用甲醇洗涤,然后用乙醚洗涤;洗涤完成后将其固体产物用二氯甲烷和甲醇的混合溶液重结晶,得到绿色晶体即为产品。
上述方案中:二氯甲烷和甲醇的混合溶液中二氯甲烷、甲醇的体积比为1:1。
本发明选用nicl2·6h2o和二苄基二硫代氨基甲酸钾作为起始原料进行反应,与现有的工艺相比,本发明只需要反应5-7h,反应时间大大缩短。本发明在室温下反应,不需要任何加热能耗,能耗低。本发明的方法,经过反应重结晶后得到纯度大于99%的绿色晶体的产品,收率大于67%,比现有工艺未经重结晶的50%的收率有大幅提升,取得了意想不到的效果。
所制备的镍配合物缓蚀剂作为金属缓蚀剂的应用。即其在用作金属缓蚀剂中的应用,能延缓铜在0.5mol/l硫酸溶液中的腐蚀速度。0.5mol/l硫酸溶液中加入镍配合物缓蚀剂的浓度为0.002mol/l-0.008mol/l。
有益效果
本发明具有下列特点和有益效果:本发明常温常压下即可操作,安全系数更高;使用极其简单的反应釜即可,无需复杂、昂贵的反应釜;产率达到67%以上,比传统合成方法的50%产率有大幅提升。而采用本发明所述制备方法制备得到的ni(dbtc)2配合物缓蚀剂可以大幅度延缓铜金属在酸性环境下的腐蚀速度。
附图说明
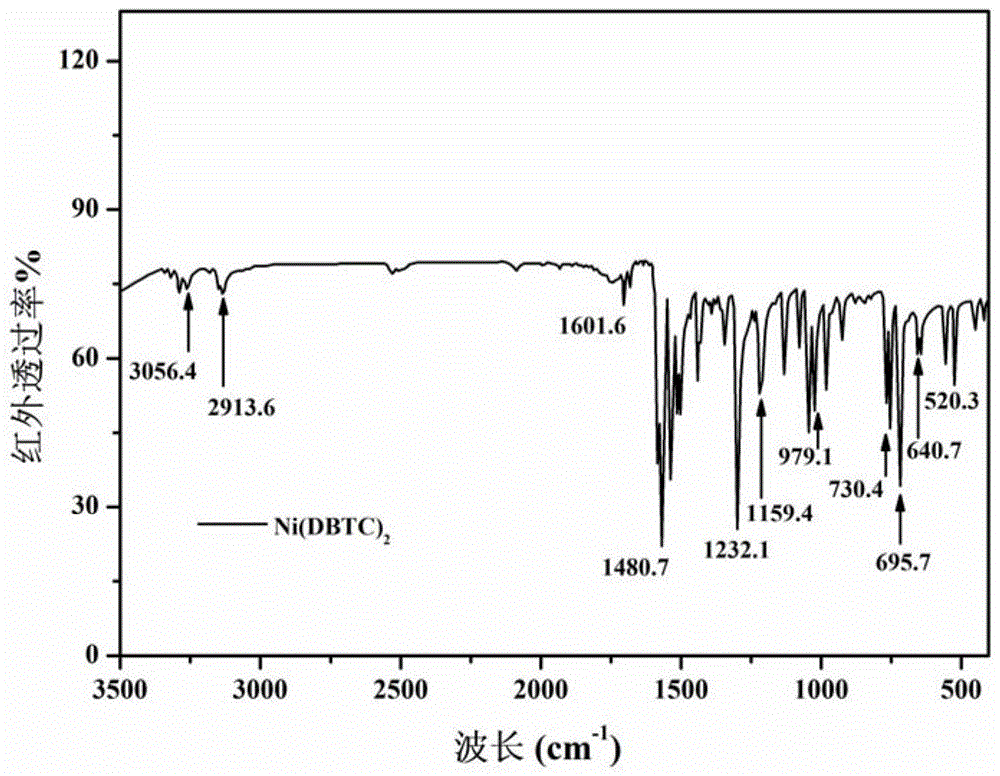
图1是本发明所制备的ni(dbtc)2缓蚀剂的红外光谱图。
图2为99.99%纯铜(质量分数)在不同浓度ni(dbtc)2缓蚀剂的0.5mol/lh2so4溶液中的极化曲线。
图3(a~c)为99.99%铜样,及其在不添加和含0.008mol/lni(dbtc)2缓蚀剂的0.5mol/lh2so4溶液中浸泡32小时的sem图像。
具体实施方式
下面结合附图对本发明作进一步的详细说明。
实施例1
在装有搅拌器的100ml三口烧瓶中加入20ml配制好的0.05mol/l二苄基二硫代氨基甲酸钾的甲醇溶液,再在搅拌的条件下逐渐加入10毫升所配制的0.05mol/l的nicl2水溶液(避免浓度局部变化大)。加入完后,在室温(25℃左右)下将反应混合物搅拌5小时至反应完全,最终形成浅绿色固体。将浅绿色固体过滤,得到固体产物。将上述过滤所得到的固体产物用甲醇洗涤三次,再用乙醚洗涤三次。洗涤后的固体物质置于体积比为二氯甲烷:甲醇=1:1的混合溶液中重结晶,得到绿色晶体,即为本发明的最终产物ni(dbtc)2配合物,收率为67.0%。以上所有步骤均在室温(5-25℃)和常压下进行。所用化学品试剂从商业公司购买获得并直接使用无需进一步纯化。
实施例2
在装有搅拌器的100ml三口烧瓶中加入20ml配制好的0.05mol/l二苄基二硫代氨基甲酸钾的甲醇溶液,再在搅拌的条件下逐渐加入10毫升所配制的0.05mol/l的nicl2水溶液。加完后在室温(25℃左右)下将反应混合物搅拌6小时至反应完全,最终形成浅绿色固体。将浅绿色固体过滤,得到固体产物。将上述过滤所得到的固体产物用甲醇洗涤三次,再用乙醚洗涤三次。洗涤后的固体物质置于体积比为二氯甲烷:甲醇=1:1的混合溶液中重结晶,得到绿色晶体,即为本发明的最终产物ni(dbtc)2配合物,收率为67.3%。以上所有步骤均在室温(5-25℃)和常压下进行。所用化学品试剂从商业公司购买获得并直接使用无需进一步纯化。
实施例3
在装有搅拌器的100ml三口烧瓶中加入20ml配制好的0.05mol/l二苄基二硫代氨基甲酸钾的甲醇溶液,再在搅拌的条件下逐渐加入10毫升所配制的0.05mol/l的nicl2水溶液。加完后,在室温(5℃左右)下将反应混合物搅拌7小时至反应完全,最终形成浅绿色固体。反应完后,将浅绿色固体过滤,得到固体产物。将上述过滤所得到的固体产物用甲醇洗涤三次,再用乙醚洗涤三次。洗涤后的固体物质置于体积比为二氯甲烷:甲醇=1:1的混合溶液中重结晶,得到绿色晶体,即为本发明的最终产物ni(dbtc)2配合物,收率为67.1%。以上所有步骤均在室温(5-25℃)和常压下进行。所用化学品试剂从商业公司购买获得并直接使用无需进一步纯化。
实施例4本发明制备得到的ni(dbtc)2缓蚀剂缓蚀效果评价
4.1失重法
失重实验使用质量分数为99.99%的铜片,尺寸为50mm*25mm*2mm。第一步将铜片进行预处理:依次用800目、1200目、1500目、和2000目的金刚砂纸对铜片进行打磨,然后用蒸馏水将铜片上的粉末杂质冲洗干净,进一步用丙酮和无水乙醇擦洗铜片,最后将铜片在室温下干燥并将干燥好的铜片用分析天平称重。第二步将预处理好的铜片悬挂于0.000mol/l、0.002mol/l、0.004mol/l、0.006mol/l、0.008mol/l浓度的ni(dbtc)2的含硫酸(硫酸浓度0.5mol/l)水溶液中,瓶口用胶塞塞住,置于衡温60℃水浴锅中。4小时后将铜片取出,用硬质的橡皮擦擦掉附着在铜样表面的腐蚀产物,然后用蒸馏水冲洗干净,最后用丙酮和无水乙醇擦洗铜样,室温干燥后称重。最后一步根据铜样在五种浓度缓蚀剂溶液中浸泡前后的质量差来计算其在硫酸溶液中的平均腐蚀速率和平均缓蚀效率。
计算缓蚀剂在硫酸溶液中的平均缓蚀速率,计算公式如下:
cr=δw/s×t
上式中△w是铜片浸泡前后的质量差(毫克);s和t分别表示铜片的表面积(cm2)和浸泡在缓蚀剂溶液中的时间(小时)。
计算缓蚀剂的缓蚀效率,公式如下:
η=(cr0-cr1)/cr0×100%
其中cr0是铜片在未加缓蚀剂的硫酸溶液中的腐蚀速率(mgcm-2h-1);cr1是铜片在加缓蚀剂的酸性溶液中的腐蚀速率(mgcm-2h-1)。
表1铜样在不同浓度的二苄基二硫代氨基甲酸镍缓蚀剂的0.5mol/l的h2so4水溶液中的失重实验数据
表1中是采用静态失重法测得的质量分数99.99%铜片在空白0.5mol/l硫酸溶液中和添加不同量的二苄基二硫代氨基甲酸镍缓蚀剂的0.5mol/l硫酸溶液中的腐蚀速率(v)和缓蚀效率(η)的结果。可以看出在0.5mol/l硫酸水溶液中加入二苄基二硫代氨基甲酸镍缓蚀剂使其浓度为0.002mol/l时,铜片在硫酸溶液中的腐蚀速率明显降低,缓释效率达到88.38%。加入缓蚀剂使其浓度达到0.004mol/l时,缓释效率达到95.22%。随着加入更多的缓蚀剂其浓度增大,缓蚀效率也随着增大。大约在0.006mol/l时缓蚀效率基本趋于稳定。此后,随着缓蚀剂浓度的增加,缓蚀效率变化不大。
4.2极化曲线法
运用chi660b电化学工作站测定其塔菲尔曲线,采用三电极体系。将工作电极置于0.000mol/l、0.002mol/l、0.004mol/l、0.008mol/l缓蚀剂的0.5mol/l硫酸溶液中浸泡,测定开路电位,待开路电位稳定后,测定其极化曲线。测试的电位扫描幅度为-250~250mv,扫描速率为2mvs-1。
根据以下式子计算腐蚀效率:
其中
室温下铜在空白硫酸溶液和添加不同量缓蚀剂的硫酸溶液中的极化曲线如图2所示。阴极tafel斜率(βc)、阳极斜率(βa)、自腐蚀电位(ecorr)、自腐蚀电流(icorr)等数据被罗列在表2中。
表2质量分数99.99%铜在含有不同浓度缓蚀剂的0.5mol/l的硫酸溶液中腐蚀的极化曲线参数
由表2可知,加入缓蚀剂后,腐蚀电流密度明显减小,阴阳极极化曲线负移,说明ni(dbtc)2配合物能有效抑制电极的阳极溶解和阴极析氢反应。自腐蚀电位ecorr和阴极、阳极tafel斜率均变化不大,说明缓蚀剂没有改变金属基体阳极溶解和阴极析氢反应机理。ecorr略向阴极移动,一般认为ecorr变化在85mv以上才可以明显判断缓蚀剂类型为阴极型缓蚀剂或阳极型缓蚀剂,△ecorr=39mv,由此推断ni(dbtc)2配合物型缓蚀剂是以阴极抑制为主的混合型缓蚀剂。当ni(dbtc)2配合物型缓蚀剂浓度为0时,rp值为3.7ωcm2。当ni(dbtc)2配合物型缓蚀剂浓度为0.008mol/l时,rp值为107.6ωcm2,对应的缓蚀效率为97.1%。
4.3腐蚀形貌分析
298k温度下经过研磨的铜片在不添加缓蚀剂和含0.008mol/l缓蚀剂的硫酸溶液中浸泡32小时,根据扫描电镜样品仓和样品台的要求把铜样切割成合适尺寸,用导电胶将其粘接在样品座上,即可开始使用扫描电子显微镜(sem)进行腐蚀形貌分析。
铜样以及其在未添加和含0.008mol/l二苄基二硫代氨基甲酸镍缓蚀剂的0.5mol/l硫酸溶液中浸泡32小时后的sem像如图3(a~c)所示。从图3(b)中可以看出,在未添加缓蚀剂的酸性溶液中铜样表面出现严重的腐蚀,有大量的腐蚀产物和腐蚀坑,铜样表面打磨过的划痕消失。而图3(c),加入缓蚀剂后铜样表面全面腐蚀减小,腐蚀程度明显减缓,铜样表面明显平整,只是有少量的点蚀。
这说明ni(dbtc)2配合物型缓蚀剂在铜表面形成吸附膜,能够有效阻滞硫酸介质对铜金属的腐蚀。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解;其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
- 还没有人留言评论。精彩留言会获得点赞!