一种幽门螺杆菌液体培养方法与流程
本发明涉及细菌培养技术领域,具体涉及幽门螺杆菌液体培养方法。
背景技术:
自1984年马歇尔和沃伦成功从胃黏膜组织中分离得到幽门螺杆菌(helicobacterpylori,h.pylori)后,越来越多的研究证实h.pylori与胃炎、消化性溃疡及胃癌等疾病的发病密切相关。h.pylori呈全球性分布,世界上一半以上的人口曾感染过h.pylori,世界卫生组织已将其列为胃癌的一级致癌因子。h.pylori培养检查的特异性100%,是临床上诊断h.pylori感染的“金标准”。h.pylori是一种呈“s”形、弧形或弯曲形的革兰阴性微需氧菌,对体外的培养条件要求非常严格。目前h.pylori的体外培养多以固体培养为主。对于该领域的科研工作者来说,方便、快捷的获得体外培养的h.pylori进行研究极为重要,在h.pylori疫苗制备方面,液体培养的方法则更方便h.pylori疫苗的各种毒力因子提取和检测。目前,国内外液体培养h.pylori的方法虽有些报道,但由于h.pylori的生长对生存环境的变化比较敏感,为了保证h.pylori的存活,大多液体培养方法操作复杂,对实验室硬件要求较高。为此,本课题组以常规固体培养法作为对照,在前人液体培养法的基础上,根据实验室条件,建立了一种生长良好且简便实用的液体培养方法。
技术实现要素:
本发明的目的在于提供幽门螺杆菌液体培养方法,以建立一种简便的h.pylori液体体培养方法。
幽门螺杆菌液体培养方法包括如下步骤:
步骤(1):h.pylori固体培养
(a1)取质量比为3~4/85~95的哥伦比亚琼脂粉和蒸馏水,并将哥伦比亚琼脂粉溶于蒸馏水中获得溶解质a;
(b1)将溶解质a在110~120℃的环境中高压灭菌10~20min;
(c1)待溶解质a的温度降低至45~50℃,向溶解质a中加入无菌脱纤维羊血和h.pylori选择剂,溶解质a、无菌脱纤维羊血和h.pylori选择剂的体积比为85~95/10~15/0.4~0.8,混合均匀后快速制板,冷却后获得获得哥伦比亚血琼脂平板;
(d1)取冻存的h.pylori标准株nctc11639至35~37℃的水中水浴至完全融化,并接种于哥伦比亚血琼脂平板上;
(e1)将哥伦比亚血琼脂平板放入内部温度为35~37℃厌氧罐中恒温培养3d,厌氧罐内初始时的气体含量为5%o2、10%co2、85%n2;
步骤(2):h.pylori液体培养
(a2)取质量比为3~4/90的脑心浸液粉和双蒸水,并将脑心浸液粉溶于双蒸水中制成脑心浸液;
(b2)将脑心浸液在110~120℃的环境中高压灭菌10~20min;
(c2)取体积比为8~10/1~2/0.4~0.8的脑心浸液、胎牛血清和h.pylori选择剂混合并制成h.pylori液体培养基;
(d2)向t25细胞培养瓶中加入10~12mlh.pylori液体培养基,取出已固体培养3d的哥伦比亚血琼脂平板,并刮取菌苔加入t25细胞培养瓶,使h.pylori液体培养基与菌苔混合均匀;
(e2)将t25细胞培养瓶置于厌氧罐中,并将厌氧罐内建立为空气含量为5%o2、10%co2、85%n2的微需氧环境,密封厌氧罐并将厌氧罐置于空气摇床上,环境温度控制在35~37℃培养3d。
本基础方案的有益效果在于:
(1)本基础方案选取脑心浸液作为基础液体培养基,加入10%的胎牛血清,为h.pylori提供必要的营养成分,但将其使用的抗生素换为目前已在培养h.pylori时使用成熟的h.pylori选择剂(sr0147e),有效的排除了杂菌的污染。
(2)本方案培养出的h.pylori除了典型的h.pylori形态外,还出现了少量长丝状菌体,后经固体培养基传代,其性状能保存至少两代。
(3)在h.pylori的疫苗研发中,很多成分的制备需要通过液体培养h.pylori来获得,本方法建立了一种简便、有效的h.pylori液体培养方法,可进行广泛应用。
优选方案一:作为对基础方案的进一步优化,所述空气摇床的转速控制在120~160r/min;150r/min的振荡频率有利于h.pylori的生长。
优选方案二:作为对优选方案一的进一步优化,所述步骤(1)和步骤(2)中厌氧罐内微需氧环境通过向厌氧罐内加入微需氧产气袋建立。打开厌氧罐,剪开微需氧产气袋子,并向厌氧罐中加入微需氧产气袋,密封厌氧罐;微需氧产气袋内的位置将吸收氧气产生二氧化碳,从而建立起微需氧环境。相比于抽气换气法建立微需氧环境,本优选方案的方法操作简单,成本较低。
优选方案三:作为对优选方案二的进一步优化,在所述步骤(2)h.pylori液体培养的e2步骤中,培养进行至35~36h时更换微需氧产气袋。在培养过程中,随着菌落的形成和生长,对厌氧罐内的气体环境将具有一定程度的改变,及时更换厌氧产气袋,有利于维持微需氧环境在相对恒定的状态。
优选方案四:作为对优选方案三的进一步优化,步骤(1)的b1步骤、步骤(2)的b2步骤采用在密封环境内将水加热至沸腾进行灭菌。在水加热的过程中,水沸腾后将产生大量蒸汽,从而使得气压升高,则水的沸点进一步升高,以此达到高温高压状态;在密封环境中加热使水沸腾,以建立高温高压状态便于控制压力和温度。
优选方案五:作为对优选方案四的进一步优化,所述步骤(2)h.pylori液体培养的(e2)步骤中,t25细胞培养瓶竖直放置与厌氧罐中;有利于气体充分弥散于液体中,较好地为h.pylori的生长提供适宜的培养环境。
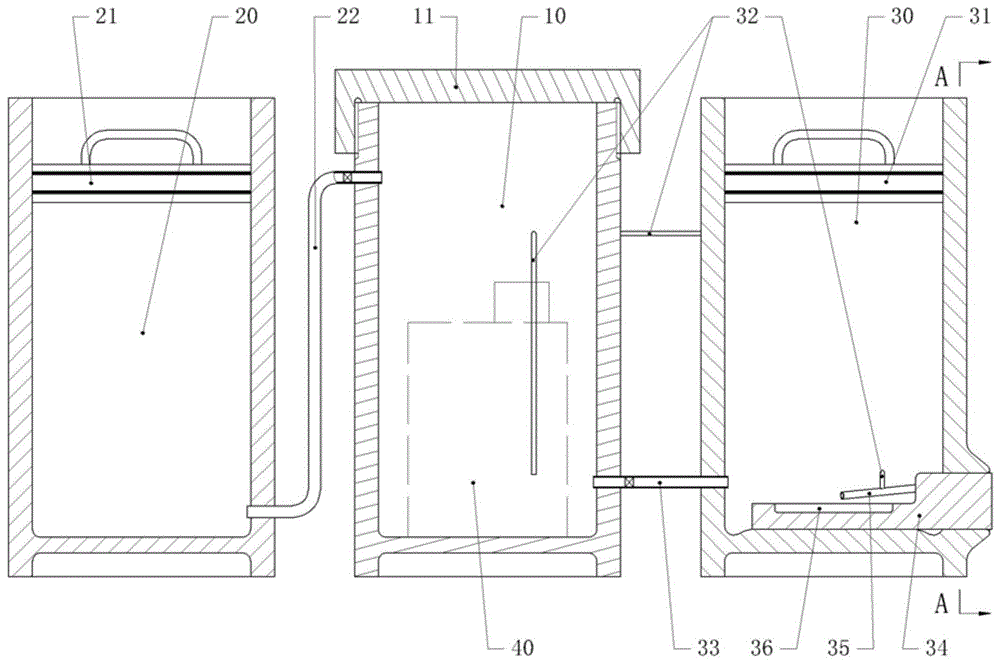
优选方案六:作为对优选方案五的进一步优化,所述步骤(2)h.pylori液体培养的(e2)步骤中所采用的厌氧罐包括厌氧罐包括反应罐、培养罐和排气罐,反应罐、培养罐和排气罐的顶部均设有开口,反应罐和排气罐内分别设有第一密封盖和第二密封盖,第一密封盖和第二密封盖的边缘分别与反应罐和排气罐的内壁滑动连接,培养罐的顶部设有盖体,盖体螺纹连接在培养罐的顶部;反应罐的下部第一管道与培养罐连通,培养罐通过第二管道与排气罐的下部连通,第一管道和第二管道内均设有单向阀,仅有反应罐内的气体可进入培养罐内,培养罐内的气体仅能进入排气罐内,排气罐的下部设有排气管,且排气管内设有阻止外部气体进入排气罐内的单向阀;
在(e2)步骤中,向反应罐和培养罐中分别投入微需氧产气袋,并将t25细胞培养瓶放入培养罐中,并封闭反应罐、培养罐和排气罐的开口,使第一密封盖位于反应罐的上部,第三密封盖位于排气罐的下部;培养进行至35~36h时,向上拉动第三密封盖。
在优选方案六中,更新厌氧罐内的微需氧环境时,t25细胞培养瓶不会与外部空气接触,因此不会导致高浓度的氧含量对h.pylori造成损害。
优选方案七:作为对优选方案六的进一步优化,所述反应罐的下部通过第一管道与培养罐的上部连通,培养罐的下部通过第二管道与排气罐的下部连通。反应罐内的气体从培养罐的上部进入培养罐内,培养罐内的气体从培养罐的下部进入排气罐内,可以避免培养罐内的原气体和新加入的气体混合。
附图说明
图1为本发明实施例中厌氧罐的示意图;
图2为本发明实施例中排气罐沿a-a截面的局部剖视图。
具体实施方式
下面通过具体实施方式进一步详细说明:
说明书附图中的附图标记包括:培养罐10、第二密封盖11、反应罐20、第一密封盖21、第一管道22、排气罐30、第三密封盖31、吸料管32、第二管道33、滑块34、第一限位槽341、第二限位槽342、排气管35、放置槽36、钢球37、密封杆38、压簧39、t25细胞培养瓶40。
具体实施过程如下:
幽门螺杆菌液体培养方法包括如下步骤:
步骤(1):h.pylori固体培养
(a1)取3.7g哥伦比亚琼脂粉和90ml蒸馏水,并将哥伦比亚琼脂粉溶于蒸馏水中获得溶解质a;
(b1)将溶解质a在118℃的环境中高压灭菌15min;
(c1)待溶解质a的温度降低至50℃,向溶解质a中加入10ml无菌脱纤维羊血和400μl的h.pylori选择剂,混合均匀后快速制板,冷却后获得获得哥伦比亚血琼脂平板;
(d1)取冻存的h.pylori标准株nctc11639至37℃的水中水浴至完全融化,并接种于哥伦比亚血琼脂平板上;
(e1)将哥伦比亚血琼脂平板放入内部温度为37℃厌氧罐中恒温培养3d,厌氧罐内初始时的气体含量为5%o2、10%co2、85%n2;
步骤(2):h.pylori液体培养
(a2)取3.7g的脑心浸液粉和90ml双蒸水,并将脑心浸液粉溶于双蒸水中制成脑心浸液;
(b2)将脑心浸液在118℃的环境中高压灭菌15min;
(c2)取9ml脑心浸液、1ml胎牛血清和400μlh.pylori选择剂混合并制成h.pylori液体培养基;
(d2)向t25细胞培养瓶中加入10mlh.pylori液体培养基,取出已固体培养3d的哥伦比亚血琼脂平板,并刮取菌苔加入t25细胞培养瓶,使h.pylori液体培养基与菌苔混合均匀;
(e2)将t25细胞培养瓶置于厌氧罐中,并将厌氧罐内建立为空气含量为5%o2、10%co2、85%n2的微需氧环境,密封厌氧罐并将厌氧罐置于空气摇床上,空气摇床的转速控制在150r/min,环境温度控制在37℃培养3d。
如图1所示,厌氧罐包括反应罐20、培养罐10和排气罐30,反应罐20、培养罐10和排气罐30的顶部均设有开口,且反应罐20和排气罐30内分别设有第一密封盖21和第二密封盖11,第一密封盖21和第二密封盖11的边缘分别与反应罐20和排气罐30的内壁滑动连接,即第一密封盖21和第二密封盖11分别可在反应罐20和排气罐30的内滑动。第一密封盖21和第二密封盖11的边缘设有密封圈,从而使得第一密封盖21和第二密封盖11可分别将反应罐20和排气罐30密封。培养罐10的顶部设有盖体,盖体螺纹连接在培养罐10的上端以将培养罐10顶部的开口密封。本实施例中,培养罐10为圆桶状,反应罐20和排气罐30均为横截面为正方形的立方体。
反应罐20的下部通过第一管道22与培养罐10的上部连通,培养罐10的下部通过第二管道33与排气罐30的下部连通;且第一管道22和第二管道33内均设有单向阀,以使得只有反应罐20内的气体可进入培养罐10内,而培养罐10内的气体仅能进入排气罐30内。
如图1、图2所示,在排气罐30的底部设有贯穿排气罐30侧壁的滑块34,滑块34的一端位于排气罐30内,滑块34的另一端位于排气罐30外,从而使得滑块34可向排气罐30外滑动。在滑块34的两侧壁上分别设有呈球面的第一限位槽341和第二限位槽342,而在排气罐30的侧壁内设有对滑块34进行限位的第一限位结构和第二限位结构;第一限位结构和第二限位结构均包括安装槽,设于安装槽内的钢球37以及与钢球37相抵的压簧39。当钢球37分别嵌入第一限位槽341和第二限位槽342时,钢球37可对滑块34进行限位;当滑块34受到向外的推力,第一限位槽341和第二限位槽342的侧壁将挤压钢球37,从而压簧39被压缩,钢球37进入安装槽内,则滑块34可滑出排气罐30。
滑块34位于排气罐30内的上表面上设有放置槽36,放置槽36内放入采样片。滑块34的上方设有排气管35,排气管35的一端与排气罐30的外部连通,排气管35的另一端设置在滑块34上的放置槽36上方。第一限位结构的安装槽向排气罐30延伸并贯穿排气管35,且第一限位结构的钢球37上固定有密封杆38,压簧39套设在密封杆38上,当滑块34挤压钢球37时,钢球37将带动密封杆38向排气管35移动,使得密封杆38伸入排气管35内将排气罐30封堵;而当钢球37分别嵌入第一限位槽341和第二限位槽342内时,排气管35将排气罐30内部与外部连通。另外,培养罐10内设有吸料管32,吸料管32为橡胶软管,吸料管32的一端可伸入t25细胞培养瓶40内,吸料管32的另一端与排气管35的中部连通,且吸料管32内设有单向阀使得培养液仅能通过吸料管32向排气管35流动。排气管35倾斜设置,且排气罐30朝向排气罐30外一端向上倾斜,而排气管35位于排气罐30内的一端向下倾斜;且在排气管35朝向排气罐30外的一端设有单向阀,以防止外部空气通过排气管35进入排气罐30内。
具体工作原理如下:
在执行步骤(2)h.pylori液体培养的(e2)步骤时,向反应罐20和培养罐10中分别投入微需氧产气袋,并将t25细胞培养瓶40竖直放入培养罐10中,使吸料管32伸入t25细胞培养瓶40内,将反应罐20、培养罐10和排气罐30的开口密封。使第一密封盖21位于反应罐20的上部,第三密封盖31位于排气罐30的下部;由于第一密封盖21和第三密封盖31受到反应罐20或排气罐30侧壁的摩擦力,第一密封盖21和第三密封盖31不会在自身重力的作用下向下滑动。
培养进行至36小时时,向上拉动第三密封盖31,则第三密封盖31向上滑动排气罐30内的空间增大,培养罐10内的气体将进入排气罐30内;同时反应罐20内的气体进入培养罐10内,这第一密封盖21向下滑动。另外,反应罐20的下部通过第一管道22与培养罐10的上部连通,培养罐10的下部通过第二管道33与排气罐30的下部连通;即反应罐20内的气体从培养罐10的上部进入培养罐10内,而培养罐10内的气体从培养罐10的下部进入排气罐30内,从而可以避免培养罐10内的原气体和新加入的气体混合。
当完成3天的培养后,向下挤压第三密封盖31,第三密封盖31将压缩排气罐30内的气体,从而排气罐30内的气压将逐渐增大,同时排气罐30内的气体将通过排气管35排出,则排气管35内形成气流。根据伯努力定律,吸料管32内将形成负压,从而吸料管32将吸取t25细胞培养瓶40内的培养液,从而培养液将进入排气管35内并随气流排出。随着第三密封盖31继续挤压排气罐30内的气体,排气罐30内的气压持续增大,且排气罐30的内部压力将向外挤压滑块34,则滑块34将挤压钢球37,使钢球37进入安装槽内;同时,第一限位结构的钢球37将带动密封杆38滑动,使密封杆38的伸入排气管35内将密封杆38封堵,从而密封杆38和吸料管32之间的一段排气管35内将聚集培养液,且由于排气管35倾斜设置,因此聚集在排气罐30内的培养液将滴落到采样片上。
当钢球37完全与第一限位槽341和第二限位槽342脱离后,滑块34在排气罐30内部的压力作用下将被推出,此时可将滑块34抽出,则可取出采样片,对培养后的h.pylori进行检测。经过检测,本实施例培养出的h.pylori除了典型的h.pylori形态外,还出现了少量长丝状菌体,后经固体培养基传代,其性状能保存至少两代。且本课题组成员分别用固体培养和液体培养后的h.pylori感染胃癌细胞株ags后,检测其上清中白细胞介素8(il8)的含量,发现液体培养的h.pylori感染胃癌细胞株ags的il8的含量高于固体培养方法,表明液体培养的h.pylori体外感染活力较固体培养强。
以上所述的仅是本发明的实施例,方案中公知的具体结构及特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明结构的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本申请要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
- 还没有人留言评论。精彩留言会获得点赞!