靶向结合Sox2蛋白的多肽药物的合成及应用的制作方法
本发明属于生物医药技术领域,具体涉及到靶向结合sox2蛋白的多肽药物的合成及应用。
背景技术:
前期,我们通过建立了高通量的肽适配子文库和筛选方法(具体应用请见专利zl201410339641.x),并筛选获得了几个与sox2蛋白紧密结合的肽适配子(具体应用请见专利zl201510263530.x),同时验证了它们的功能,在此基础上,我们对p42肽适配子进行化学合成和修饰。
sox2蛋白是一个强大的转录因子,在多个肿瘤的恶性进程(如肿瘤发生、肿瘤细胞增殖,侵袭转移,肿瘤干细胞特性维持、化疗药物抗性等)的多个方面起重要作用。
肿瘤细胞增殖实验主要包括细胞计数和克隆形成实验,细胞计数实验可以通过直接计数以及其他检测方法如cck8等方法完成。划痕实验是通过在培养的细胞中进行划痕来检测细胞的迁移能力,它反映肿瘤细胞的运动能力。
肿瘤细胞侵袭实验是一个模拟体内环境,依赖肿瘤细胞分泌蛋白酶降解基质,从而使细胞具备转移能力的能力测试,它从一定程度反映了细胞的侵袭和转移潜能。而成瘤实验可在小鼠体内真实反映处理后的细胞肿瘤再生能力,常用于药物的筛选。
技术实现要素:
本发明的目的是提供一个具有特定空间构象并能特异靶向结合sox2蛋白的多肽药物的合成及应用。通过细胞增殖实验、划痕、细胞侵袭以及成瘤实验对该多台药物的功能鉴定,表明该多肽药物使细胞增殖速率降低,细胞迁移能力、侵袭能力下降,成瘤能力差,具有显著的肿瘤抑制功能,具有重要的应用价值。
靶向结合sox2蛋白的多肽药物,其序列为:tamra-ygrkkrrqrrrcgpvwfstlffplfflislargpc。该序列包含特异靶向结合sox2蛋白的肽适配子fstlffplffl,同时在其氨基端添加了红色荧光标记基团tamra和穿透肽序列ygrkkrrqrrr。
上述靶向结合sox2蛋白的多肽药物经化学合成,并让其中的2个半胱氨酸形成一个二硫键,以此形成具有特定结构的空间构象。同时化学合成没有特异靶向结合sox2蛋白的肽适配子fstlffplffl的tamra-ygrkkrrqrrrcgpv
wislargpc作为对照。
上述靶向结合sox2的多肽药物的化学合成方法为:以fmoc-aa树脂为原料,以hobt为活化剂,dic为缩合剂,collidine为碱试剂合成带保护的肽树脂;再经切割液切割得肽粗品;肽粗品经空气氧化法氧化获得精品多肽药物。其中fmoc-aa:dic:hobt:collidine的体积比为1:1:1:2,fmoc-aa缩合过程用量过量2.5倍,每一步缩合都经过凯撒试剂(kaisertest)检测,如颜色呈阳性则重复缩合氨基酸;切割液为:三氟醋酸:edt:水:对甲酚的体积比为87.5:5:2.5:5;空气氧化法为:肽粗品溶于纯水,用氨水调ph值到9,室温搅拌反应24小时。
上述靶向结合sox2蛋白的多肽药物功能的鉴定,包括以下步骤:
1)肿瘤细胞增殖实验:在接种同样量细胞的食管鳞癌细胞kyse450细胞培养基中添加靶向结合sox2蛋白的多肽药物和对照,并在一天后,往细胞培养基中加入cck8,在第三天、第五天、第七天测定每个孔的吸光值od450和od650,以此反映细胞的增殖情况并统计分析;
2)肿瘤细胞划痕实验:在接种同样量细胞的食管鳞癌细胞kyse450细胞培养基中添加靶向结合sox2蛋白的多肽药物peptide42和对照,并在一天后,用枪头在细胞中划线,用pbs清洗后拍照,48小时后,在最初拍照划痕位置继续拍照,并统计结果;
3)肿瘤细胞侵袭实验:将同样量的食管鳞癌细胞kyse450细胞接种到涂布matrigel的transwell小室后,在上室培养基中添加0.02ug/ul的等量多肽药物peptide42和对照,上室的血清浓度为5vol%,下室血清浓度为20vol%,48小时后观察穿透膜的细胞并计数和统计分析;
4)肿瘤细胞成瘤实验:将同样量的食管鳞癌细胞kyse450细胞和matrigel混合后接种到裸鼠皮下,在肉眼可见的肿瘤形成后,分别注射等量的靶向结合sox2蛋白的多肽药物peptide42和对照,经多次注射后,观察肿瘤的生长并对形成的肿瘤进行剥离和称重,统计分析。
本发明的有益效果在于:
(1)通过化学合成方法,获得了空间构象固定,并利于示踪和穿透进入细胞的多肽药物peptide42和对照;
(2)利用细胞增殖、细胞划痕修复、细胞侵袭体外实验证实了靶向结合sox2蛋白的多肽药物peptide42对肿瘤细胞恶性进程的抑制作用;
(3)利用体内成瘤实验,证实了靶向结合sox2蛋白的多肽药物peptide42对肿瘤起始发生起抑制作用,能被用于制备食管鳞癌治疗的候选药物。
附图说明
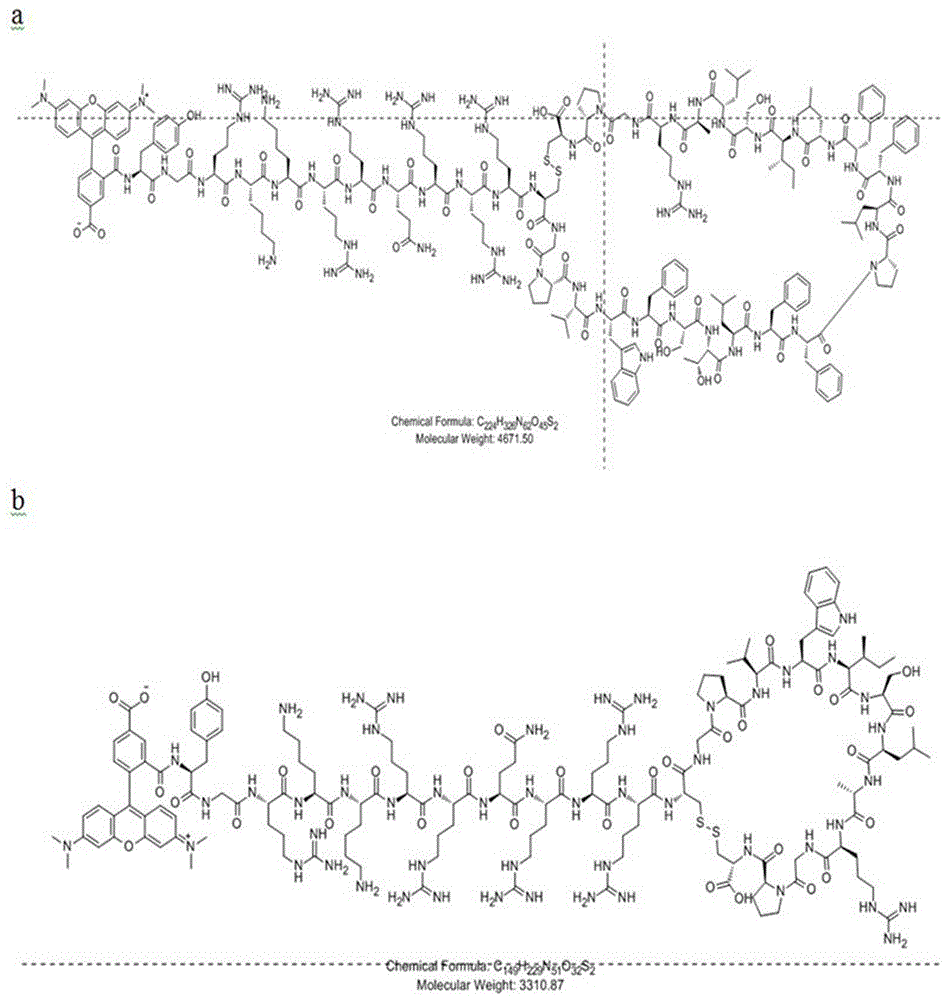
图1多肽药物和对照的空间构象图。a:多肽药物peptide42的空间构象图;b:对照的空间构象图。
图2kyse450细胞经多肽药物peptide42和对照处理后的增殖实验结果图。
图3kyse450细胞经多肽药物peptide42和对照处理后的划痕修复实验结果图。a:多肽药物peptide42和对照处理后的kyse450细胞划痕修复结果;b:多肽药物peptide42和对照处理kyse450细胞的伤痕愈合率柱形分析统计结果。
图4kyse450细胞经多肽药物peptide42和对照处理后的侵袭实验结果图。a:多肽药物peptide42和对照处理后的kyse450细胞侵袭结果;b:多肽药物peptide42和对照处理kyse450细胞侵袭柱形分析统计结果。
图5kyse450细胞皮下成瘤多肽药物peptide42和对照处理实验结果图。a:多肽药物peptide42和对照处理后的kyse450细胞荷瘤裸鼠图;b:多肽药物peptide42和对照处理后的kyse450细胞在裸鼠体内成瘤后剥离的肿瘤图;c:多肽药物peptide42和对照处理后的kyse450细胞在裸鼠体内成瘤的肿瘤统计柱形结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中的实验材料,如无特殊说明,均为常规生化试剂销售店获取。以下实施例中的定量实验,均设置为独立的三次重复实验,结果取平均值。
实施例1靶向结合sox2的多肽药物的化学合成
靶向结合sox2的多肽药物的化学合成方法为:以fmoc-aa树脂为原料,以hobt为活化剂,dic为缩合剂,collidine为碱试剂合成带保护的肽树脂;再经切割液切割得肽粗品;肽粗品经空气氧化法氧化获得精品多肽药物。其中fmoc-aa:dic:hobt:collidine体积比为1:1:1:2,fmoc-aa缩合过程用量过量2.5倍,每一步缩合都经过凯撒试剂(kaisertest)检测,如颜色呈阳性则重复缩合氨基酸。
所需合成多肽的序列为:对照:tamra-ygrkkrrqrrrcgpvwislargpc和多肽药物peptide42:tamra-ygrkkrrqrrrcgpvwfstlffplfflislargpc。
序列中各氨基酸投料量及试剂的投料量的计算:
以k表示过量2.5倍的投料量。
k=2.5×m树脂×loading=2.5×2g×0.26mmol/g=1.3mmol
活化剂:m(hobt)=m(hobt)×k=0.135g/mmol×1.3mmol=0.176g
缩合剂:v(dic)=m(dic)×k/0.81=0.126g/mmol×1.3mmol/0.81g/ml=0.2ml
碱试剂:
v(collidine)=2×m(collidine)×k/0.80g/ml=2×0.124g/mmol×1.3mmol/0.80g/ml=0.40ml
m(pro)=m(pro)×k=0.3374g//mmol×1.3mmol=0.439g
m(gly)=m(gly)×k=0.2973g/mmol×1.3mmol=0.386g
m(arg)=m(arg)×k=0.6448g/mmol×1.3mmol=0.838g
m(ala)=m(ala)×k=0.3113g/mmol×1.3mmol=0.404g
m(leu)=m(leu)×k=0.3534g/mmol×1.3mmol=0.459g
m(ser)=m(ser)×k=0.3834g/mmol×1.3mmol=0.498g
m(ile)=m(ile)×k=0.3534g/mmol×1.3mmol=0.459g
m(trp)=m(trp)×k=0.5265g/mmol×1.3mmol=0.684g
m(val)=m(val)×k=0.3224g/mmol×1.3mmol=0.419g
m(cys)=m(cys)×k=0.5857g/mmol×1.3mmol=0.761g
m(gln)=m(gln)×k=0.6107g/mmol×1.3mmol=0.794g
m(lys)=m(lys)×k=0.4685g/mmol×1.3mmol=0.609g
m(tyr)=m(tyr)×k=0.4596g/mmol×1.3mmol=0.597g
m(tamra)=m(tamra)×k=0.430g/mmol×1.3mmol=0.559g
靶向结合sox2的多肽药物的化学合成的具体步骤为:
1)合成带保护的肽树脂
①脱fmoc保护基团
取2gfmoc-cys(trt)-2-chlorotritylresin放入接肽瓶中,该树脂的取代度为0.26mmol/g,加入适量ch2cl2使树脂膨胀,然后把ch2cl2抽掉。加入12ml20vol%piperidine/dmf溶液振荡5min,抽干,再加入12ml20vol%piperidine/dmf溶液振荡15min,然后抽干,用dmf洗3次,meoh洗3次,ch2cl2洗3次,抽干,取10-20颗树脂作kaisertest检测呈阳性,假若是呈阴性,则重复以上脱帽步骤。
②fmoc-pro-oh的缩合
称取fmoc-pro-oh0.439g,hobt0.176g加入上面接肽瓶中。加入12ml(ar)级的dmf,0.4mlcollidine,0.2mldic,密封后放入振荡器中反应1小时,温度控制在35°c,反应结束后,将反应液抽干,用dmf洗树脂3次,meoh洗3次,ch2cl2洗3次,抽干,取10-20颗树脂作kaisertest显阴性,假若程阳性则重复上面缩合反应操作直到反应完全kaisertest显阴性通过。再脱fmoc保护基团加入12ml20vol%piperidine/dmf溶液振荡5min,抽干,再加入12ml20vol%piperidine/dmf溶液振荡15min,然后抽干,用dmf洗3次,meoh洗3次,ch2cl2洗3次,抽干,取10-20颗树脂作kaisertest检测呈阳性,假若是呈阴性,则重复以上脱帽步骤。
③再依次缩合fmoc-gly-oh,fmoc-arg(pbf)-oh等,序列中的氨基酸,缩合过程是从c端往n端逐个缩合,缩合方法同步骤2的fmoc-pro-oh相同,合成带保护的肽树脂。
2)切割得肽粗品
将步骤1得到的保护的肽树脂加入到20ml的三氟醋酸:edt:水:对甲酚体积比为87.5:5:2.5:5的混合液中,室温振荡2.5小时,过滤,用三氟醋酸洗树脂2次,滤液加无水乙醚得白色固体,反复用无水乙醚洗涤,得肽粗品0.45g。
3)氧化得精品多肽
称取0.3g肽粗品溶于200ml纯水,用氨水调ph值到9,室温搅拌反应24小时后,取样品检测ms,等氧化完全后,经过分离纯化冷冻后得到98%的精品多肽。制备所得的多肽药物peptide42和对照的空间构象图见图1。
实施例2
靶向结合sox2的多肽药物用于食管鳞癌治疗增殖分析,包括以下步骤:
1)对食管鳞癌细胞kyse450使用胰酶消化离心后进行细胞计数,96孔板中每孔接种1000个细胞。在接种时添加含有0.02ug/ul浓度化学合成多肽peptide42或对照的完全培养基培养细胞。每组重复5孔,共四组。
2)培养24h,吸去旧培养基,每孔加入100μl新鲜完全培养基,并加入10μlcck8溶液。
3)在细胞培养箱内继续培养0.5-4h后,450nm和650nm波长下分别测定其吸光值od450和od650。
4)分别在第三天,第五天,第七天重复步骤2,3。
5)用graphpad软件对吸光值数据进行统计分析。每个实验重复三次,采用方差统计t检验。
结果见图2,图2结果表明:与对照组相比,多肽peptide42能显著抑制食管鳞癌细胞kyse450细胞的增殖。
实施例3
靶向结合sox2的多肽药物用于食管鳞癌治疗划痕分析,包括以下步骤:
1)使用10cmdish培养kyse450细胞,待丰度达到80%时,用胰酶消化后离心,并计数细胞,在6孔细胞培养板中每孔接种1×106个细胞,接种时使用含有0.02μg/μl浓度化学合成多肽peptide42和对照的完全培养基培养细胞,并在接下来的过程中使用同样的培养基;
2)待细胞贴壁培养达到80%的丰度时,在超净工作台中用灭菌的200μl黄色枪头划线,使划线的宽度一致,便于后期的统计观察;
3)划线完后用pbs洗两遍,洗去残留漂浮细胞,并在放大倍数为40×显微镜下拍照,便于与迁移后进行比较。
4)48小时候,继续在前次拍照位置进行拍照(图3a所示),采用image-proplus6软件统计细胞迁移的面积并计算迁移率(图3b所示),由图可知,与对照相比,添加了多肽药物peptide42后,细胞的迁移能力显著降低。
实施例4
靶向sox2的合成多肽药物用于食管鳞癌治疗侵袭分析,包括以下步骤:
1)消化kyse450细胞,离心后计数,每个小室接种1×104个细胞
2)将matrigel处理过的小室插入培养的24孔板中,下室为20vol%fbs的rpmi1640培养基;
3)接种后的第二天,使用含有0.02μg/μl浓度化学合成多肽peptide42和对照添加至上室细胞培养基中;
4)在细胞培养箱内培养48h后进行细胞固定和结晶紫染色;
5)吸去小室内部培养基,用棉签刮掉内部未迁移的细胞;
6)小室浸入pbs中把残余培养基洗净后放置到4%paf液中固定15min;
7)pbs洗两次,然后转移小室浸入到1%结晶紫水溶液中,室温染色30min;
8)用水把表面残留的结晶紫晾干,小室放置到载玻片上,倒置显微镜下拍照观察(图4a所示);
9)对每组4个重复进行细胞计数后经graphpadprism5软件统计分析(图4b所示)。每个实验重复三次,采用方差统计t检验。由图可知,与对照相比,添加了多肽药物peptide42后,细胞的侵袭能力显著降低。
实施例5
靶向结合sox2的多肽药物用于食管鳞癌治疗体内成瘤能力分析,包括以下步骤:
1)用胰酶消化处于对数生长期的kyse450细胞,用完全培养液收集细胞到15ml离心管(培养皿用pbs洗1-2次以充分收集细胞)。用pbs清洗细胞3次,用无血清培养基和matrigel体积比为1:1的混合液重悬细胞,细胞浓度为2.5×107个/ml。
2)在裸鼠的背部双侧皮下注射0.2ml细胞悬液,裸鼠为4周龄雄性。
3)密切观察裸鼠的成瘤情况。在小鼠体内形成肉眼可见的肿瘤时(注射细胞1周后),每隔一天往肿瘤体内注射100μl0.04μg/μl多肽药物peptide42和对照,共注射10次(图5a所示)。
4)四周后处死裸鼠;取出皮下肿瘤,拍照、称重(图5b所示),并将各组重量进行统计学分析(图5c所示)。由图可知,与对照相比,注射了多肽药物peptide42后,细胞的体内成瘤能力显著降低。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
sequencelisting
<110>中国人民解放军南京军区福州总医院
<120>靶向结合sox2蛋白的多肽药物的合成及应用
<130>2
<160>2
<170>patentinversion3.3
<210>1
<211>40
<212>prt
<213>peptide42
<400>1
thralametargalatyrglyarglyslysargargglnargargarg
151015
cysglyprovaltrppheserthrleuphepheproleuphepheleu
202530
ileserleualaargglyprocys
3540
<210>2
<211>29
<212>prt
<213>人工序列
<400>2
thralametargalatyrglyarglyslysargargglnargargarg
151015
cysglyprovaltrpileserleualaargglyprocys
2025
- 还没有人留言评论。精彩留言会获得点赞!