一种基因重组高活性血清淀粉样蛋白SAA抗原的制备工艺的制作方法
本发明属于生物工程技术领域,尤其涉及一种基因重组高活性血清淀粉样蛋白saa抗原的制备工艺。
背景技术:
血清淀粉样蛋白saa是组织淀粉样蛋白a的前体物质,与c反应蛋白(crp)相似,是一种由肝脏细胞产生的急性时相反应蛋白。在正常人的血清中saa以恒量存在,但在炎症或感染急性期的48~72h内saa可增加数百至上千倍,并且在疾病的恢复期迅速下降,是一种比crp更灵敏的诊断细菌或病毒感染的标志物。
saa是apr期间大量产生的主要急性期蛋白质。目前,saa浓度的升高已成为炎症的临床标志物。saa可以激活包括清道夫受体sr-bi、atp受体p2x7等多种受体。
一般来说,高密度脂蛋白(hdls)被认为是抗动脉粥样硬化的。在研究hdl蛋白质组成的实验中发现,急性期蛋白血清淀粉样蛋白a(saa)可能掺入到hdl颗粒中。有研究表明saa是心血管死亡率的强有力标志物。一项前瞻性研究发现,血清saa是排斥反应过程中最早升高的指标之一。saa还可以作为监测肝移植早期排斥反应、肾移植排斥反应和急性移植物抗宿主反应的敏感标志物,因此,随着人们对saa研究的不断加深,致使其在心血管疾病的诊断上会有广阔的前景。
大肠杆菌作为优良基因工程菌,生长周期短,生产成本低,转化率高并且可以高表达目的蛋白,其表达水平远远高于其他表达系统。实现产品的产业化与成熟的重组产品的纯化工艺是息息相关,因此实现基因工程技术和蛋白工艺的有机结合,无疑会为重组高活性产品实现大规模生产奠定基础。
技术实现要素:
针对上述存在的问题,本发明提供一种基因重组高活性血清淀粉样蛋白saa抗原的制备工艺,这种制备工艺可大幅提高重组血清淀粉样蛋白saa抗原的产量和活性。
本发明采用的技术方案如下:
一种基因重组高活性血清淀粉样蛋白saa抗原的制备工艺,包括以下步骤:
1)对saa基因片段进行密码子优化,得优化saa基因片段;
2)含saa的表达质粒和含saa的表达菌株的构建:将所述优化saa基因片段连接到表达质粒上,得含saa的表达质粒;然后将含saa的表达质粒转入表达菌株中,得含saa的表达菌株即基因重组saa;
3)基因重组saa的发酵:将含saa的表达菌株在37℃的发酵培养基中培养至od600=2~3,然后加入iptg诱导培养,得发酵液;
4)细胞的收集及裂解:将所述发酵液进行离心后收集菌体,然后按质量体积比为1:10~15加入裂解缓冲液,随后利用高压均质机在4℃下将细胞裂解、离心,收集上清液;
5)saa的纯化:将所述上清液和亲和层析填料孵育60~80min,然后进行亲和层析纯化,得到融合sumo标签的saa,然后利用sumo蛋白酶酶切融合sumo标签的saa,再次亲和层析纯化回收,得到基因重组高活性血清淀粉样蛋白saa抗原。
进一步地,所述步骤1)中所述的密码子优化采用德泰生物开发的密码子优化软件maxcodontmoptimizationprogramv13。
进一步地,所述步骤2)中所述表达质粒为psumo。
进一步地,所述步骤2)中所述表达菌株为大肠杆菌e.colibl21(de3)。
进一步地,所述步骤3)中所述发酵培养基为tb培养基,所述的培养的条件为:转速200~300rpm,罐压为0.03~0.05mpa,初始通气量为3l/min,通过调节通气量维持do在25%~40%;所述iptg终浓度为0.1~0.5mmol/l。
进一步地,所述步骤4)中所述的裂解缓冲液包括1×pbs、0.5%~2%的tritonx-100、1~2mmol/ldtt、0.2~0.6mmol/lpmsf和20~30mmol/limidazole。
进一步地,所述步骤4)中所述的高压均质机的均质压力为700~900mpa。
进一步地,所述步骤5)中所述亲和层析所用填料为ni-ida,所述亲和层析所用平衡缓冲液为1×pbs和20~50mmol/limidazole。
进一步地,所述步骤5)中所述酶切的温度为4~30℃,酶切的时间为1~3h;所述融合sumo标签的saa与sumo蛋白酶的质量比为1:400~800。
进一步地,所述步骤5)中所述回收所用填料为ni-ida,所述回收的孵育时间30~60min,回收所用平衡缓冲液为1×pbs。
本发明的有益效果是:本发明采用的宿主菌大肠杆菌生长周期短,生产成本低,转化率高并且可以高表达目的蛋白,其表达水平远远高于其他表达系统,为重组高活性产品实现大规模生产奠定基础。
(1)利用德泰生物开发的密码子优化软件maxcodontmoptimizationprogramv13对saa蛋白基因进行优化,使其利于大肠杆菌高效表达,得基因重组saa,将基因重组saa经过高温培养和诱导,使saa蛋白以有活性的上清形式表达,避免了以无活性包涵体形式存在;由于选择特殊的酶切位点使得在纯化阶段通过亲和层析纯化融合蛋白,提高了最终saa蛋白的纯度和发酵产物得率,易于后续酶切合回收操作;后期经过sumo蛋白酶酶切融合sumo标签的saa,得到高活性的重组saa蛋白。
(2)本发明采用在高温37℃培养至对数生长期是降低温度到25℃开始诱导,这样可以让蛋白表达在上清,在不损失表达量的同时保证了蛋白的活性和产量,在破碎过程选择高压均质机破碎,由于其可以低温控制,保持蛋白稳定结构,并且破碎率良好,处理量大。因此整个生产工艺简单、高效快速,生产成本低。
附图说明
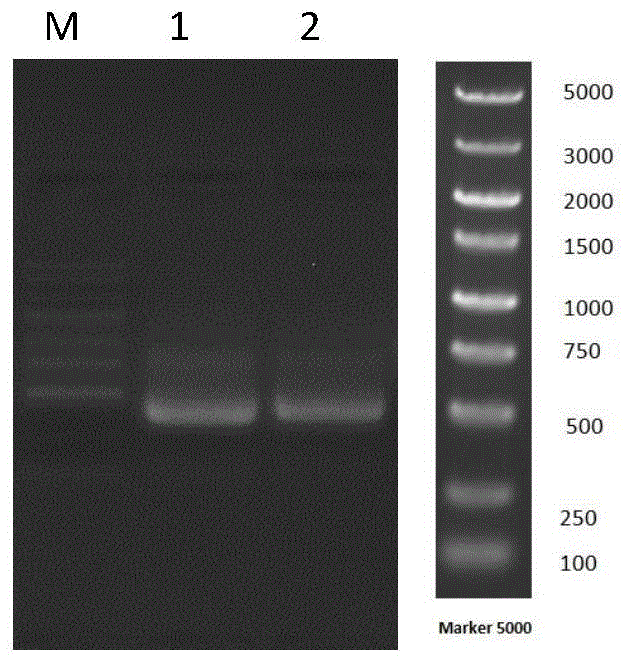
图1pcr产物琼脂糖凝胶电泳图。
图2saa蛋白在bl21(de3)表达情况图。
图3saa蛋白纯化图。
图4saa蛋白酶切回收图。
图5saa蛋白质检图。
图6测定saa蛋白浓度的标准曲线。
具体实施方式
本发明的实施方式为:
一种基因重组高活性血清淀粉样蛋白saa抗原的制备工艺,包括以下步骤:
1)对saa基因片段进行密码子优化,得优化saa基因片段;
2)含saa的表达质粒和含saa的表达菌株的构建:将所述优化saa基因片段连接到表达质粒上,得含saa的表达质粒;然后将含saa的表达质粒转入表达菌株中,得含saa的表达菌株即基因重组saa;
3)基因重组saa的发酵:将含saa的表达菌株在37℃的发酵培养基中培养至od600=2~3,然后加入iptg诱导培养,得发酵液;
4)细胞的收集及裂解:将所述发酵液进行离心后收集菌体,然后按质量体积比为1:10~15加入裂解缓冲液,随后利用高压均质机在4℃下将细胞裂解、离心,收集上清液;
5)saa的纯化:将所述上清液和亲和层析填料孵育60~80min,然后进行亲和层析纯化,得到融合sumo标签的saa,然后利用sumo蛋白酶酶切融合sumo标签的saa,再次亲和层析纯化回收,得到基因重组高活性血清淀粉样蛋白saa抗原。
进一步地,所述步骤1)中所述的密码子优化采用德泰生物开发的密码子优化软件maxcodontmoptimizationprogramv13。
进一步地,所述步骤2)中所述表达质粒为psumo。
进一步地,所述步骤2)中所述表达菌株为大肠杆菌e.colibl21(de3)。
进一步地,所述步骤3)中所述发酵培养基为tb培养基,所述的培养的条件为:转速200~300rpm,罐压为0.03~0.05mpa,初始通气量为3l/min,通过调节通气量维持do在25%~40%;所述iptg终浓度为0.1~0.5mmol/l。
进一步地,所述步骤4)中所述的裂解缓冲液包括1×pbs、0.5%~2%的tritonx-100、1~2mmol/ldtt、0.2~0.6mmol/lpmsf和20~30mmol/limidazole。
进一步地,所述步骤4)中所述的高压均质机的均质压力为700~900mpa。
进一步地,所述步骤5)中所述亲和层析所用填料为ni-ida,所述亲和层析所用平衡缓冲液为1×pbs和20~50mmol/limidazole。
进一步地,所述步骤5)中所述酶切的温度为4~30℃,酶切的时间为1~3h;所述融合sumo标签的saa与sumo蛋白酶的质量比为1:400~800。
进一步地,所述步骤5)中所述回收所用填料为ni-ida,所述回收的孵育时间30~60min,回收所用平衡缓冲液为1×pbs。
在本发明所列的技术方案范围内,本发明均可以实施包括端点值,这样会产生无数实施例,在此不再赘述,以下所列只是本发明的较优实施例,并不限于本发明的保护范围。
实施例1
1、基因重组saa的构建
以人的saa氨基酸序列,采用德泰生物最新开发的密码子优化软件maxcodontmoptimizationprogramv13对saa基因片段进行密码子优化得到cdna序列,根据目标cdna序列合成引物,利用pcr技术融合得到全长序列;
引物具体是:
primer1
aactttaagaaggagatatacatatgcatcatcatcaccaccaccgcagctttttcagctttctgggcgaag
primer2
tggtgctcgagtgcggccgcaagctttcattaatatttttccggcagaccagccggacgaaagtgattcggatc
2、以saa的cdna基因片段为模板,pcr扩增目的基因片段,反应条件为:95℃,5min;(95℃30s,60℃60s,72℃45s,25个循环);72℃,10min。纯化扩增出的saa基因和表达质粒psumo分别用stui和hindiii双酶切、连接并转化至bl21(de3)感受态细胞,通过热击将重组质粒导入大肠杆菌bl21(de3)中,得含saa的表达菌株。
3、将步骤2含saa的表达菌株加入300ullb培养基,于37℃恒温培养4h后取80μl均匀涂布到加入50ug/ml的卡那霉素平板培养基上,在37℃下培养12~24小时,即可获得重组saa大肠杆菌。
实施例2
重组saa大肠杆菌的发酵调控
将实施例1获得的重组菌株的平板上挑取单克隆接种在含lb培养基中37℃培养16h作为种液,种子液以1%接种量接种于含有3ltb培养液(含50ug/ml的硫酸卡那霉素,蛋白胨12g/l,甘油5g/l,k2hpo4·3h2o15.2g/l,酵母膏24g/l,kh2po42.33g/l),5l发酵罐中37℃培养,转速设为200rpm,罐压0.03mpa,初始通气量为3l/min,通过调节通气量维持do为25%,当菌浓度od600达到2时开始降温至25℃,加入终浓度为0.2mmiptg诱导培养6h后终止发酵,离心后收集菌体,最终获得湿菌体为20.7g/l。
实施例3
重组saa蛋白的纯化
细胞破碎:取发酵后离心收集的菌体10g加入15倍体积(150ml)的1×pbs,ph7.4,20mmimidazole,1%tritonx-100,1mmdtt,0.2mmpmsf混匀后,缓慢流加到高压均质机中,压力控制在700mpa,循环两次后将匀浆液在12500rpm,4℃离心15min,弃沉淀保留上清;
ni-ida平衡:取5mlni-ida填料,用10倍柱体积平衡缓冲液1×pbs,ph7.4,20mmimidazole平衡填料;
孵育:将填料与柱子混合,在4℃条件下孵育60min;
纯化:孵育结束,利用重力管和蠕动泵将填料和未结合杂蛋白分离,然后分别利用buffer1:1×pbs,ph7.4,20mmimidazole除杂,buffer2:1×pbs,ph7.4,50mmimidazole洗脱,buffer3:1×pbs,ph7.4,500mmimidazole洗脱,收集每个洗脱组分利用sds-page检测,最终得到的融合sumo标签的saa蛋白。
实施例4
无标签saa蛋白的酶切和回收
融合蛋白的酶切:收集纯化得到的融合蛋白,按1:20(体积比)透析至5l的pbs,ph7.4中4h,然后按照1:400(质量比)向透析结束后的蛋白中加入sumo蛋白酶,在20℃条件下酶切2h,酶切结束将混合液12500rpm离心15min取上清进行回收;
ni-ida平衡:取2mlni-ida填料,用10倍柱体积平衡缓冲液1×pbs,ph7.4平衡填料;
孵育:将填料与柱子混合,在4℃条件下孵育40min;
纯化:孵育结束,利用重力管和蠕动泵将填料和未结合杂蛋白分离,收集流穿液,利用sds-page检测,最终得到的无标签saa蛋白,蛋白纯度达到95%以上。
对所得saa重组蛋白进行相关性能测试:
图1为pcr产物琼脂糖凝胶电泳图,lane1、2是pcr产物,lanem是dnamarker。
图2为saa蛋白在bl21(de3)表达情况,lanem:sds-pageproteinmarker,lane1:对照(不加iptg),lane2:saa蛋白在25℃诱导6h的表达情况。
图3为saa蛋白纯化图,lanem:sds-pageproteinmarker,lane1:全菌破菌离心后上清,lane2:上清同ni-ida孵育后流出液,lane3-13:saa蛋白洗脱组分。
图4为saa蛋白酶切回收图,lanem:sds-pageproteinmarker,lane1:saa融合蛋白,lane2:酶切2h离心后上清,lane3:上清混合同ni-ida孵育后流出液,lane4:洗脱组分。
图5为saa蛋白质检图,lanem:sds-pageproteinmarker,lane1:bsa,lane2:saaprotein。
saa重组蛋白的浓度和活性鉴定
测定saa蛋白浓度采用bca蛋白浓度测定试剂盒。其标准曲线如附图6所示。稀释五倍测得其od=0.521,最终换算浓度为1.37mg/ml,由此得到最终酶切后无签saa蛋白的得率为50-60mg/l,产量高。
利用间接elisa法比对本发明得到的重组saa蛋白与天然saa蛋白活性,在相同抗体检测情况下:本实验抗原板包被浓度为1ug/ml(即每孔包被10ng抗原),一抗为免疫saa小鼠全血血清,使用1*pbs进行稀释,1:1000稀释后三倍连续稀释进行检测,二抗为羊抗鼠二抗,使用1*pbs进行稀释,稀释比例1:250000,阴性对照为1*pbs。每组设置两个平行样,分别为包被重组saa蛋白-1、包被重组saa蛋白-2、包被天然saa蛋白-1、包被天然saa蛋白-2,结果如下表1所示,在相同抗体检测情况下,本发明得到的重组saa蛋白效价已与天然saa蛋白效价接近,说明重组saa蛋白活性强。
表1活性对比
本发明并不局限于前述的具体实施方式。本发明扩展到任何在本说明书中披露的新特征或任何新的组合,以及披露的任一新的方法或过程的步骤或任何新的组合。
- 还没有人留言评论。精彩留言会获得点赞!