本发明属于植物基因工程技术领域,涉及桃多肽激素合成基因pprgf1及其应用。
背景技术:
溶质型桃(meltingflesh,mf)果实是呼吸跃变型果实,在乙烯的作用下,果实迅速软化,达到商品成熟。硬质型桃(stonyhard,sh)果实在成熟过程中不释放乙烯,在完全转色,并且积累高浓度糖的情况下,无论留树和采收都不软化。研究发现sh桃乙烯合成受阻是由于乙烯合成关键基因acs1的表达始终处于较低水平,而mf桃果实acs1基因的表达随着果实的成熟迅猛上升。进一步研究发现在mf桃中,生长素诱导acs1基因表达,进而诱导乙烯合成,造成果实软化。生长素和乙烯共同调控桃果实的成熟软化,然而生长素和乙烯之间的互作机制尚不清楚,研究发现一种编码类似于golven多肽激素的桃基因ctg134对果实的成熟起着调控作用,该基因在桃果实成熟期的中果皮中获得,在呼吸跃变期表达,在桃果实成熟过程中上调表达,同时该基因响应naa和1-mcp处理,暗示着glv在生长素和乙烯之间可能起着中间的调控作用。
技术实现要素:
本发明的目的之一在于提供桃多肽激素合成基因pprgf1及其所编码的蛋白。
本发明的目的之二在于提供桃多肽激素合成基因pprgf1的重组载体。
本发明的目的之三在于提供桃多肽激素合成基因pprgf1及其所编码的蛋白、重组载体在番茄育种中的应用,具体涉及在促进番茄果实成熟方面的应用。
为实现上述目的,本发明采用以下技术方案:
本发明提供桃多肽激素合成基因pprgf1,其序列如seqidno:1所示。
本发明还提供桃多肽激素合成基因pprgf1编码的蛋白,其氨基酸序列如seqidno:2所示。
本发明还提供包含所述桃多肽激素合成基因pprgf1的重组载体。
优选地,所述重组载体为农杆菌表达载体。
本发明还提供桃多肽激素合成基因pprgf1、桃多肽激素合成基因pprgf1编码的蛋白及桃多肽激素合成基因pprgf1的重组载体在番茄育种中的应用。
优选地,所述番茄育种促进番茄果实成熟。
优选地,所述番茄育种包括以下步骤:
a:构建含有所述的桃多肽激素合成基因pprgf1的重组载体;
b:将所构建的重组载体转化到番茄组织或细胞中;
c:培育筛选得到转基因番茄。
相比现有技术,本发明的有益效果在于:
1、本发明通过克隆桃多肽激素glv基因家族成员得到pprgf1,并分析了该基因在溶质型桃果实成熟过程中的表达模式,最后用农杆菌介导的方法转入micro-tom番茄中验证目的基因的功能,有利于从分子机制上阐明在桃成熟过程中的激素信号的响应机制,对进一步实现桃有目的、有针对性的品质和性状改良,培育桃新品种具有积极的指导作用。
2、相对于其它转基因引起植物表型的局部改变,如叶片形态或花结构单方面改变,或根系长度及侧根数目的变化,以及果实大小或果皮厚度的改变,pprgf1基因在果实发育过程中促进乙烯与成熟相关基因的表达刺激乙烯释放,从而促进果实的成熟。
附图说明
图1桃多肽激素合成基因pprgf1的pcr扩增电泳图,图中-表示阴性对照,+表示阳性对照,图中左侧条带的m为dl2000marker,基因pprgf1基因片段大小为489bp。
图2桃pprgf1与拟南芥atglv氨基酸多序列比对。
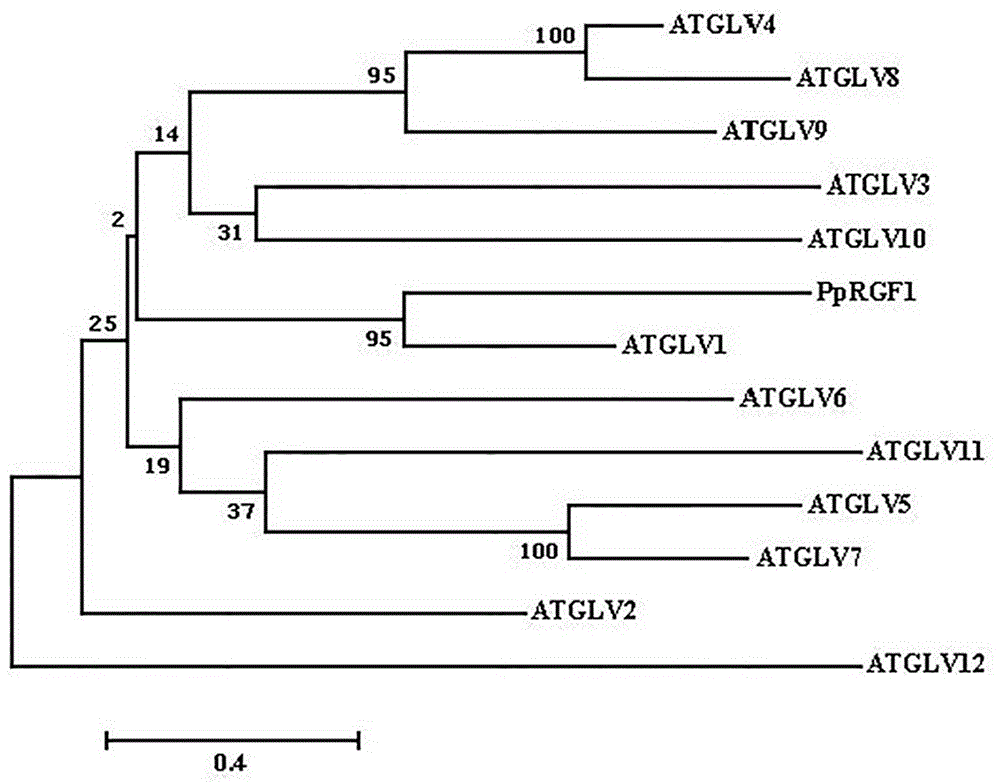
图3桃pprgf1与拟南芥atglv进化树。
图4桃多肽激素合成基因pprgf1在cn13发育期不同组织中的相对表达量。
图5桃多肽激素合成基因pprgf1在cn13和cn16果实成熟期的相对表达量。
图6野生型番茄和转基因型番茄果实在不同发育期的观察图。
图7野生型番茄和转基因型番茄果实在不同成熟期的乙烯释放量变化比较。
图8野生型番茄和转基因型番茄果实在不同发育期的硬度变化比较。
图9野生型番茄和转基因型番茄果实不同时期的野生型番茄和转基因型番茄果实不同时期的乙烯合成与信号转导相关基因及成熟相关基因的定量分析。
图10野生型番茄和转基因型番茄果实的采后形态比较。
附图中,gr表示绿熟期,b表示转色期,b+3表示转色后2天,b+6表示转色后6天,r表示果实成熟期,s1表示果实第一次指数生长时期,s2表示果实果核硬化起始期,s3表示果实第二次指数生长时期,s4i表示果实跃变前期,s4ii表示果实跃变期,s4iii表示果实跃变后期。
具体实施方式
以下实施例用于说明本发明,但不用来限定本发明的保护范围。若未特别指明,实施例中所用技术手段为本领域技术人员所熟知的常规手段。下述实施例中的试验方法,如无特别说明,均为常规方法。
本发明中溶质型品种‘中油桃13号’(cn13)和硬质型品种‘中油桃16号’(cn16)由中国农业科学院郑州果树研究所桃育种圃提供。
实施例一桃多肽激素合成基因pprgf1的分离和鉴定
试验方法
1、基因pprgf1的分离
利用植物多糖多酚试剂盒(dp441,天根生化科技(北京)有限公司)提取桃果肉rna,通过反转录试剂盒(天根生化科技(北京)有限公司)获得单链cdna,以单链cdna为模版,以下述序列为引物,通过pcr(试剂盒faststartsybrgreenmaster购于罗氏生物科技有限公司)获得基因pprgf1的全长序列,pcr扩增电泳图如图1所示。基因pprgf1的全长序列如序列表中seqidno:1所示,共489bp,共编码蛋白的氨基酸序列如序列表中seqidno:2所示,共162个。桃pprgf1与拟南芥atglv家族氨基酸序列进行多序列比对以及绘制进化树,结果如图2和图3所示。
从图2可以看出,桃pprgf1与拟南芥atglv家族蛋白均含有13个氨基酸组成的保守的c-末端基序。
从图3可以看出,桃pprgf1与atglv1的进化关系最近。
引物序列为:
正向pprgf1-f:5'-atgtcttccattgttcttct-3';
反向pprgf1-r:5'-ctaggactttctattgtgaa-3'。pcr的退火温度为58℃。
2、基因pprgf1的表达分析
荧光定量pcr操作步骤:采用多糖多酚rna提取试剂盒sk8662(生工,上海)提取根、茎、叶、花和不同发育时期桃果实的总rna,采用反转录试剂盒kr106(天根,北京)合成cdna,并以此为模板,使用lignt-cycler480ⅱ荧光定量仪进行qrt-pcr检测,采用sybrgreenⅰmaster(roche,瑞士)进行扩增反应。
反应总体积15ul,包括100ngcdna(1µl),2×lightcycler480sybrgreenimaster(7.5µl),0.5µmol·l-1上、下游引物(各0.75µl)和无rna酶水(5µl)。
反应程序:95℃预变性,5min;95℃变性30s,60℃退火30s,72℃延伸30s,共45个循环。每个样品3次重复。采用primerexpress3.0分别对各个转录本序列的设计特异性引物。
定量引物序列为:
正向qpprgf1-f:5'-tcttccaataggagcagcact-3';
反向qpprgf1-r:5'-catttgtgctttagtaagacgg-3'。
采用qrt-pcr检测pprgf1基因在溶质型‘中油桃13号’(cn13)不同组织以及溶质型‘中油桃13号’(cn13)和硬质型‘中油桃16号’(cn16)不同发育期的表达情况。两个品种(cn13和cn16)的四个采样时间点均为s1时期、s2时期、s3时期、s4i时期、s4ii时期和s4iii时期。选取actin(ppa007242m)作为内参基因(brandietal.,2011),用2--δδct公式计算基因相对表达量(livakandschmittgen,2001),结果如图4和图5所示。
从图4可以看出,基因pprgf1在cn13的根、茎、叶、花和果实不同组织中均有表达,其中在茎和果实中表达量最高。
从图5可以看出,通过对溶质型(cn13)和硬质型(cn16)桃果实不同发育期pprgf1基因的表达比较发现,果实成熟期pprgf1在溶质型(cn13)的表达明显高于硬质型(cn16),同时随着果实的成熟表达上调,而硬质型(cn16)的表达几乎检测不到。
3、pprgf1基因的功能鉴定试验
为研究pprgf1基因是否参与到桃成熟过程中的生长素与乙烯信号途径中发挥作用,通过转基因番茄来分析鉴定其功能。
3.1构建重组载体
将pcr获得的目的片段通过ptopo-blunt载体克隆,然后用一步克隆试剂盒(vazyme,南京诺唯赞生物科技有限公司)连接到com-ph2gw7.0载体上。引物分别如下:
g-pprgf1-f:5'-aaaaagcaggcttcatgtcttccattgttcttct-3';
g-pprgf1-r:5'-agaaagctgggtcctaggactttctattgtgaa-3'。
检测阳性克隆。然后将阳性克隆送至上海生工生物科技股份有限公司测序。
3.2转基因番茄阳性株的筛选
鉴于桃尚未建立高效、成熟的遗传转化体系,故采用模式植物micro-tom番茄用于pprgf1基因的功能验证,番茄转化方法参照sunetal(2006),beelynnchewandyupan(诺丁汉大学)优化。micro-tom番茄种子用75%酒精表面消毒,无菌水漂洗3次后,10%次氯酸钠消毒1h。取出后在无菌水中清洗6次,滤纸上晾干。种子播种于ph=5.9,含有0.8%琼脂的1/2ms培养基中。植物在14h/10h光暗,25℃,80%相对湿度、250μmolm-2s-1光强的组培室中培养。
提取经过测序的pprgf1-com-ph2gw7.0载体的质粒,液氮冻融法转入农杆菌gv3101中。调整农杆菌菌液浓度od至0.5,用叶盘法浸染转化micro-tom番茄,并在生根培养基上分化叶和根。待长成小苗后,提取dna,常规pcr鉴定阳性植株。收获t0代种子后,在含有卡纳霉素的1/2ms培养基上筛选阳性植株。转基因阳性植株含有抗生素基因,在含有抗生素的培养基上长出真叶和主根后移栽到土壤中培养并收获t1代种子。t1代种子播下后,利用t2代转基因番茄观察与野生型的差别。以下实验均利用t2代及后代纯合系。
pcr分子鉴定阳性植株引物:
com-ph2gw7.0f:5'-ttggagaggactccggtatt-3';
com-adapterattb2:5'-ggggaccactttgtacaagaaagctgggt-3'。
用于证实片段插入。
选取3个表达量高的转pprgf1基因株系(pprgf1-6,pprgf1-8,pprgf1-15)作为代表株系与野生型进行比较。
实施例二基因pprgf1在转基因型番茄中的作用
2.1基因pprgf1对番茄果实发育的影响
图6为野生型番茄和转基因型番茄果实在不同发育期的观察图。从图6可以看出,转基因番茄在盛花后41d开始转色,野生型番茄在盛花后45d开始转色,即转基因番茄较野生型番茄提早成熟4d左右,此外,转基因番茄与野生型番茄在成熟期的颜色相同。
2.3基因pprgf1对番茄果实硬度和乙烯释放量的影响
对转基因与野生型番茄果实花后不同天数(37dpa、41dpa、45dpa、50dpa、53dpa、59dpa)的乙烯进行测定。图7为野生型番茄和转基因型番茄果实在不同成熟期的乙烯释放量变化比较。从图7可以看出,野生型与转基因番茄的乙烯释放量均呈现先升高后降低的趋势;与野生型番茄相比,转基因番茄释放量较高,且乙烯释放高峰出现的时间较早。
图8为野生型番茄和转基因型番茄果实在不同发育期的硬度变化比较。从图8可以看出,在番茄果实成熟过程中硬度逐渐降低,并且转基因番茄硬度较野生型番茄硬度低。
2.4基因pprgf1对番茄果实成熟的调控机制
为了进一步研究pprgf1基因对果实成熟的调节机制,本发明运用qrt-pcr技术鉴定了乙烯合成与信号转导相关基因(如aco1和acs4)、成熟相关基因(如e4、e8、rin和cnr等)在果实不同发育期的表达情况。
图9为野生型番茄和转基因型番茄果实不同时期的乙烯合成与信号转导相关基因及成熟相关基因的定量分析。从图9可以看出,野生型与转基因番茄在发育过程中乙烯合成与信号转导相关基因aco1和acs4以及成熟相关基因e4、e8的表达趋势与乙烯释放趋势相同,并且转基因番茄乙烯释放高峰较野生型番茄出现早;而在果实成熟期,成熟相关基因e4、e8、rin、cnr的表达水平显示其在转基因果实中的表达水平显著高于野生型番茄果实。据此可以说明转基因番茄促进乙烯与成熟相关基因的表达,在果实发育过程中刺激乙烯的释放,从而促进果实的成熟。
2.5基因pprgf1对番茄果实皱缩衰老情况的影响
图10为野生型番茄和转基因型番茄果实的采后形态比较。从图10可以看出,在室温放置14d后转基因番茄果实开始皱缩,野生型番茄果实不皱缩;因此,与野生型番茄果实相比,转基因加速了番茄的失水皱缩,不利于采后贮藏。
以上所述之实施例,只是本发明的较佳实施例而已,仅仅用以解释本发明,并非限制本发明实施范围,对于本技术领域的技术人员来说,当然可根据本说明书中所公开的技术内容,通过置换或改变的方式轻易做出其它的实施方式,故凡在本发明的原理上所作的变化和改进等,均应包括于本发明申请专利范围内。
sequencelisting
<110>中国农业科学院郑州果树研究所
<120>桃多肽激素合成基因pprgf1及其应用
<130>2019
<160>10
<170>patentinversion3.3
<210>1
<211>489
<212>dna
<213>pprgf1
<400>1
atgtcttccattgttcttctcttttttctttgtctttctatccatgcatgcaattcccga60
cttctaggccttgttgataagcaaagtggcagtaaatcctaccattctgttgaggatgta120
gcgaaagtcttaagtgagactttaaagtcatcgatgatgcctaccatctcagttgaatac180
caagcacaacaaataaacgctgaaacattcacccatgaaagtatcccgacggctcttttg240
aggaaacaagggcatgccaatggaccagcctcaggatatgatattattgcattatcttcc300
caggttgagctgaagaaattgattgaaatgcagggattgaagaggcaggcacggacatta360
ctgggatctgcaacacataacatggaggaagacaaagattcgaaggaagatgaagctatt420
gaggtcgtaggtgttatggattatgcacaacctcacaggaagccacccattcacaataga480
aagtcctag489
<210>2
<211>162
<212>prt
<213>pprgf1编码的蛋白
<400>2
metserserilevalleuleuphepheleucysleuserilehisala
151015
cysasnserargleuleuglyleuvalasplysglnserglyserlys
202530
sertyrhisservalgluaspvalalalysvalleusergluthrleu
354045
lyssersermetmetprothrileservalglutyrglnalaglngln
505560
ileasnalagluthrphethrhisgluserileprothralaleuleu
65707580
arglysglnglyhisalaasnglyproalaserglytyraspileile
859095
alaleuserserglnvalgluleulyslysleuileglumetglngly
100105110
leulysargglnalaargthrleuleuglyseralathrhisasnmet
115120125
glugluasplysaspserlysgluaspglualailegluvalvalgly
130135140
valmetasptyralaglnprohisarglysproproilehisasnarg
145150155160
lysser
<210>3
<211>20
<212>dna
<213>正向pprgf1-f
<400>3
atgtcttccattgttcttct20
<210>4
<211>20
<212>dna
<213>反向pprgf1-r
<400>4
ctaggactttctattgtgaa20
<210>5
<211>21
<212>dna
<213>正向qpprgf1-f
<400>5
tcttccaataggagcagcact21
<210>6
<211>22
<212>dna
<213>反向qpprgf1-r
<400>6
catttgtgctttagtaagacgg22
<210>7
<211>34
<212>dna
<213>g-pprgf1-f
<400>7
aaaaagcaggcttcatgtcttccattgttcttct34
<210>8
<211>33
<212>dna
<213>g-pprgf1-r
<400>8
agaaagctgggtcctaggactttctattgtgaa33
<210>9
<211>20
<212>dna
<213>com-ph2gw7.0f
<400>9
ttggagaggactccggtatt20
<210>10
<211>29
<212>dna
<213>com-adapterattb2
<400>10
ggggaccactttgtacaagaaagctgggt29