大肠杆菌(Escherichiacoli)LHM10-1菌株及其应用的制作方法
本发明属于环境污染物生物处理技术领域,具体涉及大肠杆菌(escherichiacoli)lhm10-1菌株及其在降解四环素族抗生素中的应用。
技术背景
四环素类抗生素是一类广谱抗生素,包括四环素、土霉素、金霉素、多西环素、米诺环素、替加环素和伊拉瓦环素等,被广泛应用于人和动物细菌感染性疾病的治疗以及动物促生长。目前,四环素类抗生素是我国使用量最大的抗生素之一,2013年的使用量已高达12000吨(qian-qianzhang等,2015,environmentalscience&technology)。但由于这类药物吸收率较低,大量四环素类抗生素以母体或活性代谢物的形式存在于环境当中。研究表明中国北方畜禽粪便中的残留量为3326.6±12302.6μg/kg,而被粪便所污染的土壤当中最高也达到10967.1μg/kg(jiehou等,2015,environscipollutres)。鉴于四环素类药物的密集使用,它所造成的环境污染问题也日益严重,并且为环境中的耐药菌和耐药基因的传播提供温床,严重威胁人类健康。四环素类药物的残留问题亟待解决。
当前,解决环境中蓄积四环素类抗生素的途径主要包括非生物降解和生物降解两种(李伟明等,2012,应用生态学报)。非生物降解包括光降解、水解和氧化降解,但作用效果相对有限且过程缓慢。生物降解包括植物降解和微生物降解,但植物降解多集中在用某一植物来修复特定污染的环境,对于多种抗生素所引起的复合污染的降解能力尚待研究。而微生物降解四环素类药物的报道相对较少但效果显著,例如栖木槿假单胞菌dt1在72小时内能够降解83.21%的四环素(专利公开号:cn104403965a)和苍白杆菌属细菌kss10在96小时内降解63.33%的土霉素(sichengshao等,2019,ecotoxicologyandenvironmentalsafety),目前四环素降解效率仍然不能满足解决日益严重的环境污染问题。
技术实现要素:
本发明的目的在于克服现有技术中的问题,提供了大肠杆菌(escherichiacoli)lhm10-1菌株。
本发明的另一个目的在于提供一种大肠杆菌lhm10-1菌株在降解四环素族抗生素中的应用。
本发明的目的通过以下技术方案予以实现:
一株大肠杆菌(escherichiacoli)lhm10-1菌株,所述大肠杆菌lhm10-1菌株于2019年3月28日保藏于广东省微生物菌种保藏中心(gdmcc),保藏编号为gdmccno:60622。
本发明同时保护所述大肠杆菌(escherichiacoli)lhm10-1在制备降解四环素族抗生素的生物制剂中的应用。
进一步地,所述四环素族抗生素为四环素、金霉素、土霉素、多西环素、米诺环素、替加环素、伊拉瓦环素中的一种或多种。
本发明同时提供所述大肠杆菌(escherichiacoli)lhm10-1检测四环素族抗生素的方法,包括如下步骤:
s1:将所述的大肠杆菌(escherichiacoli)lhm10-1进行培养,得到培养液;
s2:将s1中培养液加入到待处理样品中进行降解处理。
进一步地,s2中培养液和待处理样品的体积比为0.01~0.001:1。
与现有技术相比本发明具有以下技术效果:
本发明发现了一株新的大肠杆菌lhm10-1菌株,其对四环素族抗生素具有良好的降解作用。本发明提供的大肠杆菌lhm10-1能够在16小时后降解83.91%的四环素和92.24%的伊拉瓦环素,为四环素类药物的残留问题提供了安全、高效和环保的解决途径。
附图说明
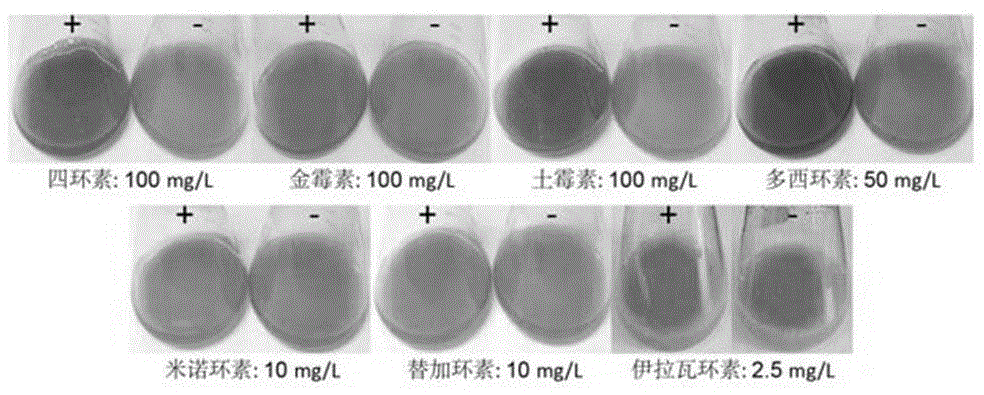
图1四环素类药物变色实验结果;
图2大肠杆菌lhm10-1对四环素降解水平的lc-ms/ms测定结果;
图3大肠杆菌lhm10-1对伊拉瓦环素降解水平的lc-ms/ms测定结果。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面结合具体实施例对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
实施例1
一株大肠杆菌(escherichiacoli)lhm10-1。上述大肠杆菌(escherichiacoli)lhm10-1菌株于2019年3月28日保藏于广东省微生物菌种保藏中心(gdmcc),保藏编号为gdmccno:60622。保藏地址为:广东省广州市先烈中路100号大院59号楼5楼。
上述大肠杆菌lhm10-1的分离和纯化
2017年7月,从江西省樟树市某猪场采集一份猪粪样品,并称取0.1g新鲜样品加入到1ml0.9%的生理盐水,涡旋混匀。吸取20μl混悬液至4ml肠道菌增菌肉汤(广东环凯微生物科技有限公司),37℃、180rpm条件下培养12-16小时。随后,将上述培养液分区划线于含有64μg/ml四环素的麦康凯琼脂培养基(广东环凯微生物科技有限公司),37℃条件下培养16-24小时。挑取红色单菌落,使用相同的麦康凯琼脂药板进行进一步的纯化,37℃条件下培养16-24小时。
16srdna菌种鉴定
刮取一环纯化后的菌株,参照天根细菌基因组dna提取试剂盒(天根生化科技有限公司)使用步骤提取该菌株的基因组。随后对16srdna基因进行pcr扩增,并将pcr产物以1%琼脂糖凝胶进行电泳。pcr体系(25μl)如下:18.375μlddh2o,2.5μl10×buffer,2μldntps,0.5μl上游引物(seqidno:1),0.5μl下游引物(seqidno:2),0.125μlr-taq酶和1μldna模板。其中,16srdna引物由广州擎科生物技术有限公司合成,而其他pcr成份购自宝生物工程(大连)有限公司。pcr程序为:94℃预变性5min;94℃变性45s,53℃退火45s,72℃延伸1min30s,循环30次;72℃再延伸10min。
根据琼脂糖凝胶电泳结果,将pcr阳性样品送往广州擎科生物技术有限公司进行测序,并利用ncbi数据库进行核苷酸序列比对分析(https://blast.ncbi.nlm.nih.gov/blast.cgi?program=blastn&page_type=blastsearch&link_loc=blasthome),从分子水平鉴定该菌株为大肠杆菌(seqidno:3)。
菌落形态特征及生理生化特性
该菌株lhm10-1在麦康凯琼脂平板上呈红色、规则圆形、表面光滑、边缘整齐;需氧,周身鞭毛,能运动,无芽孢,革兰氏阴性菌;血清型为o128:h12;发酵乳糖、甘露醇和葡萄糖等并产酸产气;最适生长ph值为6.3-7.8;最适生长温度为35~38℃。
实施例2
最小抑菌浓度(mic)的测定
采用微量肉汤稀释法,参照美国临床和实验室标准协会的相关标准(clsi:m100-s26),测定大肠杆菌lhm10-1对四环素、金霉素、土霉素、多西环素、米诺环素、替加环素和伊拉瓦环素(均购自美国sigma-aldrich公司)的mic。并以大肠杆菌atcc25922为质控菌株。
结果表明(表1),大肠杆菌lhm10-1对四环素、金霉素、土霉素、多西环素、米诺环素、替加环素和伊拉瓦环素均表现出不同水平的药物敏感性,分别为256μg/ml、128μg/ml、256μg/ml、16μg/ml、32μg/ml、8μg/ml和4μg/ml。
表1大肠杆菌lhm10-1对四环素类药物的mics
注:tc,四环素;ctc,金霉素;otc,土霉素;dox,多西环素;min,米诺环素;tgc,替加环素;era,伊拉瓦环素
实施例3
挑取纯化后的大肠杆菌lhm10-1单菌落,接种至4mllb肉汤(广东环凯微生物科技有限公司),37℃、180rpm条件下培养4-6小时。随后,吸取200μl上述大肠杆菌培养液至200ml分别含有四环素(100mg/l)、金霉素(100mg/l)、土霉素(100mg/l)、多西霉素(50mg/l)、米诺环素(10mg/l)、替加环素(10mg/l)和伊拉瓦环素(2.5mg/l)的lb肉汤中,37℃、220rpm和避光条件下培养48小时。并以不添加四环素药物的培养基为对照组。最后,使用标准的数码相机拍摄图像,并根据颜色变化初步判断大肠杆菌lhm10-1对四环素类药物的降解能力。
结果表明(图1),对于四环素、金霉素、土霉素和多西环素,大肠杆菌lhm10-1均使培养基从黄色变为中等或深黑色(对照组仍为黄色),表明这些抗生素均产生了不同程度的降解。而对于米诺环素、替加环素和伊拉瓦环素,lb培养基虽然没有任何显著的颜色变化,但细菌培养物表现出较强的生长活性,颜色变化不明显可能是由于药物自身结构差异所导致(fabiannguyen等,2014,biologicalchemistry)。
实施例4
挑取纯化后的大肠杆菌lhm10-1单菌落,接种于4mlm9培养基(1×m9最小盐,2mm硫酸镁,100μm氯化钙,0.1%l-阿拉伯糖,9g/l葡萄糖,100mg/l硫胺素和100mg/l亮氨酸;均购自sigma-aldrich公司),37℃、180rpm条件下培养8小时。吸取40μl上述细菌培养液分别至含有8μg/ml四环素和2μg/ml伊拉瓦环素且终体积为4ml的m9培养基,并在37℃、200rpm和避光条件下培养16小时。同时以仅添加四环素类药物的m9培养基为对照组。随后,将细菌培养液以12000rpm转速离心2min,并用0.22μm孔径的滤头过滤(天津津腾实验室设备有限公司)。取过滤后上清液,经10倍稀释后,参照传统方法(kevinj.forsberg等,2015,chemistry&biology)进行lc-ms/ms测定。上述实验组和对照组各设置6个平行。
结果表明,大肠杆菌lhm10-1对四环素类药物表现出良好的降解活性。其中,大肠杆菌lhm10-1在16小时后对四环素的降解率达到83.91%(图2;理论最大值即四环素初始添加量(8μg/ml),总体标准偏差为1.17%,p<0.0001),而对伊拉瓦环素的降解率甚至高达92.24%(图3;理论最大值即伊拉瓦环素初始添加量(2μg/ml),总体标准偏差为0.46%,p<0.0001)。与此同时,对照组中四环素和伊拉瓦环素自身的降解率均在25%以下。
序列表
<110>华南农业大学
<120>大肠杆菌(escherichiacoli)lhm10-1菌株及其应用
<141>2019-04-11
<160>3
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>上游引物(人工序列)
<400>1
agagtttgatcctgcctcag20
<210>2
<211>19
<212>dna
<213>下游引物(人工序列)
<400>2
ggttaccttgttacgactt19
<210>3
<211>1427
<212>dna
<213>大肠杆菌lhm10-1(escherichiacoli)
<400>3
ggcctaacacatgcaagtcgaacggtaacaggaaacagcttgctgtttcgctgacgagtg60
gcggacgggtgagtaatgtctgggaaactgcctgatggagggggataactactggaaacg120
gtagctaataccgcataacgtcgcaagaccaaagagggggaccttcgggcctcttgccat180
cggatgtgcccagatgggattagctggtaggtggggtaacggctcacctaggcgacgatc240
cctagctggtctgagaggatgaccagccacactggaactgagacacggtccagactccta300
cgggaggcagcagtggggaatattgcacaatgggcgcaagcctgatgcagccatgccgcg360
tgtatgaagaaggccttcgggttgtaaagtactttcagcggggaggaagggagtaaagtt420
aatacctttgctcattgacgttacccgcagaagaagcaccggctaactccgtgccagcag480
ccgcggtaatacggagggtgcaagcgttaatcggaattactgggcgtaaagcgcacgcag540
gcggtttgttaagtcagatgtgaaatccccgggctcaacctgggaactgcatctgatact600
ggcaagcttgagtctcgtagaggggggtagaattccaggtgtagcggtgaaatgcgtaga660
gatctggaggaataccggtggcgaaggcggccccctggacgaagactgacgctcaggtgc720
gaaagcgtggggagcaaacaggattagataccctggtagtccacgccgtaaacgatgtcg780
acttggaggttgtgcccttgaggcgtggcttccggagctaacgcgttaagtcgaccgcct840
ggggagtacggccgcaaggttaaaactcaaatgaattgacgggggcccgcacaagcggtg900
gagcatgtggtttaattcgatgcaacgcgaagaaccttacctggtcttgacatccacaga960
actttccagagatggattggtgccttcgggaactgtgagacaggtgctgcatggctgtcg1020
tcagctcgtgttgtgaaatgttgggttaagtcccgcaacgagcgcaacccttatcctttg1080
ttgccagcggtccggccgggaactcaaaggagactgccagtgataaactggaggaaggtg1140
gggatgacgtcaagtcatcatggcccttacgaccagggctacacacgtgctacaatggcg1200
catacaaagagaagcgacctcgcgagagcaagcggacctcataaagtgcgtcgtagtccg1260
gattggagtctgcaactcgactccatgaagtcggaatcgctagtaatcgtggatcagaat1320
gccacggtgaatacgttcccgggccttgtacacaccgcccgtcacaccatgggagtgggt1380
tgcaaaagaagtaggtagcttaaccttcgggagggcgcttaccactt1427
- 还没有人留言评论。精彩留言会获得点赞!