一种高效的茶树叶片蛋白质提取方法与流程
本发明属于蛋白质提取技术领域,具体涉及一种高效的茶树叶片蛋白质提取方法。
背景技术:
茶叶是我国重要的经济作物之一,香气是作为茶叶评价等级的重要指标。因此,近年来众多学者从不同角度研究茶叶香气形成的原因,以期通过人工调节的方法提高茶叶香气物质含量,提高茶叶的品质。其中,蛋白质组学是用于研究茶树叶片物质代谢的重要方法,利用蛋白质组学方法,可有效分析茶树叶片代谢过程变化,寻找茶树叶片香气合成途径中关键酶,进而进行调控。然而,由于茶树叶片含有大量的粗纤维和次生代谢物,因此严重影响了茶树叶片蛋白质的提取与分离,限制了茶叶蛋白质组学的进一步研究。近年来,众多学者开展大量茶树叶片蛋白质提取方法的研究,然而效果不佳,提取的蛋白质数量有限仅有2000个左右的蛋白质点,远远不能满足蛋白质组学研究的需求。因此,开发一种高效的茶树叶片蛋白质提取方法对于茶树叶片蛋白质组学的研究具有重要的意义。
技术实现要素:
本发明的目的在于提供一种高效的茶树叶片蛋白质提取方法,采用该方法可高效提取茶树叶片中的蛋白质,所获得蛋白质数量多,分离效果好。
为了达成上述目的,本发明采用的主要技术方案如下:
一种高效的茶树叶片蛋白质提取方法,通过四个步骤完成,步骤1)茶树叶片的初步研磨、提取、静置;步骤2)茶树叶片粗蛋白质纯化;步骤3)茶树叶片粗蛋白干燥;步骤4)茶树叶片蛋白的溶解与分离,即可获得茶树叶片蛋白质。具体步骤如下:
1)茶树叶片的初步研磨、提取、静置
取茶树叶片,剪成片状,称取4~5g茶树叶片置于研钵中,添加0.08~0.12gpvp,往研钵中加入液氮进行研磨,将研磨后的茶树叶片倒入离心管中,加入tca/丙酮混合液a,然后漩涡振荡,离心,静置10~12h;
所述tca/丙酮混合液a是采用丙酮溶液进行配制,其中tca含量为15%,巯基乙醇含量为0.1%,丙酮含量为84.9%;
2)茶树叶片粗蛋白质纯化
将静置后的样品离心,弃去上清液,加入tca/丙酮混合液b,漩涡振荡,离心,弃去上清液,收集沉淀;
所述tca/丙酮混合液b是采用丙酮溶液进行配制,其中tca含量为12%,巯基乙醇含量为0.08%,丙酮含量为87.2%;
3)茶树叶片粗蛋白干燥
将上述收集的沉淀置于-80℃环境中20~25min,然后将沉淀置于真空冷冻干燥箱中干燥10~12h,获得茶树叶片粗蛋白干粉;
4)茶树叶片蛋白的溶解与分离
取上述茶树叶片粗蛋白干粉100mg,加入蛋白质样品裂解液1200~1500μl,然后漩涡振荡,超声,离心,收集上清液即为茶树叶片蛋白质溶液。
进一步,步骤1)中,所述茶树叶片剪成1~1.5cm的片状。
进一步,步骤1)中,所述研磨的具体步骤为:往研钵中加入液氮,迅速研磨8~10s,加入液氮,迅速研磨10~12s,加入液氮,迅速研磨12~14s,加入液氮,迅速研磨15~18s。
进一步,步骤1)中,加入丙酮混合液a、漩涡振荡、离心,静置的具体步骤为:将研磨后的茶树叶片倒入离心管中,加入25~30ml的tca/丙酮混合液a,漩涡振荡20~30s,离心后弃去上清液,加入25~30ml的tca/丙酮混合液a,漩涡振荡20~30s,-20℃静置10~12h。
进一步,步骤2)的具体操作为:将静置后的样品离心,弃去上清液,加入30~35ml的tca/丙酮混合液b,漩涡振荡20~30s,离心,弃去上清液,加入30~35ml的tca/丙酮混合液b,漩涡振荡10~15s,离心,弃去上清液,加入30~35ml的tca/丙酮混合液b,漩涡振荡10~15s,离心,弃去上清液,收集沉淀。
进一步,步骤4)中,所述蛋白质样品裂解液是采用无菌水配置,其中尿素含量9.5mol/l,二硫苏糖醇含量0.8%,chaps含量3.8%,ph值5~8的ampholine含量1.8%。
进一步,步骤4)中,所述漩涡振荡,超声,离心的具体操作为:粗蛋白干粉中加入蛋白质样品裂解液后,漩涡振荡20~25s,置于超声波仪中4℃超声10~15min,漩涡振荡40~50s,置于超声波仪中4℃超声15~18min,漩涡振荡60~80s,置于超声波仪中4℃超声15~18min,然后离心,收集上清液即为茶树叶片蛋白质溶液。
步骤1)、2)、4)中,所述离心条件为4℃、13000g、30min。
本发明采用以上技术方案,以新鲜茶树叶片(二叶一芯)为材料,采用tca/丙酮混合液进行提取,分离、静置,进一步对静置后的沉淀进行清洗纯化,低温真空冷冻干燥,获得粗蛋白,再采用裂解液裂解粗蛋白,离心取上清获得纯蛋白溶液。本发明的优点在于:茶树叶片富含大量的次生代谢物,同时其粗纤维含量较高,因此在蛋白质提取时不容易分离,提取效率低。本发明运用tca/丙酮提取法,采用多次提取、多次破壁,有效提高了提取所获得的蛋白质数量,采用2d-page进行分离后,分离效果好,能有效将蛋白质分离,蛋白质点清晰;采用lc/ms/ms对蛋白质进行鉴定,结果表明,采用本发明提取的蛋白质数量在4117~4218个之间。本发明的方法为茶树叶片蛋白质组学研究奠定了重要的基础。
附图说明
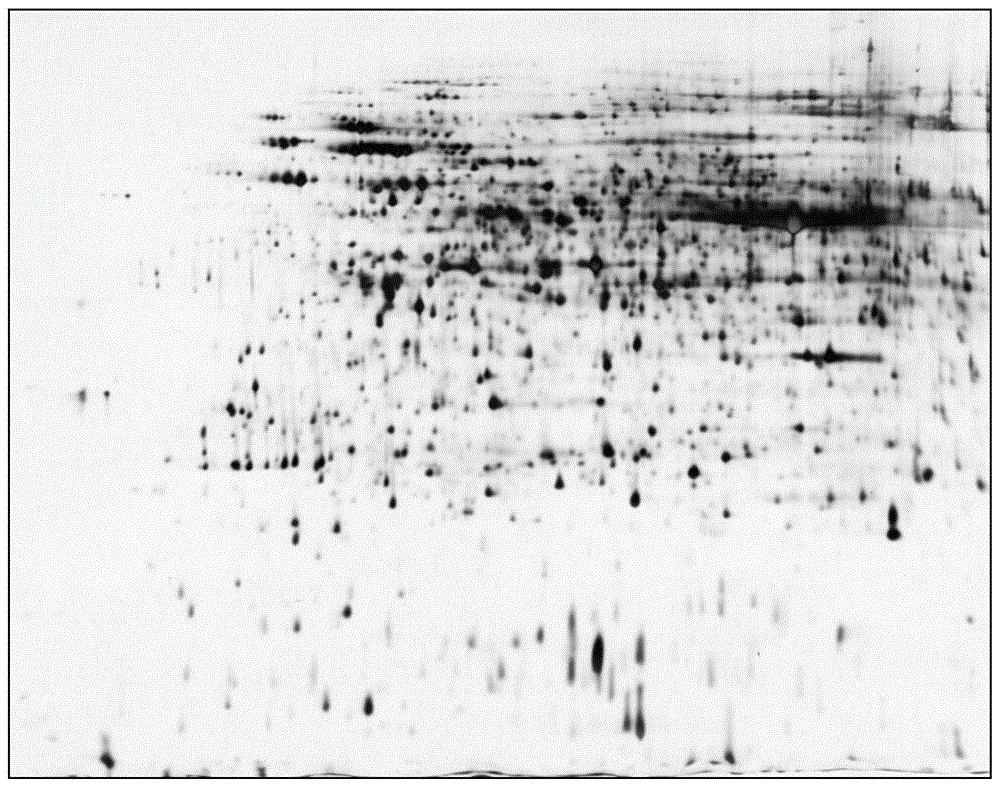
图1为实施例1茶树叶片蛋白质2d-page电泳图谱;
图2为实施例2茶树叶片蛋白质2d-page电泳图谱;
图3为实施例3茶树叶片蛋白质2d-page电泳图谱。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
实施例1
一种高效的茶树叶片蛋白质提取方法
配制tca/丙酮混合液a:采用丙酮溶液进行配制,其中tca含量为15%,巯基乙醇含量为0.1%,丙酮含量为84.9%。
配制tca/丙酮混合液b:采用丙酮溶液进行配制,其中tca含量为12%,巯基乙醇含量为0.08%,丙酮含量为87.2%。
配制蛋白质样品裂解液:采用无菌水配置,其中尿素9.5mol/l,二硫苏糖醇含量0.8%,chaps含量3.8%,ph值5~8的ampholine含量1.8%。
1)树叶片的初步研磨、提取、静置
取茶树叶片(二叶一芯),用剪刀剪成1cm的片状充分混匀,称取4g茶树叶片置于研钵中,添加0.08g左右的pvp,加入液氮,迅速研磨8s,加入液氮,迅速研磨10s,加入液氮,迅速研磨12s,加入液氮,迅速研磨15s,将研磨后的茶树叶片倒入离心管中,加入25ml的tca/丙酮混合液a,漩涡振荡20s,4℃、13000g离心30min,弃去上清液,加入25ml的tca/丙酮混合液a,漩涡振荡20s,-20℃静置10h。
2)茶树叶片粗蛋白质纯化
将静置后的样品于4℃、13000g离心30min,弃去上清液,加入30ml的tca/丙酮混合液b,漩涡振荡20s,4℃、13000g离心30min,弃去上清液,加入30ml的tca/丙酮混合液b,漩涡振荡10s,4℃、13000g离心30min,弃去上清液,加入30ml的tca/丙酮混合液b,漩涡振荡10s,4℃、13000g离心30min,弃去上清液。
3)茶树叶片粗蛋白干燥
将离心后的沉淀置于-80℃中20min,将沉淀置于真空冷冻干燥箱中干燥10h,获得茶树叶片粗蛋白干粉。
4)茶树叶片蛋白的溶解与分离
称取冷冻干燥后的茶树叶片粗蛋白干粉100mg,加入蛋白质样品裂解液1200μl,漩涡振荡20s,置于超声波仪中4℃超声10min,漩涡振荡40s,置于超声波仪中4℃超声15min,漩涡振荡60s,置于超声波仪中4℃超声15min,4℃、13000g离心30min,吸取上清液即为茶树叶片蛋白质溶液。
本实施例获得的茶树叶片蛋白质经2d-page电泳后,如图1所示,茶树叶片蛋白质图谱中蛋白质点丰富,经lc-ms/ms鉴定后,共获得叶片蛋白质点4218个,为茶树叶片蛋白质组学研究奠定了重要的基础。
实施例2
一种高效的茶树叶片蛋白质提取方法
配制tca/丙酮混合液a:采用丙酮溶液进行配制,其中tca含量为15%,巯基乙醇含量为0.1%,丙酮含量为84.9%。
配制tca/丙酮混合液b:采用丙酮溶液进行配制,其中tca含量为12%,巯基乙醇含量为0.08%,丙酮含量为87.2%。
配制蛋白质样品裂解液:采用无菌水配置,其中尿素9.5mol/l,二硫苏糖醇含量0.8%,chaps含量3.8%,ph值5~8的ampholine含量1.8%。
1)树叶片的初步研磨、提取、静置
取茶树叶片(二叶一芯),用剪刀剪成1cm的片状充分混匀,称取4g茶树叶片置于研钵中,添加0.12g左右的pvp,加入液氮,迅速研磨10s,加入液氮,迅速研磨12s,加入液氮,迅速研磨14s,加入液氮,迅速研磨18s,将研磨后的茶树叶片倒入离心管中,加入25ml的tca/丙酮混合液a,漩涡振荡20s,4℃、13000g离心30min,弃去上清液,加入30ml的tca/丙酮混合液a,漩涡振荡30s,-20℃静置10h。
2)茶树叶片粗蛋白质纯化
将静置后的样品于4℃、13000g离心30min,弃去上清液,加入35ml的tca/丙酮混合液b,漩涡振荡30s,4℃、13000g离心30min,弃去上清液,加入30ml的tca/丙酮混合液b,漩涡振荡10s,4℃、13000g离心30min,弃去上清液,加入35ml的tca/丙酮混合液b,漩涡振荡15s,4℃、13000g离心30min,弃去上清液。
3)茶树叶片粗蛋白干燥
将离心后的沉淀置于-80℃中25min,将沉淀置于真空冷冻干燥箱中干燥12h,获得茶树叶片粗蛋白干粉。
4)茶树叶片蛋白的溶解与分离
称取冷冻干燥后的茶树叶片粗蛋白干粉100mg,加入蛋白质样品裂解液1500μl,漩涡振荡25s,置于超声波仪中4℃超声15min,漩涡振荡50s,置于超声波仪中4℃超声18min,漩涡振荡60s,置于超声波仪中4℃超声15min,4℃、13000g离心30min,吸取上清液即为茶树叶片蛋白质溶液。
本实施例获得的茶树叶片蛋白质经2d-page电泳后,如图2所示,茶树叶片蛋白质图谱中蛋白质点丰富,经lc-ms/ms鉴定后,共获得叶片蛋白质点4188个,为茶树叶片蛋白质组学研究奠定了重要的基础。
实施例3
一种高效的茶树叶片蛋白质提取方法
配制tca/丙酮混合液a:采用丙酮溶液进行配制,其中tca含量为15%,巯基乙醇含量为0.1%,丙酮含量为84.9%。
配制tca/丙酮混合液b:采用丙酮溶液进行配制,其中tca含量为12%,巯基乙醇含量为0.08%,丙酮含量为87.2%。
配制蛋白质样品裂解液:采用无菌水配置,其中尿素9.5mol/l,二硫苏糖醇含量0.8%,chaps含量3.8%,ph值5~8的ampholine含量1.8%。
1)树叶片的初步研磨、提取、静置
取茶树叶片(二叶一芯),用剪刀剪成1.5cm的片状充分混匀,称取5g茶树叶片置于研钵中,添加0.12g左右的pvp,加入液氮,迅速研磨10s,加入液氮,迅速研磨12s,加入液氮,迅速研磨14s,加入液氮,迅速研磨18s,将研磨后的茶树叶片倒入离心管中,加入30ml的tca/丙酮混合液a,漩涡振荡30s,4℃、13000g离心30min,弃去上清液,加入30ml的tca/丙酮混合液a,漩涡振荡30s,-20℃静置12h。
2)茶树叶片粗蛋白质纯化
将静置后的样品于4℃、13000g离心30min,弃去上清液,加入35ml的tca/丙酮混合液b,漩涡振荡30s,4℃、13000g离心30min,弃去上清液,加入35ml的tca/丙酮混合液b,漩涡振荡15s,4℃、13000g离心30min,弃去上清液,加入35ml的tca/丙酮混合液b,漩涡振荡15s,4℃、13000g离心30min,弃去上清液。
3)茶树叶片粗蛋白干燥
将离心后的沉淀置于-80℃中25min,将沉淀置于真空冷冻干燥箱中干燥12h,获得茶树叶片粗蛋白干粉。
4)茶树叶片蛋白的溶解与分离
称取冷冻干燥后的茶树叶片粗蛋白干粉100mg,加入蛋白质样品裂解液1500μl,漩涡振荡25s,置于超声波仪中4℃超声15min,漩涡振荡50s,置于超声波仪中4℃超声18min,漩涡振荡80s,置于超声波仪中4℃超声18min,4℃、13000g离心30min,吸取上清液即为茶树叶片蛋白质溶液。
本实施例获得的茶树叶片蛋白质经2d-page电泳后,如图3所示,茶树叶片蛋白质图谱中蛋白质点丰富,经lc-ms/ms鉴定后,共获得叶片蛋白质点4117个,为茶树叶片蛋白质组学研究奠定了重要的基础。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!