本发明涉及光电材料领域,具体而言,涉及一种新型有机半导体材料、制备方法、场效应晶体管器件及其制作方法。
背景技术:
有机半导体材料为电导率介于有机绝缘体和有机导体之间的一类有机化合物材料。有机半导体(organicsemiconductor)是具有半导体性质的有机材料。单分子,短链(低聚物)和有机高聚物可以是半导体。半导体小分子(芬香碳氢化合物)包括多环芬香化合物并五苯,蒽和红莹烯。高分子有机半导体包括高3-已基噻吩,高p-次苯基次亚乙烯基及聚乙炔和它们的派生物。
目前兼具光致发光与导电的有机半导体材料比较少,而且大部分化合物的合成步骤复杂,且合成难度较大,合成原料不容易购买,成本高。
鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种新型有机半导体材料,该新型有机半导体材料兼具发光与导电的性能。
本发明的第二目的在于提供一种新型有机半导体材料的制备方法,该制备方法原料易得,且原料可以选择多样化,成本低,合成步骤简单,操作简单,合成难度小。
本发明的第三目的在于提供一种场效应晶体管器件,该场效应晶体管器件具有不同的电荷传输性能。
本发明的第四目的在于提供一种场效应晶体管器件的制作方法,该制作方法简单,制作出的场效应晶体管器件易于加工。
本发明是这样实现的:
一种新型有机半导体材料,新型有机半导体材料为如下化学式的化合物:
式1:
式1中r1为cnh2n+1,其中,n为4,6,8,12中的任意一种,优选的,n为4或6,更优选的,n为4;r2为x,硝基和氰基中的任意一种;x可以是h,f,cl,br和i中的任意一种;
或式2:式2中r1为cnh2n+1,其中,n为4,6,8,12中的任意一种,优选的,n为4或6,更优选的,n为4;
或式3:
式3中r3为cnh2n+1,其中,n为4,6,8,12中的任意一种,优选的,n为4或6,更优选的,n为6。
式1,式2和式3中通过选择不同c原子数的烷基作为侧链,解决了有机半导体材料的溶解性问题。式1中通过引入具有不同电子效应的修饰基团x,对有机半导体材料的分子轨道能级、光学性能、热学性能以及电化学性能进行调节,以合成出光电性能不同的有机半导体分子。修饰基团x为吸电子基团,可以根据需要引入不同吸电子强度的吸电子基团。
强吸电子集团可以为硝基(-no2)或三卤甲基(-cx3)x=f、cl;中吸电子基团可以是氰基(-cn)或磺酸基(-so3h);弱吸电子基团可以是甲酰基(-cho)、酰基(-cor)或羧基(-cooh)。
式1和式2为不对称结构的芘化合物衍生物,可升华,操作简单,便于场效应晶体管器件的构筑。式3为对称结构的芘化合物衍生物,溶解性较差,且无法在其稳定存在的温度下升华,因此,不能采用物理气相沉积法制备场效应晶体管器件,而采用溶液法制备。
本发明所提供的一种新型有机半导体材料的固体形态在365nm紫外光激发下可以发出颜色深浅不一的红光。
一种新型有机半导体材料的制备方法,包括如下依次进行的步骤:分别提供如下摩尔比为2:3的化合物a和化合物b在冰醋酸回流条件下合成式1,或分别提供如下摩尔比为2:3的化合物a和化合物c在冰醋酸回流条件下合成式2,或分别提供如下摩尔比为1:3的化合物d和化合物e在氮气保护下加热合成式3;在其他实施例中保护气体也可以是氩气。
化合物a:化合物b:化合物c:化合物d:化合物e:
其中,r1为cnh2n+1,其中,n为4,6,8,12中的任意一种,优选的,n为4或6,更优选的,n为4;r2为x,硝基和氰基中的任意一种;x可以是h,f,cl,br和i中的任意一种;r3为cnh2n+1,其中,n为4,6,8,12中的任意一种,优选的,n为4或6,更优选的,n为6。
在本发明应用较佳的实施例中,上述化合物a和化合物b的摩尔比为1:1-2,化合物a和化合物c的摩尔比为1:1-2,化合物d和化合物e的摩尔比为1:2.5-4。化合物a和化合物b的摩尔比为2:3,化合物a和化合物c的摩尔比为2:3,化合物d和化合物e的摩尔比为1:3。
在本发明应用较佳的实施例中,上述化合物a由如下反应方程制得:
其中,r1为cnh2n+1,n为4,6,8,12中的任意一种,优选的,n为4或6,更优选的,n为4。
上述由芘为原料反应步骤为:
在本发明应用较佳的实施例中,上述化合物d由如下反应方程制得:
r3为cnh2n+1,其中,n为4,6,8,12中的任意一种,优选的,n为4或6,更优选的,n为6。
在本发明应用较佳的实施例中,上述化合物a和化合物b反应合成式1的步骤还包括:将式1的初产物通过柱层析法制得粗产物,再将粗产物用有机溶剂进行重结晶。
在本发明应用较佳的实施例中,上述柱层析法所用的层析柱包括石油醚和二氯甲烷,石油醚和二氯甲烷的体积比为1:1-1.5,优选的,石油醚和二氯甲烷的体积比为1:1,重结晶的有机溶剂为三氯甲烷和甲醇的混合溶剂,三氯甲烷与甲醇互溶。
在本发明应用较佳的实施例中,上述化合物d与化合物e的摩尔比为3:1,加热温度为109-111℃,反应条件为搅拌过夜;
优选的,加热温度为110℃。
在本发明应用较佳的实施例中,上述还包括通过柱层析方法分离式3得到顺式产物和反式产物,制得顺式产物呈红色,反式产物呈黑红色,层析柱由石油醚和二氯甲烷组成,石油醚与二氯甲烷的体积比为3-5:1。
一种场效应晶体管器件,包括基底和活性层,发光层为上述新型有机半导体材料,活性层设置于基底表面,基底为硅片。
一种场效应晶体管器件的制作方法,将新型有机半导体材料置于管式炉高温区,并将经过清洗和修饰的硅片置于管式炉低温区,通过物理气相沉积法使新型有机半导体材料沉积于硅片上作为器件的半导体层,选用金,银和铝中的任意一种作为源漏电极,控制系统真空度低于3.9×10-4-4.1×10-4pa,沉积厚度为50nm的金作为器件源漏电极;
优选的,控制系统真空度低于4.0×10-4pa。
一种场效应晶体管器件的制作方法,将新型有机半导体材料与有机溶剂混合,控制新型有机半导体材料的浓度为0.5-1.5mg/ml,将配好的溶液经有机滤膜过滤后,在旋转涂膜仪上开始制备薄膜,控制转速为3500-4500rpm,最后将硅片在118-120℃退火,全程操作在氩气条件下进行;
优选的,有机溶剂为甲苯,控制新型有机半导体材料的浓度为1mg/ml,控制转速为4000rpm,将硅片在120℃退火。
本发明具有以下有益效果:
本发明提供了一种新型有机半导体材料,该新型有机半导体材料兼具发光与导电的性能。
本发明还提供了一种新型有机半导体材料的制备方法,该制备方法原料易得,且原料可以选择多样化,成本低,合成步骤简单,操作简单,合成难度小。
本发明还提供了一种场效应晶体管器件,该场效应晶体管器件具有不同的电荷传输性能。
本发明还提供了一种场效应晶体管器件的制作方法,该制作方法简单,制作出的场效应晶体管器件易于加工。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为溶液状态下各化合物的荧光发射光谱;
图2为固体状态下各化合物的荧光发射光谱;
图3为各化合物场效应器件的转移曲线。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1:
不对称芘衍生物的构筑
(1)芘-4,5-二酮
用二氯甲烷(100ml),乙腈(100ml)将芘(5.05g,25mmol)溶于500ml圆底烧瓶后开启机械搅拌,然后依次加入高碘酸钠(25.5g,120mmol),一水合三氯化钌(0.5g),水(120ml)在常温下反应18h。将圆底烧瓶中的溶剂用旋蒸仪蒸干后,用二氯甲烷萃取产物,旋干溶剂后用石油醚,二氯甲烷(1:1)过柱可得粗产物,然后用三氯甲烷,石油醚进行重结晶,在三氯甲烷回流状态下粗产物能够全部溶解,然后加石油醚直至固体物质不再析出,得终产物。性状:橘红色固体。
反应方程如下:
(2)9,10-二溴芘-4,5-二酮
将芘-4,5-二酮粉末(0.5g,2.15mmol)加入100ml双口瓶中加入浓硫酸(9ml)后开启磁力搅拌,搅拌均匀后分批加入n-溴代丁二酰亚胺(nbs,1.21g,8.6mmol)在常温下反应4.5h。本实施例中通过采用分批加入的方法保证了反应物在加入后能充分反应,防止一次性倒入导致浓硫酸破坏nbs的活性。反应结束后加入大量水至不再有橙黄色固体析出。抽滤,烘干。此步不进行提纯,直接用于下步反应。
反应方程如下:
(3)4,5-二溴-9,10-二丁氧基芘
将9,10-二溴芘-4,5-二酮(500mg,1.29mmol),保险粉(0.7g,4.04mmol)和四丁基溴化铵(130mg,0.404mmol)溶于四氢呋喃(15ml)和水(15ml)混合溶剂中搅拌5分钟。后加入饱和氢氧化钾(15ml),溴代正丁烷(1ml,10.02mmol),回流4.5h。用乙酸乙酯萃取有机层,干燥旋干后用柱层析法(石油醚)收集产物。性状:无色晶体。保险粉为连二亚硫酸钠,具有强还原性。四氢呋喃的作用为溶剂,此外,在其他实施例中还可以使用其他有机溶剂:三氯甲烷,二异丙胺或四氯化碳中的任意一种。
反应方程如下:
(4)9,10-二丁氧基芘-4,5-二腈
将4,5-二溴-9,10-二丁氧基芘(1g,2mmol),氰化亚铜(800mg,9mmol)溶于100mln-甲基吡咯烷酮中。在氮气保护下回流2h。减压蒸馏出溶剂后冷却残留物,加入三氯化铁的盐酸溶液加热搅拌过夜。用二氯甲烷萃取有机物,干燥旋干后用柱层析法(二氯甲烷:石油醚=1:4)得产物9,10-二甲基芘-4,5-二腈。性状:黄色粉末。
反应方程如下:
(5)9,10-二丁氧基芘-4,5-二羧酸
将9,10-二甲基芘-4,5-二腈(300mg,0.76mmol)溶于水和乙醇等体积(14ml)配制的氢氧化钾(637mg,11.4mmol)混合溶剂中。加热回流12h后加入盐酸溶液有橙红色固体析出,抽滤后直接用于下一步反应。
此外,在其他实施例中碱性溶液也可以是氢氧化钠。
反应方程如下:
(6)4,5-二丁氧基-15h-苯并[4,5]咪唑并[2,1-a]菲并[4,5-efg]异吲哚-15-酮1-a
1,2-二胺-苯(75.11mg,0.691mmol),9,10-二丁氧基芘-4,5-二羧(200mg,0.461mmol)加入50ml单口瓶中加入5ml冰醋酸回流5h。旋干,柱层析法(石油醚:二氯甲烷=1:1)得粗产物用丙酮进行重结晶。性状:红色针状晶体。
反应方程如下:
式中x=h,记作1a。
(7)4,5-二丁氧基-11,12-二氟-15h-苯并[4,5]咪唑并[2,1-a]菲并[4,5-efg]异吲哚-15-酮1-b
1,2-二氟-4,5-二胺-苯(99.53mg,0.691mmol),9,10-二丁氧基芘-4,5-二羧(200mg,0.461mmol)加入50ml单口瓶中加入5ml冰醋酸回流5h。旋干,柱层析法(石油醚:二氯甲烷=1:1)得粗产物用三氯甲烷和甲醇混合溶剂进行重结晶。性状:红色片状晶体。
反应方程如下:
式中x=f,记作1b。
(8)4,5-二丁氧基-11,12-二氯-15h-苯并[4,5]咪唑并[2,1-a]菲并[4,5-efg]异吲哚-15-酮1-c
1,2-二氯-4,5-二胺-苯(122mg,0.691mmol),9,10-二丁氧基芘-4,5-二羧(200mg,0.461mmol)加入50ml单口瓶中加入5ml冰醋酸回流5h,旋干,柱层析法(石油醚:二氯甲烷=1:1)得粗产物用三氯甲烷和甲醇混合溶剂进行重结晶。性状:深红色针状晶体。
反应方程如下:
式中x=cl,记作1c。
(9)4,5-二丁氧基-11,12-二硝基-15h-苯并[4,5]咪唑并[2,1-a]菲并[4,5-efg]异吲哚-15-酮1-d
1,2-二硝基-4,5-二胺-苯(136.8mg,0.691mmol),9,10-二丁氧基芘-4,5-二羧(200mg,0.461mmol)加入50ml单口瓶中加入5ml冰醋酸回流5h,旋干,柱层析法(石油醚:二氯甲烷=1:1)得粗产物用三氯甲烷和甲醇混合溶剂进行重结晶。性状:暗红色片状晶体。
反应方程如下:
式中x=no2,记作1d。
(10)11,12-二丁氧基-16h-菲并[4',5':4,5,6,7]异吲哚并[2,1-a]过亚胺16-酮1-e
1,8-二胺-萘(109.2mg,0.691mmol),9,10-二丁氧基芘-4,5-二羧酸(200mg,0.461mmol)加入50ml单口瓶中加入5ml冰醋酸回流5h,旋干,柱层析法(石油醚:二氯甲烷=1:1)得粗产物用三氯甲烷和甲醇混合溶剂进行重结晶。性状:暗红色片状晶体。
反应方程如下:
记作1e。
实施例2
对称芘衍生物的构筑
对称芘衍生物即具有顺反异构的大共轭芘衍生物。其合成反应步骤如下:
(1)合成2,7-二叔丁基芘
在250ml双口瓶中将芘(8g,40mmol)和500mg三氯化铝溶于100ml的二氯甲烷中。除氧后置于零度下搅拌15min,再加入叔丁基氯。滴加完毕后,继续在零度条件下搅拌15min。然后置于室温下搅拌反应6h。反应结束后加水淬灭反应,用二氯甲烷萃取,石油醚过柱得粗产物。性状:白色固体粉末。
反应方程如下:
(2)合成2,7-二叔丁基芘-4,5-二酮
用二氯甲烷(50ml),乙腈(50ml)将2,7-二叔丁基芘(3.93g,12.5mmol)溶于500ml圆底烧瓶后开启机械搅拌,然后依次加入高碘酸钠(12.15g,60mmol),一水合三氯化钌(0.25g),水(60ml)在常温下反应18h。将溶剂用旋蒸仪蒸干,二氯甲烷萃取产物,旋干溶剂后用石油醚/二氯甲烷(1:1)过柱可得粗产物,然后用三氯甲烷,石油醚进行重结晶,得终产物。性状:橘红色固体。
反应方程如下:
(3)合成9,10-二溴-2,7-二叔丁基芘-4,5-二酮
将2,7-二叔丁基芘-4,5-二酮(0.84g,2.43mmol)加入25ml双口瓶中加入浓硫酸(10ml)后开启磁力搅拌,搅拌均匀后分批加入n-溴代丁二酰亚胺(1.79g,10mmol)在常温下反应4.5h。反应结束后加入大量水至不再有橙黄色固体析出。抽滤,烘干。此步不进行提纯,直接用于下步反应。
(4)合成4,5-二溴-2,7-二叔丁基-9,10-双(己氧基)芘
将化合物9,10-二溴-2,7-二叔丁基芘-4,5-二酮(1g,5mmol),四丁基溴化铵(1g,5mmol)和保险粉(1g,5mmol)加入四氢呋喃/水(1:1,50ml)的混合溶液中。混合物在室温下搅拌5分钟后,向反应物中加入氢氧化钾(4.82g,86.2mmol)的水(125ml)溶液,然后再加入1-溴己烷(8.88g,53.8mmol)。将反应混合物在100℃下搅拌4小时。冷却后用乙酸乙酯(2×20ml)萃取混合物。用饱和食盐水洗涤有机相,并用无水硫酸镁干燥。除去溶剂后,通过用纯石油醚柱层析纯化粗产物,得到产物为无色固体。
反应方程如下:
(5)合成2,7-二-叔-丁基-9,10-双(己氧基)芘-4,5-二腈
将化合物4,5-二溴-2,7-二叔丁基-9,10-双(己氧基)芘(5.36g,8mmol),氰化亚铜(5.73g,64.94mmol)加入到无水nmp(133ml)中。在氮气保护中将混合物在180℃下搅拌6小时。然后,除去溶剂并冷却。向烧瓶中加入过量的三氯化铁的盐酸溶液,并在100℃下搅拌过夜。过滤沉淀物,滤液用乙酸乙酯(3×100ml)萃取。将合并的有机相用饱和盐水洗涤,之后用无水硫酸镁干燥并浓缩。通过柱层析(石油醚/二氯甲烷,4:1)纯化粗产物,得到产物为黄色固体。
反应方程如下:
(6)合成2,7-二叔丁基-9,10-双(己氧基)芘-4,5-二羧酸
将化合物2,7-二-叔-丁基-9,10-双(己氧基)芘-4,5-二腈(1g,1.77mmol),氢氧化钾加入到乙醇/水(1:1,50ml)的混合溶液中,并在加热回流下搅拌过夜。冷却后,用浓盐酸将反应混合物酸化至ph=1,过滤溶液,得到的粗产物为橙色固体,不用提纯直接进行下一步反应。
反应方程如下:
(7)合成cis-b2ipio和trans-b2ipio
将1,2,4,5-苯四胺四盐酸盐(15mg,3mmol)和2,7-二叔丁基-9,10-双(己氧基)芘-4,5-二羧酸(110mg,1mmol)加入到吡啶(5ml)中。混合物在氮气保护下加热至110℃并搅拌过夜。通过抽滤除去溶剂,固体残余物是顺式和反式异构化产物的粗品b2ipio。可以通过柱层析(石油醚/二氯甲烷,4:1)分离顺式和反式异构体产物。顺式产物cis-b2ipio为红色固体,反式产物trans-b2ipio为黑红色固体。顺式产物的产率约为40%,反式产物的产率约为10%。
反应方程如下:
合成bipio
将1,2-二氨基苯(203mg,1mmol)和2,7-二叔丁基-9,10-双(己氧基)芘-4,5-二羧酸(602mg,1mmol)加入乙酸(5ml)中。混合物加热至回流并搅拌1小时。然后通过旋转蒸发器除去溶剂,粗产物用乙酸乙酯萃取并用水(3×100ml)洗涤,并通过柱色谱(石油醚/二氯甲烷,1:1)纯化。红色固体,70%收率。
反应方程如下:
实施例3
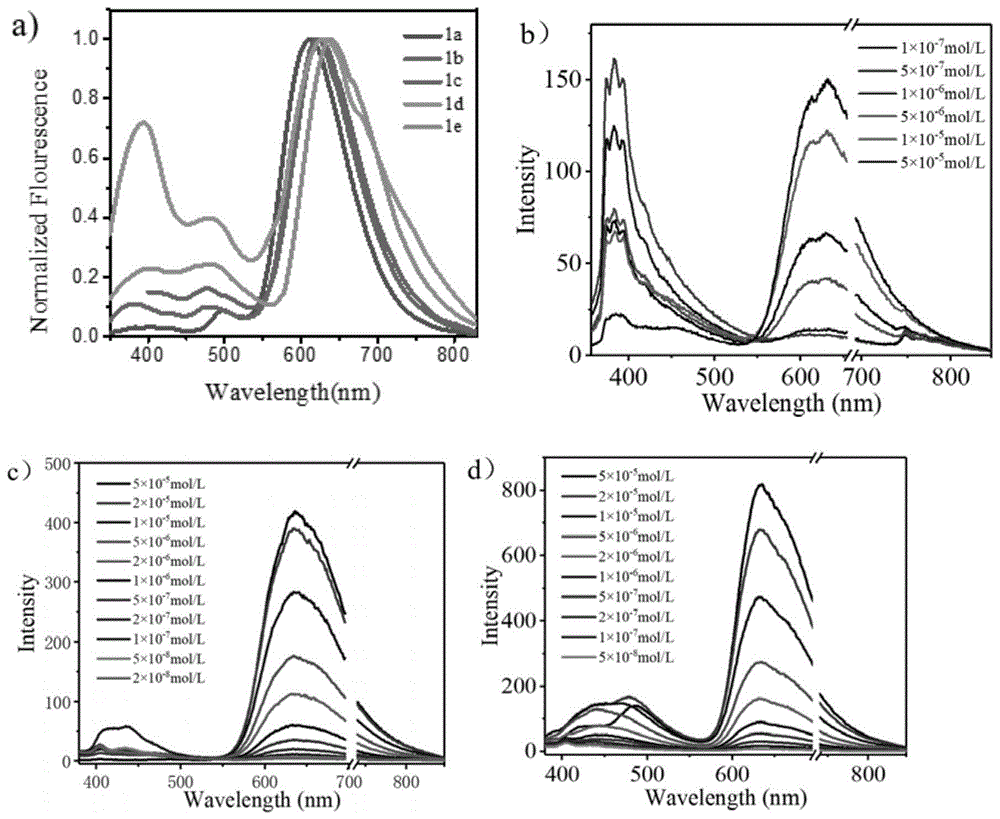
将实施例1中制备得到的化合物1a,1b,1c,1d和1e在溶液状态下分别进行荧光发射光谱的测定。测定图谱参照图1a所示,由图1a可以得出,在610-640nm处化合物1a-e出现了最强发射峰,且从a至e发射峰的峰波长逐渐红移(1a:621nm、1b:621nm、1c:625nm、1d:630nm、1e:638nm)。
实施例4
将实施例2中制备得到的化合物bipio,cis-b2ipio和trans-b2ipio在溶液状态下分别进行荧光发射光谱的测定。测定图谱参照图1b-d所示,由图1b可以得出,化合物bipio在低浓度下,出现峰值为300nm的发射带。随着浓度逐渐增加,新的发射带出现在600nm处。650nm处的结构化发射带的出现是由于激准分子的形成。新发射带600nm的出现伴随着低波长发射带的减少。进一步将浓度增加,低波长的发射峰消失,仅留下600nm的发射峰。
由图1c,1d可以得出,当化合物bipio的共轭程度进一步增加时,在不同浓度的cis-b2ipio(图1c)和trans-b2ipio(图1d)溶液中的荧光发射光谱中未发生上述现象。
实施例5
将实施例1中制备得到的化合物1a,1b,1c,1d和1e以及实施例2中制备得到的化合物cis-b2ipio和trans-b2ipio在固体状态下分别进行荧光发射光谱的测定。参照图2所示,图2a显示,除1-b较1-a的峰波长蓝移之外,1c-e的峰波长均出现红移现象(1a:642nm、1b:627nm、1c:649nm、1d:682nm、1e:684nm)。由于化合物分子间具有较强的作用力,化合物1a-1e从溶液状态到固体状态并没有发生荧光猝灭现象。由图2a和图2b可得,1a,1b,1c,1d和1e以及cis-b2ipio和trans-b2ipio在固体状态下均能在365nm紫外照射下发出红光。
实施例6
对化合物1a,1b,1c,cis-b2ipio和trans-b2ipio制成的场效应器件分别进行电流-电压特性检测,可以得出不同的化合物表现出不同的电流电压传输性能。参照图3所示,化合物1a(图3a)是一个空穴传输材料,化合物1c(图3b)表现出传输电子的能力,化合物1b(图3c,图3d)表现出传输空穴和电子的能力。化合物cis-b2ipio(图3e,3f)和trans-b2ipio(图3g,3h)均表现出传输空穴和电子的能力,但由于溶液法制场效应器件的原因,其表现出的电荷传输能力较差。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。