一种检测溶酶体极性的双光子荧光探针及其制备方法和应用与流程
本发明属于分析化学技术领域,具体涉及一种检测溶酶体极性的荧光探针及其应用。
背景技术:
极性作为影响生物体微环境变化的重要参数,在化学和化学生物学中起着至关重要的作用。目前,荧光成像技术由于其高灵敏度、无创检测和高选择性,已成为检测生物微极性环境的有力工具。极性决定了大量蛋白质和酶之间的相互作用的活性,反映了膜室的渗透性,细胞内极性反映了生物系统中许多复杂的生理和病理过程。许多细胞事件,如脂肪细胞分化,免疫反应激活,细胞迁移和死亡,以及分子跨细胞层的运输等都与细胞的极性变化有关。
溶酶体作为细胞中呈弱酸性的细胞器(ph4.5-5.5),是生物大分子运送降解的主要位点,主要是通过生物合成和内吞途径。其本身的功能用途主要是分解细胞中核酸、碳水化合物和脂质等成分。而极性则是影响着溶酶体功能的正常运作的一个重要因素,溶酶体极性的异常会带来许多疾病。因此研究溶酶体极性在疾病模型中的变化具有重要意义。
荧光成像分析法具有灵敏度高、选择性好、响应迅速、操作简单等优点,而且检测条件对细胞基本没有损伤,已经广泛用于各种生物小分子的检测。目前,用于检测细胞内溶酶体的探针也得到了迅速发展,其中一些已经商品化。但是,目前已有报道的溶酶体极性探针毒性较大而且只能用于细胞试验,而不能用于生物体,这极大限制了其在溶酶体生理功能上的应用。
技术实现要素:
针对目前溶酶体极性探针大部分只应用在细胞层面上检测溶酶体极性,本发明提供一种靶向溶酶体的探针可对不同极性作出响应,能够实现检测不同发育时期斑马鱼的极性变化,该探针具有低毒性和良好的极性响应性,能实现生物体内溶酶体极性的检测。
本发明的另一目的是提供一种上述荧光探针的合成方法,原料易得、合成步骤简单、收率高。
为实现上述目的,本发明采用如下技术方案。
一种检测细胞内溶酶体极性的荧光探针,化学名称为4-三苯基胺基-n-(2-n-吗啉基乙基)-1,8-萘酰胺,简称为mnd-lys,结构式如式(i):
式(i)。
一种上述荧光探针的合成方法,包括以下步骤:
(1)4-溴-1,8-萘二甲酸酐(1)的乙醇溶液与n-(2-氨基乙基)吗啉(2)于乙醇中加热反应,分离纯化得到4-溴-n-(2-n-吗啉基乙基)-1,8-萘酰胺(3)
(2)4-溴-n-(2-n-吗啉基乙基)-1,8-萘酰胺(3)与4-硼酸三苯胺(4)在碳酸钾和四(三苯基膦)钯存在下于四氢呋喃中加热回流,分离纯化得4-三苯基胺基-n-(2-n-吗啉基乙基)-1,8-萘酰胺,即mnd-lys:
步骤(1)中,所述4-溴-1,8-萘二甲酸酐与n-(2-氨基乙基)吗啉的摩尔比为1:1.3。
步骤(1)中,步骤(1)体系反应后体系直接抽滤,可得纯净物。
步骤(1)中,所述反应温度为70℃,反应时间为12h。
步骤(2)中,所述反应温度为60℃,反应时间为12h。
步骤(2)中,所述4-溴-n-(2-n-吗啉基乙基)-1,8-萘酰胺:碳酸钾:4-甲酰基苯硼酸:四(三苯基膦)钯的摩尔比为1:3:1.2:0.03。
步骤(2)中,所述分离纯化步骤为:将反应后的体系减压蒸馏,旋干溶剂得到粗产物后,经柱色谱分离得到提纯产物;所述柱色谱分离的流动相优选为体积比为1:5的乙酸乙酯与石油醚。
一种上述荧光探针在制备检测细胞或者生物体中溶酶体极性试剂的应用。
本发明的机理如下:
在探针结构中,“吗啉”是一个良好的定位溶酶体的靶向基团,由于“1,8-萘酐”是一个吸电子基团,“4-三苯氨基”是一个供电子基团,所以在探针mnd-lys结构中,存在由“1,8-萘酐”部分向“4-三苯氨基”部分发生电子转移,即分子内电子转移(ict)效应。正是这种ict效应使探针具有“溶剂化效应”。在高极性体系中,由于探针与周围溶剂发生耦极-耦极相互作用,使得探针通过非辐射形式损失能量,荧光强度降低,发出弱的荧光;相反,在低极性溶剂中,这种耦极-耦极之间的相互作用降低,探针主要通过辐射的方式发出荧光,荧光量子产率增加,发出强的荧光。所以,该探针能够实现溶酶体极性的监测。
本发明具有以下优点:
本发明所提供的检测不同溶酶体极性的荧光探针,能准确的定位于溶酶体,具有较高的灵敏度,良好的光学稳定性以及对极性特异性响应;并且实现了对细胞内溶酶体极性的检测。同时,本发明提供了该探针的合成方法,步骤简单、纯化方便、收率高。在检测细胞和生物体溶酶体生理作用方面具有应用前景。
附图说明
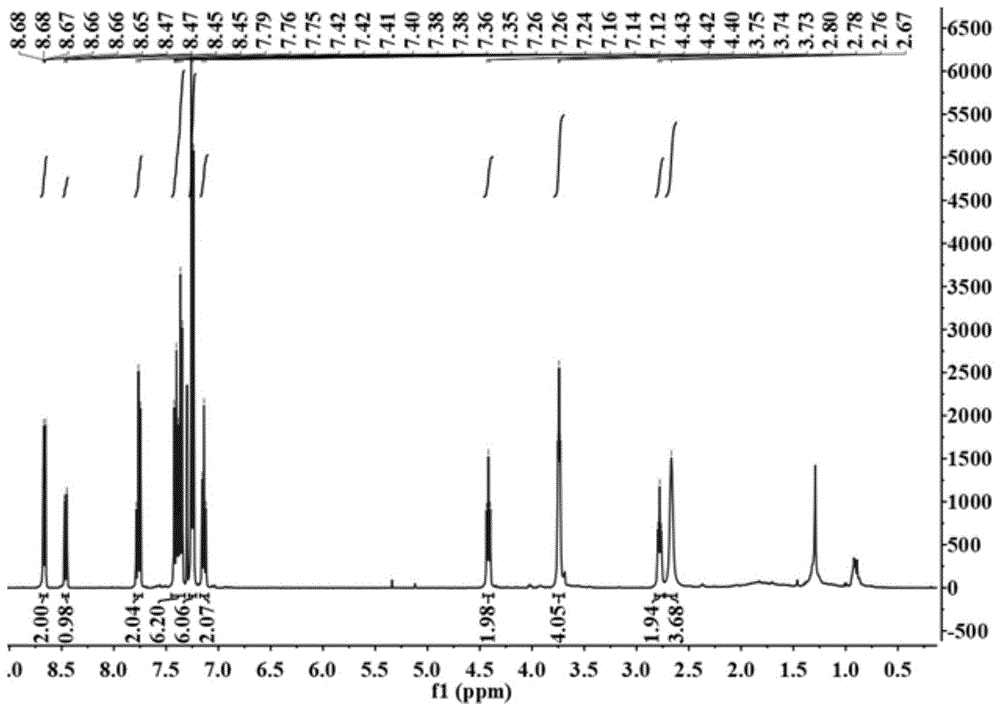
图1是探针的1hnmr谱;
图2是探针的13cnmr谱;
图3是探针在不同极性溶剂中的发射光谱;
图4是探针与商业化溶酶体染料的共定位;
图5是探针在hela细胞内的毒性试验;
图6是探针在不同细胞中的成像应用;
图7是探针在不同时期斑马鱼中的成像应用。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
实施例1荧光探针的合成
(1)将0.277g4-溴-1,8-萘二甲酸酐(1mmol)和0.169gn-(2-氨基乙基)吗啉(1.3mmol)加入装有20ml乙醇的茄形瓶中,搅拌均匀后,放入70℃油浴锅中恒温反应,反应约12h,反应完成后,出现沉淀,抽滤后,可得纯产物4-溴-n-(2-n-吗啉基乙基)-1,8-萘酰胺;
(2)称量0.278g4-溴-n-(2-n-吗啉基乙基)-1,8-萘酰胺(2mmol),和0.578g4-硼酸三苯胺(2mmol)、57mg四-(三苯基膦钯)(0.05mmol)、0.828g碳酸钾(6mmol)于四氢呋喃溶剂中混合反应,除氧,升温至60℃回流,在n2氛围环境下反应12h后,进行减压蒸馏,旋干溶剂,然后以体积比为1:5的乙酸乙酯与石油醚为流动相进行柱色谱分离提纯得4-三苯基胺基-n-(2-n-吗啉基乙基)-1,8-萘酰胺,即探针mnd-lys。探针1hnmr谱如图1,13cnmr谱如图2:
1hnmr(400mhz,chloroform-d)δ8.67(m,2h),8.46(dd,j1=8.6,j1=1.0,hz,1h),7.77(t,j=8.2hz,2h),7.38(m,6h),7.25(j=4.4hz,6h),7.14(t,j=7.4hz,2h),4.42(t,j=7.0hz,2h),3.74(j=4.4hz,,4h),2.78(t,j=6.8hz,2h),2.67(s,4h)
13cnmr(101mhz,cdcl2-d2)δ164.29,148.64,147.74,146.99,134.94,133.02,132.41,131.19,131.14,130.96,130.36,129.74,129.47,129.30,127.94,126.96,125.27,124.73,124.42,123.87,123.27,123.13,122.96,122.88,67.28,67.10,56.41,54.22,53.55,37.58。
实施例2荧光探针在不同极性溶剂中的发射光谱
配制浓度为1mm实施例1所得荧光探针mnd-lys的二甲基亚砜(dmso)的测试母液待用。
测试液中,分别取3ml不同极性的溶剂:环己烷(cyclohexane)甲苯(toluene),二氧六环(dioxane),四氢呋喃(thf),二氯甲烷(dcm),丙酮(acetone),然后加入浓度为1mm的探针母液,使得测试液中探针的最终浓度为10μm,然后进行荧光扫描(激发波长430nm,检测波段450-700nm),得各体系中荧光强度,如图3所示。由图3可知,随着溶剂极性的增加,光谱红移,荧光强度减弱。
实施例3荧光探针与商业化溶酶体染料的共定位
配制浓度为1mm实施例1所得荧光探针mnd-lys的二甲基亚砜(dmso)的测试母液待用;配制浓度为1mm的市售的溶酶体红(溶酶体的专用定位剂)的二甲基亚砜(dmso)的测试母液待用。
将适当密度的hela细胞接种到灭菌的35mm成像培养皿中,在co2培养箱(温度为37℃,5%co2)中培养,待细胞贴壁后,同时向细胞中荧光探针mnd-lys以及溶酶体商业化染料溶酶体红,使荧光探针最终浓度为10μm,溶酶体红最终浓度为2.0μm。半小时后,弃掉培养基,用pbs缓冲液冲洗细胞3次,随后进行荧光成像(激发波长:488nm,绿色通道500-550nm),成像结果如图4所示:其中,(a)为mnd-lys在绿色通道的成像图;(b)为溶酶体红在红色通道的成像图;(c)是(a)和(b)的叠加图;(d)为(a)和(b)的光谱强度叠加图;(e)两个通道的强度散点图;(f)是细胞明场成像图。由图4可知,该探针与溶酶体红的成像位置高度吻合,共定位系数高达0.94,说明探针mnd-lys主要定位在细胞中的溶酶体内,因而本发明的探针可以用来检测细胞中的极性。
实施例4荧光探针对hela细胞的毒性
用标准mtt法研究探针对hela细胞的毒性。将密度为2×104细胞/毫升的细胞铺在96孔板中,贴壁24h;然后用不同浓度的探针(0-50μm)孵育24h;然后将10μl的mtt(5mg/ml)加到每个小孔内再孵育4h;最后将培养基倒掉,再加入100μl的dmso溶解甲瓒晶体;将96孔板震荡10min,然后检测490nm光下的吸光值。细胞存活率通过下述公式计算得到:
其中,asample为实验组吸光度,ac为对照组吸光度,ab为空白组的吸光度。
如图5所示,在探针浓度为50μm以内,细胞的活性高达90%,说明探针具有较低的细胞毒性,可以用于生物体内溶酶体极性的检测。
实施例5荧光探针在活细胞中的成像应用
配制浓度为1mm实施例1所得荧光探针mnd-lys的二甲基亚砜(dmso)的测试母液待用。
将适当密度的hela分别接种到两个灭菌的35mm成像培养皿中,在co2培养箱(温度为37℃,5%co2)中培养,待细胞贴壁后,向a组加入荧光探针mnd-lys,使探针的最终浓度为10μm,弃掉培养基,用pbs缓冲液冲洗细胞3次,随后进行荧光成像;b组先用蔗糖(sucrose)溶液(80mm)孵育10分钟,然后再加入探针,探针的最终浓度为10μm,弃掉培养基,用pbs缓冲液冲洗细胞3次,随后进行荧光成像(激发波长:488nm;发射波段:500-550nm),荧光成像结果如图6所示。由图6可知,用蔗糖处理过的细胞的荧光强度比正常处理的细胞的荧光强度弱,说明蔗糖处理后细胞内溶酶体的极性变弱。本发明的探针的荧光强弱能够对不同极性溶酶体作出响应。
实施例6荧光探针在不同时期斑马鱼的成像应用
利用探针mnd-lys测量了斑马鱼胚胎发育阶段和青年成鱼阶段的极性差异。利用浓度为10μm的探针孵育斑马鱼胚胎和成年斑马鱼个30min;然后用双光子共聚焦显微镜在4倍镜下成像斑马鱼。如图7所示,胚胎时期的斑马鱼明显比成年斑马鱼荧光强度强。此外,用尼康a1mp共聚焦显微镜计算了斑马鱼在不同阶段的平均荧光强度,结果表明胚胎时期的斑马鱼的荧光强度比成年斑马鱼的荧光强度高大约1.8倍。这些现象说明胚胎时期的斑马鱼的极性比成年斑马鱼的极性低。
- 还没有人留言评论。精彩留言会获得点赞!