microRNA-200簇微小RNA在促进骨髓间充质干细胞向成骨细胞分化的应用的制作方法
本发明属于生物领域。具体地,涉及microrna-200微小rna在促进骨髓间充质干细胞向成骨细胞分化的应用。
背景技术:
老年骨质疏松发病率高,临床并发症多,致死率致残率高,引起的骨痛、骨折、骨骼畸形、骨坏死和骨不连接等并发症治疗困难棘手,一直是困扰临床医生和病人的问题。相对于绝经后骨质疏松,老年性骨质疏松的特点为成骨细胞功能降低,骨质量受损,骨骼强度发生不可逆转的改变,但目前临床上治疗老年性骨质疏松缺乏有效手段,治疗药物非常有限,因为不能有效提高骨强度,所以往往不能从本质上改善病情。
研究发现,增龄相关的成骨细胞功能减退主要原因为,骨髓间充质干细胞(mscs)向成骨分化减少,而向脂肪细胞分化增加,导致老年人的骨髓腔中红骨髓减少,取而代之的是大量脂肪组织形成的黄骨髓。所以,提高老年成骨细胞功能,增加骨质形成的关键在于促进间充质干细胞向成骨细胞的分化,减少其向脂肪细胞的分化。msc向成骨细胞分化是目前研究热点,已有大量文献报道骨形态发生蛋白(bonemorphogeneticprotein,bmp-2)-osterix信号通路在该过程中的作用。随着microrna的发现,其通过bmp信号通路在msc成骨向分化过程中所起的调控作用也日益受到重视。在骨科系统损伤中,大约l0-l5%的病例存在骨愈合问题,并且需要外部干预促进骨生长。因此,骨分化、骨愈合方面研究对于临床治疗具有重大意义。
msc的成骨分化是目前研究骨再生愈合的热点,也是骨关节组织工程的基础。而bmps是目前已知的最重要的成骨促进因子,目前对其功能的研究主要集中在干细胞向成骨方向分化过程中所起的骨形成诱导作用。
因此,本领域迫切需要开发一种能够治疗/预防成骨功能低下的方法。
技术实现要素:
本发明提供了microrna-200簇微小rna在促进骨髓间充质干细胞向成骨细胞分化的应用。
在本发明的第一方面,提供了一种活性成分的用途,所述的活性成分选自下组:
(a).mirna-200簇的微小rna,
其中,所述mirna-200簇的微小rna选自下组:
(a1)mirna-200类微小rna,所述的mirna-200类微小rna选自下组:mir-200a、mir-200b、mir-200c、mir-141和mir-429;
(a2)经修饰的mirna-200类微小rna衍生物;或核心序列为aauacug、长度为2-8nt、功能与mirna-200类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;
(b).前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna-200簇的微小rna;
(c).多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;
(d).表达载体,所述表达载体含有(a)中所述的mirna-200簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;
(e).(a)中所述的微小rna的激动剂;
其中,所述的活性成分用于制备一药物组合物,所述药物组合物用于治疗/预防成骨功能低下疾病。
在另一优选例中,所述的mirna-200a的序列如seqidno.:1所示:5'-uguagcaauggucugucacaau-3'。
在另一优选例中,所述的mirna-200b的序列如seqidno.:2所示:5'-aguaguaaugguccgucauaau-3'。
在另一优选例中,所述的mirna-200c的序列如seqidno.:3所示:5'-agguaguaaugggccgucauaau-3'。
在另一优选例中,所述的mirna-141的序列如seqidno.:4所示:5'-gguagaaauggucugucacaau-3'。
在另一优选例中,所述的mirna-429的序列如seqidno.:5所示:5'-ugccaaaauggucugucauaau-3'。
在另一优选例中,所述成骨功能低下疾病选自下组:老年性骨质疏松症、糖皮质激素性骨质疏松、骨折不愈合或延迟愈合、骨不连接、骨坏死、糖尿病合并骨质疏松、hiv合并骨质疏松、或其组合。
在另一优选例中,所述的药物组合物包括所述的活性成分和药学上可接受的载体。
在另一优选例中,所述的mirna-200簇的微小rna来源于哺乳动物,优选地,来源于人、大鼠、或小鼠。
在另一优选例中,所述的mirna-200簇的微小rna是人工合成的。
在另一优选例中,所述的药物组合物还包括额外的用于治疗/预防成骨功能低下的辅助活性成分。
在另一优选例中,所述的经修饰的mirna衍生物,其修饰选自下组的一种或多种修饰形式:核苷酸的糖基修饰、核苷酸之间连接方式的修饰、胆固醇修饰、锁核苷酸修饰、肽段修饰、脂类修饰、卤素修饰、烃基修饰、和核酸修饰。
在另一优选例中,所述的核苷酸的糖基修饰包括2-o-甲基的糖基修饰、2-o-甲氧乙酯的糖基修饰、2-o-烷基的糖基修饰、2-氟代的糖基修饰、糖环修饰、锁核苷酸修饰;和/或
所述的核苷酸之间连接方式的修饰包括硫代磷酸修饰、磷酸烷基化修饰;和/或
所述的核酸修饰包括“tt”修饰。
在另一优选例中,(a)中所述经修饰的mirna衍生物是具有式i所示结构的化合物单体或其多聚体:
(x)n-(y)m(i)
式中,
各x为(a)中所述的微小rna;
各y独立地为促进微小rna施药稳定性的修饰物;
y连接于x的左侧、右侧或中间;
n为1-100的(较佳地1-20)正整数(较佳地n为1、2、3、4或5);
m为1-1000的(较佳地1-200)正整数;
各“-”表示接头、化学键、或共价键。
在另一优选例中,所述的接头是长度为1-10个碱基的核酸序列。
在另一优选例中,所述的y包括(但不限于)胆固醇、类固醇、甾醇、醇、有机酸、脂肪酸、酯、单糖、多糖、氨基酸、多肽、单核苷酸、多核苷酸。
在另一优选例中,(b)所述的前体mirna的核苷酸序列如seqidno.:6所示:
5'-ccagcucgggcagccguggccaucuuacugggcagcauuggauggagucaggucucuaauacugccugguaaugaugacggcggagcccugcacg-3'。
在另一优选例中,(c)中所述的多核苷酸具有式ii所示的结构:
seq正向-x-seq反向
式ii,
式ii中,
seq正向为能在宿主中被加工成所述的微小rna核苷酸序列;
seq反向为与seq正向基本上互补或完全互补的核苷酸序列;
x为位于seq正向和seq反向之间的间隔序列,并且所述间隔序列与seq正向和seq反向不互补;
并且式ii所示的结构在转入宿主细胞后,形成式iii所示的二级结构:
式iii中,seq正向、seq反向和x的定义如上述,
||表示在seq正向和seq反向之间形成的碱基互补配对关系。
在另一优选例中,(d)中所述的表达载体包括:病毒载体和非病毒载体。
在另一优选例中,(e)中所述mirna-200簇的微小rna的激动剂选自下组:促进mirna-200簇的微小rna表达的物质、提高mirna-200簇的微小rna活性的物质。
在另一优选例中,所述的药学上可接受的载体选自下组:水、盐水、脂质体、脂质、蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。
在本发明的第二方面,提供了一种药物组合物,所述的药物组合物含有活性成分,和药学上可接受的载体,其中,所述的活性成分选自:
(a).mirna-200簇的微小rna,
其中,所述mirna-200簇的微小rna选自下组:
(a1)mirna-200类微小rna,所述的mirna-200类微小rna选自下组:mir-200a、mir-200b、mir-200c、mir-141和mir-429;
(a2)经修饰的mirna-200类微小rna衍生物;或核心序列为aauacug、长度为2-8nt、功能与mirna-200类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;
(b).前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna-200簇的微小rna;
(c).多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;
(d).表达载体,所述表达载体含有(a)中所述的mirna-200簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;
(e).(a)中所述的微小rna的激动剂;
(f)任选的第二活性成分,所述第二活性成分为其他的治疗/预防成骨功能低下的药物;和
(g)药学上可接受的载体。
在另一优选例中,所述的其他的治疗/预防成骨功能低下的药物选自下组:甲状旁腺激素及其类似物、维生素k2等。
在本发明的第三方面,提供了一种筛选治疗成骨功能疾病的候选化合物的方法,包括步骤:
(a)将加入测试化合物的培养体系作为实验组;将不加入测试化合物的培养体系作为空白对照组,其中,所述的培养体系中含有培养的骨髓间充质干细胞;和成骨培养基。
(b)测试实验组和空白对照组中所述骨髓间充质干细胞中osterix、bmp-2或alp的表达量;
其中,当实验组中osterix、bmp-2或alp的表达量显著高于对照组时,则表明该测试化合物为治疗成骨功能疾病的候选化合物。
在另一优选例中,所述“显著高于”指在实验组中osterix、bmp-2或alp的表达量e1与空白实验组中osterix、bmp-2或alp的表达量e0之比(e1/e0)≥2,较佳地≥3,更佳地≥4。
在本发明的第四方面,提供了一种治疗/预防成骨功能低下的方法,包括步骤:向需要的对象施用权利要求2所述的药物组合物,或施用一活性成分,所述活性成分选自下组:
(a).mirna-200簇的微小rna,
其中,所述mirna-200簇的微小rna选自下组:
(a1)mirna-200类微小rna,所述的mirna-200类微小rna选自下组:mir-200a、mir-200b、mir-200c、mir-141和mir-429;
(a2)经修饰的mirna-200类微小rna衍生物;或核心序列为aauacug、长度为2-8nt、功能与mirna-200类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;
(b).前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna-200簇的微小rna;
(c).多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;
(d).表达载体,所述表达载体含有(a)中所述的mirna-200簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;
(e).(a)中所述的微小rna的激动剂。
在另一优选例中,所述对象为哺乳动物,较佳地,为人、小鼠、或大鼠。
在另一优选例中,所述方法在成骨诱导条件下进行。
本发明人发现的微小rna-200b-3p(mirna-200b-3p)能在转录后水平调控基因表达,促进bmp-osterix信号通路从而促进mscs的成骨向分化。bmp-2属多肽生长因子/转化生长因子超家族,在有丝分裂、趋化性、骨形态生成及细胞凋亡中都发挥了广泛作用,特别是在成骨诱导方面,目前它是得到公认的能够有效促进骨形成的蛋白。friediaender等和govender等分别证明了大剂量bmp-2可以提高骨缺损的愈合率。zhu等发现,通过向msc中共转染bmp-2和bmp-7能够,促使其向成骨细胞分化,同时能够增强脊柱融合效果。baitzer等通过转基因技术,发现bmp-2可以促进骨愈合,而egermann等通过将携带bmp-2腺病毒注射到大段骨缺损的成年羊模型体内,成功提高了骨缺损的愈合速度。abe等也发现通过转染腺病毒载体编码的bmp-2,可以显著提高骨髓msc细胞的碱性磷酸酶活性,并促进骨缺损的愈合。
mirnas是近几年发现的一类非编码小rnas,能够降解靶基因的mrna,从而起到转录后调控作用,是对传统调控机制的重要补充,其具有一对多和多对一的特征。现在针对mirnas研究主要集中于干细胞分化、肿瘤及多种疾病的发生和发展机制上。随着对mirnas研究的深入,针对其在干细胞向成骨系细胞分化过程中所发挥的作用也逐步被揭示。
已知mirna的靶位点大多位于mrna的3’-非翻译区(3’-untranslatedregion,3’-utr),功能性的单链(maturemirna,成熟mirna)被整合到rna诱导沉默复合体(rna-inducedsilencingcomplex,risc)中,与靶mrna结合,通过mrna剪切、mrna去腺苷或抑制翻译等方式在转录后水平抑制基因表达。这种调节方式依赖于mirna种子区序列(2~7nt)与靶mrna3’-非翻译区序列的互补配对。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
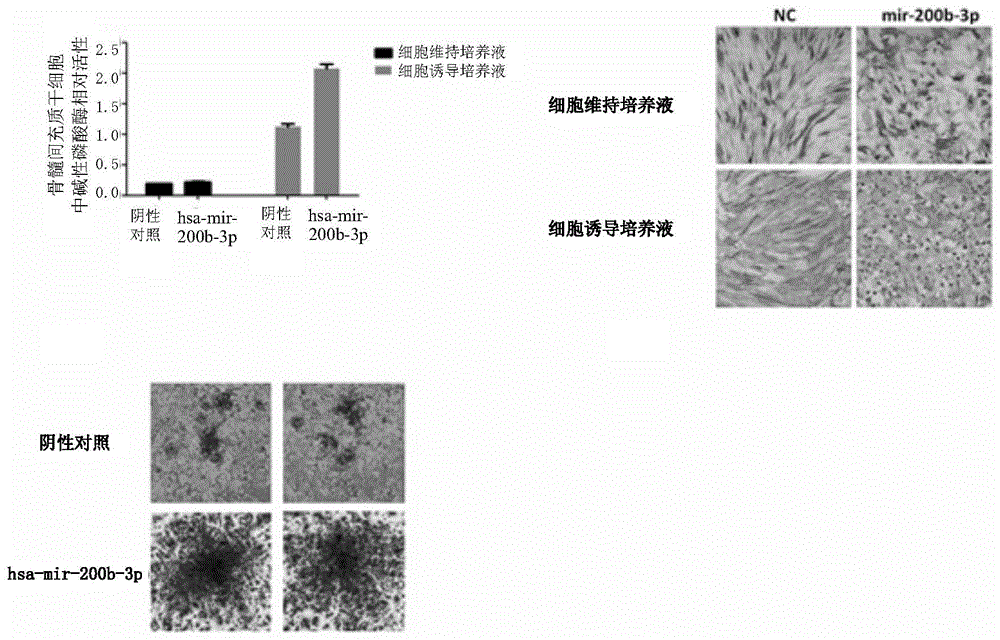
图1显示了microrna转染msc对msc成骨向分化的影响,发现mir-200b-3p对msc的成骨分化的作用。
图2显示了采用碱性磷酸酶染色和定量测定的方法进一步证实了转染mir-200b-3p对msc成骨向分化的促进作用。
图3显示了比较mir-200b-3p转染与对照组的msc的碱性磷酸酶(alp)、骨钙素(osteocalcin)、osterix和bmp-2的基因表达,结果表明mir-200b-3p显著性促进msc的alp、osterix、bmp-2的表达。
具体实施方式
本发明人经过广泛而深入的研究,首次意外地发现,mirna-200簇的微小rna能够上调msc的bmp-2基因和蛋白表达,特别是能够促进间充质干细胞向成骨细胞的分化,增强碱性磷酸酶活性和钙沉积,从而达到促进成骨细胞,促进骨形成、修复骨缺损或治疗骨坏死及骨质疏松等疾病的效果。在此基础上,完成了本发明。
成骨功能低下疾病
在本发明中,所述成骨功能低下疾病没有特别限制,包括本领域中已知的各种与成骨功能低下相关的疾病。代表性的、与成骨功能低下相关的疾病例子包括(但并不限于):老年性骨质疏松症、糖皮质激素性骨质疏松、骨折不愈合或延迟愈合、骨不连接、骨坏死、糖尿病合并骨质疏松、hiv合并骨质疏松等。
mirna及其前体
微小rna(microrna,简称mirna)是近年来在线虫,果蝇和植物,哺乳动物等真核生物中发现的一种内源性的长度为22个核苷酸左右的非编码单链小rna。它在表达上具有组织和时间的特异性,通过与靶mrna的碱基互补配对而在转录后水平上对基因的表达进行负调控,导致mrna的降解或翻译抑制,是调节其他功能基因表达的重要调控分子。越来越多的证据表明mirna虽然微小,但它通过与靶mrna形成完全或者不完全互不配对从而对生物体的各种生命过程有着至关重要的作用。本发明提供了一类涉及通过抑制p110α蛋白从而治疗脂肪肝的mirna。如本文所用,所述的“mirna”是指一类rna分子,从可形成mirna前体的转录物加工而来。成熟的mirna通常具有18-26个核苷酸(nt)(更特别的约19-22nt),也不排除具有其它数目核苷酸的mirna分子。mirna通常可被northern印迹检测到。
人来源的mirna可被从人细胞中分离。如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和多肽是没有分离纯化的,但同样的多聚核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。
mirna可从前体mirna(precursormirna,pre-mirna)加工而来,所述的前体mirna可折叠成一种稳定的茎环(发夹)结构,所述的茎环结构长度一般在50-100bp之间。所述的前体mirna可折叠成稳定的茎环结构,茎环结构的茎部两侧包含基本上互补的两条序列。所述的前体mirna可以是天然的或是人工合成的。
前体mirna可被剪切生成mirna,所述的mirna可与编码基因的mrna的至少一部分序列基本上互补。如本文所用,“基本上互补”是指核苷酸的序列是足够互补的,可以以一种可预见的方式发生相互作用,如形成二级结构(如茎环结构)。通常,两条“基本上互补”的核苷酸序列互相之间至少有70%的核苷酸是互补的;优选的,至少有80%的核苷酸是互补的;更优选的,至少有90%的核苷酸是互补的;进一步优选的,至少有95%的核苷酸是互补的;如98%、99%或100%。一般地,两条足够互补的分子之间可以具有最多40个不匹配的核苷酸;优选的,具有最多30个不匹配的核苷酸;更优选的,具有最多20个不匹配的核苷酸;进一步优选的,具有最多10个不匹配的核苷酸,如具有1、2、3、4、5、8、11个不匹配的核苷酸。
如本申请所用,“茎环”结构也被称作“发夹”结构,是指一种核苷酸分子,其可形成一种包括双链区域(茎部)的二级结构,所述的双链区域由该核苷酸分子的两个区域(位于同一分子上)形成,两个区域分列双链部分的两侧;其还包括至少一个“环”结构,包括非互补的核苷酸分子,即单链区域。即使该核苷酸分子的两个区域不是完全互补的,核苷酸的双链部分也可保持双链状态。例如,插入、缺失、取代等可导致一个小区域的不互补或该小区域自身形成茎环结构或其它形式的二级结构,然而,该两个区域仍可基本上互补,并在可预见的方式中发生相互作用,形成茎环结构的双链区域。茎环结构是本领域技术人员所熟知的,通常在获得了一条具有一级结构的核苷酸序列的核酸后,本领域技术人员能够确定该核酸是否能形成茎环结构。
在另一优选例中,所述的微小rna来源于人或非人哺乳动物;较佳地所述的非人哺乳动物为大鼠、小鼠,鼠和人的mirna-200簇的序列完全一致。所述的“功能与mirna-200簇相同或基本相同”是指保留了mirna-200簇的≥40%、≥50%、≥60%、≥70%、≥80%、≥90%的成骨功能低下相关疾病。
本发明还包括mirna变体和衍生物。此外,广义上的mirna衍生物也可包括mirna变体。本领域的普通技术人员可以使用通用的方法对mirna-200簇进行修饰,修饰方式包括(但不限于):甲基化修饰、烃基修饰、糖基化修饰(如2-甲氧基-糖基修饰、烃基-糖基修饰、糖环修饰等)、核酸化修饰、肽段修饰、脂类修饰、卤素修饰、核酸修饰(如“tt”修饰)等。
多核苷酸构建物
根据本发明所提供的mirna序列,可设计出在被导入后可被加工成可影响相应的mrna表达的mirna的多核苷酸构建物,也即所述多核苷酸构建物能够在体内上调相应的mirna的量。因此,本发明提供了一种分离的多核苷酸(构建物),所述的多核苷酸(构建物)可被人细胞转录成前体mirna,所述的前体mirna可被人细胞剪切且表达成所述的mirna。
作为本发明的一种优选方式,所述的多核苷酸构建物含有式ii所示的结构:
seq正向-x-seq反向
式ii
式ii中,
seq正向为可在细胞中表达成所述的mirna-27b的核苷酸序列,seq反向为与seq正向基本上互补的核苷酸序列;或者,seq反向为可在细胞中表达成所述的mirna的核苷酸序列,seq正向为与seq正向基本上互补的核苷酸序列;x为位于seq正向和seq反向之间的间隔序列,并且所述间隔序列与seq正向和seq反向不互补;
式i所示的结构在转入细胞后,形成式iii所示的二级结构:
式iii中,seq正向、seq反向和x的定义如上述;
||表示在seq正向和seq反向之间形成的碱基互补配对关系。
通常,所述的多核苷酸构建物位于表达载体上。因此,本发明还包括一种载体,它含有所述的mirna,或所述的多核苷酸构建物。所述的表达载体通常还含有启动子、复制起点和/或标记基因等。本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。
药物组合物及施用方法
如本文所用,术语“活性成分”指的是可用于本发明的mirna-200簇、mirna-200簇衍生物或其前体序列、或含有其的表达载体。优选地,所述的活性成分选自下组:
(a).mirna-200簇的微小rna,
其中,所述mirna-200簇的微小rna选自下组:
(a1)mirna-200类微小rna,所述的mirna-200类微小rna选自下组:mir-200a、mir-200b、mir-200c、mir-141和mir-429;
(a2)经修饰的mirna-200类微小rna衍生物;或核心序列为aauacug、长度为2-8nt、功能与mirna-200类微小rna相同或基本相同的微小rna或经修饰的mirna衍生物;
(b).前体mirna,所述的前体mirna能在宿主内加工成(a)中所述的mirna-200簇的微小rna;
(c).多核苷酸,所述的多核苷酸能被宿主转录形成(b)中所述的前体mirna,并加工形成(a)中所述的微小rna;
(d).表达载体,所述表达载体含有(a)中所述的mirna-200簇的微小rna、或(b)中所述的前体mirna、或(c)中所述的多核苷酸;
(e).(a)中所述的微小rna的激动剂。
如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量,可指为实现预期的效果所需的剂量和时段的有效的量。此有效量可能因某些因子而产生不同的变化,如疾病的种类或治疗时疾病的病症、被施用的特定标的器官的构造、病人个体大小、或疾病或症状的严重性。本领域具有通常知识者不需要过度实验即可凭经验决定特定化合物的有效量。
如本文所用,术语“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
本发明的药物组合物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。
本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
本发明所述的药学上可接受的载体包括(但不限于):水、盐水、脂质体、脂质、蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。载体的选择应与给药方式相匹配,这些都是本领域的普通技术人员所熟知的。
本发明的优点主要包括:
(1)本发明首次提出,mir-200b-3p能够提高碱性磷酸酶的活性,上调bmp-2和osterix基因和蛋白的表达,明显增加间充质干细胞的成骨功能,具有用于成骨功能缺陷性疾病干预治疗的潜力;
(2)本发明发现mir-200b-3p通过调节wnt-bmp2之间的对话,对破骨功能产生影响;
(3)本发明发现mir-200b-3p抑制wnt-b-catenin而调节骨内血管发生,影响肿瘤骨转移或骨肿瘤的扩散。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
在本发明中,如果没有特殊说明,实施例中所用的材料均为市售产品。
通用方法
本发明人首先使用geo数据集gse67630对年轻人的msc与老年人msc的microrna进行差异表达的比较,然后对所有差异表达≥3倍或者≤0.3倍的microrna进行体外功能的验证。
本发明中,所述geo数据集为https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse67630。该数据集是目前应用最广泛且在科研领域、药物开发领域认可程度最高的数据库。本发明使用该数据库可以保证预测的准确性与可靠性。
在本发明中,用“nc”表示阴性对照,其是一种非特异性的mirna模拟物,核酸序列如下:5’-uucuccgaacgugucacguuu-3(seqidno.:7),由上海吉玛公司合成。
本发明中所使用的人间充质干细胞系是在科研以及药物开发领域常用的细胞系。
实施例中所使用的试剂、仪器:
人骨髓间充质干细胞:赛业生物科技有限公司;
msc成骨向诱导培养液:赛业生物科技有限公司;
msc维持细胞培养液:赛业生物科技有限公司;
转染试剂:lipofectaminetmrnaimaxtransfectionreagent购于invitrogen;
碱性磷酸酶活性检测底物:购于sigma
碱性磷酸酶活性染色缓冲液:碧云天
茜素红染色试剂:购于赛业生物科技有限公司
cdna合成试剂,qrt-pcr反应试剂:均购于takara
qrt-pcr引物:均由上海生工生物工程股份有限公司合成
除特别指定外,本发明中所使用的方法均为本领域中的常规方法。
实施例1
mir-200b-3p在成骨诱导条件下促进msc向成骨分化
所用细胞模型为人骨髓间充质干细胞msc,其培养条件如下:用含10%干细胞专用胎牛血清,1%谷氨酰胺的msc基础培养液,于含5%二氧化碳的37℃恒温培养箱中进行细胞培养。在msc细胞中转染20nmhsa-mir-200b-3p或nc(阴性对照),在诱导成骨(induce)的条件下,第7天后检测孔板内alp活性及alp染色,第9天茜素红染色实验。(成骨诱导条件:成骨培养基础培养基(购买自广州赛业生物科技有限公司)+10%fbs+50mg/mll-抗坏血酸+10mm甘油磷酸酯+100nm地塞米松+抗生素)
结果如图1所示,mir-200b-3p在成骨条件下可显著促进msc成骨向分化。
实施例2
mir-200b-3p在成骨诱导条件下时间依赖的增强msc成骨向分化
在人骨髓间充质干细胞msc内分别转染20nm的nc(阴性对照)、mir-200b-3p,在1、3、6、9天检测alp活性。
结果如图2所示,与nc比,随时间的增加,mir-200b-3p可显著增加alp活性。
实施例3
mir-200b-3p在成骨诱导条件下促进mscs细胞中成骨相关基因表达
在人骨髓间充质干细胞msc内分别转染20nm的nc(阴性对照)、mir-200b-3p,检测第七天与成骨相关基因骨钙蛋白(osterix)、bmp-2、alp、锌指转录因子(osteocalcin)、转录水平的表达。
结果如图3所示,与阴性对照相比,mir-200b-3p可促进osterix、bmp-2、alp的mrna水平。
经研究发现,在培养的人骨髓间充质干细胞中,mir-200b-3p可剂量依赖地增加碱性磷酸酶活性(alp)(图1),并alp染色明显增强(图2),mir-200b-3p可引起msc细胞的bmp-2和osterix的基因表达明显升高(图3)。上述结果说明mir-200b-3p确实可以通过上调成骨细胞重要的促进蛋白bmp-2及下游的转录因子osterix,从而起到显著促进间充质干细胞成骨向分化的作用。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>华东医院
中国科学院上海药物研究所
<120>microrna-200簇微小rna在促进骨髓间充质干细胞向成骨细胞分化的应用
<130>p2018-1858
<160>7
<170>siposequencelisting1.0
<210>1
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>1
uguagcaauggucugucacaau22
<210>2
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>2
aguaguaaugguccgucauaau22
<210>3
<211>23
<212>rna
<213>人工序列(artificialsequence)
<400>3
agguaguaaugggccgucauaau23
<210>4
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>4
gguagaaauggucugucacaau22
<210>5
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>5
ugccaaaauggucugucauaau22
<210>6
<211>95
<212>rna
<213>人工序列(artificialsequence)
<400>6
ccagcucgggcagccguggccaucuuacugggcagcauuggauggagucaggucucuaau60
acugccugguaaugaugacggcggagcccugcacg95
<210>7
<211>21
<212>rna
<213>人工序列(artificialsequence)
<400>7
uucuccgaacgugucacguuu21
- 还没有人留言评论。精彩留言会获得点赞!