一种茶树热激蛋白CssHSP-6基因的重组载体和表达方法与流程
本发明涉及一种茶树热激蛋白csshsp-6基因的重组载体和表达方法,属于生物技术领域。
背景技术:
茶树,原名:茶,山茶科、山茶属灌木或小乔木,嫩枝无毛。叶革质,长圆形或椭圆形。茶树的叶子可制茶(有别于油茶树),种子可以榨油,茶树材质细密,其木可用于雕刻。分布主要集中在南纬16度至北纬30度之间,茶树喜欢温暖湿润气候,平均气温10℃以上时芽开始萌动,生长最适温度为20~25℃;年降水量要在1000毫米以上;喜光耐阴,适于在漫射光下生育;一生分为幼苗期、幼年期、成年期和衰老期。
热激蛋白是一类在有机体受到高温等逆境刺激后大量表达的蛋白质,是生物对逆境胁迫短期适应的必需组成成分,对减轻逆境胁迫引起的伤害有很大的作用。它最早是1962年在果蝇中发现并于1974年首先分离得到,现已证明它普遍存在于动物、植物、微生物中。
基因的原核表达是研究基因功能的常用技术之一。蛋白原核表达时常常存在大肠杆菌中由于稀有密码子造成表达限制,形成包涵体;毒性较强的蛋白表达时会抑制蛋白的表达,造成表达产量过低;另外一个容易忽视的问题是大肠杆菌内还原性过高会导致二硫键不能正确形成,导致表达产物不溶。针对上述难题,通常的做法是将包涵体用尿素溶解后在变性的情况下进行纯化,然后复性。但此方法步骤繁琐,成功率低。目前茶树热激蛋白csshsp-6基因已被发现,但如何将其以可溶性形式表达出来尚是本领域的难题。本发明通过选用不同的细菌菌株、采用不同的诱导温度以及诱导剂iptg的浓度来筛选csshsp-6蛋白可溶性表达的条件,为基因功能学、蛋白质晶体等研究打下基础。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种茶树热激蛋白csshsp-6基因的重组载体和表达方法。
本发明的技术方案是:一种茶树热激蛋白csshsp-6基因的重组载体,所述重组载体的制备方法如下:提取茶树叶片的rna,并反转录出cdna;以cdna为模板扩增csshsp-6基因;将csshsp-6扩增产物经ecori和xhoi双酶切后,通过dna连接酶插入到经同样双酶切的pet-28a表达载体中,得到重组质粒pet-28a-csshsp-6。
优选地,以cdna为模板,利用以下引物扩增csshsp-6基因,引物序列如下:
上游引物:csshsp-6-f:gcgaattcatggcgatgattccaag下划线为ecori酶切位点;
下游引物:csshsp-6-r:cgctcgagtcaaccagatatctcaatagactta下划线为xhoi酶切位点;
上下游引物分别如seqidno.3、4所示。
本发明还提供一种表达茶树热激蛋白csshsp-6基因的方法,包括以下步骤:
(1)用权利要求1或1所述的重组载体转化大肠杆菌细胞,得到表达csshsp-6的重组原核表达菌株;
(2)将重组原核表达菌株接种到卡那霉素液体培养基或卡那霉素+氯霉素液体培养基中,过夜培养活化菌株;
(3)将活化的重组原核表达菌株再转接到卡那霉素液体培养基或卡那霉素+氯霉素液体培养基中,震荡培养后加入iptg诱导重组csshsp-6的表达;
(4)诱导完成后,回收并纯化所表达的csshsp-6重组蛋白。
优选地,步骤(3)中在震荡培养至od600=0.5时,加入终浓度为0.8mm的iptg,在37℃诱导培养。
优选地,所述卡那霉素液体培养基中卡那霉素为50ug/ml。
优选地,所述卡那霉素+氯霉素液体培养基中卡那霉素为50ug/ml,氯霉素为50ug/ml。
本发明的有益效果是:本发明为得到csshsp-6可溶性蛋白,构建了茶树热激蛋白csshsp-6基因的原核表达载体,并且针对蛋白表达条件进行一系列的优化,发现当诱导温度为37℃时,其表达量最佳;随着iptg浓度的增加,蛋白表达量逐渐增加,最佳诱导浓度为0.8mm;在37℃,iptg浓度为0.8mm时,诱导表达13h时,表达量为最佳。经sds-page电泳检测,得到分子量约为23kda的目的条带,为csshsp-6蛋白预期大小,最终得到csshsp-6可溶性蛋白。同时,本发明用蛋白纯化系统对其进行纯化,其结果为进一步研究蛋白晶体结构和生物学特性奠定基础,进而为通过基因编辑方法提高茶树的抗病性提供依据。
附图说明
图1为酶切结果示意图,1为酶切的质粒dna,2为ecori和xhoi内切酶切结果,m为dnamarker;
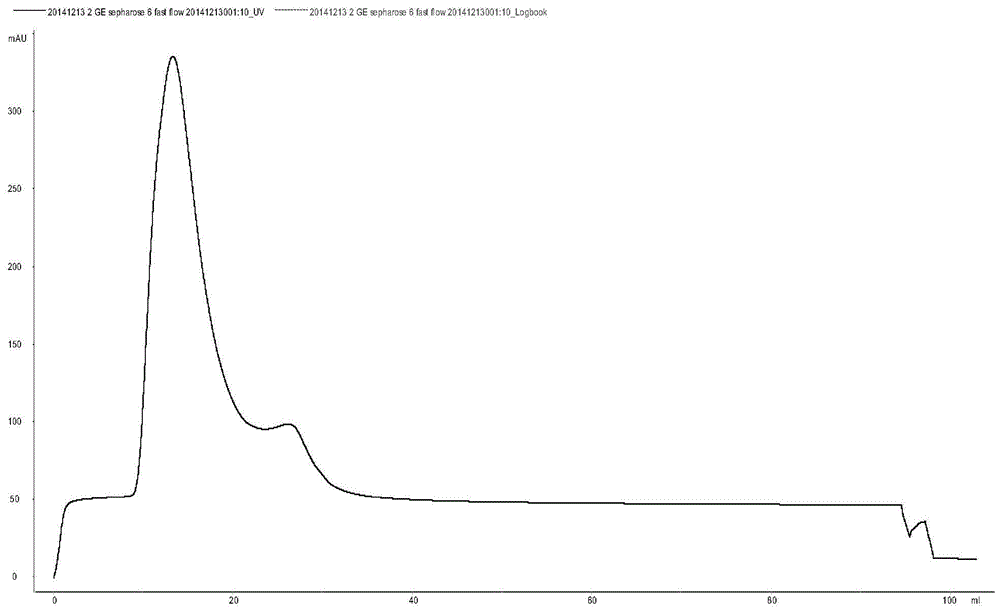
图2为csshsp-6蛋白通过akta蛋白纯化系统纯化和脱盐得到的蛋白峰图;
图3为csshsp-6蛋白纯化后的电泳结果图;
图4为sds-page电泳测试最佳表达菌株的结果图;
图5为sds-page电泳测试最佳iptg诱导浓度的结果图;
图6为sds-page电泳测试最佳诱导温度的结果图;
图7为westernblot检测图。
具体实施方式
下面结合附图及具体的实施例对发明进行进一步介绍:
实施例1:茶树热激蛋白csshsp-6基因重组载体的构建与鉴定
1、提取茶树叶片的rna,并反转录出cdna
取茶树叶片材料,利用rna提取试剂盒(天根生化科技(北京)有限公司)提取苗期总rna,用反转录试剂盒(promega)反转录得cdna。
2、以cdna为模板扩增csshsp-6基因;
设计引物,以cdna为模板对csshsp-6基因进行扩增,csshsp-6基因的核苷酸序列如seqidno.1所示,由csshsp-6基因编码的蛋白质的氨基酸序列如seqidno.2所示。
引物如下:
上游引物:csshsp-6-f:gcgaattcatggcgatgattccaag下划线为ecori酶切位点;
下游引物:csshsp-6-r:cgctcgagtcaaccagatatctcaatagactta下划线为xhoi酶切位点;
上下游引物分别如seqidno.3、4所示。
用于载体构建的基因扩增所用的pcr扩增体系如下:5×buffer10μl,fastpfuflydnapolymerase1μl(全式金),2.5mmoldntps4μl,cdna模板0.5μl,10μmol上下游引物各1μl,ddh2o32.5μl。
以下为pcr扩增条件:95℃2min,35个循环(95℃20s,58℃20s,72℃30s-1min,72℃5min。
3、构建csshsp-6基因重组载体
pcr产物经纯化后,连接到pet-28a载体。采用1%琼脂糖对pcr产物进行检测。pcr产物参考南京诺唯赞生物科技有限公司琼脂糖凝胶回收试剂盒说明书进行回收。回收后的产物经ecori和xhoi双酶切后通过dna连接酶插入到经同样双酶切的pet-28a表达载体中,16℃连接16小时,构建pet-28a-csshsp-6重组质粒。
将重组质粒转化到大肠杆菌菌株dh5a,在50ug/ml卡那霉素固体平板上于37℃培养,挑选单菌落经酶切鉴定正确后(酶切结果如图1所示),再通过北京擎科生物科技有限公司测序验证其序列正确性。测序结果表明,所获得的csshsp-6基因编码区序列与预计相符,说明重组质粒构建成功并将其命名为pet-28a-csshsp-6,即重组载体。
实施例2:csshsp-6蛋白的诱导表达
1、获得csshsp-6的重组原核表达菌株
挑选实施例1中测序成功的单克隆接种到50ug/ml卡那霉素液体培养基中,37℃、200rpm过夜培养,按照南京诺唯赞生物科技有限公司质粒小量提取试剂盒将pet-28a-csshsp-6重组表达载体提取出来,取重组表达载体转化大肠杆菌bl21(de3)、rosetta(de3)、bl21(de3)plyss菌株,检测csshsp-6蛋白的表达。
2、过夜培养活化菌株
过夜培养活化上述的重组原核表达菌株。例如,将bl21(de3)菌株转接到50ug/ml卡那霉素液体培养基中,将rosetta(de3)、bl21(de3)plyss菌株转接到50ug/ml卡那霉素+50ug/ml氯霉素液体培养基中,37℃、200rpm过夜培养活化菌株。
3、诱导表达
将活化的重组原核表达菌株转接到含相应抗生素的液体培养基中,例如,将活化的bl21(de3)菌株转接到50ug/ml卡那霉素液体培养基中,将rosetta(de3)、bl21(de3)plyss菌株转接到50ug/ml卡那霉素+50ug/ml氯霉素液体培养基中,37℃震荡培养至od600=0.5时,加入终浓度为0.8mm的iptg,在37℃诱导培养10小时,获得csshsp-6的重组蛋白。
4、csshsp-6重组蛋白的纯化
诱导完成后,回收并纯化所表达的csshsp-6重组蛋白,采用akta蛋白纯化系统进行纯化和脱盐,优选地,采用aktapurifier10快速蛋白纯化系统进行蛋白纯化,步骤如下:
由于pet28a在终止子前具有6个his编码序列,所以pet28a-csshsp-6重组表达载体获取的蛋白可以利用ni-nta进行亲和层析纯化。亲和层析是以蛋白质或生物大分子和结合在介质上配基间的特异亲和力为基础,因为his-tags所用层析凝胶的基质上连接了一个nta[(nitrilotriaceticacid)氮基三乙酸],可以与ni离子结合,而ni离子与融合蛋白的6×his氨基酸之间产生吸引力,从而将带有his-tags组氨酸标签的融合蛋白与其它蛋白区分开来,组氨酸残基的五元咪唑环是蛋白与ni离子作用的关键,因此当我们用高浓度的咪唑(imidazole)溶液洗脱的时侯(如400mm),咪唑便于蛋白质his-tags的咪唑环竞争结合,最终将融合蛋白从凝胶上洗脱下来。
具体操作:取出-80℃保存的菌体,加入lysisbuffer重悬,重悬后的菌液于冰浴中进行超声波破碎,其功率为350w,占空比50%,每个循环30s,总时间35min。破碎后的匀浆,4℃,1,2000rpm离心30min。用蠕动泵将上清液吸附到ni-nta吸附柱上,5ml/min,重复一次,保留20μl通过吸附柱的样品进行蛋白胶电泳;将ni-nta吸附柱连接到快速蛋白纯化系统上,进行洗脱;根据uv吸收曲线收集蛋白,并取样进行蛋白胶电泳检测。
图2为akta蛋白纯化系统纯化蛋白峰图。csshsp-6蛋白通过akta蛋白纯化系统纯化得到的蛋白峰图。
图3为csshsp-6蛋白纯化后的电泳图。其为在37℃,iptg浓度1.0mm时表达纯化csshsp-6蛋白结果。1为ni柱亲和后流出液;2为经过ni柱亲和后纯化后的蛋白;m为蛋白marker。红色箭头所指示为csshsp-6蛋白。图4显示,此条件下csshsp-6蛋白多出现在了上清液中,为可溶性表达,通过akta蛋白纯化系统纯化后得到的csshsp-6蛋白纯度达到要求,可用于后续实验。
实施例3:csshsp-6蛋白诱导表达条件的验证
1、获得csshsp-6的重组表达菌株
挑选实施例1中测序成功的单克隆接种到50ug/ml卡那霉素液体培养基中,37℃、200rpm过夜培养,按照南京诺唯赞生物科技有限公司质粒小量提取试剂盒将pet-28a-csshsp-6重组表达载体提取出来,取重组表达载体分别转化大肠杆菌bl21(de3)、rosetta(de3)、bl21(de3)plyss菌株,涂布于含50ug/ml卡那霉素平板(rosetta(de3)、bl21(de3)plyss菌株需补加50ug/ml氯霉素)上于37℃进行过夜培养,挑取单菌落接种到含相应抗生素的液体培养基中,37℃、200rpm过夜培养,在菌液中加入灭菌50%甘油,混匀后冻存于-80℃冰箱,得到表达csshsp-6的原核表达菌株。
2、csshsp-6基因诱导表达菌株的确定
分别接种上述的重组原核表达菌株bl21(de3)、rosetta(de3)、bl21(de3)plyss,到50ug/ml卡那霉素(rosetta(de3)、bl21(de3)plyss菌株需补加50ug/ml氯霉素)液体培养基中,37℃、200rpm过夜培养活化菌株。将活化的重组原核表达菌株转接到50ug/ml卡那霉素(rosetta(de3)、bl21(de3)plyss菌株需补加50ug/ml氯霉素)液体培养基中,37℃震荡培养至od600=0.5时,加入终浓度为1mm的iptg,在16℃诱导培养13小时(取pet-28a菌作阴性对照)。诱导完成后4℃,1,2000rpm离心2min,收集菌体,细菌沉淀与阴性对照用2ml预冷pbsbuffer(用前加入1mmpmsf)悬浮,用超声破碎仪进行细胞破碎,每次10sec,共10次,每次间隔30sec;1,2000rpm离心10min,取上清,sds-page电泳检测,测试表达菌株,结果如图4所示,bl21(de3)、rosetta(de3)、bl21(de3)plyss都能较好表达csshsp-6蛋白,但在bl21(de3)表达最佳。
3、csshsp-6基因诱导表达最佳iptg浓度的确定
接种上述的重组原核表达菌株bl21(de3)到50ug/ml卡那霉素液体培养基中,37℃、200rpm过夜培养活化菌株。将活化的重组原核表达菌株转接到50ug/ml卡那霉素液体培养基中,37℃震荡培养至od600=0.5时,分别加入终浓度为0、0.6、0.8、1.0mm的iptg,在25℃诱导培养8小时(取未诱导的菌作阴性对照)。诱导完成后4℃,1,2000rpm离心2min,收集菌体,细菌沉淀与阴性对照用2ml预冷pbsbuffer(用前加入1mmpmsf)悬浮,用超声破碎仪进行细胞破碎,每次10sec,共10次,每次间隔30sec;1,2000rpm离心10min,取上清,sds-page电泳检测,测试最佳iptg诱导浓度,结果如图5所示,csshsp-6诱导表达最佳iptg浓度为0.8mm。
4、csshsp-6基因诱导表达最佳温度的确定
接种上述的重组原核表达菌株bl21(de3)到50ug/ml卡那霉素液体培养基中,37℃、200rpm过夜培养活化菌株。将活化的重组原核表达菌株转接到50ug/ml卡那霉素液体培养基中,37℃震荡培养至od600=0.5时,加入终浓度为0.8mm的iptg,分别在16、20、25、30、和37℃诱导培养4-13小时(取pet-28a菌作阴性对照)。诱导完成后4℃,1,2000rpm离心2min,收集菌体,细菌沉淀与阴性对照用2ml预冷pbsbuffer(用前加入1mmpmsf)悬浮,用超声破碎仪进行细胞破碎,每次10sec,共10次,每次间隔30sec;1,2000rpm离心10min,取上清,sds-page电泳检测,测试最佳诱导温度,结果如图6所示,最佳诱导温度是37℃。
实施例4:csshsp-6重组蛋白的westernblot检测
(一)提取经过纯化后的csshsp-6蛋白:
1.培养含有pet-28a-csshsp-6质粒的大肠杆菌表达菌株,iptg诱导表达;
2.加入蛋白裂解液(50mmtrisph8.0,120mmnacl,1mmdtt,0.5%np-40,用前加入1mmpmsf,1mmdtt),用超声波破碎细胞后,离心收集上清,冰上放置20min;
3.15,000g,4℃离心5min,弃沉淀;
4.取200μl上清加入5×loadingbuffer,震荡混匀,剩余样品-80℃冻存;
5.沸水煮5min,冰浴,12,000rpm离心5min,吸取上清15μl进行蛋白电泳,剩余样品-20℃冻存;
6.制备sds-page胶,先用90v进行电泳20min,待样品进入分离胶时,用150v电压进行电泳,至溴酚蓝跑出分离胶时停止电泳。
(二)转膜
用裁纸刀裁出比胶稍大一些的pvdf膜(对于pvdf膜,先用甲醇浸泡30秒,再在ddh2o中浸泡3-5min,然后放入转膜buffer中)将胶板夹放入转移电泳槽。倒入转膜缓冲液,4℃,100v90min。
(三)封闭
转膜完成后,取出pvdf膜,放于用5%脱脂奶粉的pbst溶液中,摇床上封闭2h。
(四)一抗孵育
弃去封闭液,加入antihis抗体(1:5000),摇床孵育12h。
(五)二抗孵育
倒掉一抗,用1×pbst洗涤pvdf膜3次,每次5min;加入对应的二抗(羊抗小鼠),摇床孵育1h。
(六)ecl曝光
弃二抗,用1×pbst洗涤pvdf膜3次,每次5min;在pvdf膜上加入hrp化学发光底物液,在天能5200化学发光检测仪上检测蛋白表达信号(如图7所示),从结果可以看出成功表达出csshsp-6蛋白。
核苷酸系列表:
sequencelisting
序列表
<110>贵州大学
<120>一种茶树热激蛋白csshsp-6基因的重组载体和表达方法
<160>4
<210>1
<211>480
<212>dna
<213>茶树热激蛋白csshsp-6
<400>1
atggcgatgattccaagcatcttcggcggccgtcgaagcaatgtcttcgatccattctct60
ctcgacatctgggatccctttgagggctttcccttcaacaacgccctcgccaacatcccc120
aactccgcccgcgagacctccgcctttgccaacactcgcattgactggaaagagactcca180
gaggctcacatcttcaaagccgatcttccagggctgaagaaggaagaagtgaaggtggaa240
gttgaagaaggaagagttttgcagatcagcggggagagaagcagagagcatgaggagaag300
aacgagaaatggcacctcgtcgagcggagcagcggcaagttcctccgcaggttcaggctg360
ccagagaatgtgaagacggatcatgtgaaggctaatatggaggacggtgtgctgactgtg420
atggtgcctaaggaagaagagaagaagcctgaggttaagtctattgagatatctggttga480
<210>2
<211>159
<212>prt
<213>茶树热激蛋白csshsp-6
<400>2
mamipsifggrrsnvfdpfsldiwdpfegfpfnnalanipnsaretsafantridwketp60
eahifkadlpglkkeevkveveegrvlqisgersreheeknekwhlverssgkflrrfrl120
penvktdhvkanmedgvltvmvpkeeekkpevksieisg159
<210>3
<211>25
<212>dna
<213>人工序列
<400>3
gcgaattcatggcgatgattccaag25
<210>4
<211>33
<212>dna
<213>人工序列
<400>4
cgctcgagtcaaccagatatctcaatagactta33
- 还没有人留言评论。精彩留言会获得点赞!