外周血记忆T细胞培养方法与流程
本发明涉及细胞培养
技术领域:
,具体而言,涉及一种外周血记忆t细胞培养方法。
背景技术:
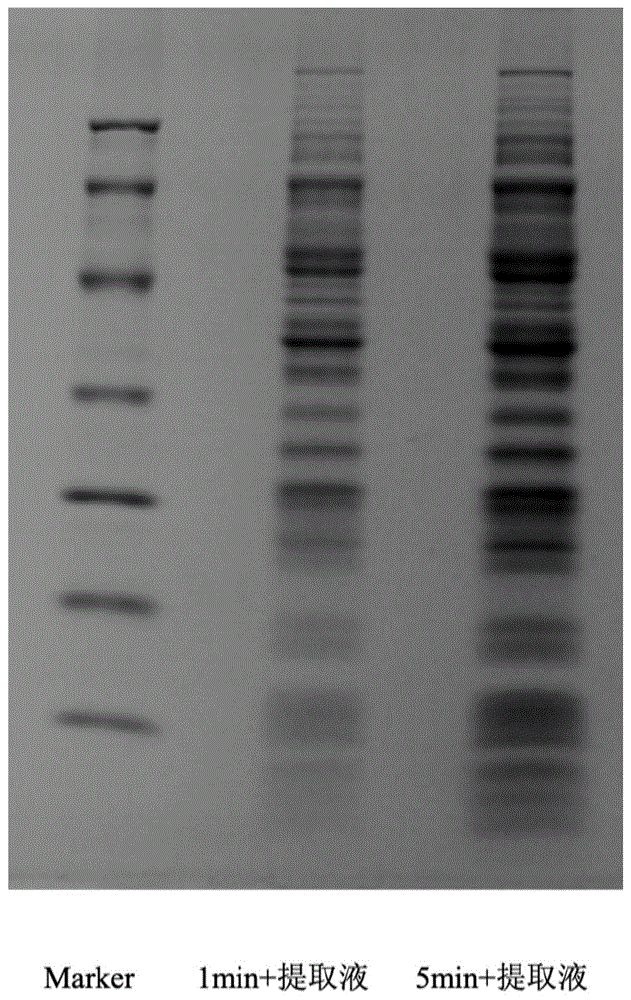
:t细胞根据其分化程度可分为初始t细胞,记忆t细胞,效应t细胞。初始t细胞在胸腺中发育成熟迁移至外周淋巴组织中(如脾脏、淋巴结)。肿瘤患者体内初始t细胞接触肿瘤细胞表面肿瘤相关抗原(taa),在apc细胞的识别和呈递下,以及一系列的信号通路,增殖分化为效应t细胞和记忆t细胞。效应t细胞和记忆t细胞有着不同的功能,前者分泌穿孔素、颗粒素酶和颗粒溶素等物质,并通过fas配体直接杀伤肿瘤细胞,但在体内存活时间较短(3~4个月),且无法继续增殖。高度分化的细胞毒性t细胞(cytotoxiclymphocyte,ctl)是效应t细胞,在体内的半衰期大约只有15天。记忆t细胞能够在血液系统中长期存在(10~20年),遇到taa后还能再次被激活,并分裂增殖为具有杀伤功能的效应性t细胞(ctl)。免疫记忆是获得性免疫应答的主要特征。机体对抗原初次应答后,形成的效应信息可存留在机体免疫系统。免疫记忆的物质基础是处于静息态的记忆t细胞和记忆b细胞,其中记忆t细胞尤为重要,是机体有效清除各种病原体的关键。记忆t细胞的形成分为三步:第一,t细胞在抗原刺激下被活化,不断增殖形成大量效应t细胞,以清除相应的抗原;第二,抗原清除后,90%以上的效应t细胞死亡,被机体清除;第三,留存下来的t细胞,进入静息期,在机体内维持一定的数量,成为记忆t细胞。cd8+记忆性t细胞的维持不需要抗原的持续刺激,记忆性t细胞的再激活只需要较低的抗原浓度,相比于初始t细胞对共刺激信号依赖弱,相比初始t细胞对抗原的反应速度更快。记忆性t细胞再次激活后可迅速通过分裂增殖产生大量具有免疫效应的效应t细胞,并释放大量有效的细胞因子,如ifn-γ、il-4和tnf-α等,从而增强抗肿瘤细胞的功效。目前,肿瘤过继t细胞治疗多采用cd8+t细胞,但是这些终末分化的效应t细胞在人体和小鼠中的抗肿瘤效果是短暂且不稳定的。而记忆t细胞拥有较强的生存能力和快速的二次免疫,因此通过体外的特异性肿瘤抗原的初次免疫和抗原呈递细胞的共同刺激,在体内可以发挥更强的肿瘤杀伤功能。然而现有的记忆t细胞体外培育方法,普遍存在扩增记忆t细胞倍率低、细胞活性差等问题。有鉴于此,特提出本发明。技术实现要素:本发明涉及一种外周血记忆t细胞培养方法,包括:a)将由外周血分离得到的pbmc进行磁珠分选得到cd8+t细胞;将所述cd8+t细胞接种于包被有cd3抗体及cd28抗体的培养容器中进行培养;培养体系中含4%~6%自体血浆,且细胞因子主要包括ifn-γ900u/ml~1100u/ml以及il-2900u/ml~1100u/ml;b)换液进行扩增培养,新培养体系中含4%~6%自体血浆,且细胞因子主要包括il-2900u/ml~1100u/ml,il-1a900u/ml~1100u/ml,il-7900u/ml~1100u/ml,il-1515ng/ml~25ng/ml;c)将扩增好的t细胞与dc细胞共培养;其中所述dc细胞预先与自体肿瘤抗原共培养。与现有技术相比,本发明能够有效在体外扩增记忆t细胞,并有效提高活性记忆t细胞的比例。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为实施例1与对比例1所提取肿瘤抗原的电泳结果图;图2为对比例1所提取肿瘤抗原的电泳结果图;图3为实施例1的流式细胞检测结果图;图4为对比例3的流式细胞检测结果图;图5为对比例4的流式细胞检测结果图;图6为对比例5的流式细胞检测结果图。具体实施方式本发明涉及一种外周血记忆t细胞培养方法,包括:a)将由外周血分离得到的pbmc进行磁珠分选得到cd8+t细胞;将所述cd8+t细胞接种于包被有cd3抗体及cd28抗体的培养容器中进行培养;培养体系中含4%~6%自体血浆,且细胞因子主要包括ifn-γ900u/ml~1100u/ml以及il-2900u/ml~1100u/ml;b)换液进行扩增培养,新培养体系中含4%~6%自体血浆,且细胞因子主要包括il-2900u/ml~1100u/ml,il-1a900u/ml~1100u/ml,il-7900u/ml~1100u/ml,il-1515ng/ml~25ng/ml;c)将扩增好的t细胞与dc细胞共培养;其中所述dc细胞预先与自体肿瘤抗原共培养。在一些实施方式中,在步骤a)中,培养体系中的细胞因子主要包括ifn-γ950u/ml~1050u/ml以及il-2950u/ml~1050u/ml;在一些实施方式中,在步骤a)中,培养体系中的细胞因子主要包括ifn-γ1000u/ml以及il-21000u/ml。在一些实施方式中,在步骤b)中,新培养体系中的细胞因子主要包括il-2950u/ml~1050u/ml,il-1a950u/ml~1050u/ml,il-7950u/ml~1050u/ml,il-1517ng/ml~23ng/ml;在一些实施方式中,在步骤b)中,新培养体系中的细胞因子主要包括il-21000u/ml,il-1a1000u/ml,il-71000u/ml,il-1520ng/ml。在一些实施方式中,所述磁珠分选包括:a1)将所述pbmc计数后离心,用磁珠分选液重悬pbmc并孵育得到孵育液;以所述pbmc为107cells计,所述磁珠分选液主要包含80μl~100μlmacsbuffer以及8μl~12μlcd8+t细胞biotin-antibody(southernbiotec,9536-08);a2)将所述孵育液与17μl~23μlanti-biotinmicrobeads(美天旎,130-090-485)接触并再次孵育;a3)过分选柱,弃去流下来的细胞,用macsbuffer冲洗柱子,收集流下的液体得到cd8+t细胞。在一些实施方式中,在步骤a)中,所述培养体系中的基础培养基为vivo培养基。在一些实施方式中,在步骤a)中,包被液中cd3抗体浓度450ng/ml~550ng/ml,cd28抗体450ng/ml~550ng/ml;在一些实施方式中,在步骤a)中,包被液中cd3抗体浓度500ng/ml,cd28抗体500ng/ml。在一些实施方式中,在步骤a)中,以培养面积为25cm2计,培养基的加入量为12ml~18ml,细胞接种量通常为0.8×107~1.2×107。在一些实施方式中,在步骤a)中,以培养面积为25cm2计,培养基的加入量为14ml~16ml,细胞接种量为0.9×107~1.1×107。如非特别强调,本申请所述方法涉及到的细胞培养条件均在30至45℃之间和在1至10%的co2之间,优选为36至38℃之间和在4至6%的co2之间。在一些实施方式中,步骤a)中的培养时间通常为20h~28h。在一些实施方式中,步骤a)中的培养时间为24h。在一些实施方式中,在步骤b)中,所述培养体系中的基础培养基为aim-v培养基。在一些实施方式中,步骤b)中的培养时间通常为5~7天。在一些实施方式中,步骤b)中的培养时间为6天。在一些实施方式中,步骤c)中的培养时间通常≤7天。在一些实施方式中,步骤c)中的培养时间为8、9、10、11天。在一些实施方式中,所述自体肿瘤抗原的制备方法包括:将肿瘤组织经机械破碎后重悬于抗原提取液后经280w~320w超声破碎50s~70s,冰浴震荡,离心后将上清低温透析。在一些实施方式中,所述抗原提取液的下述组分在水溶液中的工作浓度在以下范围内:-金属离子螯合剂4mm~6mm,-碘乙酰胺2nm~3nm,-zwittergent0.18g/ml%~0.28g/ml%,以及-缓冲组分;且所述抗原提取液在抗原提取的过程中的ph为8.2~8.6。在一些实施方式中,所述抗原提取液的下述组分在水溶液中的工作浓度在以下范围内:-金属离子螯合剂5mm,-碘乙酰胺2.5nm,-zwittergent0.2g/ml%,以及-缓冲组分;且所述抗原提取液在抗原提取的过程中的ph为8.4。在一些实施方式中,金属离子螯合剂是络合离子的试剂,其降低它们的浓度。通常,离子是金属离子,诸如ca、mg、fe、zn和cu,但也可以络合非金属离子,诸如p。通过与多价(金属)离子形成稳定的水溶性络合物,螯合剂通过阻断(金属)离子的正常反应性而防止不期望的相互作用。合适的螯合剂的实例包括egta(乙二醇四乙酸)、bapta(1,2-双(邻氨基苯氧基)乙烷-n,n,n’,n’-四乙酸)、dtpa(二亚乙基三胺五乙酸)、edta(乙二胺四乙酸)和nta(n,n-双(羧基甲基)甘氨酸)。在一些实施方式中,所述金属离子螯合剂是乙二胺四乙酸(edta)或其盐。在一些实施方式中,edta的盐可以选自edta·na2或edta·k2。如本文使用的术语“缓冲液/缓冲组分”指水溶液或组合物,当酸或碱加入该溶液或组合物中时,所述水溶液或组合物抵抗ph中的变化。这种对ph变化的抗性是由于此类溶液的缓冲性质。因此,显示出缓冲活性的溶液或组合物被称为缓冲液或缓冲溶液。缓冲液一般不具有无限的维持溶液或组合物的ph的能力。相反,它们一般能够维持在特定范围内的ph,例如ph7–ph9。一般地,缓冲液能够维持在其pka上和下一个对数内的ph(参见例如,mohan,buffers,aguideforthepreparationanduseofbuffersinbiologicalsystems,calbiochem,1999)。缓冲液和缓冲溶液一般由缓冲盐或优选非离子缓冲液组分如tris和hepes制备。可以在本发明的方法中使用的缓冲液优选选自磷酸盐缓冲液、磷酸盐缓冲盐水缓冲液(pbs)、2-氨基-2羟甲基-1,3-丙二醇(tris)缓冲液、tris缓冲盐水溶液(tbs)和tris/edta(te)。在一些实施方式中,所述缓冲组分选自tris-hcl,其在水溶液中的工作浓度在以下范围内0.008m~0.012m,优选0.01m。在一些实施方式中,“水溶液”中的水为反渗水(reverseosmosiswater)、蒸馏水(distilledwater)、去离子水(deionizedwater)、反渗水(reverseosmosiswater)。下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例11.肿瘤抗原的制备1)无菌状态下,肿瘤组织块用适量生理盐水清洗去除血液,去除其他组织。2)用剪刀最大程度剪碎后,重悬于抗原提取液(0.01mtris-hcl,ph8.4,含5mmedta,2.5nm碘乙酰胺和0.2%zwittergent3-12)中。3)超声波300w破碎1min使小块组织进一步解离,4℃冰浴震荡2h。4)12000rpm离心15min,上清置于透析袋中,4℃隔夜在蒸馏水内透析。5)浓缩后即得到肿瘤抗原。2.外周血dc细胞培养2.1.外周血dc细胞培养基1)dc培养:aim-v培养基(含1%自体血浆),gm-csf浓度50ng/ml,il-4浓度50ng/ml。2)dc成熟培养基:aim-v培养基(含1%自体血浆),gm-csf浓度50ng/ml,il-4浓度50ng/ml,tnf-α浓度10ng/ml,pge-2浓度1μg/ml。2.2.外周血dc细胞培养方法1)培养第0天,取1个t175培养瓶,将得到的pbmc细胞加到培养瓶中,每瓶细胞数1.5*108,加入aim-v培养基50ml,加500ul自体血浆,培养箱贴壁培养2h。2)培养2h后,取出培养瓶,倒去上清液,加入30mlaim-v培养基洗培养瓶,洗2次。加入配好的dc培养基30ml,培养箱培养。3)第3天,取出培养瓶,拍打培养瓶,使贴壁细胞漂浮。补加dc培养基20ml和肿瘤抗原500μl,培养箱培养。4)第4天取1个新的t75培养瓶,加入7ml自体血浆,置于培养箱中包被过夜。5)第5天,取出dc培养瓶,拍打培养瓶,使细胞悬浮,将细胞液收集到50ml离心管内。此时观察有大量细胞贴壁,向培养瓶中加15mlpbs,置于4℃15min。取出培养瓶,拍打,大部分细胞漂浮。将pbs倒出,再加入15mlpbs,置于4℃5min。5min后,取出培养瓶,拍打,细胞基本漂浮,将pbs倒入50ml离心管,离心,1400rpm,5min,离心后,倒去上清。取出第4天包被的t75培养瓶,倒去包被液。将细胞转移到t75培养瓶内,加入20ml成熟培养基。6)第7天,收获细胞,离心,去除培养基,将负载肿瘤抗原的成熟dc细胞与记忆t细胞共培养。3.外周血记忆t细胞培养3.1外周血记忆t细胞培养基1)包被液:d-pbs,cd3单抗浓度500ng/ml,cd28浓度500ng/ml。2)记忆t细胞初始培养基:vivo培养基(含5%自体血浆)。il-21000iuml。3)记忆t细胞扩增培养基:aim-v培养基(含5%自体血浆),il-2浓度1000iu/ml,il-1a1000iu/ml,il-71000iu/ml,il-1520ng/ml。3.2外周血记忆t细胞培养方法1)第0天,将制备好的pbmc进行计数,用磁珠分选液重悬细胞,macsbuffer90μl/107细胞,加入cd8+t细胞biotin-antibody10μl/107细胞,混匀,2-8℃孵育10min,加入20μlanti-biotinmicrobeads/107细胞,混匀,2-8℃孵育10min,过柱,弃去流下来的细胞,用1mlmacsbuffer冲洗柱子,收集流下的液体,即为cd8+t细胞。2)第0天,取t25培养瓶,加入3ml包被液,置于培养箱中包被2h,备用。取出包被好的t25培养瓶,倒去包被液,取制备好的cd8+t1.0×107,接种到t25培养瓶内,加15ml记忆t细胞初始培养基,加入ifn-γ终浓度为1000u/ml,置于37℃、5%co2培养箱中。3)培养第1天,取出培养瓶,加入15ml记忆t细胞扩增培养基,将培养瓶重新置于37℃、5%co2培养箱中。4)培养第4天,将细胞全部转移到t75,加记忆t细胞扩增培养基20ml,置于37℃、5%co2培养箱中。5)培养第7天,将细胞和收获的dc细胞同时转移到t175中,加记忆t细胞扩增培养基70ml,置于37℃、5%co2培养箱中。6)培养第10天,将细胞转移到细胞培养袋中加入500ml记忆t细胞扩增培养基,置于37℃、5%co2培养箱中。7)培养第14天,收获细胞,进行流式表型检测和扩增倍数计算。经检测培养14d后,记忆t细胞扩增32.85倍,具有很高的扩增倍数。实施例21.肿瘤抗原的制备1)无菌状态下,肿瘤组织块用适量生理盐水清洗去除血液,去除其他组织。2)用剪刀最大程度剪碎后,重悬于抗原提取液(0.012mtris-hcl,ph8.2,含4mmedta,3nm碘乙酰胺和0.18g/ml%zwittergent3-12)中。3)超声波280w超声破碎70s使小块组织进一步解离,4℃冰浴震荡2h。4)12000rpm离心15min,上清置于透析袋中,4℃隔夜在蒸馏水内透析。5)浓缩后即得到肿瘤抗原。2.外周血dc细胞培养同实施例1。3.外周血记忆t细胞培养3.1外周血记忆t细胞培养基1)包被液:d-pbs,cd3单抗浓度450ng/ml,cd28浓度550ng/ml。2)记忆t细胞初始培养基:vivo培养基(含4%自体血浆)。il-2900u/ml。3)记忆t细胞扩增培养基:aim-v培养基(含4%自体血浆),il-2浓度900u/ml,il-1a1100u/ml,il-7900u/ml,il-1525ng/ml。3.2外周血记忆t细胞培养方法1)第0天,将制备好的pbmc进行计数,用磁珠分选液重悬细胞,macsbuffer100μl/107细胞,加入cd8+t细胞biotin-antibody8μl/107细胞,混匀,2-8℃孵育10min,加入17μlanti-biotinmicrobeads/107细胞,混匀,2-8℃孵育10min,过柱,弃去流下来的细胞,用1mlmacsbuffer冲洗柱子,收集流下的液体,即为cd8+t细胞。2)第0天,取t25培养瓶,加入3ml包被液,置于培养箱中包被2h,备用。取出包被好的t25培养瓶,倒去包被液,取制备好的cd8+t1.0×107,接种到t25培养瓶内,加15ml记忆t细胞初始培养基,加入ifn-γ终浓度为900u/ml~1100u/ml,置于37℃、5%co2培养箱中。3)培养第1天,取出培养瓶,加入15ml记忆t细胞扩增培养基,将培养瓶重新置于37℃、5%co2培养箱中。4)培养第4天,将细胞全部转移到t75,加记忆t细胞扩增培养基20ml,置于37℃、5%co2培养箱中。5)培养第7天,将细胞和收获的dc细胞同时转移到t175中,加记忆t细胞扩增培养基70ml,置于37℃、5%co2培养箱中。6)培养第10天,将细胞转移到细胞培养袋中加入500ml记忆t细胞扩增培养基,置于37℃、5%co2培养箱中。7)培养第14天,收获细胞,进行流式表型检测和扩增倍数计算。实施例31.肿瘤抗原的制备1)无菌状态下,肿瘤组织块用适量生理盐水清洗去除血液,去除其他组织。2)用剪刀最大程度剪碎后,重悬于抗原提取液(0.008mtris-hcl,ph8.6,含6mmedta,2nm碘乙酰胺和0.28g/ml%zwittergent3-12)中。3)超声波320w超声破碎50s使小块组织进一步解离,4℃冰浴震荡2h。4)12000rpm离心15min,上清置于透析袋中,4℃隔夜在蒸馏水内透析。5)浓缩后即得到肿瘤抗原。2.外周血dc细胞培养同实施例1。3.外周血记忆t细胞培养3.1外周血记忆t细胞培养基1)包被液:d-pbs,cd3单抗浓度550ng/ml,cd28浓度450ng/ml。2)记忆t细胞初始培养基:vivo培养基(含6%自体血浆)。il-21100u/ml。3)记忆t细胞扩增培养基:aim-v培养基(含6%自体血浆),il-2浓度1100u/ml,il-1a900u/ml,il-71100u/ml,il-1515ng/ml。3.2外周血记忆t细胞培养方法1)第0天,将制备好的pbmc进行计数,用磁珠分选液重悬细胞,macsbuffer80μl/107细胞,加入cd8+t细胞biotin-antibody12μl/107细胞,混匀,2-8℃孵育10min,加入23μlanti-biotinmicrobeads/107细胞,混匀,2-8℃孵育10min,过柱,弃去流下来的细胞,用1mlmacsbuffer冲洗柱子,收集流下的液体,即为cd8+t细胞。2)第0天,取t25培养瓶,加入3ml包被液,置于培养箱中包被2h,备用。取出包被好的t25培养瓶,倒去包被液,取制备好的cd8+t1.0×107,接种到t25培养瓶内,加15ml记忆t细胞初始培养基,加入ifn-γ终浓度为900u/ml~1100u/ml,置于37℃、5%co2培养箱中。3)培养第1天,取出培养瓶,加入15ml记忆t细胞扩增培养基,将培养瓶重新置于37℃、5%co2培养箱中。4)培养第4天,将细胞全部转移到t75,加记忆t细胞扩增培养基20ml,置于37℃、5%co2培养箱中。5)培养第7天,将细胞和收获的dc细胞同时转移到t175中,加记忆t细胞扩增培养基70ml,置于37℃、5%co2培养箱中。6)培养第10天,将细胞转移到细胞培养袋中加入500ml记忆t细胞扩增培养基,置于37℃、5%co2培养箱中。7)培养第14天,收获细胞,进行流式表型检测和扩增倍数计算。实验例1.抗原提取方法对比试验抗原提取方法实施例1超声波1min+抗原提取液对比例1超声波5min+抗原提取液对比例2抗原提取液实施例1与对比例1的实验结果如图1所示;抗原提取液的实验结果如图2所示。可以看到单独提取液提取抗原较少,超声5min抗原提取量明显增加,但根据后续cck8杀伤实验,发现5min+提取液组并不能提高细胞的杀伤能力,故推测超声5min增加的抗原多为胞内抗原,对于细胞杀伤能力没有增强作用。负载肺肿瘤抗原的记忆t细胞对a549的抑制率记忆t:a5491min+提取液5min+提取液5:159.77%60.63%10:160.31%62.01%2.初始细胞制备对比试验初始细胞制备实施例1ficoll密度梯度离心提取pbmc+macs磁珠分选对比例3ficoll密度梯度离心提取pbmc实施例1结果如图3所示;对比例3结果如图4所示。其中图3a,cd3+cd8+:87.22%;图3b,cd3+cd45ra+:56.17%;图3c,cd3+cd45ro+:99.47%;图4a,cd3+cd8+:62.67%;图4b,cd3+cd45ra+:37.06%;图4c,cd3+cd45ro+:89.36%。3.培养方案对比试验实施例1结果如图3所示;对比例4结果如图5所示;对比例5结果如图6所示。其中图5a,cd3+cd8+:80.14%;图5b,cd3+cd45ra+:49.96%;图5c,cd3+cd45ro+:97.69%;图6a,cd3+cd8+:77.58%;图6b,cd3+cd45ra+:42.10%;图6c,cd3+cd45ro+:91.01%。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1