一种含四苯基苯的有机发光材料及制备与应用的制作方法
本发明属于有机光电材料领域,具体涉及一种含四苯基苯的有机发光材料及制备与应用。
背景技术:
随着有机电子产业的兴起和蓬勃发展,有机光电材料在有机电致发光二极管领域得到广泛应用,由于其重要的科学研究价值和广阔的商业应用前景,目前已成为材料科学中一个快速增长的领域。探索和开发性能更优、发光效率高、发射波长可调的有机发光材料是科研人员急需解决的难题。但是高效的发光材料的开发是相当难的,这是因为传统的材料在聚集态下会导致其发光淬灭。
技术实现要素:
针对以上现有技术存在的缺点和不足之处,本发明的首要目的在于提供一种含四苯基苯的有机发光材料。四苯基苯分子结构简单,便于化学修饰和功能化。本发明利用四苯基苯构筑了高固态发光效率的材料。将四苯基苯与空穴传输材料、电子传输材料结合,能够得到同时具有高固态发光效率和双级传输特性的发光材料。这些材料在有机光电领域表现出了优异性能。总体来说,四苯基苯是一个结构简单,性能优异的具有聚集诱导发光特性的功能基团,在有机光电材料的构筑中有广阔的应用前景。
本发明的另一目的在于提供上述含四苯基苯的有机发光材料的制备方法。
本发明的再一目的在于提供上述含四苯基苯的有机发光材料在有机电致发光器件中的应用。
本发明目的通过以下技术方案实现:
一种含四苯基苯的有机发光材料,具有式i所示的结构式:
其中,r1为芳香环衍生物给电子基团,r2为芳香环衍生物吸电子基团。
进一步地,所述r1为以下1~20取代基中的一种:
其中,r'为氢原子、叔丁基、甲氧基、氰基、氟原子或烷基链,n为0~10的自然数,*为取代位置;
所述r2为以下a~o取代基中的一种:
其中,r''为氢原子、叔丁基、甲氧基、氰基、氟原子或烷基链,n为0~10的自然数,*为取代位置。
进一步地,所述烷基链指具有1~20个碳原子的直链、支链或者环状烷基链,或一个或多个碳原子被氧原子、烯基、炔基、芳基、羰基、羟基、氨基、羧基、氰基、硝基或者酯基取代的烷基链,或一个或多个氢原子被氟原子、氯原子、溴原子、碘原子取代的烷基链。
上述含四苯基苯的有机发光材料的制备方法,包含以下步骤:
以1,4-二溴-2,5-三联苯和r2取代的苯硼酸为原料,通过suzuki反应得到含r2的芳香环化合物;然后在四三苯基膦钯催化剂的作用下,含r2的芳香环化合物与r1取代的苯硼酸或硼酸酯进行反应,得到含四苯基苯的有机发光材料;上述制备方法的反应式如下式所示:
上述含四苯基苯的有机发光材料在有机电致发光器件中的应用。
本发明通过在四苯基苯接上不同的给、吸电子基团,从而很好的调节四苯基苯衍生物的载流子传输性能。所得的结构扭曲,聚集状态下不易产生强的π-π相互作用;此外,这种扭曲的分子结构有利于提高材料的三线态能级,从而所得材料可以用作不同光色的发光主体材料。有机电致发光器件的表征数据可以表明,本发明的含四苯基苯的有机发光材料不仅可以作为发光层,还可以作为磷光主体材料使用,从而制备得到光电性能良好、结构简单、成本低廉的电致发光器件,在有机电致发光领域具有广泛的应用前景,有望在平板显示和固态照明等领域得到广泛应用。
相对于现有技术,本发明具有如下优点及有益效果:
(1)本发明的含四苯基苯的有机发光材料具有高效固态发光、双极性的特征,可制备出高效率、低程度效率滚降、非掺杂蓝光有机电致发光器件;
(2)本发明的含四苯基苯的有机发光材料合成方法简单、原料易得、产率较高,得到的材料结构稳定,存放简单;
(3)本发明的含四苯基苯的有机发光材料,电致发光性能优异,可以广泛应用于有机电致发光等领域。
附图说明
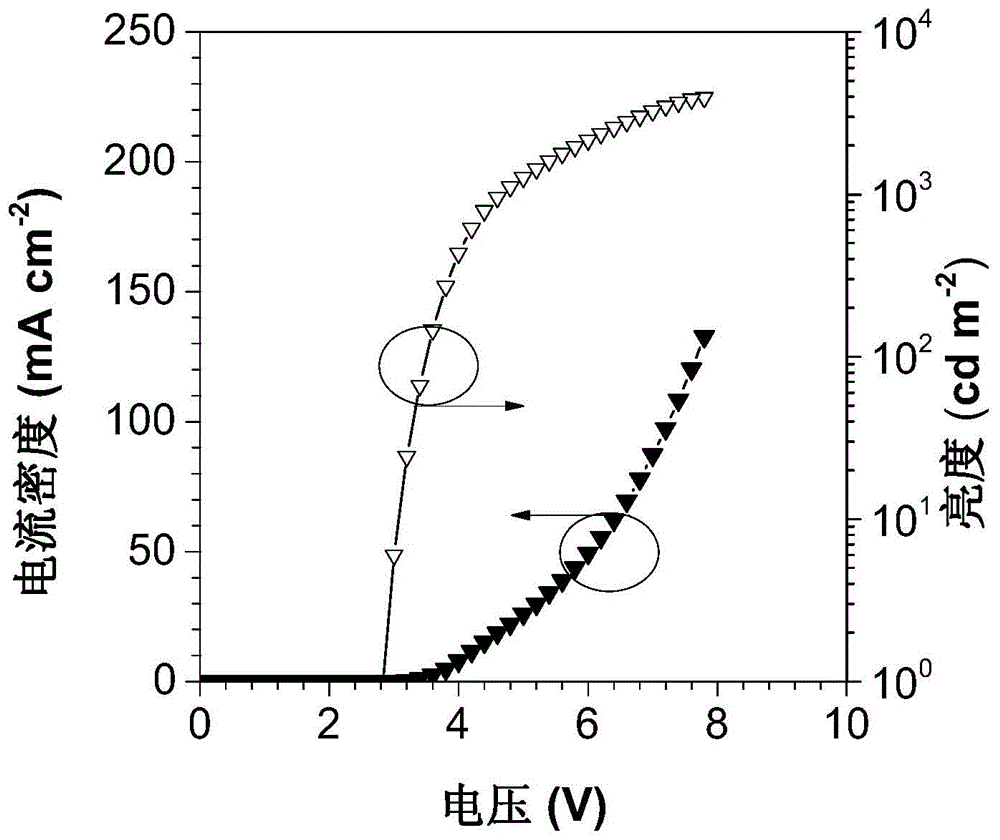
图1为利用实施例1含四苯基苯的有机电致发光材料制备得到的非掺杂蓝光oleds器件的j-v-l曲线图;
图2为利用实施例1含四苯基苯的有机电致发光材料制备得到的非掺杂蓝光oleds器件的效率随亮度变化的曲线图;
图3为利用实施例1含四苯基苯的有机电致发光材料制备得到的混合白光oleds器件的j-v-l曲线图;
图4为利用实施例1含四苯基苯的有机电致发光材料制备得到的混合白光oleds器件的效率随亮度变化的曲线图;
图5为利用实施例2含四苯基苯的有机电致发光材料制备得到的非掺杂蓝光oleds器件的j-v-l曲线图;
图6为利用实施例2含四苯基苯的有机电致发光材料制备得到的非掺杂蓝光oleds器件的效率随亮度变化的曲线图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1
本实施例含四苯基苯的有机电致发光材料(tpa-tpb-cn)的制备:
合成路线如下:
(1)将对溴三联苯(化合物1)(6g,15.5mmol)、4-氰基苯硼酸(化合物2)(2.50g,17.0mmol)、无水碳酸钾(6.4g,46.5mmol)和pd(pph3)4(895mg,0.8mmol)加入250ml反应瓶,在氮气保护下,加入105mlthf和15ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体3,产率73%;
(2)将中间体3(2.136g,1.5mmol)、4-苯硼酸三苯胺(化合物4)(1.6g,3.9mmol)、无水碳酸钾(1.616g,11.7mmol)和pd(pph3)4(225mg,0.195mmol)加入250ml反应瓶,在氮气保护下,加入10mlthf和5ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体tpa-tpb-cn,产率85%;产物鉴定数据如下:
1hnmr(mhz):δ(tms,ppm):7.59(s,1h),7.55(t,1h),7.53(t,1h),7.51(d,3h),7.48(d,2h),7.37(t,1h),7.35(t,1h),7.26(m,14h),7.22(m,2h),7.10(m,6h),7.03(m,2h)。
实施例2
本实施例含四苯基苯的有机电致发光材料(cz-tpb-cn)的制备
合成路线如下:
将中间体3(2.136g,1.5mmol)、4-硼酸咔唑(化合物5)(1.119g,3.9mmol)、无水碳酸钾(1.616g,11.7mmol)和pd(pph3)4(225mg,0.195mmol)加入250ml反应瓶,在氮气保护下,加入10mlthf和5ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体cz-tpb-cn,产率86%;产物鉴定数据如下:
1hnmr(500mhz,cd2cl2),δ(tms,ppm):8.16(m,1h),8.14(m,1h),7.69(s,1h),7.58(d,2h),7.56(m,1h),7.47(d,4h),7.45-7.38(m,6h),7.35-7.25(m,12h)。
实施例3
本实施例含四苯基苯的有机电致发光材料(3phcz-tpb-cn)的制备
合成路线如下:
将中间体3(2.136g,1.5mmol)、化合物6(1.415g,3.9mmol)、无水碳酸钾(1.616g,11.7mmol)和pd(pph3)4(225mg,0.195mmol)加入250ml反应瓶,在氮气保护下,加入10mlthf和5ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体3phcz-tpb-cn,产率84%;产物鉴定数据如下:
1hnmr(500mhz,cdcl3),δ(tms,ppm):8.35(d,1h),8.18(m,1h),7.59-7.66(m,8h),7.50(d,3h),7.47(m,4h),7.27-7.45(d,13h),7.29(m,2h)。
实施例4
本实施例含四苯基苯的有机电致发光材料(ad-tpb-cn)的制备
合成路线如下:
将中间体3(2.136g,1.5mmol)、化合物7(1.283g,3.9mmol)、无水碳酸钾(1.616g,11.7mmol)和pd(pph3)4(225mg,0.195mmol)加入250ml反应瓶,在氮气保护下,加入10mlthf和5ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体ad-tpb-cn,产率87%;产物鉴定数据如下:
1hnmr(400mhz,):δ(tms,ppm):7.69(s,1h),7.58(d,2h),7.56(t,1h),7.47(t,4h),7.40(t,1h),7.38(t,1h),7.33-7.25(m,10h),7.22(d,1h),7.20(s,1h),6.97(m,4h),6.26(m,2h),1.66(m,6h)。
实施例5
本实施例含四苯基苯的有机电致发光材料(czph-tpb-cn)的制备
合成路线如下:
将中间体3(2.136g,1.5mmol)、化合物8(1.416g,3.9mmol)、无水碳酸钾(1.616g,11.7mmol)和pd(pph3)4(225mg,0.195mmol)加入250ml反应瓶,在氮气保护下,加入10mlthf和5ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体czph-tpb-cn,产率89%。
实施例6
本实施例含四苯基苯的有机电致发光材料(dpa-tpb-cn)的制备
合成路线如下:
将中间体3(2.136g,1.5mmol)、化合物9(1.127g,3.9mmol)、无水碳酸钾(1.616g,11.7mmol)和pd(pph3)4(225mg,0.195mmol)加入250ml反应瓶,在氮气保护下,加入10mlthf和5ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体dpa-tpb-cn,产率88%。
实施例7
本实施例含四苯基苯的有机电致发光材料(cz-tpb-3q)的制备:
合成路线如下:
(1)将对溴三联苯(化合物1)(5.43g,14.0mmol)、咔唑苯硼酸(化合物10)(4.82g,16.8mmol)、无水碳酸钾(5.8g,42.0mmol)和pd(pph3)4(809mg,0.7mmol)加入250ml反应瓶,在氮气保护下,加入90mlthf和21ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体11,产率91%;
(2)将中间体11(1.10g,2mmol)、4硼酸-1,3,5三苯基三嗪(化合物12)(847mg,2.4mmol)、无水碳酸钾(828mg,6.0mmol)和pd(pph3)4(116mg,0.10mmol)加入125ml反应瓶,在氮气保护下,加入14mlthf和3ml水,回流过夜,反应冷却后经二氯甲烷萃取,浓缩后做粉过柱,得到白色固体
tpa-tpb-3q,产率84%。
实施例8
本实施例测试含四苯基苯的有机电致发光材料(tpa-tpb-cn)的蓝光oleds器件性能:
利用实施例1制备得到的含四苯基苯的有机电致发光材料tpa-tpb-cn(固态荧光量子产率=93.2%)作为发光材料制备得到非掺杂蓝光器件,并对其器件性能进行测试表征,结果见图1~2。
器件结构:ito/hat-cn(5nm)/tapc(50nm)/tcta(5nm)/tpa-tpb-cn(20nm)/tmpypb(40nm)/lif(1nm)/al。
图1为利用实施例1含四苯基苯的有机电致发光材料制备得到的非掺杂蓝光oleds器件的j-v-l曲线图。从图中可以看出,基于tpa-tpb-cn的非掺杂器件的最大亮度高并且启动电压低,为3945cd/m2,2.8v。
图2为利用实施例1含四苯基苯的有机电致发光材料制备得到的非掺杂深蓝光oled器件的效率随亮度变化的曲线图。从图中可以看出,基于tpa-tpb-cn的非掺杂器件具有良好的效率且效率滚降低,其最大外量子效率为6.8%;当亮度为1000cd/m2时,外量子效率还维持在6.33%;发光波长在446nm。
实施例9
本实施例测试含四苯基苯的有机电致发光材料(tpa-tpb-cn)的混合白光oleds器件性能:
利用实施例1制备得到的含四苯基苯的有机电致发光材料tpa-tpb-cn作为蓝光发光层和黄色磷光主体制备得到双色白光器件,并对其器件进行测试表征,结果见图3~4。
器件结构:ito/hat-cn(5nm)/tapc(50nm)/tcta(5nm)/tpa-tpb-cn(8nm)/tpa-tpb-cn:3%po-01(12nm)/tmpypb(40nm)/lif(1nm)/al。
图3为利用实施例1含四苯基苯的有机电致发光材料(tpa-tpb-cn)的混合白光oleds器件的j-v-l曲线图。从图中可以看出,所获得器件最大亮度高并且启动电压低,为51393cd/m2,2.8v。
图4为利用实施例1含四苯基苯的有机电致发光材料(tpa-tpb-cn)的双色白光oleds器件的效率随亮度变化的曲线图。从图中可以看出,获得的双色白光器件具有良好的效率且效率滚降低,其最大功率效率和外量子效率分别为60.7lm/w,19.1%;当亮度为1000cd/m2时,外量子效率为18.7%。
实施例10
本实施例测试含四苯基苯的有机电致发光材料(cz-tpb-cn)的非掺杂深蓝光oleds器件性能:
利用实施例2制备得到的含四苯基苯的有机电致发光材料cz-tpb-cn(固态荧光量子产率=99.9%)作为发光材料制备得到非掺杂蓝光器件,并对其器件进行测试表征,结果见图5~6。
器件结构:ito/hat-cn(5nm)/tapc(50nm)/mcp(5nm)/cz-tpb-cn(20nm)/tmpypb(40nm)/lif(1nm)/al。
图5为利用实施例2含四苯基苯的有机电致发光材料制备得到非掺杂蓝光oleds器件的j-v-l曲线图。从图中可以看出,所得到的器件的最大亮度和启动电压分别为709cd/m2,3.4v。
图6为利用实施例2含四苯基苯的有机电致发光材料制备得到的非掺杂蓝光oleds器件的效率随亮度变化的曲线图。从图中可以看出,所获得的器件都具有良好的效率且效率滚降低,其最大外量子效率为4.17%;当亮度为100cd/m2时,外量子效率为3.80%。
上述数据表明,本发明通过在四苯基苯上接上不同的给电子基团,获得同时具有aie性能和深蓝发光的分子,将这类材料作为发光层制备出的非掺杂深蓝光oleds器件效率高,效率滚降程度较小;基于这类材料制备出的结构简单的非掺杂oleds器件,具有更低的启动电压,较高的效率,且效率滚降程度更小;同时也可以将这类材料用作主体制备双色白光器件,所获得器件效率高,滚降小。总之,这类材料在有机电致发光领域有很广阔的应用前景。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!