表面活性剂凝胶对α-糜蛋白酶包封的酶活性保护方法与流程
本发明属于酶包封活性保护技术领域,具体涉及一种表面活性剂凝胶对α-糜蛋白酶包封的酶活性保护方法。
背景技术:
酶是动植物等生命系统中各种生物化学过程的必须生物催化剂。在生物体内,通过环境刺激对酶进行表达,实现对酶活性的激活或抑制,使生物化学过程有序地进行。当将酶制剂在生物体外应用时,为酶创造一个仿生的环境,从而提高酶活性、酶的催化反应稳定性及贮存稳定性,常常是提高酶的生物化学利用率的关键因素,这在医学及药剂学领域是十分重要的。表面活性剂或两性大分子(聚表面活性剂)能建立酶制剂的仿生环境,如胶束、囊泡、液晶及凝胶等,具有良好的应用前景。
α-糜蛋白酶(α-ct)是一种被广泛研究的丝氨酸蛋白酶,它可以催化蛋白质中肽键的水解,也能够催化小分子酰胺和酯键的水解,尤其对肽键的酰基侧有芳香基团的分子有选择性催化作用。α-ct价格便宜、来源丰富、对肽键的水解能力非常强且具有生物毒性低、不良反应小的优势,在医学上常用于术后消肿、抗炎、助长新生肉芽及促进创口愈合。在我们的前期工作及一些文献报道中已经涉及到阳离子季铵盐表面活性剂与α-ct相互作用及对其催化活性、构象影响的研究,非常重要的结论之一是在表面活性剂浓度小于cmc时α-ct酶表现出超活性,而在大于cmc时,酶活性仅有小的损失。但是,在这种介质中在酶具有高活性的同时,酶构象的稳定性降低,即此时酶具有高活性和低稳定性。这种制剂可以在某些一次性、短中期的领域获得应用价值。另外,阳离子对α-ct活性影响的研究都是在中性ph的缓冲溶液中进行的,而α-ct的活性与ph值密切相关,通常在ph=7左右能取得最大催化活性,在酸性条件下快速失活。
在生物体系内,如细胞,拥挤效应或排液效应常常是激发生物分子高的生物活性或稳定性的重要因素。因此在采用两亲分子建立酶分子的仿生环境时,考虑要建立一个既能激发酶活性,又能长时间保护酶活性的具有拥挤效应的环境。根据研究结果,阳离子表面活性剂水凝胶是实现这一理念的理想体系。
本项发明受到国家自然科学基金(基金编号:21773059;21273061;21327003)的支持。
技术实现要素:
本发明解决的技术问题是提供了一种表面活性剂凝胶对α-糜蛋白酶包封的酶活性保护方法,该方法采用双子型阳离子表面活性剂(c14h25n(ch3)2ch2br)2,简写为14-2-14,研制酸性水介质中稳定的水凝胶,酸性水凝胶的制备是以尿苷-5’-单磷酸(ump)作为酸组分并同时作为14-2-14的反离子,混合物自组装形成蠕虫状胶束,宏观上呈现稳定的水凝胶相态,在浓度高于25mmol/l时形成的水凝胶具有特征的屈服应力值。本发明在制备了这种凝胶体系的基础上,建立了低温包封α-糜蛋白酶的技术,并且提出了酶活性保护的凝胶体系和凝胶化包封方法。
本发明为解决上述技术问题采用如下技术方案,表面活性剂凝胶对α-糜蛋白酶包封的酶活性保护方法,其特征在于具体过程为:配制14-2-14与ump的摩尔量比为1:1的酸性水介质混合物,其中14-2-14与ump的浓度均大于25mmol/l,将酸性水介质混合物加热至35~65℃溶解得到粘稠的水溶胶,再将粘稠的水溶胶在≥27℃的温度下恒温培养得到稳定凝胶体系,利用14-2-14/ump凝胶剪切变稀和α-ct能增加14-2-14/ump凝胶流动性的特征,在35℃温度条件下将α-ct加入到不断搅拌的稳定凝胶体系中,α-ct被固定在蠕虫状胶束的网格中即可实现α-ct的包封及酶活性的保护;当粘稠的水溶胶在<27℃的温度下恒温培养得到亚稳态凝胶体系,该温度条件下亚稳态凝胶长时间放置将发生沉淀,分离为高浓度的液晶相和低粘度的水相,而且温度越低相分离速度越快,在低粘度的水相中加入α-ct,再在搅拌条件下加热后静置得到包封α-ct的白色亚稳态凝胶和透明凝胶,在27~30℃的温度区间静置,α-ct被固定在蠕虫状胶束凝胶的网格中形成透明凝胶,在<27℃的温度下静置,α-ct被固定在亚稳态凝胶中形成白色亚稳态凝胶,两种凝胶状态均可实现α-ct的包封及酶活性的保护。
本发明制备了在酸性条件下双子型阳离子表面活性剂凝胶,在不同的温度区间得到两个凝胶体系,即稳定凝胶和亚稳态凝胶体系,在制备上述凝胶体系的基础上建立了低温包封α-糜蛋白酶的技术,并且提出了酶活性保护的凝胶体系和凝胶化包封方法,研究对酶活性的影响以及对酶的包封效果,最终得到了具有应用前景的酸性条件下α-糜蛋白酶活性的保护方法。
附图说明
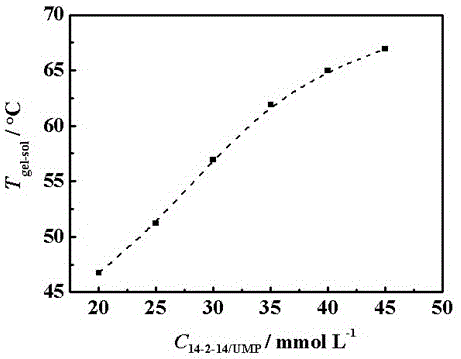
图1是dsc测量得到的不同浓度的14-2-14/ump体系的gel-sol的相转变温度曲线;
图2是不同浓度的14-2-14/ump凝胶体系在ω=6.28rad/s下测量的储能模量g′和损耗模量g″随温度变化的流变曲线。实心的符号表示g′,空心的符号表示g″,14-2-14/ump的浓度分别为(■)40mmol·l–1;(●)35mmol·l–1;(▲)30mmol·l–1;
图3是由40mmol·l–114-2-14/ump构成的凝胶(g’,▲;g”,△)和包封了0.1g·l-1a-ct的凝胶(g′,■;g″,□)在ω=6.28rad/s下测量的的储能模量及损耗模量随温度变化曲线;
图4是40mmol·l–114-2-14/ump凝胶冷冻干燥样品的扫描电子显微镜图像;
图5是在30℃时,α-ct催化2-na分解生成2-n的浓度随时间变化曲线,测量前酶培养的介质为:a.pbs;b.2mmol·l-114-2-12/ump;c.在35℃温度下采用gel-gelation法包封于20mmol·l-114-2-12/ump稳定凝胶体系;d.在4℃温度下采用2-phasegelation法包封于20mmol·l-114-2-12/ump凝胶。活性测量条件:ph7.2的10mmol·l-1pbs,0.10g·l-1α-ct,0.08mmol·l-12-na,30℃。
具体实施方式
以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
实施例
1、配制14-2-14与ump的摩尔量比为1:1的酸性水介质混合物,其中14-2-14/ump的浓度均大于25mmol/l,加热至35~65℃(与浓度相关)得到粘稠的水溶胶(sol),然后在适当的温度下恒温培养。当培养温度≥27℃时,体系由溶胶转化为透明状凝胶(gel),在容器倒置时gel不流动、不变形,长期放置不发生相变化,为热力学意义的稳定凝胶体系;当培养温度<27℃时,gel相迅速转化为白色凝胶,温度越低转化越快,在容器倒置时凝胶不流动、不变形,但是长期放置发生相变,出现沉淀的液晶相,为热力学意义上不稳定的凝胶,在此定义为亚稳态凝胶体系(psu-gel)。psu-gel可以有数天甚至十几天的稳定时间,震荡、离心等能促进psu-gel的相分离,在特定条件下具有应用价值。据此,我们得知稳定凝胶体系在人体体温附近有上、下两个感应温度,而亚稳态凝胶体系在室温附近有灵敏的温度响应。
2、使用差示扫描量热法(dsc)测量了上述psu-gel和gel之间精确的感应温度和相变焓,见表1。对于酸性的14-2-14/ump体系,psu-gel相向gel相转变的温度从14-2-14/ump浓度为25mmol/l时的26.9℃增加到50mmol/l时的27.7℃,受浓度的影响很小,平均的相变焓约为37kj/mol,在弱相互作用的能量范围,浓度对转化能量的影响很小。
表1不同浓度14-2-14/ump体系亚稳态凝胶-稳态凝胶的相变温度和焓变*
*结果来源于dsc测量
3、在高温下能够发生凝胶到溶胶的相转变,相变温度记为tgel-sol,受体系的浓度影响,浓度越高,相变温度tgel-sol越高,结果如图1所示。溶胶相为随温度升高变稀的粘性流体。由于酶结构对温度的敏感性,高温的溶胶介质不适合用于酶的包封,必须在室温附近的温度包封α-ct。
4、采用肉眼观测的方法,当14-2-14/ump的浓度达到30mmol·l–1时,稳定凝胶gel在瓶中倒置时不流动。图2为通过流变性质测量表征gel的实验结果。gel在温度较低时储能模量g’比耗损模量g”大一个数量级以上,在较高的温度下两者相交。在流变学的意义上,g’与g”相交处为gel-sol相变点的物理条件,图2中交点的温度为gel-sol的相变温度tgel-sol,与14-2-14/ump的成浓度正比,浓度越大tgel-sol越高。这些结果从流变学的角度定义了体系的稳定凝胶性质。
5、将40mmol·l–114-2-14/ump的稳定凝胶体系在35℃下放入液氮中快速冷却,然后在-50℃的初始温度下进行冷冻干燥。图4为冷冻干燥后样品的扫描电子显微镜(sem)的图片,可以看到样品呈现出蜂窝形的表面结构,表明蠕虫状胶束纠缠形成了三维网状结构,使水结构化,使体系表现为凝胶形态。
6、凝胶对目标物的包封方法一般是采用将凝胶加热至tgel-sol温度以上,加入目标物搅拌得到均匀分布的体系,再降温生成水凝胶。从图1的dsc测量结果已经看到,tgel-sol随14-2-14/ump的浓度增大而升高,不适合于对大多数酶的包封。采用两种方法实现了低温下对α-ct的包封。第一种是两相溶解再升温凝胶化法:将大于25mmol·l–1的亚稳态凝胶体系置于室温以下,如4℃,亚稳态凝胶将发生沉淀,分离为高浓度的液晶相和低粘度的水相,加入一定浓度的α-ct,再在搅拌下加热得到包封α-ct的白色亚稳态凝胶和透明凝胶,酶被固定在凝胶网格之中,以下标注为2-phasegelation方法。第二种方法是凝胶溶胶转化再降温法:利用14-2-14/ump凝胶剪切变稀和α-ct能增加14-2-14/ump凝胶流动性的特征,在35℃下将α-ct加入到不断搅拌的稳定凝胶体系中,将α-ct被固定在蠕虫状胶束的网格中,凝胶有较弱的流动性,以下标注为gel-gelation方法。采用这两种包封方法后,凝胶化的α-ct可以分别保存在稳定的gel相中或保存在亚稳态的psu-gel相中。
7、图3为40mmol·l–114-2-14/ump稳定凝胶体系在包封了0.1g/lα-ct后储能模量和损耗模量随温度的变化曲线,测量结果显示出明显的稳定凝胶的流变学特征,14-2-14/ump稳定凝胶体系包封α-ct以后,tgel-sol温度由没有包封酶的50.4℃降低到48.0℃。更多的实验结果表明,当包封的α-ct浓度提高到1.0g/l时,尽管弹性模量降低,驰豫时间由包封0.1g/l时的8.3s降低到0.38s,但是体系仍然具备凝胶状态的基本特征。
8、α-ct的酶活性用乙酸2-萘酯(2-na)在10mmol/l、ph7.2的磷酸盐缓冲溶液(pbs)中水解生成乙酸和2-萘(2-n)的酶催化反应速率表征。活性表征步骤如下:1)定量取出含α-ct溶液,如果是酸性体系要用naoh水溶液调节到中性;2)加入ph7.2的pbs定容,使结果的溶液含有0.10g/lα-ct、10mmol/lpbs、ph=7.2;3)分别移取2.96ml上述溶液置于两个3ml的比色皿中,放入uv-vis分光光度计中恒温十分钟,在328nm下调节仪器的零点;4)向参比池中加入0.04ml乙二醇,向样品池中加入0.04ml浓度为6.0mmol/l的2-na乙二醇溶液,在328nm下测量吸光度随时间的变化曲线;5)通过线性模拟计算出反应中2-n生成的初始速率,定义为α-ct的活性(实验已经排除2-na自分解和胶束催化的影响)。在上述步骤1)中分别取凝胶化的含酶样品和用纯酶配制的样品(参考样品)测量活性,两者的比值定义为相对活性。参考样品必须保证在测量时各个组分的含量完全相同,否则将会得到错误的结果。
9、ump的存在对α-ct活性的测量没有影响,与没有ump的pbs溶液中活性测量值比较的相对活性大于97%。14-2-14的存在影响α-ct活性的测量,当浓度大于cmc(0.15mmol/l,25℃)时,相对活性明显降低,如14-2-14的浓度为4mmol/l时,表观相对活性为55%。根据已有的研究结果,2-na在胶束内的溶解分配是表观活性降低的主要因素。图5为α-ct在不同条件下培养后再测量得到的2-n浓度随时间变化曲线,能够反映出培养环境对酶活性的影响。曲线a为在pbs中培养10min后的活性,视为天然酶活性的参照值(1.78e-5mmol/l·s);测量时含有低浓度的14-2-14/ump(2.0mmol·l─1)时,曲线b,反应速率明显降低,主要反映了底物增溶对酶活性测量的影响,视为测量条件的酶活性参照值(8.79e-6mmol/l·s);当将酶通过gel-gelation方法或2-phasegelation包封到20mmol·l─1的14-2-14/ump凝胶中培养以后(曲线c(6.33e-6mmol/l·s)和d(6.20e-6mmol/l·s)),相对于曲线b的相对活性vr约为0.72,活性明显降低,但是仍存在相当大的保留活性,证明凝胶包封能够在酸性条件下保护α-ct。
以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!