一种c-Met/HDAC双靶点抑制剂及其合成方法与应用与流程
本发明属于医药
技术领域:
,具体涉及一种c-met/hdac双靶点抑制剂及其合成方法与应用。
背景技术:
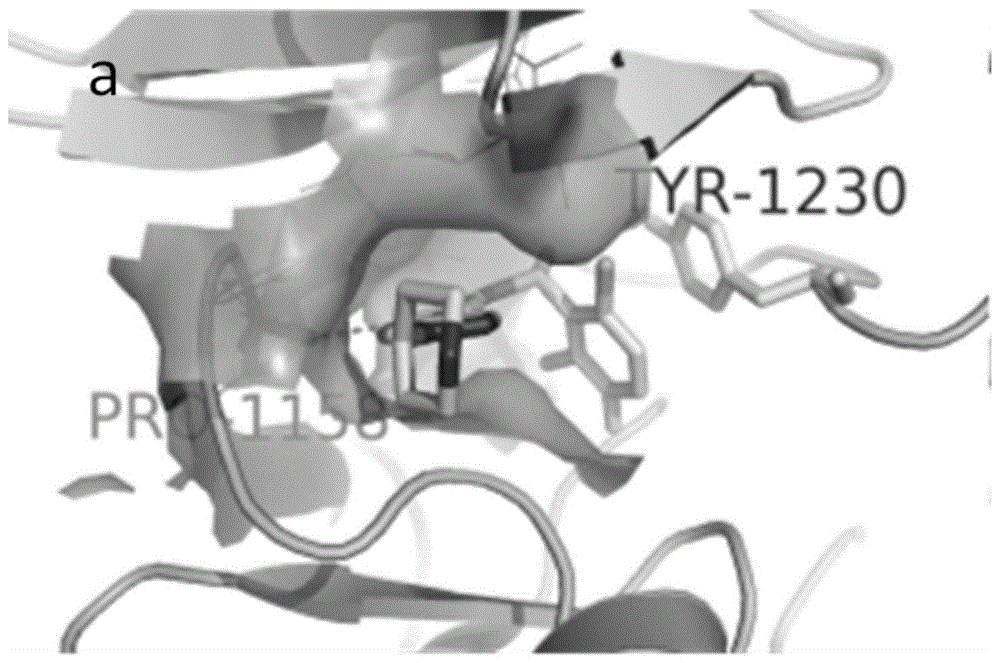
:在hgf/met信号通路中,hgf活化c-met,激活下游的ras–raf–mek–mapk和pi3k–akt信号通路,使原癌基因(c-myc)和g1/s-特异性周期蛋白-d1(cyclind1)表达升高,细胞周期检查蛋白p21和p27活性降低,促进细胞周期进程和生存。组蛋白去乙酰化酶(hdac)也是细胞周期进程的关键调节子,抑制hdac,能够促进细胞周期检查蛋白p21和p27的表达,阻滞细胞周期,降低cyclind1的转录,加快c-myc的降解。因此,c-met抑制剂和hdac抑制剂在对癌症的作用机制上存在一定协同作用。c-met与克唑替尼的复合物晶体结构如图1,从图中可以看出,化合物结构占据atp结合口袋,2,6-二氯-3-氟-苯基与活化环上的残基tyr1230形成较强的π-π相互作用,吡啶环和吡唑环结合在由残基lys1110、leu1157、val1092、ala1108、ile1084和tyr1159形成的疏水口袋中,吡啶环上的氨基与pro1158形成氢键,连接在吡唑环上的哌啶环则伸展到疏水口袋的外部。伏立诺他是一种hdac抑制剂,临床上治疗皮肤t淋巴细胞瘤,但伏立诺他对实体瘤无显著疗效。hdac2与伏立诺他的复合物晶体结构如图2,从图中可以看出,链状的羟肟酸基团深入hdac2的结合腔,与zn2+螯合并与残基asp268、his182、his142、his143和tyr312形成氢键,而苯胺酰基则暴露在结合腔之外。克唑替尼的分子式如式(ii)所示,伏立诺他的结构式如式(iii)所示。多靶点抑制剂肿瘤信号转导是肿瘤治疗和药物开发的新方向,研究表明,多靶点单一实体药物的疗效效果优于单靶点药物且具有更小的副反应。同时具有c-met和hdac双靶点的抑制剂具有协同对抗癌症的作用,而现有技术中并没有针对具有这两种靶点的单项药物的研究。鉴于以上原因,特提出本发明。技术实现要素:为了解决现有技术存在的以上问题,本发明提供了一种c-met/hdac双靶点抑制剂及其合成方法与应用,本发明的抑制剂采用药效团拼合的原理,合成了单一结构双靶点的抑制剂,可以同时抑制c-met和hdac。为了实现上述目的,本发明采用如下技术方案:一种c-met/hdac双靶点抑制剂,所述的抑制剂的结构式如式(i)所示或式(i)在药学上可接受的盐:其中,linker为直链结构、支链结构或芳香环结构。进一步的,所述的直链结构为其中n为1-7任一自然数。进一步的,所述的支链结构为进一步的,所述的芳香环结构为一种所述的c-met/hdac双靶点抑制剂的合成方法,所述的方法包括如下步骤:(1)首先合成中间体(a)反应方程式如下:(2)中间体(b)的合成方程式如下:(3)中间体(c)的合成方程式如下:(4)目标产物合成方程式如下:本发明的中的原料均采用市售的原料或者采用现有技术制备而成。进一步的,步骤(1)在室温进行搅拌反应20-24小时,加水、萃取、洗涤、干燥、过滤、浓缩,得到中间体(a),中间体(a)的产率为70-75%。进一步的,步骤(2)在碱性条件下反应,室温搅拌反应3.5-4.5小时,浓缩、调节ph=5~6,过滤、干燥,得到中间体(b),中间体(b)的产率为85-95%。进一步的,步骤(3)中中间体(b)溶解在dmf,然后加入hatu和dipea,搅拌反应10-20分钟,加入o-(四氢-2h-吡喃-2-基)羟胺,在室温下搅拌反应3.5-4.5小时,分层、洗涤、干燥、过滤、浓缩,得到中间体(c),中间体(c)产率为65-75%。进一步的,步骤(4)在室温反应25-35分钟,浓缩,调节ph至中性,得到目标产物,所述的目标产物的产率为60-64%。一种所述的c-met/hdac双靶点抑制剂在制备抗肿瘤药物中的应用。与现有技术相比,本发明的有益效果如下:(1)本发明的抑制剂以c-met抑制剂克唑替尼和hdac抑制剂伏立诺他为先导结构,设计出的一种单一结构的双靶点抑制剂,用克唑替尼的结构作为hdac抑制剂的帽状结构,代替伏立诺他结构中的苯胺酰基,保留伏立诺他中的羟肟酸结构作为金属锌离子的螯合基团,在两者之间通过引入不同结构的连接基团,利用药效团拼合的原理,设计单一结构双靶点抑制剂,得到的双靶点抑制剂对c-met与hdac均具有良好的抑制作用,且能够协同抑制c-met与hdac;(2)本发明的制备方法简单,条件温和,产率高,提供了一种新的药物研发思路,提高了治疗癌症的药物的利用效率和治疗效果,对于实体瘤的抑制具有显著的效果。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1是c-met与克唑替尼的复合物晶体结构;图2是hdac2与伏立诺他的复合物晶体结构;图3是本发明提供的双靶点抑制剂的合成路径示意图。具体实施方式为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。实施例1本实施例中的c-met/hdac双靶点抑制剂的结构式如下:其中,linker为n=4。本实施例的双靶点抑制剂的合成方法如下:(1)首先合成中间体(a)反应方程式如下:在室温的条件下,将克唑替尼(900.6mg,2mmol),5-溴戊酸甲酯(468.0mg,2.4mmol)和碳酸钾(830.0mg,6mmol)加入至30mldmf中,室温搅拌24h,tlc(薄层色谱)检测(二氯甲烷与甲醇的体积比10:1)原料反应完全。向反应液中加入30ml水,搅拌至清液,然后以乙酸乙酯(100ml)平均分2次萃取,萃取液以饱和食盐水(100ml)平均分2次洗涤,无水硫酸钠干燥、过滤、滤液减压浓缩、柱层析纯化(二氯甲烷与甲醇的体积比30:1),得到类白色中间体(a)824.0mg,产率73%。(2)中间体(b)的合成方程式如下:将中间体(a)(800mg,1.42mmol)溶解于10.0ml甲醇中,滴加2mol·l-1的氢氧化钠水溶液(5.0ml),室温搅拌4小时,tlc检测(二氯甲烷与甲醇的体积比20:1)反应完全。减压浓缩,残留物用水溶清,以1mol·l-1的盐酸调节体系ph=5~6,伴随大量白色固体,过滤,并以冰水洗涤固体,干燥,得到白色中间(b)694.0mg,产率90%。(3)中间体(c)的合成方程式如下:将中间体(b)(550.5mg,1.0mmol)溶于20mldmf中,然后加入hatu(456.3mg,1.2mmol)和n,n-二异丙基乙胺(dipea)(258.5mg,2.0mmol),在冰浴条件下搅拌15分钟,然后加入o-(四氢-2h-吡喃-2-基)羟胺(nh2-o-thp)(140.6mg,1.2mmol),在室温条件下搅拌4h,tlc监测(二氯甲烷与甲醇的体积比10:1)反应完全。加入20ml水和60ml乙酸乙酯,分层取有机相,饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩。残留物柱层析(二氯甲烷与甲醇的体积比20:1)得类白色中间体(c)454.7mg,产率70%。(4)目标产物合成方程式如下:将中间体(c)(325.0mg,0.5mmol)溶于10ml1,4-二氧六环和3ml甲醇,在5℃-10℃的冰浴条件下,滴加含1nml/lhcl的1,4-二氧六环(2ml)的溶液,滴加完毕,室温反应30分钟。tlc监测(二氯甲烷与甲醇的体积比10:1)反应完全。减压浓缩反应液,残留物溶于水至清,用0.5nnaoh水溶液调节ph至中性,得固体粗品。柱层析(二氯甲烷与甲醇的体积比10:1)得目标化合物(i-1)175.3mg,产率62%。本实施例的目标产物式(i-1)的1hnmr数据如下:1hnmr(400mhz,dmso-d6):ppm:10.46(1h,s),7.96(1h,s),7.75(d,j=1.6hz,1h),7.56-7.59(dd,j=4.76hz,5.04hz,1h),7.52(s,1h),7.45(t,j=8.68hz,8.68hz1h)6.89(d,j=1.68,1h),6.06-6.11(q,j=6.72hz,1h),5.67(s,2h),4.06-4.10(m,1h),2.93(d,j=11.48hz,2h),2.3(t,j=8hz,8hz,2h),1.88-2.06(m,8h),1.79(d,j=6.72hz,3h),1.22-1.52(m,4h)。实施例2本实施例的c-met/hdac双靶点抑制剂结构式中,linker为n=5,按照实施例1的方法进行合成,将5-溴戊酸甲酯替换为6-溴己酸甲酯,试验参数进行常规调整,得到目标产物(i-2),1hnmr数据如下:1hnmr(400mhz,dmso-d6):ppm:10.44(s,1h,n-oh),7.96(s,1h),7.75(d,j=1.68hz,1h),7.56-7.59(dd,j=4.76hz,5.04hz,1h),7.52(s,1h),7.44(t,j=8.68hz,8.68hz,1h),6.89(d,j=1.4hz,1h),6.06-6.11(q,j=6.48hz,6.72hz,6.48hz,1h),5.67(s,2h),4.06-4.13(m,1h),2.95(d,j=10.96hz,2h),2.28-2.31(t,j=6.72hz,7.56hz,2h),1.89-2.08(m,8h),1.80(d,j=6.72hz,3h),1.22-1.54(m,6h)。实施例3本实施例的c-met/hdac双靶点抑制剂结构式中,linker为n=6,按照实施例1的方法进行合成,将5-溴戊酸甲酯替换为7-溴庚酸甲酯,试验参数进行常规调整,得到目标产物(i-3),1hnmr数据如下:1hnmr(400mhz,dmso-d6):ppm:10.37(s,1h,),8.70(s,1h),7.96(s,1h),7.75(d,j=1.68hz,1h),7.57(dd,j=4.76hz,5.04hz,1h),7.52(s,1h),7.44(t,j=8.68hz,1h),6.90(d,j=1.4hz,1h),6.06-6.11(q,j=6.44hz,6.72hz,6.44hz,1h),5.66(s,2h),4.05-4.11(m,1h),2.94(d,j=11.48hz,2h),2.29(t,j=7hz,2h),1.89-2.06(m,8h),1.80(d,j=6.72hz,3h),1.23-1.50(m,8h)。实施例4本实施例的c-met/hdac双靶点抑制剂结构式中,linker为n=7,按照实施例1的方法进行合成,将5-溴戊酸甲酯替换为8-溴辛酸甲酯,试验参数进行常规调整,得到目标产物(i-4),1hnmr数据如下:1hnmr(400mhz,dmso-d6):ppm:10.37(s,1h),7.96(s,1h),7.75(d,j=1.68hz,1h),7.57(dd,j=5.04hz,4.76hz,1h),7.52(s,1h),7.44(t,j=8.68hz,8.68hz,1h),6.89(d,j=1.68hz,1h),6.06-6.11(q,j=7.04hz,6.72hz,6.72hz,1h),5.65(s,2h),4.04-4.10(m,1h),2.92(d,j=11.24hz,2h),2.27(t,j=7.28hz,2h),1.91-2.03(m,8h),1.80(d,j=6.44hz,3h),1.23-1.51(m,10h)。实施例5本实施例的c-met/hdac双靶点抑制剂结构式中,linker为按照实施例1的方法进行合成,将5-溴戊酸甲酯替换linker为试验参数进行常规调整,得到目标产物(i-5),1hnmr数据如下:1hnmr(400mhz,dmso-d6):ppm:11.24(s,1h),9.06(s,1h),7.98(s,1h),7.75(d,j=1.68hz,1h),7.72(s,1h),7.64(d,j=7.6hz,1h),7.57(dd,j=5.04hz,1h),7.53(s,1h),7.39-7.47(m,3h),6.90(d,j=1.68hz,1h),6.09-6.11(q,j=6.72hz,6.76hz,6.72hz,1h),5.67(s,2h),4.08-4.16(m,1h),3.54(s,2h),2.88(d,j=19.2hz,2h),1.90-2.15(m,6h),1.79(d,j=6.72hz,3h)。实施例6本实施例的c-met/hdac双靶点抑制剂结构式中,linker为按照实施例1的方法进行合成,将5-溴戊酸甲酯替换linker为试验参数进行常规调整,得到目标产物(i-6),1hnmr数据如下:1hnmr(400mhz,dmso-d6):ppm:11.19(s,1h),9.05(s,1h),7.97(s,1h),7.71-7.75(m,3h),7.57(dd,j=4.76hz,5.04hz,1h),7.52(s,1h),7.39-7.46(m,3h),6.89(d,j=1.4hz,1h),6.06-6.11(q,j=6.72hz,1h,ch-ch3),5.67(s,2h),4.07-4.15(m,1h),3.55(s,2h),2.87(d,j=11.2hz,2h),1.92-2.15(m,6h),1.79(d,j=6.44hz,3h)。实施例7本实施例的c-met/hdac双靶点抑制剂结构式中,linker为按照实施例1的方法进行合成,将5-溴戊酸甲酯替换linker为试验参数进行常规调整,得到目标产物(i-7),1hnmr数据如下:1hnmr(400mhz,dmso-d6):ppm:10.8(s,1h),9.09(s,1h),7.97(s,1h),7.76(s,1h),7.35-7.59(m,8h),6.90(s,1h),6.46(d,j=16.04hz,1hz,1h),6.06-6.11(q,j=6.16hz,1h),5.68(s,2h),4.03-4.11(m,1h),3.52(s,2h),2.88(d,j=10.08hz,2h),1.92-2.14(m,6h),1.80(d,j=6.44hz,3h,ch-ch3)。实施例8将化合物(i-1)565mg(1mmol)溶于10ml二氯甲烷和甲醇的混合溶液(10:1),在冰水浴的条件下滴加0.5nhcl/1,4-二氧六环溶液4ml,有固体析出,搅拌4h,tlc检测,原料反应完全,停止反应,过滤得粗品,在冰浴条件下,在乙腈中搅拌3h,过滤得i-a341mg,收率60%。1hnmr(400mhz,dmso-d6):ppm:10.39(1h,s),7.96(1h,s),7.75(d,j=1.6hz,1h),7.56-7.59(m,1h),7.52(s,1h),7.45(t,j=8.68hz,8.68hz1h)6.89(d,j=1.68,1h),6.06-6.11(q,j=6.72hz,1h),4.06-4.10(m,1h),2.93(d,j=11.48hz,2h),2.3(t,j=8hz,8hz,2h),1.88-2.06(m,8h),1.79(d,j=6.72hz,3h),1.22-1.52(m,4h)。实验例1对实施例1-7制备的双靶点抑制剂化合物(i-1)~(i-7)分别进行如下评价:1、生物活性评价:按照cisbio公司的试剂盒使用说明书,激酶tm-络氨酸激酶试验(kineasetm-tkassay)、hdac2组蛋白去乙酰化试验(hdac2histoneh3k4deacetylationassay)和hdac1组蛋白去乙酰化试验(hdac1histoneh3k9deacetylationassay)采用均相时间分辨荧光(htrf)技术分别检测待测化合物对c-met激酶活性及hdac2和hdac1脱乙酰化作用的抑制效应。实验过程分为三步:酶反应步骤、检测步骤和数据处理。(1)酶反应步骤在384孔板中分别按顺序加入化合物,底物-生物素(tksubstrate-biotin),酶等,将板子密封置于37℃孵箱中孵育进行酶反应。(2)检测步骤加入检测试剂链霉亲和素-xl665(streptavidin-xl665)及酶对应的抗体,室温放置1小时后用酶标仪检测620nm和665nm荧光值。(3)数据处理每孔的检测值:ratio=(665nm/620nm)×104,每个样品孔的特异性信号为样品孔的检测值与阴性对照孔检测值之差:deltaratio=ratio(sample)-ratio(negativecontrol),根据特异性信号计算每个化合物的抑制率:(deltaratio阳性对照-deltaratio化合物)/deltaratio阳性对照。根据化合物的浓度及对应的抑制率,求化合物的ic50。2、对c-met抑制活性的筛选(1)材料准备阳性对照化合物为克唑替尼。制备2×104um的化合物为母液,储存在-80℃的冰箱里备用。将化合物稀释为200nm的浓度进行初筛。按照htrfkineasetm-tk分析试剂盒的说明配制试剂的浓度并进行稀释为工作液浓度:streptavidin-xl665(66.68×)、tksubstrate-biotin(10×)、tkantibody-cryptate(1×)、detectionbuffer(1×)、c-met激酶(0.4ng/ul),dtt(100mm),atp(5mm)和mgcl2(1m),enzymaticbuffer(5×enzymaticbuffer,200×mgcl2,100×dtt,ddh2o)。(2)酶反应步骤阴性对照孔中加入6ul1×kinasebuffer,阳性对照孔中加入4ul1×kinasebuffer,样品孔加入4ul化合物(200nm);然后每孔加入2ultksubstrate-biotin(10×);除了阴性对照孔外,每孔再加入2ul的c-met激酶(0.4ng/ul);最后每孔再加入2ul的atp(5mm),在37℃的条件下孵育一个小时。(3)检测步骤每孔依次加入5ul的streptavidin-xl665(66.68×)和5ul的tkanti-body-cryptate(1×),室温放置一小时后。酶标仪检测665nm和620nm的荧光值。按照数据处理的方法,计算抑制率,结果见表1。表1根据初筛结果,选择和阳性化合物的抑制率相当的化合物,做进一步的筛选。复筛化合物分别选择六个浓度(200nm,100nm,20nm,10nm,2nm,0.2nm),实验过程同上,复筛化合物的ic50值见表2。表2组别ic50(nm)克唑替尼36.3i-633.1i-71503、对hdac2抑制活性的筛选(1)材料准备阳性对照化合物为伏立诺他。制备2×104um的化合物为母液,储存在-80℃的冰箱里备用。首先选择在20um的浓度进行初步筛选。按照说明配制试剂的浓度并进行稀释为工作液浓度:h3k4me0-eu(k)ab(50×),streptavidin-xl665(83.35×),detectionbuffer(1×),histoneh3(1-21)lysine4acetylatedbiotinylatedpeptide(1000nm),hdac2(2ng/ul),1×enzymaticbuffer(50mmtris-hclph8.0,1mmdtt,0.01%tween20,0.01%bsa)。(2)酶反应步骤阴性对照孔中加入6ul1×kinasebuffer,阳性对照孔中加入4ul1×kinasebuffer,检测孔加入4ul化合物(20um);然后除了阴性对照孔外,每孔再加入2ul的hdac2(2ng/ul);最后每孔加入4ul的底物histoneh3(1-21)lysine4acetylatedbiotinylatedpeptide(1000nm),在37℃的条件下孵育2个小时。(3)酶检测步骤每孔都依次加入5ul的streptavidin-xl665(83.35×)和5ul的h3k4me0-eu(k)ab(50×),室温放置一小时后。酶标仪检测665nm和620nm的荧光值。(4)数据处理按照实验方法中的数据处理方法,计算抑制率,实验数据见表3。表34、对hdac1抑制活性的筛选(1)材料准备阳性对照化合物为伏立诺他。制备2×104um的化合物为母液,储存在-80℃的冰箱里备用。首先选择在2um的浓度进行初步筛选。按照说明配制试剂的浓度并进行稀释为工作液浓度:h3k9me0-eu(k)ab(50×),streptavidin-xl665(416.5×),detectionbuffer(1×),histoneh3(1-21)lysine9acetylatedbiotinylatedpeptide(200nm),hdac1(20ng/ul),1×enzymaticbuffer(50mmtris-hclph8.0,137mmnacl,2.7mmkcl,1mmmgcl2,0.01%tween20)。(2)酶反应步骤阴性对照孔中加入6ul1×kinasebuffer,阳性对照孔中加入4ul1×kinasebuffer,检测孔加入4ul化合物(2um);然后除了阴性对照孔外,每孔再加入2ul的hdac1(20ng/ul);最后每孔加入4ul的底物histoneh3(1-21)lysine9acetylatedbiotinylatedpeptide(200nm),在37℃的条件下孵育2个小时。(3)检测步骤每孔都依次加入5ul的streptavidin-xl665(83.35×)和5ul的h3k9me0-eu(k)ab(50×),室温放置一小时后。酶标仪检测665nm和620nm的荧光值。(4)数据处理按照实验方法中的数据处理方法,计算抑制率,实验数据见表4。表4综合以上数据分析,本发明制备的化合物对c-met和hdac1/hdac2均具有一定的抑制作用,其中,化合物i-1、i-2、i-3、i-6、i-7对c-met的抑制率与克唑替尼相仿,化合物i-6的ic50值与克唑替尼在同一数量级上;化合物i-3、i-4、i-7对hdac1/hdac2的抑制率与伏立诺他相仿,因此本发明的化合物可以起到同时抑制c-met和hdac1/hdac2的作用,在抗肿瘤的机理上存在一定的协同作用,该化合物在体内的药效可能存在叠加的效应,有望降低药物的使用剂量和毒副作用。本申请人对其他实施例制备的化合物也进行了上述的试验,结果基本一致,由于篇幅有限,不再一一列举。以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1