本发明属于木质纤维素酶解技术领域,特别涉及一种利用改性β-葡萄糖苷酶强化木质纤维素酶解的方法。
背景技术:
目前能源危机和环境问题的解决迫在眉睫,为了解决这一系列问题,利用可大量再生的木质纤维素实物资源生产纤维素乙醇的相关技术发展备受关注(science,2014.345:1111.)。在纤维素乙醇的生产过程中,木质纤维素的酶解由于具有安全、清洁、反应专一性强以及不会产生化学废弃物等优点,被认为是极具发展潜力的降解纤维素的方法(science,2007.315:804-807;greenchemistry,2017.19:5479-5487.)。然而木质纤维素的酶解效率较低,纤维素酶用量大、成本高等问题都限制了其工业化发展(bioresourcetechnology,2018.265:532-541;bioresourcetechnology,2017.8524:31919-31923.)。
纤维素酶是一种复合酶,其组分较多且相对复杂,主要包含内切葡聚糖酶(endo-β-1,4-d-glucanase,简称内切酶)、外切葡聚糖酶(exo-β-1,4-d-glucanase,简称外切酶)和β-葡萄糖苷酶(β-glucosidase,亦称纤维二糖酶,简写cb)等(science,2007.315,804-807.)。因此对产酶菌株和产酶技术进行改造或通过复配调节纤维素酶的组分可以构建出更高效的纤维素酶制剂,是提高木质纤维素酶解效率的一种有效途径。harrispv等(biochemistry,2010.49:3305-3316.)利用嗜热子囊菌来源的gh61a在里氏木霉中异源表达,得到高效的复合纤维素酶,复合酶用量可降至原纤维素酶用量的一半以上。另外,商业化的β-葡萄糖苷酶制剂novozyme188常用于纤维素酶的复配,可以有效提高木质纤维素的酶解糖化效率(bioresourcetechnology,2010.101:9624-9630.)。但目前通过菌株改造或复配调节制备高效纤维素酶制剂的技术仍不成熟,工业化瓶颈难以突破,当前更是缺乏新颖的思路来指导纤维素酶的高效改造。
目前普遍认为纤维素酶和木质素间主要存在疏水作用、静电作用和氢键作用,且由于纤维素酶各组分的结构差异和各组分酶解底物的差异,木质素的吸附对不同酶组分催化活性的影响不同。其中,木质素的吸附会显著抑制内切酶和外切酶的催化活性(biotechnologyforbiofuels,2014.7:38-47;bioresourcetechnology,2018.267:110-116.),而对于β-葡萄糖苷酶,由于其缺乏与木质素结合的结合域,且其酶解底物纤维二糖是水溶性的,木质素的吸附对β-葡萄糖苷酶的催化活性和传质阻力影响较小(biotechnologyforbiofuels,2015.8:214-228.)。因此可以考虑通过对β-葡萄糖苷酶进行定向改造,以增强纤维素酶整体的催化效果。
技术实现要素:
为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一种利用改性β-葡萄糖苷酶强化木质纤维素酶解的方法。
基于木质素的吸附对纤维素酶不同组分的催化活性影响不同,本发明通过化学方法在β-葡萄糖苷酶末端直接或通过链段(linker)引入阳离子基团(如季铵根等)提高酶蛋白的等电点,或引入疏水片段(如类苯环结构、长链烷基等)增加酶蛋白的疏水性,使β-葡萄糖苷酶优先吸附在木质素上,以增加其在木质素上的吸附量,通过竞争吸附减少内切酶和外切酶在木质素上的无效吸附,从而提高木质纤维素的酶解效率。
本发明的目的通过下述方案实现:
一种利用改性β-葡萄糖苷酶强化木质纤维素酶解的方法,将含改性β-葡萄糖苷酶的复合酶制剂加入到以木质纤维素为底物的酶解体系中,实现木质纤维素的高效酶解。
所述复合酶制剂的组分,还可以包括内切葡聚糖酶、外切葡聚糖酶、木聚糖酶等酶蛋白组分中的至少一种,和/或nacl、甘油等稳定剂中的至少一种。
所述复合酶制剂中,改性β-葡萄糖苷酶,与内切葡聚糖酶、外切葡聚糖酶的质量比优选为1:(0.1-10):(0.1-10)。
所述复合酶制剂的用量优选为0.1-10mg/ml酶解体系。
优选地,所述的木质纤维素包括松木、桉木、杨木、水曲柳、沙棘、伯树、杉木、桦木、玉米芯、玉米秸秆、麦秆、甘蔗渣、稻草、稻壳、食用菌基质和花生壳中的至少一种。
优选地,所述酶解体系的缓冲体系为ph3-6、离子强度5-200mmol/l的醋酸-醋酸钠缓冲液、柠檬酸-柠檬酸钠缓冲液或磷酸盐缓冲液。
本发明方法中,所述的改性β-葡萄糖苷酶,为在β-葡萄糖苷酶末端直接或通过链段引入阳离子基团和/或疏水片段。
进一步地,所述的阳离子基团可包括季铵根、氨基等,可利用季铵盐、含有多氨基化合物、伯胺等与β-葡萄糖苷酶反应引入。
所述的季铵盐可包括甜菜碱及其衍生物、烷基季铵盐等。
所述含有多氨基化合物可包括赖氨酸短肽链、聚丙烯酰胺及其衍生物等。
所述伯胺可包括甲胺、乙胺、丁胺等,主要用于与羧基反应。
进一步地,所述的疏水片段可包括苯环结构、长链烷基等,可利用芳香族化合物、含长链烷基的化合物等与β-葡萄糖苷酶反应引入。
所述芳香族化合物可包括苯酚、苯丙氨酸、多苯环化合物等。
所述含有长链烷基的化合物可包括长链羧酸、长链全氟烷基羧酸、长链伯胺等。
进一步地,所述的链段可包括聚氧乙烯链等,可利用聚乙二醇和/或其衍生物实现,如:聚乙二醇(分子量优选为500-5000)、单甲氧基聚乙二醇、甲基烯丙醇聚氧乙烯醚或烯丙基聚氧乙烯醚等。
上述的季铵盐、含有多氨基化合物、伯胺等,芳香族化合物、含长链烷基的化合物等可在β-葡萄糖苷酶中引入阳离子基团和/或疏水片段的试剂可统称为改性剂。
更进一步地,所述的改性β-葡萄糖苷酶,可通过包括以下步骤的方法在β-葡萄糖苷酶末端直接或通过链段引入阳离子基团和/或疏水片段得到:
将改性剂与β-葡萄糖苷酶直接反应a得到产物;
或先将改性剂与聚乙二醇和/或其衍生物反应b得到改性剂中间体,再与β-葡萄糖苷酶反应c得到产物;
或先将β-葡萄糖苷酶与聚乙二醇和/或其衍生物反应d得到酶中间体,再与改性剂反应e,得到产物。
以质量份数计,所述改性剂,聚乙二醇和/或其衍生物,β-葡萄糖苷酶的用量分别为1-100份,0-100份,5-20份。
上述反应过程中,均优选先将改性剂和β-葡萄糖苷酶溶于水中配成溶液再用于反应。
将改性剂溶于水中的浓度优选为质量分数1-50%;优选调节溶液ph值为1-12,温度20-100℃。
β-葡萄糖苷酶水溶液的浓度优选为质量分数0.5-20%;优选调节水溶液的ph值为3-10,温度为0-60℃。
本发明改性方法中,反应的时间均分别优选为2-48h;反应过程中均优选保持体系ph值和温度不变。
所述先将改性剂与聚乙二醇和/或其衍生物反应b得到改性剂中间体,或先将β-葡萄糖苷酶与聚乙二醇和/或其衍生物反应d得到酶中间体,均分别优选在交联剂、活化剂或催化剂的作用下进行;所用交联剂、活化剂或催化剂的用量为1-120份。
所述的交联剂包括环氧氯丙烷、戊二醛和n,n-亚甲基双丙烯酰胺(mba)等的至少一种。
所述的活化剂包括1-(3-二甲氨基丙基)-3-乙基碳二亚胺(edc)、二环己基碳二亚胺(dcc)、n-羟基琥珀酰亚胺(nhs)等的至少一种。
所述的催化剂包括三偏磷酸钠、五氟化锑、三氟化硼乙醚络合物、氯化铝、四氯化锡、五氯化锑和四丁基溴化铵等中的至少一种。
上述反应过程中加入交联剂、活化剂或催化剂后,优选保持体系ph值和温度不变,搅拌1-60min使体系均匀。
上述改性过程中,所述调节ph均可通过加入有机酸或无机酸调节;所述的有机酸或无机酸包括盐酸、硫酸、硝酸、磷酸、醋酸、乙酸、甲酸和马来酸中的至少一种。
所述反应后,所得产物可通过超滤、凝胶过滤、离子交换层析、亲和层析、吸附分离、区带电泳、等电点聚焦中的至少一种进行纯化。
本发明的机理为:木质素的吸附会显著抑制内切葡聚糖酶和外切葡聚糖酶的催化活性,但对β-葡萄糖苷酶的催化活性影响较小。本发明通过化学修饰法在β-糖苷酶分子表面接枝疏水片段或强正电基团来增加表面的疏水性或正电荷数,增强其与木质素之间的静电作用力、疏水作用力和氢键作用力,并有效使β-葡萄糖苷酶优先吸附在木质素上,通过竞争吸附减少其他酶组分在木质素上的无效吸附,使更多的内切葡聚糖酶和外切葡聚糖酶作用在纤维素上,从而提高整体纤维素酶的催化效率。
本发明方法首次提出对β-葡萄糖苷酶进行亲木质素改性,通过竞争吸附减少内切葡聚糖酶和外切葡聚糖酶在木质素上的无效吸附,从而提高木质纤维素酶解效率,可获得提高33%以上的酶解效率。本发明方法可以提高纤维素酶整体利用效率,并且可通过该思路指导高效酶制剂的生产。
本发明相对于现有技术,具有如下的优点及有益效果:
(1)本发明的改性方法对β-葡萄糖苷酶的活力影响较小,且可有效改变酶分子的表面性能,增加酶分子与木质素间的亲和力。
(2)本发明不需要额外添加酶解助剂即可有效改善纤维素酶对木质纤维素的酶解效果。
(3)本发明提供了一种纤维素酶改造的新思路,为高效酶制剂的构建提供指导。
附图说明
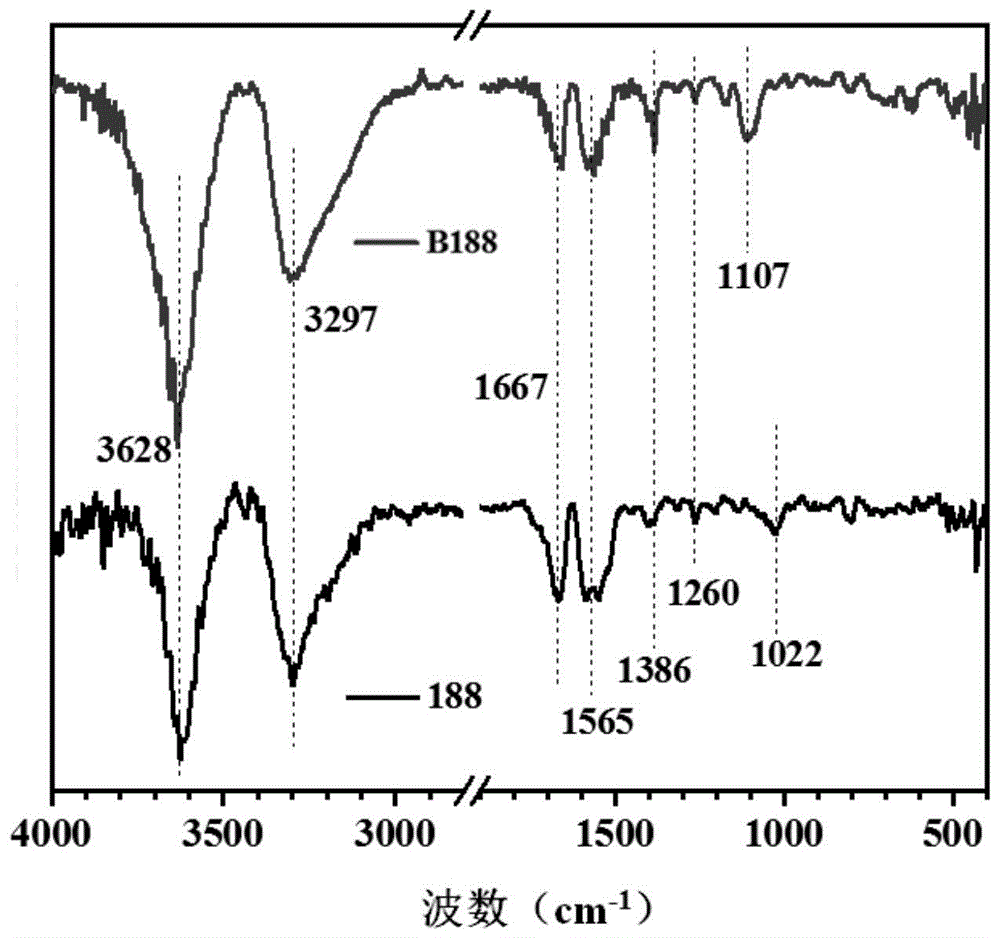
图1为实施例3的cb-b-0.3改性前后的红外光谱分析。
图2为实施例3的cb-b-0.3改性前后对纤维素酶celluclast在木质素上无效吸附影响的耗散型石英晶体微天平测试结果。其中,选用第三倍频的频率变化进行研究。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中涉及的物料均可从商业渠道获得。
实施例中的β-葡萄糖苷酶制剂是从sigma-aldrich公司购买的novozymes188;复合酶制剂组合还包括由诺维信(中国)有限公司提供的1.5l纤维素酶celluclast;实施例中β-葡萄糖苷酶的酶活力以未经过任何改性处理的原酶活力为标准。木质纤维素底物选用由济南圣泉集团股份有限公司提供的玉米芯残渣;水解液中葡萄糖浓度通过生物传感分析仪(sba-40e,山东省生物科学研究院)测定。
实施例1:本发明实施例涉及6种改性β-葡萄糖苷酶。
第一种是先用edc/nhs活化甜菜碱上的羧基,与β-葡萄糖苷酶上的氨基形成酰胺键,直接接入强正电基团得到的季铵化β-葡萄糖苷酶(cb-b)。
第二种是利用edc/nhs活化β-葡萄糖苷酶上的羧基,与丁胺上的氨基形成酰胺键,减少酶蛋白上的羧基端得到封羧基端改性的β-葡萄糖苷酶(cb-cn)。
第三种是通过成肽反应在β-葡萄糖苷酶的末端直接接入苯丙氨酸得到的疏水化β-葡萄糖苷酶(cb-p)。
第四种是利用成肽反应在β-葡萄糖苷酶的末端同时接入甜菜碱和苯丙氨酸得到同时季铵化和疏水化改性的β-葡萄糖苷酶(cb-b-p);
第五种是以聚氧乙烯链作为连接链段,连接β-葡萄糖苷酶和(3-氯-2-羟丙基)三甲基氯化铵得到的β-葡萄糖苷酶聚醚季铵盐(cb-peg-qas)。
第六种是以聚氧乙烯链作为linker,连接β-葡萄糖苷酶和3-氯-2-羟丙苯醚得到的苯基疏水化修饰的β-葡萄糖苷酶(cb-peg-op)。
改性β-葡萄糖苷酶的具体合成方法如下:
(1)cb-b-x:将甜菜碱(betaine)和n-羟基琥珀酰亚胺(nhs)及1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc·hcl)以摩尔比1:1.2:1混合,搅拌活化,期间用10%naoh和10%hcl溶液保持体系ph值在4.5左右。活化一段时间后,缓慢加入到novozyme188酶溶液中,添加完毕后在常温下反应2h,反应过程中保持体系ph值在4.8左右。反应结束,超滤提出后得到产品季铵化β-葡萄糖苷酶,保存于0℃冰箱内备用。(x为甜菜碱占novozyme188原酶的质量分数,x取值范围为0.1~1.0。)
(2)cb-cn-x:将丁胺和n-羟基琥珀酰亚胺(nhs)及1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc·hcl)以摩尔比1:1.2:1混合,调节ph到4.5左右,缓慢滴加到novozyme188酶溶液中,添加完毕后在常温下反应2h,反应过程中保持体系ph值在4.8左右。反应结束,超滤提纯得到产品封羧基端改性的β-葡萄糖苷酶,保存于0℃冰箱内备用。(x为丁胺占novozyme188原酶的质量分数,x取值范围为0.1~1.5。)
(3)cb-p-x:在novozyme188溶液中加入5g/l三偏磷酸钠溶液作为催化剂,用naoh调节至碱性条件(ph=10),室温下滴加苯丙氨酸溶液,反应24h,超滤提纯后得到产品疏水化β-葡萄糖苷酶,保存于0℃冰箱内备用。(x为苯丙氨酸占novozyme188原酶的质量分数,x取值范围为0.1~1.0。)
(4)cb-bx-py:在novozyme188溶液中加入5g/l三偏磷酸钠溶液作为催化剂,用naoh调节至碱性条件(ph=10),室温下滴加甜菜碱和苯丙氨酸的混合溶液,反应24h,超滤提纯后得到产品同时季铵化和疏水化改性的β-葡萄糖苷酶,保存于0℃冰箱内备用。(x为甜菜碱占novozyme188原酶的质量分数,x取值范围为0.1~1.0;y为苯丙氨酸占novozyme188原酶的质量分数,y取值范围为0.1~1.0。)
(5)cooh-pegm-qas中间体的合成:用去离子水配制20%羟基聚乙二醇羧酸(ho-pegm-cooh)溶液,用20%naoh水溶液将体系ph值调节到11,并搅拌升温至80℃,用蠕动泵将(3-氯-2-羟丙基)三甲基氯化铵(chptac)溶液(含量65%)缓慢加入,同时加入20%naoh水溶液保持体系ph值在11左右,滴加完毕后在80℃下反应3h。反应结束,通过超滤和离子交换色谱除去未反应的ho-pegm-cooh和chptac,得到cooh-pegm-qas中间体。(m为peg的重均分子量,m取值范围为100~5000)
cb-pegm-qas:将cooh-pegm-qas和n-羟基琥珀酰亚胺(nhs)及1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc·hcl)以摩尔比1:1.2:1混合,搅拌活化,期间用10%naoh和10%hcl溶液保持体系ph值在4.5左右。活化一段时间后,缓慢滴加到novozyme188酶溶液中,添加完毕后在常温下反应2h,反应过程中保持体系ph值在4.8左右。反应结束,超滤提纯得到β-葡萄糖苷酶聚醚季铵盐,保存于0℃冰箱内备用。
(6)β-葡萄糖苷酶聚醚中间体的合成:将羟基聚乙二醇羧酸(ho-pegm-cooh)和n-羟基琥珀酰亚胺(nhs)及1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc·hcl)以摩尔比1:1.2:1混合,搅拌活化,期间用10%naoh和10%hcl溶液保持体系ph值在4.5左右。活化一段时间后,缓慢加入到β-葡萄糖苷酶水溶液中,添加完毕后在常温下反应2h,反应过程中保持体系ph值在4.8左右。反应结束后超滤除去未反应的nhs和edc,得到β-葡萄糖苷酶聚醚(cb-pegm-oh-x),保存于0℃冰箱内备用。(m为peg的重均分子量,x为羟基聚乙二醇羧酸占novozyme188原酶的质量分数,m取值范围为100~5000,x取值范围为0.1~1.0)
cb-pegm-op:苯酚、环氧氯丙烷与路易斯酸催化剂bf3-et2o在55℃下反应2h得到中间体3-氯-2-羟丙苯醚,然后缓慢加入到ph为10的β-葡萄糖苷酶聚醚(cb-pegm-oh-x)溶液,同时加入20%naoh水溶液保持体系ph值在10左右,在55℃下反应12h。超滤提纯后得到产品苯基疏水化修饰的β-葡萄糖苷酶,保存于0℃冰箱内备用。
实施例2
将cb-b-0.1稀释后进行酶活测试,将50个纤维二糖酶活单位cb-b-0.1和10个滤纸酶活单位1.5lcelluclast复配后与5000质量份ph为4.8、离子强度为50mm的醋酸-醋酸钠缓冲溶液混合,再往体系中添加100质量份玉米芯残渣和1质量份四环素。密封后于50℃下酶解72h,测试酶解液的葡萄糖含量,计算酶解糖化收率,结果如表1所示。
实施例3
将cb-b-0.3稀释后进行酶活测试,将50个纤维二糖酶活单位cb-b-0.3和10个滤纸酶活单位1.5lcelluclast复配后与5000质量份ph为4.8、离子强度为50mm的醋酸-醋酸钠缓冲溶液混合,再往体系中添加100质量份玉米芯残渣和1质量份四环素。密封后于50℃下酶解72h,测试酶解液的葡萄糖含量,计算酶解糖化收率,结果如表1所示。
实施例4
将cb-cn-0.3稀释后进行酶活测试,将50个纤维二糖酶活单位cb-cn-0.3和10个滤纸酶活单位1.5lcelluclast复配后与5000质量份ph为4.8、离子强度为50mm的醋酸-醋酸钠缓冲溶液混合,再往体系中添加100质量份玉米芯残渣和1质量份四环素。密封后于50℃下酶解72h,测试酶解液的葡萄糖含量,计算酶解糖化收率,结果如表1所示。
实施例5
将cb-p-0.5稀释后进行酶活测试,将50个纤维二糖酶活单位cb-p-0.5和10个滤纸酶活单位1.5lcelluclast复配后与5000质量份ph为4.8、离子强度为50mm的醋酸-醋酸钠缓冲溶液混合,再往体系中添加100质量份玉米芯残渣和1质量份四环素。密封后于50℃下酶解72h,测试酶解液的葡萄糖含量,计算酶解糖化收率,结果如表1所示。
实施例6
将cb-b0.3-p0.3稀释后进行酶活测试,将50个纤维二糖酶活单位cb-b0.3-p0.3和10个滤纸酶活单位1.5lcelluclast复配后与5000质量份ph为4.8、离子强度为50mm的醋酸-醋酸钠缓冲溶液混合,再往体系中添加100质量份玉米芯残渣和1质量份四环素。密封后于50℃下酶解72h,测试酶解液的葡萄糖含量,计算酶解糖化收率,结果如表1所示。
实施例7
将cb-peg1000-qas稀释后进行酶活测试,将50个纤维二糖酶活单位cb-peg1000-qas和10个滤纸酶活单位1.5lcelluclast复配后与5000质量份ph为4.8、离子强度为50mm的醋酸-醋酸钠缓冲溶液混合,再往体系中添加100质量份玉米芯残渣和1质量份四环素。密封后于50℃下酶解72h,测试酶解液的葡萄糖含量,计算酶解糖化收率,结果如表1所示。
实施例8
将cb-peg1000-op稀释后进行酶活测试,将50个纤维二糖酶活单位cb-peg1000-op和10个滤纸酶活单位1.5lcelluclast复配后与5000质量份ph为4.8、离子强度为50mm的醋酸-醋酸钠缓冲溶液混合,再往体系中添加100质量份玉米芯残渣和1质量份四环素。密封后于50℃下酶解72h,利用生物传感分析仪测试酶解液的葡萄糖含量,计算酶解糖化收率,结果如表1所示。
表1改性β-葡萄糖苷酶的酶活收率和复合酶解糖化效率
由表1可得,改性后β-葡萄糖苷酶可有效提高木质纤维素的酶解效率。另外,改性后的β-糖苷酶的活性能够得到较好的保留,特别对于实施例7和8中以聚氧乙烯链作为连接链段可更有效保持β-葡萄糖苷酶的活性。
图1是novozyme188和cb-b-0.3的红外光谱分析,与未改性的novozyme188相比,利用甜菜碱改性后得到的cb-b-0.3的红外图谱上在1386cm-1处明显出现了归属于季铵根的特征尖峰,说明cb-b-0.3上确实接入了带强正电的季铵根。
图2是novozyme188和cb-b-0.3对1.5lcelluclast在木质素上无效吸附的qcm-d测试结果,结果表明经过改性后,cb-b-0.3在木质素上的吸附量增加,且可以减少其他纤维素酶组分在木质素上的无效吸附,验证了本发明的设计思路。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。