本发明涉及一种钒氧簇合物及其制备方法以及应用。
背景技术:
多金属氧酸盐(polyoxometalates),又称为多酸(简写为poms)。它是指由mo、w、v、nb和ta等前过渡元素以mox(x通常为5或6)为单元缩聚而成的一类具有特殊性质和结构的多氧簇合物。钒氧簇合物(povs)作为多金属氧酸盐的一个分支,近年来,关于钒氧簇合物的制备、结构及性质研究都取得了较大的进展。钒采取的配位方式可以是vo4,vo5,vo6,其价态可以是+3,+4,+5价。由于钒表现出独特的化学性质,使其拥有多样的结构和优良的物理特性,在催化,吸附,医药,磁性及光学材料等方面广受人们关注。由于锗氧化物溶解度较低,从而导致锗-钒氧簇的合成较为困难,关于锗-钒氧簇合物的研究还相对较少,而在此类簇合物中引入金属cu的例子更为罕见。
技术实现要素:
本发明的目的在于提供一种制备方法简单且具有良好磁学性能的钒氧簇合物及其制备方法以及应用。
本发明的目的通过如下技术方案实现:一种钒氧簇合物,它的化学式为:
[cu(en)2(h2o)]2[cu(phen)2]3[ge6v15o42(oh)6](oh)·6h2o;其中,en为乙二胺;phen为1,10-菲罗啉。
所述的钒氧簇合物的制备方法,将nh4vo3、geo2、cu(ac)2·h2o、c12h8n2·h2o、乙二胺以及h2o混合反应得钒氧簇合物。
所述的钒氧簇合物在制备磁性材料中的应用。
较之现有技术而言,本发明的优点在于:本发明采用水热合成法,在锗-钒氧簇体系中引入铜离子,成功制备出一种钒氧簇合物[cu(en)2(h2o)]2[cu(phen)2]3[ge6v15o42(oh)6](oh)·6h2o,该钒氧簇合物是一种新型混合价态铜胺配合物支撑的锗-钒氧簇合物。本发明的钒氧簇合物合成方法,且经磁性分析后得知,该钒氧簇合物在不同的温度范围中分别存在着反铁磁和铁磁相互作用,它可以运用于一些磁性材料的制备中。
附图说明
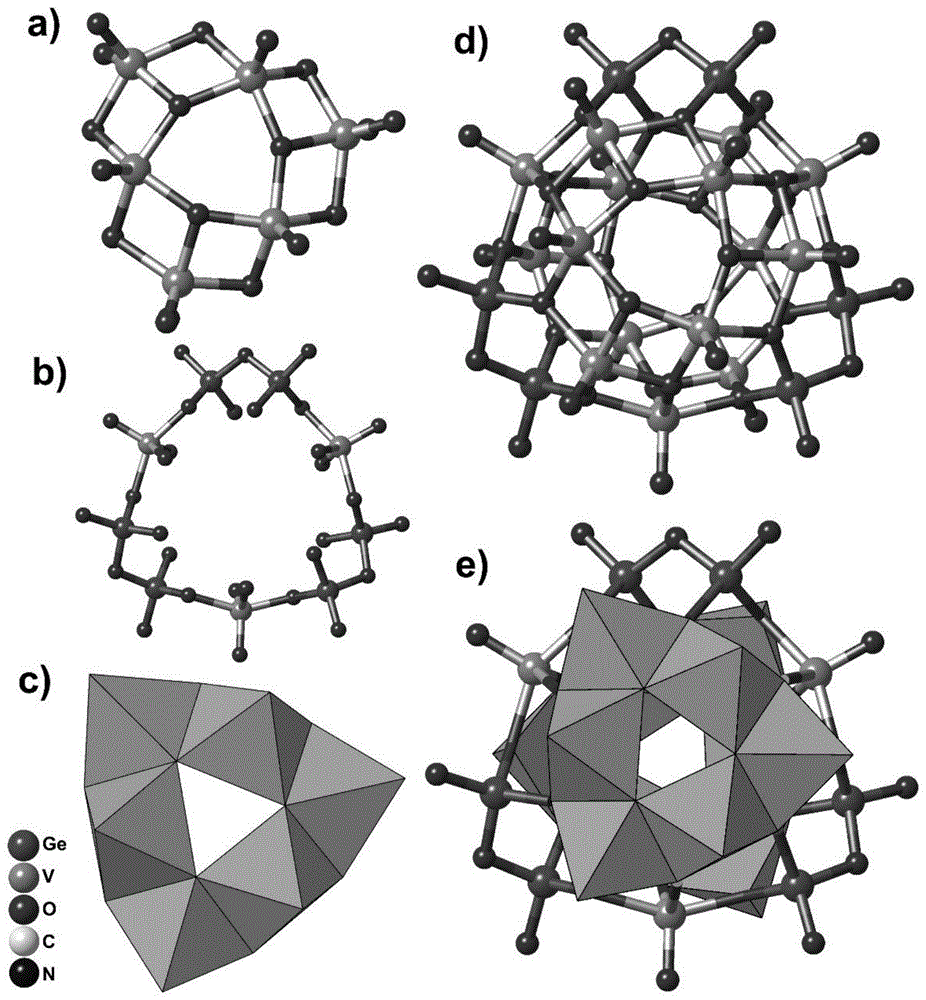
图1是本发明簇阴离子[ge6v15o42(oh)6]9-的结构图。
其中,图1的a、c为[ge6v15o48]12-簇阴离子中的两个v3簇;b为[ge6v15o48]12-簇阴离子中的ge6v3环;d、e为[ge6v15o42(oh)6]9-簇阴离子的球棍-多面体模型(多面体颜色:vo5,深绿色)。
图2是本发明钒氧簇合物的晶体结构中五个铜离子存在的两种不同配位模式图。
其中,图2的a为[cu(phen)2]结构图;b为[cu(en)2(h2o)]结构图。
图3是本发明实施例一所得的钒氧簇合物的3d堆积图。
图4是本发明实施例一所得的钒氧簇合物在常温下进行xrd测试的结果图。
图5是本发明实施例一所得的钒氧簇合物的红外光谱图。
图6是本发明实施例一所得的钒氧簇合物的热重曲线。
图7是本发明实施例一所得的钒氧簇合物的变温磁化率曲线。
具体实施方式
下面结合说明书附图和实施例对本发明内容进行详细说明:
一种钒氧簇合物,它的化学式为:
[cu(en)2(h2o)]2[cu(phen)2]3[ge6v15o42(oh)6](oh)·6h2o;其中,en为乙二胺;phen为1,10-菲罗啉。
所述的钒氧簇合物,它属于单斜晶系,空间群为p2(1)/n,晶胞参数β=92.15°。
所述的钒氧簇合物,它包括1个[ge6v15o42(oh)6]9-簇阴离子、2个[cu(en)2(h2o)]2+基团、3个[cu(phen)2]+基团、1个oh-以及6个游离水分子。
所述的钒氧簇合物的制备方法,将nh4vo3、geo2、cu(ac)2·h2o、c12h8n2·h2o、乙二胺以及h2o混合反应得钒氧簇合物。
所述的钒氧簇合物的制备方法,它包括如下具体步骤:将nh4vo3、geo2、cu(ac)2·h2o以及c12h8n2·h2o混合物后装于聚四氟乙烯内衬中,再加入乙二胺以及h2o,搅拌20-40min后于150-180℃烘箱中反应3-7天,之后自然冷却至室温,用蒸馏水洗涤、过滤,得到黑色柱状晶体,即为所述钒氧簇合物。
其中,所述nh4vo3、geo2、cu(ac)2·h2o、c12h8n2·h2o以及乙二胺的摩尔比为:2.5~3.0:2.2~2.5:2.5~3.0:1:25~35。其中,所述nh4vo3、geo2、cu(ac)2·h2o、c12h8n2·h2o以及乙二胺的最优摩尔比为:2.67:2.47:2.66:1:30。
下面结合具体实施例对本发明进行深入阐述:
本发明所需的试剂和仪器分别如表1、表2所示:
表1实验试剂
表2实验仪器
实施例一:钒氧簇合物的制备:
一种钒氧簇合物的制备方法,它包括如下具体步骤:
按照nh4vo3、geo2、cu(ac)2·h2o、c12h8n2·h2o以及乙二胺的摩尔比为2.67:2.47:2.66:1:30,依次称取nh4vo3(0.0474g),geo2(0.0392g),cu(ac)2·h2o(0.0808g),c12h8n2·h2o(0.0301g),将其混合物装于25ml的聚四氟乙烯内衬中,再加入0.3mlen和5mlh2o,搅拌30min后于170℃烘箱中反应4天,自然冷却至室温,用蒸馏水洗涤、过滤,得到黑色柱状晶体化合物1,即为所述钒氧簇合物;
其中,该钒氧簇合物的产量为0.0116g;以geo2计,其产率为21%;
元素分析(理论值):c:25.68;n:7.49;h:2.65%;(实验值):c:26.28;n:7.61;h:2.88%。
实施例二:晶体结构测定及结构解析:
在jsz5b连续变倍体式显微镜下,从实施例一合成得到的大量晶体粗产品中挑选出表面洁净、大小合适的单晶。将挑好的单晶用混匀的a、b胶粘在玻璃丝的顶端,保持单晶竖立状态,与玻璃丝在同一直线上,这样有利于在x-射线单晶衍射实验时的对心操作,然后将该玻璃丝安装在载晶台上。x-射线单晶衍射实验是在brukerapexiiccd衍射仪上进行的。在296k下,采用石墨单色器和mo靶kα射线作x-射线源,以ω-2θ扫描方式在一定的范围内收集衍射点数据,选择i>2σ(i)的独立衍射点来进行单晶结构分析。得出化合物1的晶体学数据如表3。晶体结构通过shelx-97程序由直接法解出,对所有非氢原子的各向异性参数进行了全矩阵最小二乘法修正。结构中所有的h原子都采用理论加氢的方式获得。
表3化合物1的结构参数和晶体数据
r1=∑||fo|-|fc|/∑|fo|,wr2=[∑[w(fo2-fc2)2]/∑[(wfo2)2]]1/2;w=1/[σ2(fo2)+(xp)2+yp],p=(fo2+2fc2)/3,wherex=0.0644,y=144.8067for1;
实施例三:对实施例一所得的化合物1进行晶体性能测试:
1.对化合物1进行x-射线单晶结构分析
用于x-射线结构解析的衍射数据在brukerapexiiccd衍射仪上收取;mokα射线,石墨单色器,辐射波长为采用shelxl-97程序包解析和精修晶体结构。
检测结果表明:化合物1属于单斜晶系,空间群为p2(1)/n,分子结构中含有一个[ge6v15o42(oh)6]9-簇阴离子,2个[cu(en)2(h2o)]2+基团,3个[cu(phen)2]+基团,1个oh-和6个游离水分子组成。簇阴离子[ge6v15o42(oh)6]9-的结构如图1所示,该簇阴离子具有d3对称性,由15个vo5四方锥和三个ge2o7单元构成。它可以看作是三个vo5四方锥与三个ge2o5二聚单元通过共顶点交替相连成一个ge6v3的环状结构片断(如图1的b所示),以ge6v3环为平面中心,将剩余的十二个vo5四方锥分为上下两组,每六个vo5四方锥通过共边或共顶点分别形成两个三角状结构片断(如图1的a、c所示),之后分别通过共用氧原子键连到ge3v3环状结构片断的上下两侧,从而形成一个完整的笼状簇阴离子[ge6v15o42(oh)6]9-(如图1的d、e所示)。簇阴离子与抗衡阳离子[cu(en)2(h2o)]2+,[cu(phen)2]+之间存在着静电引力作用,其堆积结构见图3。
在这个晶体结构中,五个铜离子存在两种不同的配位模式:四面体构型cun4(cu1,cu2,cu3)(如图2的a图所示)和四方锥构型cuon4(cu4,cu5)(如图2的b图所示)。其中,cu1,cu2,cu3的配位原子分别来自于配体phen分子中的四个n原子,cu-n的键长范围为cu4,cu5的配位n原子来源于两个en分子中的四个n(cd-n:),一个配位氧原子来自于一个配位水中的o原子。簇中的所有v原子都是以vo5四方锥的形式存在,其中v-o端氧键长范围为桥氧键长范围为在ge2o7基团中,ge-o键长范围为价键计算(bvs)表明,晶体中的所有v原子都是+4价(3.92~4.26),所有的ge原子也为+4价(4.08~4.14)(见表4)。由价键计算可知,只与ge原子相连的端氧原子(o1,o6,o8,o22,o38,o40)的价态范围为1.01~1.15价,表明这些都属于oh基团中的o原子。在晶体中,cu存在两种价态,+1价的cu1,cu2,cu3(1.21~1.29)和+2价的cu4,cu5(1.48~1.54),其余的o原子价态为-2价,总的价键计算可知,整个分子中存在一个游离的oh-。
表4化合物1的价键计算
2.对化合物1进行元素分析
c、h、n含量分析使用elementarvarioeliii元素分析仪完成。元素分析结果为:元素分析(理论值):c:25.68;n:7.49;h:2.65%;(实验值):c:26.28;n:7.61;h:2.88%。
3.对化合物1进行x-射线粉末衍射分析
样品的粉末测试使用brukerd8advance粉末衍射仪进行,cukα射线,辐射波长为
将化合物1样品研磨成粉末后在常温下进行xrd测试,结果如图4所示。通过pcw软件根据单晶衍射数据模拟衍射峰图,并将测得数据谱图与模拟图对比,对比图谱可知,两者的衍射峰位置吻合较好,只是在强度上有所差异,表明所合成的晶体样品(化合物1)为纯相。
4.对化合物1进行红外光谱分析
红外吸收光谱法主要通过利用物质对红外光区电磁辐射的选择性吸收特性的原理,对物质构造进行分析、定性和定量。
测定条件为:使用nicoletteis10型红外光谱仪,用溴化钾压片法,在室温下,扫描波数范围为400-4000cm-1。
从红外谱图(图5)中可看出,位于3369-3294cm-1处的吸收峰是由υs(n-h)振动引起的,位于2996-2846cm-1处的吸收峰归属于υs(c-h)振动,而位于1610-1570cm-1和1387-1432cm-1的吸收则是由σs(n-h)和σs(c-h)振动所引起的;位于3467-3370cm-1处的吸收峰是由于oh-的伸缩振动所引起的;在1016-896cm-1处的强吸收峰归属于υs(v=o)振动;而在899-741cm-1处的吸收峰则是由于geo4四面体中υs(ge-o)振动所致;配体phen的振动吸收峰出现在1430-1410cm-1处,这些结论也与化合物1晶体的单晶结构相吻合。
5.对化合物1进行热分析
热分析(tga)使用netzschpc409差示扫描量热仪进行,在n2氛围下,以每分钟10度的速度进行升温。
化合物1的热重曲线见图6,它是在氮气气氛下,20-1000℃的范围内以10℃/min的升温速率测定的。从失重曲线可以看出在20-392℃之间12.49%的失重是由于化合物中的6个水分子、7个oh-和4个en分子的失去所引起的(理论失重值12.41%);在392-830℃之间的连续失重(28.53%)是由于分子中的6个phen分子的分解所引起的(理论失重值28.89%)。在710℃之后的失重归属于整个晶体结构框架的坍塌。
6.对化合物1进行磁性分析
样品的磁性测试是在quantumdesignsquidvsmmagnetometer上进行的。磁场强度为1000oe,测试温度为2-300k。
研究了外磁场1koe下化合物1的变温磁化率曲线,以χmt对t作图,测量温度范围为2-300k。由图7可知,在常温下,化合物1的χmt值为1.41cm3·k·mol-1,大于2个未耦合的cu2+的磁矩(0.75cm3·k·mol-1,g=2.0),小于常温下理论的15个含单自旋电子v4+的χmt值5.63cm3·k·mol-1。由于cu2+均以单离子配合物的形式存在,不可能发生离子间的耦合作用,所以测试结果表明化合物簇阴离子上的钒离子相互间存在着显著的电子耦合行为。随着温度的降低,化合物1的χmt值缓慢减小至228k的1.34cm3·k·mol-1,228~300k范围内由居里-外斯定律χ=c/(t-θ),得出其居里常数c为1.71cm3·mol-1·k,居里温度θ为-65.34k,表明化合物1中四价钒离子间存在反铁磁耦合作用;之后χmt值又缓慢升高至26k的1.48cm3·k·mol-1,在26-228k上升的趋势表明v与v之间存在铁磁耦合作用;之后,随着温度的降低,其值迅速减小,直到2k达到一最小值1.04cm3·k·mol-1,2~228k范围内由居里-外斯定律χ=c/(t-θ),得出c为1.34cm3·mol-1·k,θ为2.86k。
通过以上性能测试可得出以下结论:本发明采用水热法成功将铜胺配合物引入锗-钒氧簇体系中,合成了一例[cu(en)2(h2o)]2[cu(phen)2]3[ge6v15o42(oh)6](oh)·6h2o晶体,通过x射线单晶衍射仪对晶体结构录入并进行解析,结果表明该晶体中的ge-v-o簇阴离子[ge6v15o42(oh)6]6-是基于经典的{v18o52}基础上,三个ge2o7二聚体分别取代三个vo5四方锥而成。分子结构由1个ge-v-o簇[ge6v15o42(oh)6]6-、2个[cu(en)2(h2o)]2+基团,3个[cu(phen)2]+基团,1个oh-和6个游离水分子组成。通过x-射线粉末衍射、红外光谱热分析、元素分析等对该样品进行表征,xrd谱图表明该化合物是纯相结构;热重分析和红外谱图的分析结果都进一步确定了该化合物结构特征。磁性研究表明,该样品在不同的温度范围中分别存在着反铁磁和铁磁相互作用。
需要说明的是,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明构思的前提下,还可以作出若干改变、改进和润饰,这些改变、改进和润饰也应视为本发明的保护范围。