一种阿尼昂尼昂病毒的检测方法及一管双色RT-PCR试剂盒与流程
本发明涉及生物检测
技术领域:
,尤其涉及一种阿尼昂尼昂病毒的检测方法及一管双色rt-pcr试剂盒。
背景技术:
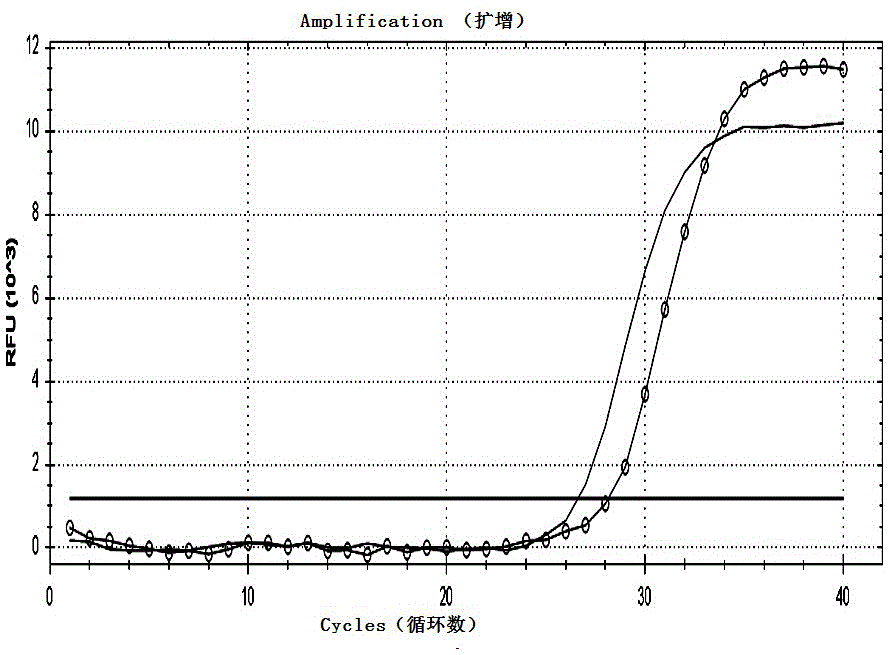
:随着生物技术的发展,传染病病原体的鉴定、检测方法从分离培养到免疫学检测,再到基因检测技术,为临床诊断带来了许多便利。目前,针对传染病病原体的检测,大多使用核酸检测方法。在病原体的定性和定量核酸检测中,实验人员操作中的随机误差、扩增仪孔间温度的差异、标本核酸提取后抑制物的残留、待扩增靶核酸的浓度、逆转录的效率及试剂的问题等,均可能会影响聚合酶链式反应(pcr)扩增的效率,进而造成检测结果的偏差,甚至假阴性、假阳性的结果。在检测过程中,内部对照(ipc)可用于提示抑制剂的有无,对全过程进行控制;外部对照(epc)可用于试验结果有效性的检验。但是,目前检测实验室大部分自配试剂均没有包含内部对照,即使使用,利用的也大多是病毒、质粒dna或体外转录rna,病毒存在潜在的传染危险性;质粒dna极易造成实验室污染,且一旦污染,较长时间都会存在影响;体外转录rna也极不稳定,因此,均难以达到实验要求。针对上述问题,业界通过ms2假病毒包装系统构建了一系列披甲rna,用于检测过程的质量控制,广泛应用于流感病毒、诺如病毒、sars病毒、hiv-1病毒等的检测。阿尼昂尼昂热是由阿尼昂尼昂病毒(o’nyong-nyongvirus,onnv)引起的、被视为一种被忽视的热带流行性传染病,1959~1962年间曾导致东非200多万人感染和发病,沉寂30年后又在非洲发生流行。其症状与基孔肯雅热类似,传播途径却同疟疾类似,均通过按蚊传播。鉴于此,一般通过核酸检测方法进行检测用以鉴别与其症状类似的基孔肯雅热以及与其共享蚊媒的疟疾。目前,已发表的文献中,能用于onnv检测的核酸检测方法只有4篇报道(liu,etal.2016;saxton-shaw,etal.2013;smith,etal.2009;waggoner,etal.2017),但是这些方法中均未使用披甲rna作为ipc和epc用于onnv的检测,导致这些检测方法对于检测过程中由于实验人员操作中的随机误差、扩增仪孔间温度的差异、标本核酸提取后抑制物的残留、待扩增靶核酸的浓度、逆转录的效率及试剂等带来的偏差、假阴性、假阳性等影响结果有效性的问题得不到很好的解决。因此,为提高的onnv核酸检测结果的有效性性,急需发明一种新的onnv核酸检测方法,并开发出一种能用于onnv的检测试剂盒。技术实现要素:鉴于上述问题,为提高的onnv核酸检测结果的有效性,本发明的目的在于提供一种阿尼昂尼昂病毒(onnv)的检测方法和试剂盒,避免检测过程中由于实验人员操作中的随机误差、扩增仪孔间温度的差异、标本核酸提取后抑制物的残留、待扩增靶核酸的浓度、逆转录的效率及试剂等带来的偏差、假阴性、假阳性等。本发明的一种阿尼昂尼昂病毒(onnv)的检测方法,包括如下步骤:(1)分别将onnv的982bp片段、卡那霉素(kana)的205bp片段融入pet-ms2包装载体得到pet-ms2-onnv、pet-ms2-kaic,并纯化,以纯化后的pet-ms2-onnv作为外部对照(epc),纯化后的pet-ms2-kaic作为内部对照(ipc);(2)将等量的内部对照(如1×106拷贝)分别加入到待测样品、外部对照、阴性对照,即待测样品组、阳性对照组、阴性对照组,分别在提取病毒核酸后加入扩增反应液、酶混合液、超纯水,混匀、离心,进行rt-pcr扩增和检测;(3)结果判定:反应结束后,根据待测样品的扩增曲线和ct值判断待测样品是否为onnv阳性。在上述步骤(2)中阴性对照选用正常人血清。进一步地,在上述步骤(2)中设有空白对照组,不加入内部对照到空白对照中成立空白对照组,提取病毒核酸后加入扩增反应液、酶混合液、超纯水,混匀、离心,进行rt-pcr扩增和检测。空白对照可选用超纯水。进一步地,在上述步骤(2)中进行rt-pcr扩增和检测的反应体积为12.5μl,包含:6.25μl扩增反应液,0.5μl酶混合液,0.75μl超纯水,5μl提取的待测样品的rna、或5μl阳性对照、或5μl阴性对照、或5μl空白对照。进一步地,在上述步骤(2)中进行rt-pcr扩增和检测的反应条件是:42°c5分钟;95°c10秒钟;40个循环的95°c10秒—60°c30秒;在60°c30秒阶段分别在fam通道和hex通道收集荧光信号。更进一步地,在上述步骤(3)中结果判定的方法包括如下步骤:(1)判断质控系统,有效标准:hex通道所有待测样品、阳性对照、阴性对照的扩增曲线呈现标准的s形曲线,且ct值一致;同时,fam通道阳性对照的扩增曲线呈现标准的s形曲线,且ct值<30,阴性对照无s形曲线;(2)在质控系统有效时,判断待检样品结果:当待检样品fam通道无s形曲线时,判为onnv阴性;当待检样品fam通道有s形曲线,且ct值≤38时,判为onnv阳性;当待测样品fam通道有s形曲线,且ct值介于38和40之间时,浓缩待测样品,再重新检测;当重新检测待测样品fam通道有s形曲线,且ct值介于38和40之间,但ct值有减少且曲线有对数增长期时,判为onnv阳性;当重新检测检测样品fam通道无荧光增幅现象时,判为onnv阴性。更进一步地,在上述步骤(3)中扩增反应液包括onnv的正向引物:5’-tggatagggttcgatacgacacc-3’;反向引物:5’-tcagtacctgctcatcagccca-3’;探针:5’-fam-tgtacaatgcaatggctggcgcataccc-bhq-3’和kana的正向引物:5’-cgataccgtaaagcacgagg-3’;反向引物:5’-gaccgctatcaggacatagc-3’;探针:5’-hex-tcagcccattcgccgccaagctcttca-bhq-3’。根据本发明提供的阿尼昂尼昂病毒的检测方法,为方便使用,本发明还制备出一种阿尼昂尼昂病毒的一管双色rt-pcr试剂盒,包括上述内部对照、外部对照。进一步地,试剂盒还加入rt-pcr扩增和检测所用的阴性对照、空白对照、2x扩增反应液、25x酶混合液。其中2x扩增反应液具体组分为:100mmtris-hcl(ph8.3)、100mmkcl、20mmmgcl2、1mmspermidine(亚精胺)、0.1%tween(吐温)-20、0.2mg/lbsa、0.4mmdntp、0.8μm引物onnv-f、0.8μm引物onnv-r、0.4μm探针onnv-p、0.8μm引物kana-f、0.8μm引物kana-r、0.4μm探针kana-p。进一步地,引物onnv-f:5’-tggatagggttcgatacgacacc-3’;引物onnv-r:5’-tcagtacctgctcatcagccca-3’;探针onnv-p:5’-fam-tgtacaatgcaatggctggcgcataccc-bhq-3’;引物kana-f:5’-cgataccgtaaagcacgagg-3’;引物kana-r:5’-gaccgctatcaggacatagc-3’;探针kana-p:5’-hex-tcagcccattcgccgccaagctcttca-bhq-3’。其中25x酶混合液具体组分为:7.5u/μlamv反转录酶、25u/μlribonucleaseinhibitor、25u/μlhs-taq酶。本发明的阿尼昂尼昂病毒的检测方法和一管双色rt-pcr试剂盒,含有内部对照(ipc),可用于提示抑制剂的有无,对全过程进行控制;含有外部对照(epc),可用于试验结果有效性的检验。经过敏感性评价、特异性评价、重复性评价和临床评价,显示本发明的检验方法具有高敏感性和特异性,重复性好,临床测试准确。与现有技术比较,本发明能较好的解决现有技术中onnv核酸检测时由于实验人员操作中的随机误差、扩增仪孔间温度的差异、标本核酸提取后抑制物的残留、待扩增靶核酸的浓度和逆转录的效率及试剂等带来的偏差、假阴性、假阳性等,影响结果有效性的问题。以下将结合附图对本发明的构思、具体实施及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。附图说明图1为实施例中纯化前的epc的pcr、rt-pcr检测结果,图中实线表示用rt-pcr检测,带圆圈的线表示用pcr检测;图2为实施例中纯化前的ipc的pcr、rt-pcr检测结果,图中实线表示用rt-pcr检测,带圆圈的线表示用pcr检测;图3为实施例中纯化后的epc的pcr、rt-pcr检测结果,图中实线表示用rt-pcr检测,带圆圈的线表示用pcr检测;图4为实施例中纯化后的ipc的pcr、rt-pcr检测结果,图中实线表示用rt-pcr检测,带圆圈的线表示用pcr检测;图5为实施例中试剂盒检测的敏感性评价中epc稀释1×10、1×102、1×103、1×104、1×105、1×106、1×107、1×108倍的检测结果;图6为实施例中试剂盒检测的敏感性评价中ipc的检测结果;图7为实施例中试剂盒检测的特异性评价中onnv、chikv、mayv、dv、ml检测结果,其中除onnv为阳性外,chikv、mayv、dv、ml和nc均为阴性;图8为实施例中试剂盒检测的特异性评价中ipc的检测结果;图9为实施例中试剂盒检测的重复性评价中检测结果;图10实施例中试剂盒检测的重复性评价中ipc的检测结果;图11为实施例中试剂盒检测的临床评价中55份发热病人血清和2份蚊子样本的检测结果;图12为实施例中试剂盒检测的临床评价中ipc的检测结果。具体实施方式以下参考说明书附图介绍本发明的优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。实施例11、ipc和epc的构建体外合成ms2噬菌体成熟酶、包膜蛋白、包装位点等基因,经ncoi和bamhi双酶切后连接到pet28a+载体中得到pet-ms2包装载体。onnv的982bp片段以及卡那霉素(kana)的205bp片段被分别合成,经bamhi和hindiii双酶切后连接到pet-ms2得到pet-ms2-onnv(作为epc)和pet-ms2-kaic(作为ipc)。2、ipc和epc的纯化将上述质粒转化到大肠杆菌bl21中,经1mmiptg在37℃诱导16小时后,于4°c条件下5000g离心5min,弃上清,保留沉淀,用商业化试剂(如宝生物公司的histalongravitycolumn)进行纯化。按照100mg沉淀加入2mlhistalonxtractorbuffer,混匀后,按比例加入1µl的benzonase核酸酶、dnasei和rnasea,37°c孵育2小时然后21°c继续孵育16小时。于4°c条件下10000g离心20分钟,弃沉淀,将上清过histalongravity柱,用washbuffer清洗后再用elutionbuffer洗脱,即为纯化后的ipc和epc。将纯化前后的ipc和epc,同时通过pcr和rt-pcr检测,图1为纯化前的ipc的pcr、rt-pcr检测结果,图2为纯化前的epc的pcr、rt-pcr检测结果,结果显示纯化前的ipc和epc可被pcr和rt-pcr检出;图3为纯化后的ipc的pcr、rt-pcr检测结果,图4为纯化后的epc的pcr、rt-pcr检测结果,结果显示纯化后的ipc和epc仅可被rt-pcr检出,这表明纯化后的ipc和epc中不含有残留的dna。3、特异性引物和探针的设计从美国ncbi的基因库下载尽量多的onnv和kana基因序列,然后利用分子生物学软件bioedit对下载的序列进行同源比对分析,寻找高度同源的保守序列作为引物和探针设计的候选区,同时结合软件primerselect进行引物设计。核心设计思想是:综合考虑对onnv检测的特异性和通用性,引物和探针设计应遵循的普遍性原则(如tm值、3’末端自由能、gc含量、避免出现内部二级结构及形成二聚体等),以及多重扩增反应时各引物和探针之间的相互影响等,本实施例优选出如下引物和探针:onnv的正向引物onnv-f:5’-tggatagggttcgatacgacacc-3’(其在genbank参考序列m20303的位置为601-623);反向引物onnv-r:5’-tcagtacctgctcatcagccca-3’(其在genbank参考序列m20303的位置为673-694);探针onnv-p:5’-fam-tgtacaatgcaatggctggcgcataccc-bhq-3’(其在genbank参考序列m20303的位置为629-656);kana的正向引物kana-f:5’-cgataccgtaaagcacgagg-3’(其在genbank参考序列kf411445的位置为975-994);反向引物kana-r:5’-gaccgctatcaggacatagc-3’(其在genbank参考序列kf411445的位置为1049-1068);探针kana-p:5’-hex-tcagcccattcgccgccaagctcttca-bhq-3’(其在genbank参考序列kf411445的位置为1001-1027)。4、一管双色rt-pcr检测试剂盒的组成试剂盒保存于-20℃,其组成包括以下部分:(1)2x扩增反应液:如表1所示,其组分为100mmtris-hcl(ph8.3)、100mmkcl、20mmmgcl2、20mmdtt、1mmspermidine(亚精胺)、0.1%tween(吐温)-20、0.2mg/lbsa、0.4mmdntp、0.8μm引物onnv-f、0.8μm引物onnv-r、0.4μm探针onnv-p、0.8μm引物kana-f、0.8μm引物kana-r、0.4μm探针kana-p;其中引物onnv-f是序列编号为seqidno:1所示的核苷酸序列,引物onnv-r是序列编号为seqidno:2所示的核苷酸序列,探针onnv-p是序列编号为seqidno:3所示的核苷酸序列,引物kana-f是序列编号为seqidno:4所示的核苷酸序列,引物kana-r是序列编号为seqidno:5所示的核苷酸序列,探针kana-p是序列编号为seqidno:6所示的核苷酸序列;表1组分浓度工作浓度tris-hcl(ph8.3)100mm50mmkcl100mm50mmmgcl220mm10mmdtt20mm10mmspermidine1mm0.5mmtween-200.1%0.05%bsa0.2mg/l0.1mg/ldntpmix0.4mm0.2mmonnv-f0.8μm0.4μmonnv-r0.8μm0.4μmonnv-p0.4μm0.2μmkana-f0.8μm0.4μmkana-r0.8μm0.4μmkana-p0.4μm0.2μm(2)25x酶混合液:如表2所示,其组分为:7.5u/μlamv反转录酶、25u/μlribonucleaseinhibitor(核糖核酸酶抑制剂)、25u/μlhs-taq酶;表2组分浓度工作浓度amv反转录酶7.5u/μl0.3u/μlribonucleaseinhibitor25u/μl1u/μlhs-taq酶25u/μl1u/μl(3)阳性对照(pc组):epc;(4)阴性对照(nc组):正常人血清,在核酸提取时与标本同时平行提取以作为阴性对照使用;(5)空白对照(空白对照组):超纯水。5、试剂盒的检测方法(1)提取待测样品的rna,即模板rna:先将1×106拷贝的ipc分别加入待测样品、阳性对照、阴性对照,然后按照根据样本类型选用合适的商品化试剂盒提取病毒核酸;(2)按照以下方法配制反应液:反应体积为12.5μl;取6.25μl2x扩增反应液、0.5μl25x酶混合液、0.75μl超纯水加入0.2ml光学pcr反应管,再加入5μl提取的待测样品的rna、或5μl阳性对照、或5μl阴性对照、或5μl空白对照,振荡混匀后瞬时离心数秒;(3)上机检测:将反应管置于荧光pcr仪上进行扩增和检测。反应条件是:42°c5分钟;95°c10秒钟;40个循环的95°c10秒—60°c30秒;于“60°c30秒”阶段分别在fam通道和hex通道收集荧光信号。(4)结果判定:首先是判断质控系统,有效性标准:hex通道所有待测样品、阳性对照、阴性对照的扩增曲线呈现标准的s形曲线,且ct值一致;同时,fam通道阳性对照的扩增曲线呈现标准的s形曲线,且ct值<30,阴性对照和空白对照无典型s形曲线。当质控系统有效时,判断待检样品结果:当待检样品fam通道无s形曲线时,判为onnv阴性;当待检样品fam通道有明显的s形曲线,且ct值≤38时,判为onnv阳性;当待测样品fam通道有明显的s形曲线,ct值介于38和40之间时,建议采用浓缩方式处理待测样品,再重新进行实时荧光rt-pcr检测;若重新检测待测样品fam通道有明显的s形曲线,ct值仍介于38和40之间,ct值亦有减少趋势,且曲线有明显的对数增长期,判为onnv阳性,此类样本建议用其他方法进一步验证,否则,判为阴性;当待测样品fam通道无荧光增幅现象时,判为onnv阴性。(5)注意事项:实验全过程都应使用无粉手套。为了避免实验中的交叉污染,在加模板的过程中,应首先加空白对照和阴性对照,其次加待检样品,最后加阳性对照。6、对检测方法的灵敏性评价(1)样本:以上述制备的epc作为模板,10倍梯度稀释,稀释1×10、1×102、1×103、1×104、1×105、1×106、1×107、1×108倍,提取rna后利用微量紫外分光光度计测定纯化后rna的浓度,通过分子量计算出初始rna模板的拷贝数。(2.)方法:使用本实施例的试剂盒,采用“5、试剂盒的检测方法”中所述检测方法进行反应液配制,然后将反应管置于荧光pcr仪上进行扩增和检测。反应完成后观察荧光曲线图谱,分析本实施例的试剂盒所能检测到的模板拷贝数最低限。(3)结果:图5为试剂盒epc稀释1×10、1×102、1×103、1×104、1×105、1×106、1×107、1×108倍的检测结果、图6为ipc的检测结果,如图5、图6所示相当于1×108至1×103拷贝的模板rna均可有效扩增,而1×102至1×101拷贝的模板rna以及阴性对照均无扩增,表明本试剂盒的检测下限为1×103拷贝(见图5)。7、对检测方法的特异性评价(1)样本:与onnv具有类似症状的基孔肯雅病毒(chikv)、马亚罗病毒(mayv)、四种型别的登革热病毒(dv)、以及与onnv共享病媒的四种型别的疟原虫(ml)。(2)方法:使用本实施例的试剂盒,采用“5、试剂盒的检测方法”中所述检测方法对以上样本进行检测,观察该试剂盒是否会发生非特异性的检测结果。(3)结果:根据检测试剂盒扩增的荧光图谱进行分析,图7为试剂盒检测的特异性评价中onnv、chikv、mayv、dv、ml检测结果,图8为试剂盒检测的特异性评价中ipc的检测结果,如图7所示仅对onnv样本的检测结果为阳性,其它病原体和阴性对照(nc)的检测均为阴性,证明本试剂盒的检测方法有较好的特异性。8、对检测方法的重复性评价(1)样本:上述制备的epc,稀释到其核酸提取后的rna浓度为1×105拷贝,制作10份平行样本。(2)方法:使用本实施例的试剂盒,采用“5、试剂盒的检测方法”中所述检测方法对以上样本进行检测,观察该试剂盒的重复性。(3)结果:根据检测试剂盒扩增的荧光图谱ct值进行分析,图9为试剂盒检测的复性评价中检测结果,图10为试剂盒检测的重复性评价中ipc的检测结果,本实施例试剂盒对onnv样本的检测结果变异系数为1.15%,小于5%的阈值,表明本试剂盒的检测方法有较好的重复性。9、对检测方法的临床评价(1)样本:55份来自入境发热人员的血清样本,2份按蚊样本。(2)方法:使用本实施例的试剂盒,采用“5、试剂盒的检测方法”中所述检测方法对以上样本进行检测,对该试剂盒进行临床评价。(3)结果:根据检测试剂盒扩增的荧光图谱ct值进行分析,图11为试剂盒检测的临床评价中发热病人血清和蚊子样本的检测结果,图12为试剂盒检测的临床评价中ipc的检测结果,如图11所示55份发热病人血清样本均为onnv核酸阴性,2份按蚊样本也呈现onnv核酸阴性。以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本
技术领域:
中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。序列表<110>珠海国际旅行卫生保健中心<120>一种阿尼昂尼昂病毒的检测方法及一管双色rt-pcr试剂盒<160>6<170>siposequencelisting1.0<210>1<211>23<212>dna<213>人工序列(o'nyong-nyongvirus)<220><221>misc_feature<222>(1)..(23)<223>正向引物onnv-f<400>1tggatagggttcgatacgacacc23<210>2<211>22<212>dna<213>人工序列(o'nyong-nyongvirus)<220><221>misc_feature<222>(1)..(22)<223>反向引物onnv-r<400>2tcagtacctgctcatcagccca22<210>3<211>28<212>dna<213>人工序列(o'nyong-nyongvirus)<220><221>misc_feature<222>(1)..(28)<223>探针onnv-p<400>3tgtacaatgcaatggctggcgcataccc28<210>4<211>20<212>dna<213>人工序列(o'nyong-nyongvirus)<220><221>misc_feature<222>(1)..(20)<223>正向引物kana-f<400>4cgataccgtaaagcacgagg20<210>5<211>20<212>dna<213>人工序列(o'nyong-nyongvirus)<220><221>misc_feature<222>(1)..(20)<223>反向引物kana-r<400>5gaccgctatcaggacatagc20<210>6<211>27<212>dna<213>人工序列(o'nyong-nyongvirus)<220><221>misc_feature<222>(1)..(27)<223>探针kana-p<400>6tcagcccattcgccgccaagctcttca27当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1