姜黄素-4-O-乙酰-Arg-Gly-Asp-Phe锶盐,其合成,活性和应用的制作方法
本发明涉及姜黄素-4-och2co-arg-gly-asp-phe锶,涉及它的制备方法,涉及它的抗骨质疏松活性。因而本发明涉及它在制备抗骨质疏松药物中的应用。本发明属于生物医药领域。
技术背景
世界卫生组织预测,到2050年老年人口数量将达到20亿。这意味着人口老龄化是全球要面临的重要问题。骨质疏松就是困扰着老年人的疾病之一。考虑到人口基数,骨质疏松对我国老龄人健康的威胁尤其严重。姜黄素是从植物姜黄根茎中提取的天然产物,具有广泛的药理活性。例如抗肿瘤,抗血栓和抗炎症。不过,姜黄素生物利用度低及水溶性差。为改善姜黄素生物利用度及水溶性文献报道了各种姜黄素衍生物。临床上雷尼酸锶用于治疗和预防绝经后妇女骨质疏松,药效团是锶离子。因溶解度差,导致雷尼酸锶的临床剂量大。因临床剂量大,导致雷尼酸锶副作用大。发明人一直致力开发溶解度好,剂量低及副作用小的锶盐。经过三年探索,发明人发现姜黄素-4-och2co-arg-gly-asp-phe锶具有这三个特点。根据这个发现,发明人提出了本发明。
技术实现要素:
本发明的第一个内容是提供下式的姜黄素-4-och2co-arg-gly-asp-phe锶。
本发明的第二个内容是提供姜黄素-4-och2co-arg-gly-asp-phe锶的合成方法,该方法包括:
(1)合成3-甲氧基-4-(乙酸苄酯氧基)苯甲醛;
(2)合成6-(4-羟基-3-甲氧基苯基)-5,6-己烯-2,4-二酮;
(3)合成1-(4-羟基-3-甲氧基苯基)-7-(4-氧乙酰苄酯基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮;
(4)合成1-(4-羟基-3-甲氧基苯基)-7-(4-氧乙酰乙酸基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮;
(5)合成姜黄素-4-och2co-arg-gly-asp(obzl)-phe-obzl;
(6)合成姜黄素-4-och2co-arg-gly-asp-phe;
(7)合成姜黄素-4-och2co-arg-gly-asp-phe锶。
本发明第三个内容是评价姜黄素-4-och2co-arg-gly-asp-phe锶的抗骨质疏松作用。
附图说明
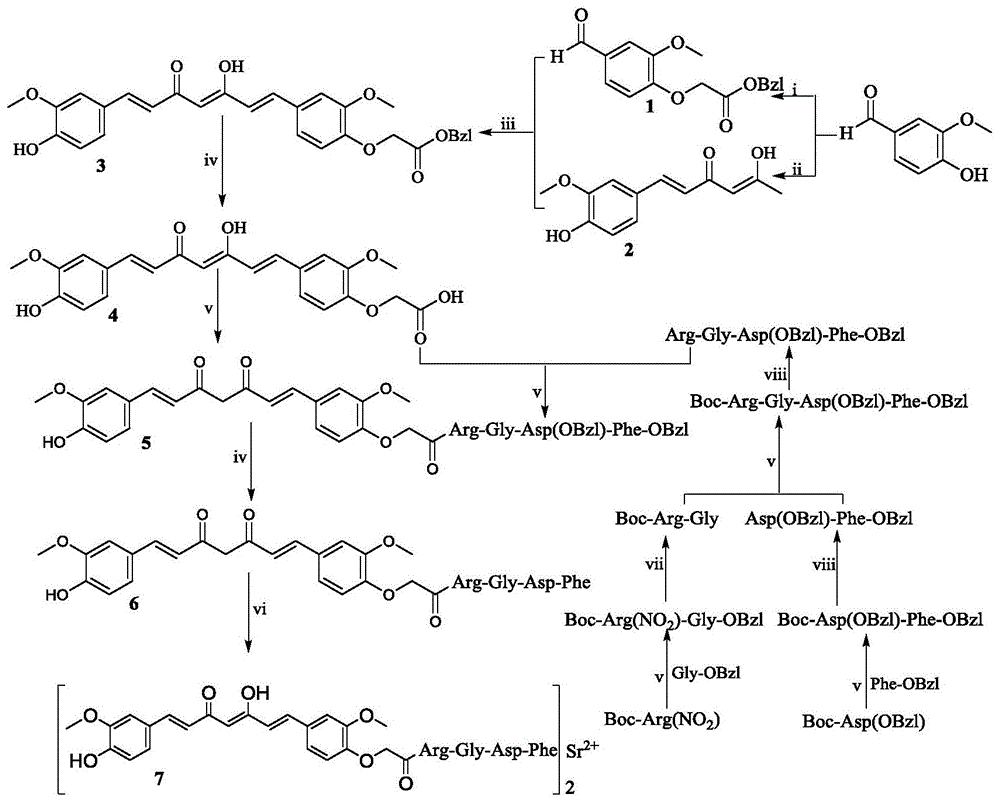
图1姜黄素-4-och2co-arg-gly-asp-phe锶的合成路线。i)k2co3,brch2cooch2c5h5,无水四氢呋喃,60℃,48h;ⅱ)乙酰丙酮,b2o3,(nbuo)3b,nbu-nh3,无水乙酸乙酯,60-80℃,4h;ⅲ)b2o3,b2o3,(nbuo)3b,无水乙酸乙酯,60-80℃,4h;ⅳ)naoh水溶液(2m),meoh;ⅴ)1-羟基苯并三唑,二环己基碳二亚胺,n-甲基吗啉,无水四氢呋喃;vi)sr(oh)2,meoh;vii)pd/c,h2,meoh;viii)氯化氢的乙酸乙酯溶液(4m)。
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实施例1制备3-甲氧基-4-(乙酸苄酯氧基)苯甲醛(1)
将15.2g(100mmol)香草醛溶解于100ml无水四氢呋喃,加入6.9g(50mmol)无水碳酸钾,室温搅拌2h,溶液由淡黄色澄清变为乳白色浑浊状态后,加入15ml(76mmol)溴乙酸苄酯,60℃搅拌48h。反应混合物过滤,滤液减压浓缩,残留物用100ml乙酸乙酯溶解。得到的溶液用5%khso4水溶液洗(30ml×3)及饱和nacl水溶液洗(30ml×3),用无水na2so4干燥12h,过滤,滤液减压浓缩,残留物在无水乙醚中放置,析出27.6g(92%)标题化合物,为无色晶体。esi-ms(m/e):301[m+h]+。
实施例2制备6-(4-羟基-3-甲氧基苯基)-5,6-己烯-2,4-二酮(2)
将9.9ml(97.0mmol)乙酰丙酮分散于50ml无水乙酸乙酯中,加4.6g(66.7mmol)硼酐,60℃搅拌1h。之后,依次加5.06g(33.3mmol)香草醛和9ml(33.5mmol)硼酸三正丁酯,80℃搅拌0.5h。之后,加34ml正丁胺的无水乙酸乙酯溶液(1/10,v/v),80℃搅拌2h。降温至60℃,加34ml稀盐酸(1m),搅拌0.5h,冷却至室温。过滤,滤液用5%khso4水溶液洗(30ml×3)及饱和nacl水溶液洗(30ml×3),用无水na2so4干燥12h,过滤,滤液减压浓缩,残留物用硅胶柱层析纯化,得到3.1g(40%)标题化合物,为淡黄色粉末。esi-ms(m/e):235[m+h]+。
实施例3制备1-(4-羟基-3-甲氧基苯基)-7-(4-氧乙酰苄酯基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮(3)
超声将5g(21.4mmol)6-(4-羟基-3-甲氧基苯基)-5,6-己烯-2,4-二酮(2),3g(42.8mmol)硼酐及30ml无水乙酸乙酯悬浮。悬浮液于60℃搅拌1h,加6.4g(21.4mmol)3-甲氧基-4-(乙酸苄酯氧基)苯甲醛和5.7ml(21.2mmol)硼酸三正丁酯,80℃搅拌0.5h,加21ml正丁胺的无水乙酸乙酯溶液(1/10,v/v),搅拌2h。降温至60℃,加42.7ml稀盐酸(1m),搅拌0.5h,冷却至室温。过滤,滤液用5%khso4水溶液洗(30ml×3)及饱和nacl水溶液洗(30ml×3),用无水na2so4干燥12h,过滤,滤液减压浓缩,残留物用硅胶柱层析纯化,得到4.9g(45%)标题化合物,为深黄色粉末。esi-ms(m/e):517[m+h]+。
实施例4制1-(4-羟基-3-甲氧基苯基)-7-(4-氧乙酰乙酸基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮(4)
将200mg(0.387mmol)1-(4-羟基-3-甲氧基苯基)-7-(4-氧乙酰苄酯基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮(3)溶于10ml甲醇,0℃加1mlnaoh水溶液(2m)调反应液ph为14,搅拌2h。0℃用稀盐酸(2m)调反应液ph为7。反应混合物减压浓缩,残留物加3ml蒸馏水溶解,用稀盐酸(2m)调ph为2,得到的水溶液用乙酸乙酯萃取(30ml×3)之后用饱和nacl水溶液洗(30ml×3),无水na2so4干燥12h,过滤,滤液减压浓缩,残留物用硅胶柱层析纯化,得到135mg(82%)标题化合物,为深黄色粉末。esi-ms(m/e):427[m+h]+;1h-nmr(300mhz,dmso-d6):δ/ppm=16.31(s,1h),12.989(s,1h),9.660(s,1h),7.570(d,j=15.9hz,2h),7.378(s,1h),7.330(s,1h),7.223(d,j=8.1hz,1h),7.164(d,j=7.5hz,1h),6.921-6.817(m,3h),6.769(d,j=15.9hz,1h),6.096(s,1h),4.742(s,2h),3.854(s,3h)。
实施例5制备boc-arg(no2)-gly-obzl
将5g(14.3mmol)boc-arg(no2)和2.1g(15.5mmol)1-羟基苯并三唑用80ml无水四氢呋喃溶解,0℃往溶液中加3.2g(17.1mmol)二环己基碳二亚胺,搅拌0.5h。之后,加3.9g(14.3mmol)gly-obzl,用n-甲基吗啉调ph为9,室温搅拌4h。过滤,滤液减压浓缩,残留物用乙酸乙酯溶解,乙酸乙酯溶液依次用饱和nahco3水溶液洗(30ml×3),5%khso4水溶液洗(30ml×3)及饱和nacl水溶液洗(30ml×3),无水na2so4干燥12h,过滤,滤液减压浓缩,得到的固体用用二氯甲烷重结晶,得到7.9g(82.1%)标题化合物,为无色晶体。esi-ms(m/e):467[m+h]+。
实施例6制备boc-arg-gly
将4g(8.56mmol)boc-arg(no2)-gly-obzl用100ml甲醇溶解,加400mg钯碳。用真空循环水泵抽走空气后,充入氢气,重复3遍后,保持通入氢气的状态搅拌48h。过滤,滤液减压浓缩,得到2.2g(80.1%)标题化合物,为无色固体。esi-ms(m/e):332[m+h]+。
实施例7制备boc-asp(obzl)-phe-obzl
采取实施5的方法从5g(15.48mmol)boc-asp(obzl)和4.3g(17.02mmol)phe-obzl得到7.4g(85.3%)标题化合物,为黄色固体。esi-ms(m/e):561[m+h]+。
实施例8制备asp(obzl)-phe-obzl
将5g(9.74mmol)boc-asp(obzl)-phe-obzl用60ml氯化氢的乙酸乙酯溶液(4m)溶解,0℃搅拌5h。反应液减压浓缩,残留物用10ml无水乙酸乙酯溶解,再减压浓缩,残留物再用10ml无水乙酸乙酯溶解。该操作重复3次。残留物分散在10ml无水乙醚中,静置,弃乙醚,得到3.8g(95.2%)标题化合物,为淡黄色固体。esi-ms(m/e):461[m+h]+。
实施例9制备boc-arg-gly-asp(obzl)-phe-obzl
采取实施5的方法从2.17g(6.86mmol)boc-arg-gly和3.78g(8.23mmol)asp(obzl)-phe-obzl得到1.06g(20.1%)标题化合物,为无色粉末。esi-ms(m/e):774[m+h]+。
实施例10制备arg-gly-asp(obzl)-phe-obzl
采取实施8的方法从500mg(0.646mmol)boc-arg-gly-asp(obzl)-phe-obzl得到425mg(99.9%)标题化合物,为淡黄色固体。esi-ms(m/e):674[m+h]+。
实施例11制备姜黄素-4-och2co-arg-gly-asp(obzl)-phe-obzl(5)
将350mg(0.812mmol)1-(4-羟基-3-甲氧基苯基)-7-(4-氧乙酰乙酸基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮(4)和109mg(0.812mmol)1-羟基苯并三唑用50ml无水四氢呋喃溶解。0℃往溶液中加200mg(0.974mmol)二环己基碳二亚胺,搅拌0.5h。之后,加655mg(0.974mmol)arg-gly-asp(obzl)-phe-obzl,用n-甲基吗啉调ph为9,室温搅拌4h。过滤,滤液减压浓缩,残留物用二氯甲烷溶解。二氯甲烷溶液依次用饱和nahco3水溶液洗(30ml×3),5%khso4水溶液洗(30ml×3)及饱和nacl水溶液洗(30ml×3),无水na2so4干燥12h,过滤,滤液减压浓缩,得到的固体用硅胶柱层析纯化,得到108mg(12.4%)标题化合物,为深黄色粉末。esi-ms(m/e):1084[m+h]+;1h-nmr(300mhz,dmso-d6):δ/ppm=9.801(s,1h),8.462-8.411(m,2h),8.308–8.245(m,2h),7.889(d,j=8.1hz,1h),7.633(d,j=8.1hz,1h),7.564(d,j=15.9hz,1h),7.448–7.398(m,2h),7.368-7.138(m,17h),6.958(d,j=8.4hz,1h),6.867(d,j=8.4hz,1h),6.773(d,j=15.9hz,1h),6.112(s,1h),5.063–5.011(m,4h),4.718–4.672(m,1h),4.630(m,2h),4.494–4.446(m,1h),4.405–4.387(m,1h),4.059–3.988(m,1h),3.843(s,6h),3.754(d,j=5.4hz,1h),3.689(t,j=4.8hz,4h),3.111–2.929(m,4h),2.420(s,2h),1.753–1.478(m,4h)。
实施例12制备姜黄素-4-och2co-arg-gly-asp-phe(6)
0℃往200mg(0.184mmol)姜黄素-4-och2co-arg-gly-asp(obzl)-phe-obzl(5)和20ml甲醇的溶液中加1mlnaoh水溶液(2m),使溶液由橙黄色变为深红色,ph为14。搅拌2h之后用稀盐酸(2m)调ph为7,反应液减压除浓缩,残留物用10ml蒸馏水溶解,水溶液用naoh水溶液(2m)调ph为9,之后用乙酸乙酯洗(5ml×3),水层用稀盐酸(2m)调ph为7,用c18柱纯化,得到20mg(12.1%)标题化合物,为深黄色粉末。esi-ms(m/e):901[m+h]+;1h-nmr(300mhz,dmso-d6):δ/ppm=12.655-12.624(m,2h),9.712(s,1h),8.323-8.298(m,2h),8.135(m,2h),7.594(s,1h),7.543(s,1h),7.393(s,1h),7.328(s,1h),7.245-7.221(m,7h),6.975-6.747(m,4h),6.095(s,1h),4.628(s,2h),4.503-4.411(m,3h),3.861(s,3h),3.837(s,3h),3.736(m,2h),3.163-2.877(m,4h),1.737-1.483(m,5h)。
实施例13制备姜黄素-4-och2co-arg-gly-asp-phe锶(7)
将20mg(0.022mmol)姜黄素-4-och2co-arg-gly-asp-phe(6)用10ml甲醇溶解。将11.6mg(0.044mmol)八水氢氧化锶用10ml蒸馏水溶解,0℃混合这两种溶液,搅拌2h,过滤,得到的红色固体用c18柱纯化,得到17.3mg(78.1%)标题化合物。ft-ms(m/e):990.40015[m-h]-(990.4);mp>245.6℃;
实验例1评价姜黄素-4-och2co-arg-gly-asp-phe锶的抗骨质疏松活性
雌性icr小鼠(25±2g)用作手术组及假手术组小鼠。手术组小鼠腹腔注射5%水合氯醛的生理盐水溶液(0.1ml/10g)。先后用碘伏及洁尔灭擦拭小鼠下腹部,剪开下腹部表皮层,沿着腹白线剪开肌肉层,剪开腹腔后在膀胱下找到子宫,沿子宫找到两侧输卵管,在两侧输卵管的盲端找到两侧呈小菜花状且有脂肪包裹的卵巢,在远离子宫处结扎输卵管,摘除两个卵巢,在结扎处滴加一滴青霉素溶液,将其放回腹腔后,在缝合肌肉层前后均滴加一滴青霉素溶液,缝合表皮层后于伤口处先后用洁尔灭及碘伏涂抹。这里涂抹青霉素,洁尔灭及碘伏均为防止伤口感染。置于鼠笼中,保温3~5h后小鼠苏醒。
假手术组小鼠腹腔注射5%水合氯醛的生理盐水(0.1ml/10g)。先后用碘伏及洁尔灭擦拭小鼠下腹部,剪开下腹部表皮层,沿着腹白线剪开肌肉层,剪开腹腔后在膀胱下找到子宫,沿子宫找到两侧输卵管,在两侧输卵管的盲端找到两侧呈小菜花状且有脂肪包裹的卵巢,不结扎输卵管,也不摘除卵巢,将其放回腹腔后,在缝合肌肉层前后均滴加一滴青霉素溶液,缝合表皮层后,于伤口处先后用洁尔灭及碘伏涂抹。置于鼠笼中,保温3~5h后小鼠苏醒。
手术后恢复七天。第八天模型组随机分组。小鼠或每天一次灌胃给予姜黄素-4-och2co-arg-gly-asp-phe锶(7)与5‰cmcna的混悬液(剂量50.13μmol/kg/天)或雷尼酸锶与5‰cmcna混悬液(剂量501.3μmol/kg/天)或5‰cmcna溶液(剂量0.1ml/10g/天)。连续灌胃28天后小鼠经乙醚麻醉,牺牲,取双侧股骨,剔除肌肉组织,用游标卡尺测量其解剖长度,根据以下方法测量骨干重,骨灰重,骨矿含量。
1)脱脂:配置三氯甲烷/甲醇=2/1的脱脂液,将小鼠左侧股骨浸泡于脱脂液中,每次3h,浸泡两次。在通风橱内挥发脱脂液。
2)测定骨干重:将股骨放入烘箱中120℃烘干6h,冷却至室温后称股骨干重。
3)测定骨灰重:称坩埚的重量(m1),将已测定干重的股骨置于小坩埚中,放入马弗炉中800℃煅烧8h,冷却到室温,称股骨灰和坩埚的总重(m2),将m2-m1计算股骨的灰重。
4)测定骨矿含量(bmc):计算股骨灰重与股骨干重的比值,得到骨矿含量。数据见表1。在50.13μmol/kg/天剂量下化合物7连续治疗28天的小鼠的骨矿含量(0.590±0.021)大于在0.1ml/10g/天剂量下5‰cmcna连续治疗28天的小鼠的骨矿含量(0.571±0.007,p<0.05),与在501.3μmol/kg/天剂量下雷尼酸锶连续治疗28天的小鼠的骨矿含量相当(0.595±0.019,p>0.05)。可见,化合物7在50.13μmol/kg/天剂量下不仅具有抗骨质疏松作用,而且可使小鼠的骨矿物密度恢复至摘除卵巢之前的水平。在只有阳性药雷尼酸锶1/10的剂量下化合物7仍有这么优秀的抗骨质疏松作用,说明本发明有突出的技术效果。
表1化合物7对去势小鼠股骨干重,灰重及骨矿含量的影响
a)与cmcna组比p<0.01;b)与cmcna比p<0.05,与假手术组比p>0.05,与雷尼酸锶组比p>0.05;n=12。
- 还没有人留言评论。精彩留言会获得点赞!