一种自噬靶向性蛋白降解技术及其应用的制作方法
本发明涉及靶向性蛋白降解技术领域,具体涉及一种自噬靶向性蛋白降解技术及其应用,更具体地,涉及一种自噬靶向嵌合体及其应用以及利用自噬降解靶蛋白的靶向性蛋白降解方法。
背景技术:
利用蛋白降解靶向嵌合体(proteolysistargetingchimera,protac)选择性降解靶蛋白的靶向蛋白降解技术是近些年发展起来的一种新技术(参考neklesatk,winklerjd,crewscm.targetedproteindegradationbyprotacs.pharmacolther.2017jun;174:138-144,本申请中将相应部分的全部内容引入本文中作为参考)。protac是双功能分子,其一端能特异结合靶蛋白,另一端特异结合特定的泛素连接酶,两者之间经由连接体基团(linker)连接。protac因能同时结合靶蛋白及泛素连接酶,使靶蛋白临近泛素连接酶,故能增强靶蛋白的泛素化,最终经由蛋白酶体(proteasome)降解(参考neklesatk,winklerjd,crewscm.targetedproteindegradationbyprotacs.pharmacolther.2017jun;174:138-144,本申请中将相应部分的全部内容引入本文中作为参考)。protac因为对靶蛋白具有选择性,能作用于许多传统难以成药的靶点,且在细胞内能被重复使用,能起到类似催化的效应,故无需高浓度即可达到治疗效果,所以被认为有可能超过单克隆抗体成为下一个重磅疗法(参考deshaiesrj.proteindegradation:primetimeforprotacs.natchembiol.2015sep;11(9):634-5,本申请中将相应部分的全部内容引入本文中作为参考)。但是,protac也有下述的缺点或应用局限:(1)protac虽能把靶蛋白募集到泛素连接酶附近,但这有时并不足以导致靶蛋白被泛素化,因为泛素化反应取决于靶蛋白、protac及泛素连接酶形成的三元复合物的空间结构。protac中的连接体的长度对其活性有至关重要的影响。目前,构建一个功能良好的protac仍非常具有挑战性。(2)由于细胞内存在去泛素化酶,protac即使介导了靶蛋白的泛素化,若被泛素化的靶蛋白没有被及时降解,其有可能被去泛素化酶去泛素化而最终不能为蛋白酶体降解。(3)蛋白质的聚合物不能被蛋白酶体降解,有些蛋白质的寡聚物甚至对蛋白酶体有毒性作用,因此protac不能用于直接降解蛋白质聚合物。(4)在有些病理情况下,蛋白酶体自身功能受损不能有效降解蛋白质,因此不能用protac来增强靶蛋白的清除。
除了蛋白酶体外,细胞内的另一个蛋白质降解途径是自噬(参考gaticad,lahiriv,klionskydj.cargorecognitionanddegradationbyselectiveautophagy.natcellbiol.2018mar;20(3):233-242,本申请中将相应部分的全部内容引入本文中作为参考)。与蛋白酶体不同,自噬能降解蛋白聚合物甚至细胞器。自噬有非选择性和选择性两种(参考gaticad,lahiriv,klionskydj.cargorecognitionanddegradationbyselectiveautophagy.natcellbiol.2018mar;20(3):233-242,本申请中将相应部分的全部内容引入本文中作为参考)。非选择性自噬是细胞在营养物质缺乏时的一种反应,表现为随机摄取部分胞浆进吞噬泡(phagophore),随后形成吞噬小体(autophagosome),最后吞噬小体与溶酶体(lysosome)结合,降解所含的荷载物,为细胞提供蛋白合成所需的氨基酸等。选择性自噬则是细胞选择降解有聚集倾向的异常折叠的蛋白质(aggregation-pronemisfoldedproteins)、蛋白质聚合物(proteinaggregates)或损伤的细胞器的一种方式。其中,选择性降解有聚集倾向的异常折叠的蛋白质(aggregation-pronemisfoldedproteins)或蛋白质聚合物(proteinaggregates)的自噬被成为聚合物自噬(aggrephagy)(参考gaticad,lahiriv,klionskydj.cargorecognitionanddegradationbyselectiveautophagy.natcellbiol.2018mar;20(3):233-242,本申请中将相应部分的全部内容引入本文中作为参考)。选择性自噬由自噬受体如p62,nbr1和optn等介导。自噬受体(比如p62)c-端的uba(ubiquitinassociated)区段与荷载物(cargo)相结合,而其lc3作用区段(lc3-interactingregionmotif,lir)则与共价连接到成长的吞噬泡内膜表面的atg8家族的蛋白(比如lc3)结合。吞噬泡的形成则依赖于装载有荷载物的自噬受体聚集形成足够大的结构。吞噬泡最终封闭,形成有双层膜结构的吞噬小体(autophagosome)。吞噬小体与溶酶体(lysosome)结合,导致其内所含的靶蛋白,自噬受体及lc3等为溶酶体内的多种蛋白酶降解(参考gaticad,lahiriv,klionskydj.cargorecognitionanddegradationbyselectiveautophagy.natcellbiol.2018mar;20(3):233-242,本申请中将相应部分的全部内容引入本文中作为参考)。迄今为止,尚未见利用自噬选择性降解特定靶蛋白的技术的报道。
阿尔茨海默病(alzheimer’sdisease,ad)是最常见的一种痴呆症,约占痴呆症的50-70%。据统计,2016年中国有约1000万ad患者,全球则有4400万ad患者。随着人口的老龄化,ad的发病率将进一步上升,预计到2050年中国将有约4000万ad患者。目前所有治疗ad的药物都是表征药物(symptomaticdrugs),只能短暂缓解症状而不能延缓病情的进展。全球迫切期待有能真正改变ad进展的新药(disease-modifyingdrugs)。
ad的两个特征性的病理变化是老年斑(senileplaques,sps)及神经元纤维缠结(neurofibrillarytangles,nfts),分别是由β-淀粉样蛋白(aβ)及高度磷酸化的tau蛋白形成的聚合物,其中tau病变而不是aβ病变与ad的痴呆程度呈正相关(参考wangy,mandelkowe.tauinphysiologyandpathology.natrevneurosci.2016jan;17(1):5-21,本申请中将相应部分的全部内容引入本文中作为参考)。最新的研究显示tau介导aβ诱导的神经毒性,为aβ的神经毒性所必需(参考robersoned,scearce-leviek,palopjj,yanf,chengih,wut,gersteinh,yugq,muckel.reducingendogenoustauamelioratesamyloidbeta-induceddeficitsinanalzheimer'sdiseasemousemodel.science.2007may4;316(5825):750-4,本申请中将相应部分的全部内容引入本文中作为参考);并且tau是朊病毒样蛋白(prion-likeprotein)(参考goedertm,eisenbergds,crowtherra.propagationoftauaggregatesandneurodegeneration.annurevneurosci.2017jul25;40:189-210,本申请中将相应部分的全部内容引入本文中作为参考),能在神经元间传播从而导致tau病变的扩散,提示其可能是ad必需的药物靶点。
除了ad外,tau的聚集也见于连锁于17号染色体伴帕金森病的额颞叶痴呆(frontotemporaldementialinkedtochromosome-17parkinsonism,ftdp-17)、皮克氏病(pick’sdisease,pid)、进行性核上麻痹(progressivesupranuclearpalsy,psp)、皮质基底节变性(corticobasaldegeneration,cbd)、原发性年龄相关性tau病(primaryage-relatedtauopathy,part)、嗜银颗粒病(argyrophilicgraindisease,agd)、老化相关tau星形胶质细胞病(aging-relatedtauastrogliopathy,artag)、慢性创伤性脑病(chronictraumaticencephalopathy,cte)、球形胶质细胞tau病变(globularglialtauopathy,ggt)、帕金森病(parkinson’sdisease,pd)、亨廷顿氏病(huntington’sdisease,hd)等一系列神经退行性疾病。这类疾病包括ad被统称为tau疾病(tauopathies)。tau蛋白是引起这类疾病的重要原因,故也是这类疾病的重要治疗靶点。
目前,虽然已有多种基于tau蛋白的治疗提案,但其中最有吸引力的方案之一是降低细胞内tau蛋白的含量。该方案之所以受青睐,主要基于下述原因:(1)大量的证据表明,降低细胞内tau蛋白的含量,在动物模型中甚少引起副作用;(2)降低tau蛋白的含量可抑制tau蛋白的聚集,而tau蛋白的聚集则是引起神经元退行性变的重要原因;(3)降低tau蛋白的含量可降低多种因素(比如aβ)引起的神经元兴奋性神经毒性作用。因此,降低tau蛋白也被认为是一种新的潜在的治疗癫痫及中风的方案。
降低细胞内靶蛋白常用的技术方法有两种。(1)用sirna、mirna或反义寡核苷酸降低靶蛋白的表达。由于这些寡核苷酸在组织中的分布不好,药物代谢动力学较差,加之有脱靶的可能性,目前其在临床的应用受到限制,还有待进一步改进。(2)增强靶蛋白的降解。常见的方法是增强蛋白降解系统包括蛋白酶系统及自噬系统的活性。但非特异性地增强蛋白降解系统的活性易引起其它非靶蛋白的降解而产生严重副作用,故目前尚未有激活蛋白降解系统的药物获批在临床应用。理想的方法是只选择性增强靶蛋白的降解而避免因增强蛋白降解系统的活性而导致的非靶蛋白的降解。
技术实现要素:
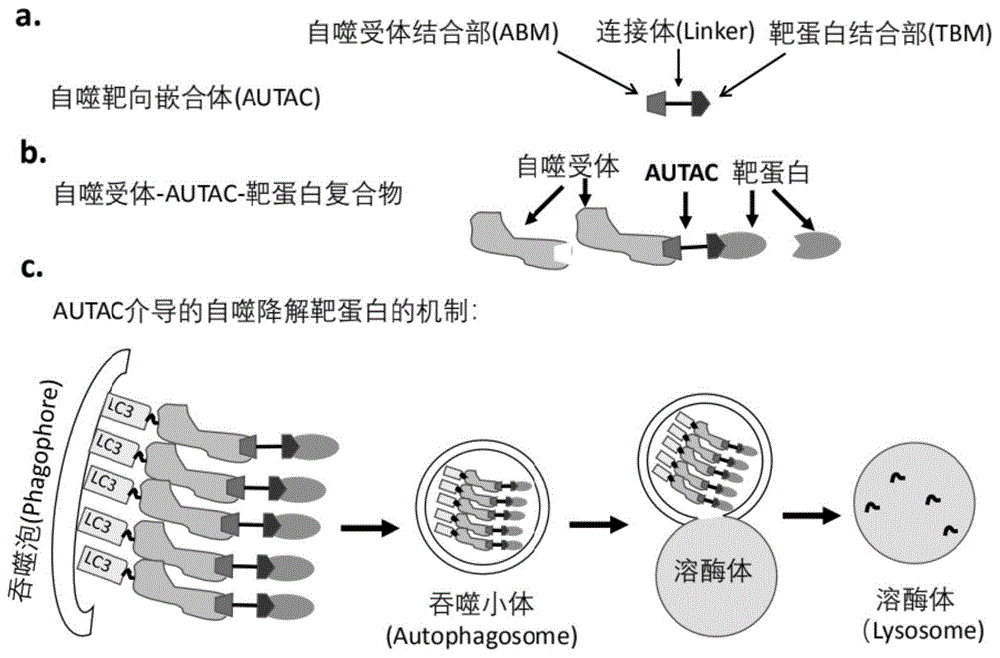
本发明的目的是构建一种自噬靶向性蛋白降解技术。最近有研究表明,自噬受体p62的zz区段与特定的配体结合后能促进其聚集,增加吞噬小体的形成,从而增强自噬(参考cha-molstadh,yuje,fengz,leesh,kimjg,yangp,hanb,sungkw,yooyd,hwangj,mcguiret,shimsm,songhd,ganipisettis,wangn,jangjm,leemj,kimsj,leekh,hongjt,ciechanovera,mook-jungi,kimkp,xiexq,kwonyt,kimby.p62/sqstm1/sequestosome-1isann-recogninofthen-endrulepathwaywhichmodulatesautophagosomebiogenesis.natcommun.2017jul24;8(1):102,本申请中将相应部分的全部内容引入本文中作为参考)。为了实现此目的,本发明的发明人通过深入研究发现,要利用自噬选择性降解靶蛋白,可以构建一种双功能分子化合物,其一端能特异结合靶蛋白,另一端特异结合自噬受体,两者之间经由连接体基团(linker)连接。该双功能分子与自噬受体结合可促进自噬受体的聚集及与lc3的结合,从而引起自噬受体及其荷载物与其经连接体连接的靶蛋白向自噬小体(autophagosome)转运,最终自噬小体与溶酶体结合,导致靶蛋白的降解。与蛋白降解靶向嵌合体(proteolysistargetingchimeras,protac)介导靶蛋白经蛋白酶体降解不同,这种双功能分子是介导靶蛋白经自噬的降解,因此我们把它称为自噬靶向嵌合体(autophagytargetingchimera,(autac))。
与protac技术类似,autac技术除了对靶蛋白的选择性,其另一个优点是能作用于许多传统难以成药的靶点。许多传统的小分子药物必须作用于靶蛋白的特定的结合口袋(bindingpockets),才能发挥抑制作用。autac技术则没有这种限制,其只要能与靶蛋白的任何区段相互作用,并且无需很高的亲和力,即可导致靶蛋白的降解从而抑制靶蛋白的功能,故能作用于许多传统难以成药的靶点。与protac相比,autac的优点是能直接介导蛋白质聚合物的降解。
为此,本发明提供了一种利用自噬降解靶蛋白的靶向性蛋白降解方法,该方法利用自噬靶向嵌合体来介导靶蛋白经自噬的降解,所述自噬靶向嵌合体是一种双功能分子,其化学结构为tbm-l-abm或其药学上可接受的盐、对映体、立体异构体、溶剂化物、多晶型物或n-氧化物,其中,tbm为靶蛋白结合部分,l为连接体基团,abm为自噬受体结合部分,所述靶蛋白结合部分与所述自噬受体结合部分通过连接基团连接。
本发明还提供了一种自噬靶向嵌合体,该自噬靶向嵌合体的化学结构为tbm-l-abm或其药学上可接受的盐、对映体、立体异构体、溶剂化物、多晶型物或n-氧化物,其中,tbm为靶蛋白结合部分,l为连接体基团,abm为自噬受体结合部分,所述靶蛋白结合部分与所述自噬受体结合部分通过连接基团连接。
可选地,tbm能够结合的靶蛋白为tau蛋白、α-突触核蛋白、聚谷氨酰胺蛋白包括亨廷顿蛋白、铜/锌超氧化物歧化酶、tdp-43、c9orf72、fus或它们中的一种或多种的聚合物。
可选地,abm能够结合的自噬受体为p62、nbr1、optn、calcoco2/ndp52、tax1bp1、nix、bnip3、fundc1、bcl2l13或fkbp8。
优选地,所述自噬受体p62为p62的zz区段,所述p62的zz区段的氨基酸序列如seq.id.no:1所示。
在优选的实施方式中,abm为具有式(1)所示结构的基团,
其中,r1和r2为h或c1-c4的烷基;
r3为-r4-m-,abm通过m与连接体基团l相连,其中,r4为-o-或c1-c4的亚烷基,m为键、c1-c4的亚烷基、-nh-或-r5-ch(oh)-r6-nh-r7-,其中r5、r6和r7为c1-c4的亚烷基。
在优选的实施方式中,l为基团-x-y-z-,x与tbm相连,z与abm相连,
其中,x为键、c1-c4的亚烷基或-nh-;
y为-r8-(r10-e-r11)n-r9-,其中r8和r9各自为键或c1-c8的亚烷基,r10和r11各自为c1-c4的亚烷基,n为0-10的整数,e为o、s、酰胺基、哌嗪基、nr12、s(o)、s(o)2、-s(o)2o、-os(o)2、os(o)2o、
z为-a-b-,其中a为键、o或s,b为键、c1-c4的亚烷基或-nh-r13-,其中r13为c1-c4的亚烷基。
在优选的实施方式中,tbm为具有式(2)所示结构的基团,或者为式(2)所示结构的基团中①、②、③、④、⑤、⑥、⑦、⑧、⑨或⑩位被取代基团进一步修饰的基团,其中,tbm通过式(2)中的①、②、③、④、⑤、⑥、⑦、⑧、⑨或⑩位与所述连接体基团l相连,
其中,r14为c1-c4的亚烷基,r15和r16各自为c1-c4的烷基,r17为键、h、c1-c4的烷基或-r18-o-,其中,r18为c1-c4的亚烷基。
在优选的实施方式中,所述自噬靶向嵌合体化合物1和化合物2的结构如下。
化合物1
化合物2
本发明还提供了一种利用自噬降解靶蛋白的靶向性蛋白降解方法,该方法包括:利用自噬靶向嵌合体来介导靶蛋白经自噬的降解,所述自噬靶向嵌合体为上述的自噬靶向嵌合体。
本发明还提供了降解有需要的患者体内的tau蛋白的方法,包括给予所述患者有效量的上述自噬靶向嵌合体。
在优选的实施方式中,所述自噬靶向嵌合体通过选自以下至少一种方式被给予所述患者:鼻服、吸入、局部、口服、肌内、皮下、经皮、腹腔、硬膜外、鞘内和静脉内途径。
本发明还提供了上述自噬靶向嵌合体在制备用于治疗或预防与tau蛋白有关的疾病的药物中的应用。
可选地,所述疾病为阿尔茨海默病、连锁于17号染色体伴帕金森病的额颞叶痴呆、皮克氏病、进行性核上麻痹、皮质基底节变性、原发性年龄相关性tau病、嗜银颗粒病、老化相关tau星形胶质细胞病、慢性创伤性脑病、球形胶质细胞tau病变、帕金森病、亨廷顿病、脑卒中和癫痫中的至少一种。
本发明所述的自噬靶向性蛋白降解方法,通过利用自噬靶向嵌合体介导靶蛋白经自噬降解。所述自噬靶向嵌合体一端能特异结合靶蛋白,另一端特异结合自噬受体,两者之间经由连接体基团连接。所述自噬靶向嵌合体与自噬受体结合可促进自噬受体的聚集及与lc3的结合,从而引起自噬受体及其荷载物与其经连接体连接的靶蛋白向自噬小体转运,最终自噬小体与溶酶体结合,导致靶蛋白的降解。
本发明构建的针对tau蛋白的自噬靶向嵌合体化合物1和化合物2,通过免疫印迹试验证实所述化合物1和所述化合物2能增强细胞中tau蛋白的降解,从而降低tau蛋白的含量。此外,给正常小鼠皮下注射所述自噬靶向嵌合体能显著降低小鼠大脑中tau蛋白的含量。由此表明,本发明所述的自噬靶向嵌合体可介导靶蛋白经自噬降解,因而在预防和治疗包括阿尔茨海默病在内的一系列tau疾病中可发挥作用。
附图说明
图1显示了自噬靶向嵌合体(autac)介导自噬选择性降解靶蛋白的机制;
图2是本发明实施例1制备的化合物c090019的核磁共振谱图;
图3是本发明实施例2制备的化合物c080019的核磁共振谱图;
图4使用不同浓度的本发明提供的化合物c090019对细胞内tau蛋白进行降解的免疫印迹杂交结果(a)及半定量分析(b);
图5使用不同浓度的本发明提供的化合物c080019对细胞内tau蛋白进行降解的免疫印迹杂交结果(a)及半定量分析(b);
图6经皮下注射本发明提供的化合物c090019对小鼠大脑皮质及海马中tau蛋白含量的影响的免疫印迹杂交结果(a,c)及半定量分析(b,d)。
具体实施方式
以下结合附图对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
本发明提供了一种利用自噬降解靶蛋白的靶向性蛋白降解方法,该方法利用自噬靶向嵌合体来介导靶蛋白经自噬的降解,所述自噬靶向嵌合体是一种双功能分子,其化学结构为tbm-l-abm或其药学上可接受的盐、对映体、立体异构体、溶剂化物、多晶型物或n-氧化物,其中,tbm为靶蛋白结合部分,l为连接体基团,abm为自噬受体结合部分,所述靶蛋白结合部分与所述自噬受体结合部分通过连接基团连接。
图1显示了自噬靶向嵌合体(autac)介导自噬选择性降解靶蛋白的机制。参见图1,本发明所述的自噬靶向嵌合体的化学结构为tbm-l-abm或其药学上可接受的盐、对映体、立体异构体、溶剂化物、多晶型物或n-氧化物,其中,tbm为靶蛋白结合部分,l为连接体基团,abm为自噬受体结合部分,所述靶蛋白结合部分与所述自噬受体结合部分通过连接基团连接。
所述自噬靶向嵌合体可介导生物体内各种需要降解的蛋白经自噬降解。
可选地,tbm能够结合的靶蛋白为tau蛋白、α-突触核蛋白(α-synuclein)(np_000336.1)、聚谷氨酰胺蛋白(polyglutamineproteins)包括亨廷顿蛋白(huntingtonprotein)(np_002102.4)、铜/锌超氧化物歧化酶(cu/znsuperoxidedismutase(sod1))(np_000445.1)、tdp-43(tardna-bindingprotein43)(np_031401.1)、c9orf72(np_001242983.1)、fus(融合的肉瘤,fusedinsarcoma)或它们中的一种或多种的聚合物。
可选地,abm能够结合的自噬受体为p62(sqstm1,sequestosome1)(aah17222.1)、nbr1(与brca1基因相邻的基因,neighborofbrca1gene)(eaw60953.1)、optn(optineurin)(np_001008213.1)、calcoco2(结合钙且卷曲螺旋结构区段,calciumbindingandcoiled-coildomain2)/ndp52(aah15893.1)、tax1bp1、nix(aad03589.1)、bnip3(bcl2相关的永生基因,bcl2-associatedathanogene)(aah01936.2)、fundc1(np_776155.1)、bcl2l13(geneid:23786)、fkbp8(aaq84561.1)。
优选地,所述abm能够结合的自噬受体为p62的zz区段,所述p62的zz区段的氨基酸序列如seq.id.no:1所示。
seq.id.no:1:
cysaspglycysasnglyprovalvalglythrargtyrlyscysservalcysproasptyraspleucysservalcysgluglylysglyleuhisargglyhis
在较优选的实施方式中,abm为具有式(1)所示结构的基团,
其中,r1和r2为h或c1-c4的烷基(如甲基、乙基、正丙基、异丙基或正丁基及其同分异构体);
r3为-r4-m-,abm通过“-m-”与连接体基团l相连,其中,r4为-o-、c1-c4的亚烷基(如亚甲基、亚乙基、亚丙基或亚丁基),m为键、c1-c4的亚烷基(如亚甲基、亚乙基、亚丙基或亚丁基)、-nh-或-r5-ch(oh)-r6-nh-r7-,其中r5、r6和r7为c1-c4的亚烷基(如亚甲基、亚乙基、亚丙基或亚丁基)。当“-m-”为-r5-ch(oh)-r6-nh-r7-时,“-r7-”与连接体基团l直接相连。
进一步优选地,在式(1)所示结构中,r1和r2为h,r3为-r4-nh-或-o-r5-ch(oh)-r6-nh-r7-,其中,r4、r5和r6为亚甲基,r7为亚乙基。
在较优选的实施方式中,l为基团-x-y-z-,x与tbm相连,z与abm相连。
其中,x为键、c1-c4的亚烷基(如亚甲基、亚乙基、亚丙基或亚丁基)或-nh-。
y为-r8-(r10-e-r11)n-r9-,其中r8和r9各自为键或c1-c8的亚烷基(如亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、亚庚基或亚辛基),r10和r11各自为c1-c4的亚烷基(如亚甲基、亚乙基、亚丙基或亚丁基),n为0-10的整数(如0、1、2、3、4、5、6、7、8、9或10),e为o、s、酰胺基、哌嗪基、nr12、s(o)、s(o)2、-s(o)2o、-os(o)2、os(o)2o、
z为-a-b-,其中a为键、o或s,b为键、c1-c4的亚烷基或-nh-r13-,其中r13为c1-c4的亚烷基。
在较优选的实施方式中,tbm为具有式(2)所示结构的基团,或者为式(2)所示结构的基团中①、②、③、④、⑤、⑥、⑦、⑧、⑨或⑩位被取代基团进一步修饰的基团,其中,tbm通过式(2)中的①、②、③、④、⑤、⑥、⑦、⑧、⑨或⑩位与所述连接体基团l相连,
其中,r14为c1-c4的亚烷基(如亚甲基、亚乙基、亚丙基或亚丁基),r15和r16各自为c1-c4的烷基(如甲基、乙基、丙基、正丁基或异丁基),r17为键、h、c1-c4的烷基(如甲基、乙基、丙基或丁基)或-r18-o-,其中,r18为c1-c4的亚烷基(如亚甲基、亚乙基、亚丙基或亚丁基)。
其中,修饰式(2)所示结构的基团中①、②、③、④、⑤、⑥、⑦、⑧、⑨或⑩位的取代基团可以为卤素(如氟或氯)、c1-c4的烷基(如甲基、乙基、丙基或丁基)、c1-c4的烷氧基(如甲氧基、乙氧基、丙氧基或丁氧基)、羧基、氨基、胺基、c6-c18的芳基(如苯基)或苄基。
进一步优选地,在式(2)所示结构中,tbm通过式(2)中的⑤位与所述连接体基团l相连,r14为亚乙基,r15和r16各自为甲基,r17为键、亚甲基或-ch2ch2-o-。
在本发明中,通过构建针对tau蛋白的自噬靶向嵌合体化合物1和化合物2,验证了本发明所述的自噬靶向嵌合体可利用自噬特异性降解靶蛋白,所述化合物1和化合物2的结构如下。
化合物1
化合物2
上述自噬靶向嵌合体化合物1和化合物2分别命名为c090019和c080019,可以按照以下工艺路线制备:
(1)中间物质化合物a和化合物b合成路线:
化合物a合成路线:
化合物b合成路线:
(2)化合物1合成路线:
(3)化合物2合成路线:
中间物质化合物a和化合物b具体制备过程包括如下步骤:
(1)制备化合物a
(1.1)制备化合物3-2
在0-5℃下,将化合物3-1和三乙胺(tea)溶于四氢呋喃(thf)中,然后加入1-(1,4-二氮杂环庚烷-1-基)乙酮,将所得混合物料在0-5℃下搅拌1-1.5h,并在室温条件下搅拌搅拌1-1.5h。反应完成后,浓缩反应混合物,通过柱色谱法纯化,得到化合物3-2(白色固体)。
(1.2)制备化合物a
在70-90℃下,将化合物3-2、2-(噻吩-2-基)乙胺和k2co3溶于甲基腈(ch3cn)中,搅拌过夜。反应完成后滤出k2co3并浓缩有机层,通过柱色谱法纯化,得到化合物a(白色固体)。
(2)制备化合物b
在70-90℃下,将化合物3-3、2-(氯甲基)环氧乙烷和k2co3溶于甲基腈(ch3cn)中,搅拌过夜。反应完成后滤出k2co3并浓缩有机层,通过柱色谱法纯化,得到化合物化合物b(无色油状物)。
化合物1具体制备过程包括如下步骤:
(1)制备化合物4-2
在0-5℃下,将化合物4-1和三乙胺(tea)溶于二氯甲烷(dcm)中,加入mscl,将得到的混合物在0-5℃下搅拌10-15min,并加热至室温反应1-1.5h。反应完成后,浓缩所得混合物,并使用石油醚/乙酸乙酯(pe/ea)通过柱色谱法纯化所得残余物,得到化合物4-2(无色油状物)。
(2)制备化合物4-3
在70-90℃下,将化合物4-2和ki溶于丙酮,搅拌过夜。反应完成后,浓缩反应混合物,并使用石油醚/乙酸乙酯(pe/ea)通过柱色谱法纯化所得残余物,得到化合物4-3(无色油状物)。
(3)制备化合物4-4
将化合物4-3溶于四氢呋喃(thf),加入nah,在0-5℃下搅拌20-40min,然后加入化合物c,将所得混合溶液在室温下搅拌过夜。反应结束后,将溶液用h2o淬灭并用乙酸乙酯(ea)萃取。将有机层干燥并真空浓缩,通过硅胶色谱法使用5-10%甲醇/二氯甲烷(meoh/dcm)纯化残余物,得到化合物4-4(黄色固体)。
(4)制备化合物4-5
将化合物4-4溶于甲醇(meoh),加入pd/c,将所得混合物料在20-30℃、h2保护下搅拌6-10h。反应结束后,过滤所得混合物料,并将滤液真空浓缩,通过硅胶色谱法使用5-20%甲醇/二氯甲烷(meoh/dcm)纯化残余物,得到化合物4-5(无色油状物)。
(5)制备化合物4-6
在70-90℃下,将化合物4-5、化合物a和k2co3溶于ch3cn(甲基腈),搅拌过夜。反应完全后,滤出k2co3并浓缩有机层,通过prep-tlc使用甲醇/二氯甲烷(meoh/dcm)纯化,得到化合物4-6(白色固体)。
(6)制备化合物4-7
将化合物4-6溶于二恶烷,再加入hcl/二恶烷,将所得混合物料在室温下搅拌3-5h。反应完全后,将反应所得溶液真空浓缩,将残余物用na2co3(aq)中和,用乙酸乙酯(ea)萃取,将有机层干燥并真空浓缩,通过硅胶色谱法使用5-10%甲醇/二氯甲烷(meoh/dcm)纯化残余物,得到化合物4-7(黄色固体)。
(7)制备化合物1(目标化合物“c090019”)
在60-70℃下,将化合物4-7、化合物b溶于ch3oh,搅拌过夜。反应完全后,除去溶剂并通过prep-tlc和prep-hplc纯化残余物,得到化合物1(棕色油状物)。
化合物2具体制备过程包括如下步骤:
(1)制备化合物5-2
在20-30℃下,将化合物5-1、四溴化碳(cbr4)和三苯基膦(pph3)溶于四氢呋喃(thf),搅拌过夜。反应完全后,浓缩溶液,并使用石油醚/乙酸乙酯(pe/ea)通过柱色谱法纯化,得到化合物5-2(黄色油状物)。
(2)制备化合物5-3
将化合物5-2溶于四氢呋喃(thf),加入nah,在0-5℃下搅拌20-40min,然后加入化合物c,将所得混合物料在室温下搅拌过夜。反应完全后,将溶液用h2o淬灭并用乙酸乙酯(ea)萃取,将有机层干燥并真空浓缩,通过硅胶色谱法使用5-10%甲醇/二氯甲烷(meoh/dcm)纯化残余物,得到化合物5-3(黄色油状物)。
(3)制备化合物5-4
将化合物5-3溶于甲醇(meoh),加入pd/c,将所得混合物料在20-30℃、h2保护下搅拌6-10h。反应完全后,所得混合物料通过二氧化硅过滤,滤液真空浓缩,残余物通过硅胶色谱法使用5-15%甲醇/二氯甲烷(meoh/dcm)纯化,得到化合物5-4(无色油状物)。
(4)制备化合物5-5
在70-90℃下,将化合物5-4、化合物a和k2co3溶于甲基腈(ch3cn),搅拌过夜。反应完全后,滤出k2co3,浓缩有机层,并使用甲醇/二氯甲烷(meoh/dcm)通过柱色谱法纯化,得到化合物5-5(白色固体)。
(5)制备化合物5-6
将化合物5-5溶于二恶烷,再加入hcl/二恶烷,将所得混合物料在室温下搅拌3-5h。反应完全后,将所得混合溶液真空浓缩,将残余物用na2co3(aq)中和,用乙酸乙酯(ea)萃取,将有机层干燥并真空浓缩,通过硅胶色谱法使用5-10%甲醇/二氯甲烷(meoh/dcm)纯化残余物,得到化合物5-6(黄色固体)。
(6)制备化合物2(目标化合物“c080019”)
将化合物5-6和化合物c溶于甲醇(meoh),将所得溶液在室温下搅拌3-5h,然后加入nabh4,将所得混合物料在室温下搅拌1-1.5h。反应完全后,将混合物用h2o分解并除去溶剂,将得到的残余物用h2o稀释,用乙酸乙酯(ea)萃取,将有机相干燥并浓缩。通过prep-tlc和prep-hplc纯化残余物,得到化合物2(无色油状物)。
本发明还提供了利用自噬降解靶蛋白的靶向性蛋白降解方法,该方法包括:利用自噬靶向嵌合体来介导靶蛋白经自噬的降解,所述自噬靶向嵌合体为上述的自噬靶向嵌合体。
本发明还提供了降解有需要的患者体内的tau蛋白的方法,包括给予所述患者有效量的本发明提供的上述化合物1或化合物2。
在上述方法中,所述化合物1或化合物2通过选自以下至少一种方式被给予所述患者:鼻服、吸入、局部、口服、肌内、皮下、经皮、腹腔、硬膜外、鞘内和静脉内途径。
本发明还提供了上述化合物1或化合物2在制备用于治疗或预防与tau蛋白有关的疾病的药物中的应用。所述疾病可以为阿尔茨海默病、连锁于17号染色体伴帕金森病的额颞叶痴呆、皮克氏病、进行性核上麻痹、皮质基底节变性、原发性年龄相关性tau病、嗜银颗粒病、老化相关tau星形胶质细胞病、慢性创伤性脑病、球形胶质细胞tau病变、帕金森病、亨廷顿病、脑卒中和癫痫中的至少一种。
以下将通过实施例对本发明进行详细描述。
实施例1
制备中间物质化合物a和化合物b:
(1)制备化合物a
(1.1)制备化合物3-2
在0℃下,将化合物3-1(1.20g,6.55mmol)和三乙胺(tea)(1.10g,9.82mmol)溶于四氢呋喃(thf)(60ml)中,然后加入1-(1,4-二氮杂环庚烷-1-基)乙酮(0.93g,6.55mmol),将所得混合物料在0℃下搅拌1h,并在室温条件下搅拌搅拌1h。通过tlc(ea/pe=1:4)显示化合物3-1完全消耗确认反应完成。浓缩反应混合物,通过柱色谱法纯化,得到900mg化合物3-2,为白色固体。
(1.2)制备化合物a
在80℃下,将化合物3-2(900mg,3.1mmol)、2-(噻吩-2-基)乙胺(590g,4.6mmol)和k2co3(635mg,4.6mmol)溶于甲基腈(ch3cn)(60ml)中,搅拌过夜。通过tlc(ea/pe=1:1)显示化合物3-2完全消耗确认反应完成。滤出k2co3并浓缩有机层,通过柱色谱法纯化,得到600mg化合物a,为白色固体。
(2)制备化合物b
在80℃下,将化合物3-3(1.0g,3.26mmol)、2-(氯甲基)环氧乙烷(359mg,3.91mmol)和k2co3(674mg,4.89mmol)溶于甲基腈(ch3cn)(60ml)中,搅拌过夜。通过tlc(ea/pe=1:9)显示化合物3-3完全消耗确认反应完成。滤出k2co3并浓缩有机层,通过柱色谱法纯化,得到400mg化合物b,为无色油状物。
制备化合物1:
(1)制备化合物4-2
在0℃下,将化合物4-1(1.50g,5.92mmol)和三乙胺(tea)(1.20g,11.85mmol)溶于二氯甲烷(dcm)(100ml)中,加入mscl(0.89g,7.12mmol),将得到的混合物在0℃下搅拌10min,并加热至室温反应1h。通过tlc(ea/pe=3:7)显示化合物4-1完全消耗确认反应完成。浓缩所得混合物,并使用石油醚(pe)通过柱色谱法纯化所得残余物,得到1.2g化合物4-2,为无色油状物。
(2)制备化合物4-3
在80℃下,将化合物4-2(1.2g,3.62mmol)和ki(1.8g,10.87mmol)溶于丙酮(100ml),搅拌过夜。通过tlc(ea/pe=1:1)显示化合物4-2完全消耗确认反应完成。浓缩反应混合物,并使用石油醚(pe)通过柱色谱法纯化所得残余物,得到650mg化合物4-3,为无色油状物。
(3)制备化合物4-4
将化合物4-3(650mg,1.79mmol)溶于四氢呋喃(thf)(50ml),加入nah(86mg,3.58mmol),在0℃下搅拌30min,然后加入化合物c(469mg,2.68mmol),将所得混合溶液在室温下搅拌过夜。通过tlc(meoh/dcm=1:9)显示化合物4-3完全消耗确认反应完成。将溶液用h2o(30ml)淬灭并用乙酸乙酯(ea)(40ml×3)萃取。将有机层干燥并真空浓缩,通过硅胶色谱法使用8wt%甲醇(meoh)纯化残余物,得到120mg化合物4-4,为黄色固体。
(4)制备化合物4-5
将化合物4-4(120mg,0.1mmol)溶于甲醇(meoh)(5ml),加入pd/c(50mg),将所得混合物料在25℃、h2保护下搅拌8h。通过tlc(meoh/dcm=1:9)显示化合物4-4完全消耗确认反应完成。过滤所得混合物料,并将滤液真空浓缩,通过硅胶色谱法使用8wt%甲醇(meoh)纯化残余物,得到80mg化合物4-5,为无色油状物。
(5)制备化合物4-6
在80℃下,将化合物4-5(80mg,0.25mmol)、化合物a(142mg,0.37mmol)和k2co3(69mg,0.50mmol)溶于ch3cn(甲基腈)(20ml),搅拌过夜。通过tlc(meoh/dcm=1:19)显示化合物4-5完全消耗确认反应完成。滤出k2co3并浓缩有机层,通过prep-tlc使用甲醇(meoh)纯化,得到100mg化合物4-6,为白色固体。
(6)制备化合物4-7
将化合物4-6(100mg,0.15mmol)溶于二恶烷(10ml),再加入hcl(3ml,3.0mmol),将所得混合物料在室温下搅拌4h。通过lcms(meoh/dcm=1:4)显示化合物4-6完全消耗确认反应完成。将反应所得溶液真空浓缩,将残余物用na2co3(aq)中和,用乙酸乙酯(ea)(10ml×3)萃取,将有机层干燥并真空浓缩,通过硅胶色谱法使用8wt%甲醇(meoh)纯化残余物,得到62mg化合物4-7,为黄色固体。
(7)制备化合物1(目标化合物“c090019”)
在65℃下,将化合物4-7(62mg,0.1mmol)、化合物b(39mg,0.1mmol)溶于ch3oh(10ml),搅拌过夜。通过tlc(meoh/dcm=1:4)显示化合物4-7完全消耗确认反应完成。除去溶剂并通过prep-tlc和prep-hplc纯化残余物,得到22mg化合物1,为棕色油状物。该化合物的核磁共振谱图如图2所示。
实施例2
制备中间物质化合物a:
(1)制备化合物3-2
在0℃下,将化合物3-1(1.20g,6.55mmol)和三乙胺(tea)(1.10g,9.82mmol)溶于四氢呋喃(thf)(60ml)中,然后加入1-(1,4-二氮杂环庚烷-1-基)乙酮(0.93g,6.55mmol),将所得混合物料在0℃下搅拌1h,并在室温条件下搅拌搅拌1h。通过tlc(ea/pe=1:4)显示化合物3-1完全消耗确认反应完成。浓缩反应混合物,通过柱色谱法纯化,得到900mg化合物3-2,为白色固体。
(2)制备化合物a
在80℃下,将化合物3-2(900mg,3.1mmol)、2-(噻吩-2-基)乙胺(590g,4.6mmol)和k2co3(635mg,4.6mmol)溶于甲基腈(ch3cn)(60ml)中,搅拌过夜。通过tlc(ea/pe=1:1)显示化合物3-2完全消耗确认反应完成。滤出k2co3并浓缩有机层,通过柱色谱法纯化,得到600mg化合物a,为白色固体。
制备化合物2:
(1)制备化合物5-2
在25℃下,将化合物5-1(1.0g,3.36mmol)、四溴化碳(cbr4)(1.0g,3.36mmol)和三苯基膦(pph3)(1.0g,4.04mmol)溶于四氢呋喃(thf)(60ml),搅拌过夜。通过tlc(ea/pe=1:19)显示化合物5-1完全消耗确认反应完成。浓缩溶液,并使用石油醚(pe)通过柱色谱法纯化,得到850mg化合物5-2,为黄色油状物。
(2)制备化合物5-3
将化合物5-2(850mg,2.36mmol)溶于四氢呋喃(thf)(50ml),加入nah(113mg,4.72mmol),在0℃下搅拌30min,然后加入化合物c(569mg,3.54mmol),将所得混合物料在室温下搅拌过夜。通过tlc(ea/pe=1:4)显示化合物5-2完全消耗确认反应完成。将溶液用h2o(30ml)淬灭并用乙酸乙酯(ea)(30ml×3)萃取,将有机层干燥并真空浓缩,通过硅胶色谱法使用8wt%甲醇(meoh)纯化残余物,得到200mg化合物5-3,为黄色油状物。
(3)制备化合物5-4
将化合物5-3(120mg,0.27mmol)溶于甲醇(meoh)(15ml),加入pd/c(50mg),将所得混合物料在25℃、h2保护下搅拌8h。通过tlc(meoh/dcm=1:9)显示化合物5-3完全消耗确认反应完成。所得混合物料通过二氧化硅过滤,滤液真空浓缩,残余物通过硅胶色谱法使用8wt%甲醇(meoh)纯化,得到75mg化合物5-4,为无色油状物。
(4)制备化合物5-5
在80℃下,将化合物5-4(75mg,0.21mmol)、化合物a(97mg,0.25mmol)和k2co3(69mg,0.50mmol)溶于甲基腈(ch3cn)(20ml),搅拌过夜。通过tlc(meoh/dcm=1:19)显示化合物5-4完全消耗确认反应完成。滤出k2co3,浓缩有机层,并使用甲醇(meoh)通过柱色谱法纯化,得到80mg化合物5-5,为白色固体。
(5)制备化合物5-6
将化合物5-5(80mg,0.12mmol)溶于二恶烷(10ml),再加入hcl(3.6ml,3.6mmol),将所得混合物料在室温下搅拌4h。通过lcms(meoh/dcm=1:4)显示化合物5-5完全消耗确认反应完成。将所得混合溶液真空浓缩,将残余物用na2co3(aq)中和,用乙酸乙酯(ea)(10ml×3)萃取,将有机层干燥并真空浓缩,通过硅胶色谱法使用8wt%甲醇(meoh)纯化残余物,得到50mg化合物5-6,为黄色固体。
(6)制备化合物2(目标化合物“c080019”)
将化合物5-6(50mg,0.08mmol)和化合物c(26mg,0.08mmol)溶于甲醇(meoh)(10ml),将所得溶液在室温下搅拌4h,然后加入nabh4(12mg,0.32mmol),将所得混合物料在室温下搅拌1h。将混合物用h2o分解并除去溶剂,将得到的残余物用h2o稀释,用乙酸乙酯(ea)(10ml×3)萃取,将有机相干燥并浓缩。通过prep-tlc和prep-hplc纯化残余物,得到23mg化合物2,为无色油状物。该化合物的核磁共振谱图如图3所示。
测试例
一、动物样品制备
1、动物的饲养
c57bl/6小鼠购买于华阜康(北京公司)。实验动物严格按照《中国实验动物管理条例》管理,温度控制在25℃,保持12小时昼夜颠倒节律,所有动物实验均经过华中科技大学同济医学院伦理委员会批准。
2、动物的药物处理
用皮下注射方式给小鼠给药。首先配置助溶剂(20%羟丙基-β-环糊精(hp-β-cd)),取2g粉末溶于10ml生理盐水中,震荡混匀。将小鼠称重,计算皮下注射所需的给药量(15mg/kg),将等体积的药物(实验组)和dmso(对照组)分别加入到10倍体积的助溶剂中,震荡混匀,用1ml注射器吸取适量药物,固定老鼠头颈部,沿颈部皮肤松弛部位进针,缓慢注射药物,可感受到药物形成皮丘,出针后观察是否漏液。如果有漏液,舍弃该鼠,重新注射一只取代这只小鼠。
3、样品的制备
首先准备好小鼠脑组织匀浆所用的仪器及耗材,配置新鲜的匀浆液(50mmtris-hcl,ph7.4-7.5,100mmnacl,1%triton,5mmedta,1mmpmsf(sigma,p-7626),1×蛋白酶抑制剂混合物(proteaseinhibitorscocktail,sigma,p8340)),并将匀浆液置于冰上预冷。用6%的水合氯醛麻醉小鼠后,将小鼠断头,取出完整的脑组织,置于放在冰上的玻璃板上,迅速切掉小脑,分开左右脑,将一半脑组织置于多聚甲醛溶液中固定,将另一半脑组织分离皮层和海马,皮层取靠近额颞叶的1/3,分别置于预冷的1.5ml的ep管中。将脑组织称重后放入匀浆管中,按1:10(脑组织质量:匀浆液体积=1:10)加入匀浆液,打开匀浆机,forward和reverse各匀浆50下,收集匀浆液至ep管中,冰上静置30分钟,每隔10分钟将管内液体吹打混匀,然后在预冷至4℃的离心机中离心12000rpm×20分钟,将上清分为两部分。第一部分取适量体积,按3:1加入4×sds上样缓冲液,在通风橱里按10:1加入250mmβ-巯基乙醇,混匀后在铁浴锅上加热95℃×10分钟,待冷却后震荡混匀,离心,收于-80℃冰箱保存。另一部分留约10μl,测蛋白浓度,其余置液氮迅速冷冻后,再转到-80℃冰箱保存。免疫印迹杂交上样前,将样品用适量的1×sds上样缓冲液稀释4~5倍后,重新加热10分钟,待冷却后,短暂离心,混匀样品。
二、细胞样品制备
1、细胞培养
细胞在37℃、5%co2细胞培养箱中培养。hek293tau细胞(稳定表达野生型全长tau蛋白)的培养基是dmem/highglucose(hyclon,1234)、10%胎牛血清fbs(fetalbovineserum,fbs)(biologicalindustries,04-001-1acs)、0.2mg/mlg418。细胞接种后,每2-3天更换一次培养基,并在倒置显微镜下观察细胞状态及生长情况。当培养瓶中的细胞覆盖率达到80%-90%时,传代或铺板。
2、药物处理
提前一天将细胞种植于24孔板中,每孔细胞接种量约2.5×105。细胞培养24小时后,移除原有的培养基,更换为新鲜培养基,然后加不同剂量的上述实施例制备的小分子化合物(0μm,0.01μm,0.1μm,1μm,5μm),继续培养24小时,最后收取细胞样品。
3、样品的制备
(1)将1×pbs及细胞裂解液(50mmtris-hcl,ph7.4-7.5,100mmnacl,1%triton,5mmedta,1mmpmsf(sigma,p-7626),1×蛋白酶抑制剂混合物(sigma,p8340))放在冰上预冷。
(2)将六孔细胞培养板从37℃恒温细胞培养箱中拿出,置于冰上,吸取培养基弃掉,沿孔壁缓缓加入预冷的pbs,轻轻摇晃,弃掉,然后再加入新鲜的预冷的pbs,洗两遍,最后一次吸净pbs,加入适量的配好的细胞裂解液,轻轻摇晃铺匀覆盖细胞,冰上静置10分钟,用干净的细胞刮子沿孔板底部刮取细胞,收集细胞裂解液于1.5ml的ep管中,冰上静置30分钟,每隔10分钟将管内液体吹打混匀。
(3)将样品在预冷至4℃的离心机中离心12000rpm×20分钟,将上清分为两部分,第一部分取适量体积,按3:1加入4×sds上样缓冲液(4×sdsloadingbuffer:0.2mtris-hclph6.8,2%sds,40%甘油),在通风橱里按10:1加入250mmβ-巯基乙醇,在铁浴锅上加热95℃×10分钟,震荡混匀,离心,收于-80℃冰箱保存。另一部分留约10μl,测蛋白浓度。
三、样品蛋白质含量的测定(bca法)
1、将蛋白样品震荡后进行适当稀释(样品各取5μl与45μl双蒸水混合稀释,各设2个平行样),离心震荡;
2、设六个标准管,分别取20mg/mlbsa(100mgbsa溶于5ml双蒸水中)0μl、10μl、20μl、30μl、40μl、50μl,分别加1000μl、990μl、980μl、970μl、960μl、950μl双蒸水配制成0μg/μl、0.2μg/μl、0.4μg/μl、0.6μg/μl、0.8μg/μl、1.0μg/μl的标准蛋白;
3、将稀释过的蛋白样品和稀释过的标准蛋白分别加入96孔板内(5μl/孔,用pcr枪贴壁和底的交界处,每加一个孔换一个枪头),各设3个平行孔。
4、工作液由试剂盒中a液和b液按50:1比例配制而成。将工作液加入96孔板中,每孔快速悬空加入95μl,加完后盖上盖子迅速贴底沿同方向震荡,手不要触碰96孔板底,用塑料盒垫着37℃孵育30分钟;
5、用1ml注射器针头去气泡,打开biotek开关,打开gen5,点左箭头图标,点击ok,导出excel;
6、复制标准蛋白od值,框选od值和标准蛋白浓度插入散点图。选择数据点添加趋势线,显示公式,显示r平方值(小数点后应至少有2个9),去掉异常值。复制样品蛋白od值,上方输入相应样品组号,去掉异常值。
四、tau蛋白含量测定(免疫印迹法)
1、搭架子(两种玻璃板,三个瓶子,五个试剂,滤纸,卫生纸,垃圾桶,枪,枪头,梳齿)
(1)擦净桌面和底架,洗净梳齿、玻璃板、蒸馏水瓶和上、下部胶瓶,并烘干上、下部胶瓶,拿出配制电泳胶的试剂恢复至室温;
(2)将较高的玻璃板朝内叠在一起,按住上部使下部紧贴桌面使其平齐,将夹子向外翻夹紧,放在底架上用夹子扣住。
(3)注入双蒸水检验是否漏液,若漏液则重装后再检漏。
2、制备电泳胶
表1
(1)依次加入20%arc/bis,tris缓冲液,temed和10%aps,用移液器吹打混匀,整个过程防止混合液中混有气泡;
(2)沿两个角分别将分离胶缓缓注入到胶膜内(吸取时深入液面下轻柔吹打混匀,每次枪头留少量液体以防产生气泡),每块胶用量为3×900μl,观察胶不漏后沿两个角分别用双蒸水将胶膜的空隙处填满(防止氧气抑制聚合并保持下部胶水平,可多放一段时间);
(3)等待凝胶30分钟左右待分离胶凝固后倾去双蒸水,并用滤纸将剩余水吸尽,并用记号笔标出下部胶的上沿;
(4)沿两个角分别将浓缩胶缓缓注入到胶膜内,斜着从左往右插入所需规格梳齿(上样量<20μl用小梳齿,上样量>20μl用大梳齿),在泳道间补胶避免缩胶,等待凝胶(约需50分钟)。
3、上样和蛋白的电泳分离(上样针,样品,排插,marker,电泳液,电泳槽,蒸馏水瓶)。
清洗电泳架下面的导电丝,将转移到电泳架上,用记号笔标出泳道及编号,缓慢垂直拔出梳齿,用电泳液加满凝胶槽,用微量加样器取样品加入各个泳道(marker加1μl于第1泳道)。上完样后将电泳架转移至电泳槽,加电泳液后盖上盖子使红色对红色,黑色对黑色,加样后先用恒流10ma/块胶电泳约30分钟(按两次启动),待溴酚蓝指示剂电泳至浓缩胶与分离胶交界处成以线状时,改为恒压100v(若无法恒压可调高电流)电泳约60分钟至溴酚蓝到凝胶底部且marker条带都完全分离。
4、转膜(标记nc膜,转膜液,滤纸,冰盒,盆子,盘子,转膜槽,塑料板,清洗镊子)
(1)将nc膜用记号笔标记后浸于回收的转膜液10-20分钟(有利于蛋白质的固定,能平衡凝胶且去除sds),按住两旁的卡口取下凝胶槽,用小板撬起玻璃板和白瓷板右侧中间部分,期间保持剩余胶的电泳。
(2)依欲显分子量范围用玻璃板垂直略倾斜并轻微地左右来回一次切胶,用镊子将浸过转膜液的三层滤纸贴在胶上,用小板小心地将胶撬起放在的海绵上(滤纸朝下),另一面贴上倒置的nc膜,将胶和nc膜浸没至转膜液中(胶在上)用玻璃棒赶气泡,用镊子夹起小心放在手上(胶在上),用镊子将浸过转膜液的三层滤纸贴在胶上,倒置放在海绵上,再贴上三层滤纸。由下至上放置黑塑料板→一层海绵→三层滤纸→胶→nc膜→三层滤纸→一层海绵→透明塑料板,若不紧可用橡皮筋固定。
(3)正确安置电极后,将转膜槽放入冰浴中(通电前不要将胶长时间泡在转膜液中,以免蛋白质扩散分解),转移电流为恒流276ma,电压一般在140v(可以适当补充甲醇提高电压),具体转移时间根据所需要转移的蛋白质的分子量的大小决定,转移的蛋白质的分子量<100kda时时间为1h,>100kda时时间为1.5h。
5、免疫印迹显色(清洗镊子,装有双蒸水的盒子,牛奶,保鲜袋,卫生纸,一抗,冰盒,平板,透明胶,tbst,黑色塑料袋,二抗)
(1)封闭:转膜结束后小心地将nc膜用含5%脱脂奶粉的tbs封闭液于室温振荡封闭1h或4℃过夜,回收未与胶接触的滤纸。
(2)一抗孵育:取出nc膜,用1×tbs漂去膜表面残留的奶渍,用镊子夹着nc膜竖在卫生纸上除去多余的水,将nc膜marker一侧朝外置于保鲜袋中用卫生纸排水排气。加入一抗(可加入0.1%的吐温20降低背景)封口贴在平板上(有marker和蛋白的一面朝上),透明胶带不要压在目标条带上,于4℃孵育过夜。
(3)二抗孵育:次日从孵育袋中取出nc膜并回收一抗,用tbst缓冲液漂洗3×5分钟,用1×tbs漂去膜表面残留的盐离子,用镊子夹着nc膜竖在卫生纸上除去多余的水,将nc膜置于保鲜袋中用卫生纸排水排气。避光加入辣根过氧化物标记的羊抗兔或羊抗鼠的odyssey二抗(可加入0.1%的吐温20(tween20)降低背景),封口贴在平板上(有marker和蛋白的一面朝上),透明胶带不要压在目标条带上,于室温慢摇孵育约1小时后,从孵育袋中取出nc膜并回收二抗,用tbst缓冲液漂洗3×5分钟。漂洗完毕后,用1×tbs漂洗去掉膜表面残留的盐离子。
(4)显色:先用蘸有无水乙醇的擦镜纸将玻璃板擦干净。将nc膜marker侧朝上放置在玻璃板上,加入按说明书说明配置的ecl化学发光底物(beyoeclstar,p0018am)孵育约1分钟,然后用ecl显影仪器(上海勤翔科学仪器有限公司,chemiscope3300mini)拍摄照片。
(5)半定量分析:用imagej软件对获得的图像做灰度定量。
(6)统计分析:统计分析用graphpadprism软件完成。
图4是使用不同浓度的本发明提供的化合物c090019对细胞内tau蛋白进行降解的免疫印迹杂交结果(a)及半定量分析(b)。结果显示:0.1μm,0.5μm,1μm及5μm的该化合物能显著降低细胞tau蛋白的含量。图5是使用不同浓度的本发明提供的化合物c080019对细胞内tau蛋白进行降解的免疫印迹杂交结果(a)及半定量分析(b)。结果显示:0.5μm,1μm及5μm的该化合物能显著降低细胞tau蛋白的含量。图6是经皮下注射本发明提供的化合物c090019对小鼠大脑皮质及海马中tau蛋白含量的影响的免疫印迹杂交结果(a,c)及半定量分析(b,d)。结果显示:该小分子化合物c090019能显著降低小鼠大脑皮质及海马的tau蛋白的含量。
由此可见,本发明构建的针对tau蛋白的自噬靶向嵌合体化合物c090019或化合物c080019可降低细胞中的tau蛋白含量。因而本发明所述的利用自噬降解靶蛋白的靶向性蛋白降解方法能特异降解靶蛋白。
由于tau蛋白在细胞内异常聚集参与20多种神经退行性疾病,其聚积量与这些退行性疾病的神经变性和记忆障碍正相关。因此,降解tau蛋白即可达到预防或/和治疗tau-相关的神经退行性变性病,如阿尔茨海默病、连锁于17号染色体伴帕金森病的额颞叶痴呆、皮克氏病、进行性核上麻痹、皮质基底节变性、原发性年龄相关性tau病、嗜银颗粒病、老化相关tau星形胶质细胞病、慢性创伤性脑病、球形胶质细胞tau病变、帕金森病、亨廷顿病、脑卒中和癫痫。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
序列表
<110>上海强睿生物科技有限公司
<120>一种自噬靶向性蛋白降解技术及其应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>36
<212>prt
<213>humanp62proteinzzdomainsequence
<400>1
cysaspglycysasnglyprovalvalglythrargtyrlyscysser
151015
valcysproasptyraspleucysservalcysgluglylysglyleu
202530
hisargglyhis
35
- 还没有人留言评论。精彩留言会获得点赞!