一种玉米α-淀粉酶及其编码基因与应用的制作方法
本发明属于植物分子生物学和基因工程技术领域,具体涉及一种玉米α-淀粉酶及其编码基因在花粉育性控制中的应用,还涉及结合该α-淀粉酶对淀粉的水解功能以影响水稻等植物的雄性生育力的应用。通过利用现代生物技术,将其应用于杂交种子生产技术体系,既能保证制种质量,又可提高制种效率,还能有效防止转基因扩散。
背景技术:
杂交水稻育种是有效提高水稻产量和品质的主要途径。由于杂交技术的应用,使得增产、抗病、抗虫、抗旱、抗除草剂、耐涝、抗寒、耐盐和抗倒伏等各种性状的聚合都成为了可能。杂交技术的应用依赖于向母本提供花粉的父本,然后通过父本和母本的杂交方法获得杂交种。尽管水稻杂交优势利用是最为经济有效的提高水稻产量和品质的途径之一,但其仍然存在较多的限制因素,例如各种优势性状的聚合难度较大、杂交作物所占的比重较小等。虽然大部分的农作物都尽可能的利用杂种优势,但仍然存在巨大的潜力。
目前应用于水稻生产上的主要杂交育种技术有“三系法”和“两系法”。“三系法”由于受恢保关系的制约,限制了水稻种质资源的利用及强优势组合的选育;而“两系法”由于其不育系育性受环境条件因素的影响调控,在实际制种生产中隐藏着较大的风险。由此可见,传统的“三系法”和“两系法”均存在一定的技术缺陷,一定程度上限制了杂交水稻的进一步发展和推广应用,而雄性不育系资源是严重制约水稻杂交技术发展的关键因素。此外,“三系法”和“两系法”育种方法周期长、见效慢,难以满足生产发展的迫切需求。
为了解决“三系法”和“两系法”等繁殖雄性不育材料的问题,先后有众多科学家想通过利用分子设计方法来解决这一问题。1993年,plantgeneticsystem公司提出专利申请(williamsm,leemansj..maintenanceofmale-sterileplants.1993.patentno.wo93/25695.),即在雄性不育植株中转入连锁的育性恢复基因、花粉失活(败育)基因和用于筛选的标记基因,即可获得该不育系植株的保持系,然后通过自交实现不育系和保持系的繁殖。此外,2002年perez-prat等人提出通过在雄性不育的植株中转入连锁的育性恢复基因和筛选标记基因两套元件就可获得雄性不育植株的保持系,并进一步可繁育成不育系(perez-prat,e.,andvanlookerencampagne,m.m..hybridseedproductionandthechallengeofpropagatingmale-sterileplants.trendsplantsci.2002.7,199-203.)。这些构想的提出为精确利用分子生物学技术开展作物分子杂交育种提供了新的思路。当前有很多研究表明其它功能基因也可能通过生物技术方法构建转基因雄性不育植株,然而,近年来随着转基因作物的种类和种植面积的不断增加,转基因安全问题也受到越来越多人的关注和重视。转基因植物中携带的外源基因可通过天然杂交的方式整合到非转基因品种或其它野生近缘种中,从而造成转基因安全问题。在杂交亲和的植物种类之间,花粉介导的基因漂移是不可避免的。
植物的雄性不育主要表现在花粉败育,它涉及雄性器官缺失、造孢细胞异常、减数分裂异常、胼胝质代谢异常、绒毡层发育异常、花粉壁发育异常、花药开裂异常和花粉萌发失败等各个过程。因此,了解花粉发育的全过程和分子机理是研究植物雄性不育的基础和关键所在。花粉的发育过程较为复杂,它涉及到许多基因的表达调控,其中在花粉发育后期,淀粉能为花粉的萌发和花粉管的延伸储备能量。因此,当花粉粒中的淀粉提前被α-淀粉酶降解,使得花粉粒能量来源被瓦解,最终遏制花粉的生长,出现畸形花粉粒,导致植物雄性不育。
淀粉酶可以水解淀粉,主要分布在动植物、细菌和真菌中,人们通过利用生物技术,已经克隆出了各种淀粉酶基因(崔锦,马向东(2009)淀粉酶基因的多样性.郑州牧业工程高等专科学校学报,29(2):21-23),同时对淀粉酶的多样性进行了相关研究。研究表明,淀粉酶基因除了在来源多样性外,其基因结构和功能方面皆呈现多样性。淀粉酶可分为α-淀粉酶、β-淀粉酶和λ-淀粉酶,其中α-淀粉酶属于内切葡萄糖苷酶,可以从淀粉链内部随机切割α-1,4糖苷键,使淀粉水解成麦芽糖和葡萄糖等,并释放能量(morrisgp,beckpl,herridgems,etal.hapten-inducedmodelofchronicinflammationandulcerationintheratcolon[j].gastroenterology,1989,96(3):795-803)。因此,在成熟花粉中,适量的淀粉酶可水解淀粉,其所产生的能量可提供给花粉的正常发育以及花粉管的萌发和生长。然而,若在花粉形成过程中淀粉酶过表达或沉默表达,都会降低花粉能量代谢水平,导致淀粉积累量不足,从而产生败育花粉。已有研究报道,玉米α-淀粉酶基因与花粉发育后期特异性表达启动子重组,可使转基因植物表达α-淀粉酶,导致转基因花粉败育,从而有效降低花粉介导的基因漂移的风险(chang,z.,chen,z.,wang,n.,xie,g.,lu,j.,yan,w.,zhou,j.,tang,x.,anddeng,x.w..(2016).constructionofamalesterilitysystemforhybridricebreedingandseedproductionusinganuclearmalesterilitygene.procnatlacadsciusa.113,14145-14150.;zhang,d.,wu,s.,an,x.,xie,k.,dong,z.,zhou,y.,xu,l.,fang,w.,liu,s.,zhu,t.,li,j.,rao,l.,zhao,j.,andwan,x.(2017).constructionofamulti-controlsterilitysystemforamaizemale-sterilelineandhybridseedproductionbasedonthezmms7geneencodingaphd-fingertranscriptionfactor.plantbiotechnol.j.16,459-471.)。这些α-淀粉酶基因为水稻或玉米通过生物技术实现不育系转基因植株的获得,特别是在控制育性和转基因漂移等方面提供了新的选择。为利用上述技术,需要各种不同的α-淀粉酶基因,这些α-淀粉酶基因可来自玉米等禾本科植物,但相关研究还鲜少报道。
技术实现要素:
本发明的目的是提供一种玉米α-淀粉酶在导致花粉败育及制备转基因花粉败育植株中的应用,即来自玉米的一个新的α-淀粉酶基因,从而可有效避免转基因花粉的污染,以获得新的雄性不育系及其应用。
为实现上述目的,本发明提供了一种玉米α-淀粉酶,包括:
1)seqidno:1所示的核苷酸序列;或
2)在seqidno:1所示的核苷酸序列中经取代、缺失或添加一个或几个核苷酸且具有同等功能的由a)衍生的核苷酸序列;或
3)在严格条件下与seqidno:1所示序列杂交且可表达相同功能蛋白质的核苷酸序列;或
4)与1)、2)或3)的核苷酸序列具有90%以上同源性且可表达相同功能蛋白质的核苷酸序列。
本发明还提供与玉米α-淀粉酶核苷酸序列互补的dna分子。本领域技术人能够容易鉴定并利用与玉米花粉败育基因α-淀粉酶核苷酸序列互补的dna分子,因此,在严格条件下与本发明的花粉败育基因α-淀粉酶序列或其片段杂交的序列包括在本发明中。其中,所述核苷酸序列互补,是指在严格条件下能与α-淀粉酶的dna序列杂交。
所述的严格条件是指探针与其靶序列杂交至可探测程度超过与其它序列杂交的条件。严格条件具有序列依赖性,且会因环境的不同而有所改变。通过严格控制杂交或洗涤条件,可鉴定出与探针100%互补的靶序列。可通过选择性的调节严格条件以允许存在一些序列错配,从而可探测到较低程度的相似性。
通常的,严格条件是在ph值7.0-8.3下盐浓度低于大约1.5m钠离子,典型的大约0.01-1.0m钠离子浓度(或其它盐类),温度对短探针(如10-50个核苷酸)至少大约30℃,对长探针(如超过50个核苷酸)至少大约60℃。通过添加去稳定剂如甲酰胺也可获得严格条件。低严格条件,例如,包括在1mnacl、30-35%甲酰胺、l%sds(十二烷基磺酸钠)的缓冲溶液中37℃杂交,在1至2×ssc(20×ssc=3.0mnacl/0.3m柠檬酸三钠)中50-55℃洗涤。中度严格条件,例如,包括在1mnacl、40-45%甲酰胺、l%sds的缓冲溶液中37℃杂交,在0.5至1×ssc中55-60℃洗涤。高度严格条件,例如,包括在1mnacl、50%甲酰胺、l%sds的缓冲溶液中37℃杂交,在0.1×ssc中60-65℃洗涤。非必要的,洗涤缓冲液可含有大约0.1%-1%的sds。杂交时间大约4-12小时。
特别典型的是杂交后的洗涤,其中关键因素是最终洗涤溶液的离子强度和温度。对于dna-dna杂交体,tm=81.5℃+16.6(logm)+0.41(%gc)-0.61(%form)-500/l;其中tm是50%互补靶序列与完全配对探针杂交的温度(在规定的离子强度和ph下),m是单价阳离子的摩尔浓度,%gc是鸟嘌呤核苷酸和胞嘧啶核苷酸在dna中的百分比,%form是甲酰胺在杂交溶液中的百分比,l是杂交体在碱基对中的长度。tm降低大约l℃,错配就增加1%;因此,tm杂交或洗涤条件可被调节以与所需同一性的序列杂交。例如,如果探寻的序列具有≥85%的同一性,tm可以降低10℃。一般地,选择的严格条件是低于特定序列的热解链温度(tm)大约5℃,且其在规定的离子强度和ph下互补。但是,高度严格条件可以应用低于热解链温度(tm)1、2、3或4℃的杂交或洗涤;中度严格条件可以应用低于热解链温度(tm)6、7、8、9或10℃的杂交或洗涤;低度严格条件可以应用低于热解链温度(tm)11、12、13、14、15或20℃的杂交或洗涤。如果所需的错配程度使tm低于45℃(水溶液)或32℃(甲酰胺溶液),优选增加ssc浓度以能够使用较高的温度。核酸杂交的指南见于tijssen(1993)生物化学和分子生物学实验室技术一用核酸探针杂交,第i部分,第2章(elsevier,newyork);和ausubel等人编辑(1995)分子生物学现代方法第2章(greenepublishingandwiley-interscience,newyork)。见sambrook等人(1989)分子克隆:实验室手册(第二版,coldspringharborlaboratorypress,plainview,newyork)。
所述严格条件优选为在0.5%sds(十二烷基磺酸钠)、6×ssc(柠檬酸钠)的溶液中,在65℃下杂交,然后用2×ssc、0.1%sds和1×ssc、0.1%sds各洗膜1次。
此外,本发明所述的玉米α-淀粉酶的氨基酸序列为:
1)由seqidno:2所示的氨基酸序列组成的蛋白质;或
2)将seqidno:2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加由seqidno:2衍生的且保持seqidno:2所示的蛋白功能的蛋白。
本发明中氨基酸序列的取代、缺失或添加是本领域的常规技术,优选这种氨基酸变化为:小的特性改变,即不显著影响蛋白的折叠和/或活性的保守氨基酸取代;小的缺失,通常约1-30个氨基酸的缺失;小的氨基或羧基端延伸,例如氨基端延伸一个甲硫氨酸残基;小的连接肽,例如约20-25个残基长。
保守取代的实例是在下列氨基酸组内发生的取代:碱性氨基酸(如精氨酸、赖氨酸和组氨酸)、酸性氨基酸(如谷氨酸和天冬氨酸)、极性氨基酸(如谷氨酰胺、天冬酰胺)、疏水性氨基酸(如亮氨酸、异亮氨酸和缬氨酸)、芳香氨基酸(如苯丙氨酸、色氨酸和酪氨酸),以及小分子氨基酸(如甘氨酸、丙氨酸、丝氨酸、苏氨酸和甲硫氨酸)。通常不改变特定活性的那些氨基酸取代在本领域内是众所周知的,并且已由,例如,n.neurath和r.l.hill在1979年纽约学术出版社(academicpress)出版的《protein》中进行了描述。最常见的互换有ala/ser,val/ile,asp/glu,thu/ser,ala/thr,ser/asn,ala/val,ser/gly,tyr/phe,ala/pro,lys/arg,asp/asn,leu/ile,leu/val,ala/glu和asp/gly,以及它们相反的互换。
对于本领域的技术人员而言显而易见地,这种取代可以在对分子功能起重要作用的区域之外发生,而且仍产生活性多肽。对于由本发明的多肽,其活性必需的并因此选择不被取代的氨基酸残基,可以根据本领域已知的方法,如定点诱变或丙氨酸扫描诱变进行鉴定(如参见,cunningham和wells,1989,science244:1081-1085)。后一技术是在分子中每一个带正电荷的残基处引入突变,检测所得突变分子的影响雄性生育力活性,从而确定对该分子活性而言重要的氨基酸残基。底物-酶相互作用位点也可以通过其三维结构的分析来测定,这种三维结构可由核磁共振分析、结晶学或光亲和标记等技术测定(参见,如devos等,1992,science255:306-312;smith等,1992,j.mol.biol224:899-904;wlodaver等,1992,febsletters309:59-64)。
因此,与seqidno:2所示的氨基酸序列具有一定同源性的氨基酸序列也包括在本发明中。这些序列与本发明序列类似性/相同性典型的大于60%,优选的大于75%,更优选的大于80%,甚至更优选的大于90%,并且可以大于95%。也可以根据更特定的相同性和/或类似性范围定义本发明的优选的多核苷酸和蛋白质。例如与本发明示例的序列有49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的相同性和/或类似性。
本发明提供了一种玉米α-淀粉酶在制备花粉败育转基因植株中的应用,所述的玉米α-淀粉酶的氨基酸序列为:
1)由seqidno:2所示的氨基酸序列组成的蛋白;或
2)将seqidno:2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加由seqidno:2衍生的且保持seqidno:2所示的蛋白功能的蛋白。
其中,玉米α-淀粉酶的编码基因具有:
1)seqidno:1所示的核苷酸序列;或
2)在seqidno:1所示的核苷酸序列中经取代、缺失或添加一个或几个核苷酸且具有同等功能的由1)衍生的核苷酸序列;或
3)在严格条件下与seqidno:1所示序列杂交且可表达相同功能蛋白质的核苷酸序列;或
4)与1)、2)或3)的核苷酸序列具有90%以上同源性且可表达相同功能蛋白质的核苷酸序列。
本发明提供了一种表达盒,其特征在于,包含在有效连接的调控序列调控下的玉米α-淀粉酶的基因,以调控水稻雄性生育力。
本发明中所述调控序列包括但不限于启动子、转运肽、终止子、增强子、前导序列、内含子以及其它可操作地连接到所述影响雄性生育力的基因的调节序列。
具体地,所述调控序列含造粉体蛋白转导肽和花粉发育后期特异性表达启动子。更具体地,所述的含造粉体蛋白转导肽为bt1(tp)信号肽,其核苷酸序列如seqidno:3所示;所述的花粉发育后期特异性表达启动子为pg47启动子,其核苷酸序列如seqidno:4所示。
本发明提供一种包含上述玉米α-淀粉酶的基因或表达盒的dna构建体,以及包含该dna构建体的重组表达载体。
本发明含有上述的玉米α-淀粉酶的重组表达载体可通过农杆菌介导法或基因枪法法等常规生物学方法转化水稻细胞或愈伤组织获得独立的转基因细胞或组织,从而获得水稻雄性不育的转基因株系。
所述转基因水稻为外源基因在花粉后期特异表达的转基因水稻,优选为授粉/受精能力增强/削弱的转基因植物,更优选为雄性不育转基因水稻。
本发明提供了上述玉米α-淀粉酶或其编码基因或含有该编码基因的生物材料在降解植物花粉中淀粉的方法。
本发明提供了上述玉米α-淀粉酶或其编码基因或含有该编码基因的生物材料在调控水稻花粉发育的方法。所述的调控是降解水稻花粉中淀粉酶或诱导水稻雄性不育。
本发明提供了上述玉米α-淀粉酶或其编码基因或含有该编码基因的生物材料在诱导水稻雄性不育的方法,以产生部分雄性不育植物。所示的植物为禾本科植物。
本发明提供了上述玉米α-淀粉酶或其编码基因或含有该编码基因的生物材料在影响水稻雄性生育力的方法,以产生部分雄性不育水稻。
本发明提供了上述玉米α-淀粉酶或其编码基因或含有该编码基因的生物材料在阻断植物花粉中外源基因扩散的方法,其特征在于,将含有上述玉米α-淀粉酶基因的表达盒转化植物愈伤组织,将转化后的愈伤组织进行诱导分化和生根培养来获得转基因花粉败育的转基因植物,使转基因植物花粉无法正常授粉,进而降解植物中外源基因扩散。
将本发明中所述构建体或所述重组载体导入植物,常规转化方法包括但不限于,农杆菌介导的转化、微量发射轰击、直接将dna摄入原生质体、电穿孔或晶须硅介导的dna导入。
本发明中所述的将核苷酸序列“引入”植株时,其表示可通过直接转化的方法发生,所述方法例如对植物组织的农杆菌介导的转化、微粒发射轰击、电穿孔等;或者可通过将具有异源核苷酸序列的植株与另一植株杂交来进行,使得后代具有并入它们基因组的核苷酸序列。此类育种技术是本领域技术人员公知的。
所述的玉米α-淀粉酶的基因序列为:
1)seqidno:1所示的核苷酸序列;或
2)在seqidno:1所示的核苷酸序列中经取代、缺失或添加一个或几个核苷酸且具有同等功能的由1)衍生的核苷酸序列;或
3)在严格条件下与seqidno:1所示序列杂交且可表达相同功能蛋白质的核苷酸序列;或
4)与1)、2)或3)的核苷酸序列具有90%以上同源性且可表达相同功能蛋白质的核苷酸序列。
所述植物为禾本科植物。优选的,所述植物包括但不限于水稻、玉米、高粱、大麦、小麦、大豆、棉花、向日葵。
本发明的提供一种玉米α-淀粉酶在花粉育性控制中的应用,具有以下优点:
1)植物α-淀粉酶作为花粉败育基因可来自水稻、玉米、高粱、大麦、小麦等,其中来自玉米α-淀粉酶对水稻基因工程有利,对玉米的基因工程更是影响巨大。
2)玉米α-淀粉酶花粉碘染实验表明,α-淀粉酶zm-aa2基因能在花粉发育后期特异性表达启动子pg47的驱动下,精确地作用于水稻花粉粒中的淀粉,最终使得可育花粉和败育花粉的比例为1:1。
3)本发明的玉米α-淀粉酶基因在花粉发育后期特异性表达基因启动子pg47和造粉体蛋白转运肽bt1(tp)的调控下,可有效控制转基因的扩散;可用于水稻保持系的保持和不育系的扩繁,并可在杂交制种过程中省去人工去雄步骤,具有广阔的应用前景。
4)本明为获得转基因雄性不育植株提供了一种新的方法。
附图说明
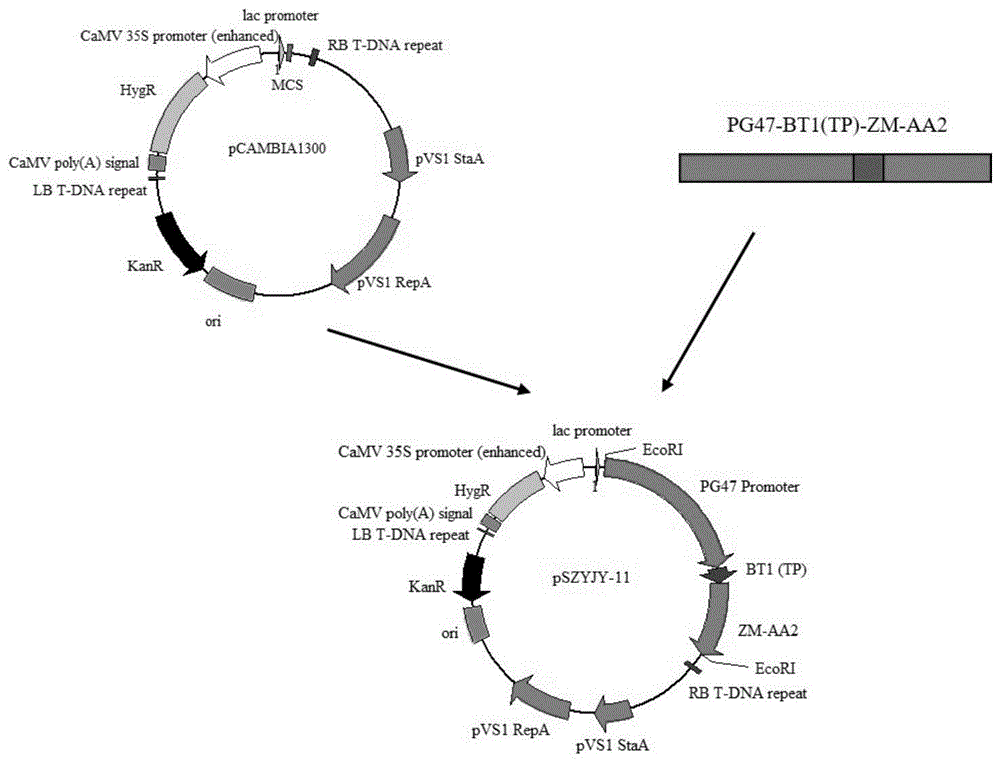
图1为α-淀粉酶基因zm-aa2的重组表达载体pszyjy-11的构建流程图。
图2为含重组表达载体pszyjy-11的转基因水稻阳性植株的生长表型图,其中,左图为野生型对照,右图为转基因水稻,标尺为10cm。
图3为含重组表达载体pszyjy-11的转基因水稻的花药表型图,其中,左图为野生型对照,右图为转基因水稻,标尺为1mm。
图4为含重组表达载体pszyjy-11的转基因水稻的花粉碘染图,其中,左图为野生型对照,右图是转基因水稻,白色箭头指示约半数花粉因败育被染成黄褐色,黑色箭头指示约半数花粉因可育被染成黑蓝色,标尺为100μm。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。在没有违背本发明精神和实质的情况下,对本发明中采用的方法、步骤或条件所作出的修改或替换,均属于本发明的范围。若未特别指明,实施例中所用的各种技术手段为本领域技术人员所通用的常规手段。
实施例1、玉米α-淀粉酶基因zm-aa2的获取
1、玉米rna的提取
利用trizolreagent方法提取野生型玉米b73材料的rna:称取玉米叶片放入液氮中,取出后用研钵磨成粉末,然后加入1mltrizolreagent(transgenbiotech),剧烈震荡均匀,接着加入0.2ml氯仿,剧烈震荡15s,室温静置3min;12000rmp4℃离心15min;从离心机中小心取出离心管,吸取0.6ml上清液转移至另一新的离心管中;向上清中加入等体积的异丙醇,上下颠倒离心管充分混匀后,在室温下静置10min;12000rmp4℃离心10min;弃上清,管底出现白色胶状沉淀,加1ml75%乙醇(用灭菌后depc水配置)洗涤,剧烈涡旋,10000rmp4℃离心5min;弃上清、室温晾干沉淀(沉淀变为无色透明状);加50ulrnase-free水溶解沉淀,55℃-60℃孵育10min,置于-70℃保存。
2、玉米cdna的获得
以玉米叶片rna为模板,利用primescriptrtreagentkit(drr047a,takara)试剂盒进行逆转录,具体方法如下:
(1)去gdna
5×gdnaeraserbuffer2ul
gdnaeraser1ul
rna1ug
加rnasefreeh2o补齐至10ul
42℃,2min。
(2)逆转录
加rnasefreeh2o补齐至20ul
37℃,2min;85℃,5s。
(3)获得玉米的cdna分装保存于-20℃。
注:所有实验用品均为rnase-free。
3、玉米α-淀粉酶基因zm-aa2的获取
通过ncbi数据库获得玉米的α-淀粉酶基因zm-aa2(grmzm2g103055)的核苷酸序列(seqidno:1所示)和氨基酸序列(seqidno:2所示)。zm-aa2核苷酸序列是通过设计引物序列(seqidno:5-6所示),以玉米叶片的cdna为模板pcr克隆获得,pcr产物长度为1287bp,产物测序后序列与seqidno:1一致。引物设计使用primerpremier5软件设计,扩增体系及程序如下:
加ddh2o补齐至50ul
pcr程序:预变性94℃3min;变性98℃30s,退火55-65℃30s,延伸72℃2min,30个循环;延伸72℃10min。
实施例2、pg47启动子和bt1转运肽基因的获取
pg47启动子(seqidno:4所示)和bt1转运肽的基因序列(seqidno:3所示)通过pcr从pzhen18b载体质粒(chang,z.,chen,z.,wang,n.,xie,g.,lu,j.,yan,w.,zhou,j.,tang,x.,anddeng,x.w..constructionofamalesterilitysystemforhybridricebreedingandseedproductionusinganuclearmalesterilitygene.procnatlacadsciusa.2016.113,14145-14150.)中扩增而来。其中pg47启动子扩增所需引物如序列表中seqidno:7-8所示,正向引物带有ecori酶切位点和10bp载体骨架序列,反向引物含有10bp的bt1基因的5’端序列;bt1基因扩增所需引物如序列表中seqidno:9-10所示,其中正向引物带有10bp的pg47的3’端序列,反向引物带有10bp的zm-aa2的5’端序列。扩增后得到序列长度为2783bp的启动子pg47和序列长度为225bp的bt1转运肽的核苷酸序列。引物设计使用primerpremier5软件设计,引物上酶切位点左侧的10个碱基为骨架载体重组片段,用于连接载体时进行同源重组连接,扩增体系及程序如下:
加ddh2o补齐至50ul
pcr程序:预变性94℃3min;变性98℃30s,退火55-65℃30s,延伸72℃3min,30个循环;延伸72℃10min。
实施例3、含玉米α-淀粉酶基因zm-aa2的重组表达载体pszyjy-11的构建
1、获取zm-aa2基因片段
用seqidno:11-12扩增zm-aa2片段。其中正向引物带有10bp的bt1基因的3’端序列,反向引物带有ecori酶切位点和10bp的载体骨架序列,引物上酶切位点左侧的10个碱基为骨架载体重组片段,用于连接载体时进行同源重组连接,扩增体系如下:
加ddh2o补齐至50ul
pcr程序:预变性94℃3min;变性98℃30s,退火55-65℃30s,延伸72℃2min,30个循环;延伸72℃10min。扩增产物zm-aa2拼接片段利用1%琼脂糖凝胶电泳回收到1200bp左右产物。
2、获取bt1-zmaa2融合片段
用seqidno:9和12引物扩增bt1-zm-aa2融合片段,扩增体系如下:
加ddh2o补齐至50ul
pcr程序:预变性94℃3min;变性98℃30s,退火55-65℃30s,延伸72℃2min,30个循环;延伸72℃10min。扩增产物bt1-zm-aa2拼接片段利用1%琼脂糖凝胶电泳回收到1500bp左右产物。
3、获取pg47-bt1-zmaa2融合片段
用seqidno:7和12引物扩增pg47-bt1-zm-aa2融合片段,扩增体系如下:
加ddh2o补齐至50ul
pcr程序:预变性94℃3min;变性98℃30s,退火55-65℃30s,延伸72℃5min,30个循环;延伸72℃10min。扩增产物pg47-bt1-zm-aa2拼接片段利用1%琼脂糖凝胶电泳回收到4500bp左右产物。
4、构建水稻重组表达载体pszyjy-11
构建流程如图1所示,将实施例3中扩增产物融合片段pg47-bt1-zm-aa2插入pcambia1300载体的ecori酶切位点。其中实施例3中经引物seqidno:7和12扩增后利用1%琼脂糖凝胶电泳回收到4500bp左右产物。同时用ecori单酶切pcambia1300载体,回收线性酶切载体。最后将pg47-bt1-zm-aa2融合片段连接到pcambia1300载体中,连接体系如下:
pg47-bt1-zm-aa2pcr产物(50ng)2ul
酶切pcambia1300载体产物(50ng)2ul
5xin-fusionhdenzymepremix(takara)1ul
50℃连接20min。
将上述全部连接产物热激转化至大肠杆菌感受态细胞,挑选阳性克隆测序,并将测序正确的阳性克隆命名为pszyjy-11。
实施例4、转基因水稻植株的获得
将pszyjy-11质粒经2.5kv电击转化至农杆菌感受态agl0中,并在含有卡那霉素和利福平的yeb培养板上28℃培养,用pszyjy-11载体特异性引物seqidno:13-14经pcr验证并挑选阳性克隆。
将上述获得的农杆菌阳性克隆进行培养,并通过农杆菌介导的遗传转化法侵染水稻武运粳7(hieiy,ohtas,komarit,kumashirot.(1994).efficienttransformationofrice(oryzasatival.)mediatedbyagrobacteriumandsequenceanalysisoftheboundariesofthet-dna.theplantjournal.6:271-282)。经共培养、筛选、分化、生根等环节获取t0代转基因幼苗,提取dna,经pcr验证后获得含pszyjy-11质粒的转基因阳性植株,自交结实获得t1代,取t1代植株进行后续分析。
实施例5、转基因植株表型观察和花粉碘化钾染色分析
1、转基因水稻表型观察
如图2和3所示,含pszyjy-11质粒的t1代转基因阳性植株的生长表型和花药形态与野生型无明显差异。
2、花粉碘化钾染色分析
配制碘化钾染色液溶液:取2gki溶于5-10ml蒸馏水中,然后加入用适量的无水乙醇溶解的1gi2,待全部溶解后,再加蒸馏水定容至600ml,贮于棕色瓶中备用。
对水稻转基因植株的成熟花粉进行镜检,并对花粉粒育性进行分析,具体方法如下:
a、花粉采集:取充分成熟将要开花的花药,剥除颖壳,取出花药;
b、镜检:取100ul的碘化钾染色液置于载玻片上,再将花药置于载玻片上,用镊子将花药充分捣碎以利于花粉粒释放,盖上盖玻片,置于低倍显微镜下观察。染色后呈黑蓝色的花粉粒为可育花粉粒,呈黄褐色的为败育花粉粒。
转基因植株的花粉粒经碘化钾染色分析和花粉粒碘染结果(如图4所示)表明:可育花粉与败育花粉符合1:1的分离比例,即约50%花粉表现为雄性不育,不能染成黑蓝色,而约50%花粉可染成黑蓝色;而野生型(或其它不携带花粉败育基因的转基因植株)则是完全雄性可育的,即100%花粉可被成黑蓝色。结果说明,玉米α-淀粉酶基因zm-aa2能在水稻花粉中降解淀粉,因此导致花粉粒在发育过程中因缺少淀粉而能量供给不足,从而引起花粉败育。由此证明α-淀粉酶基因能够降解花粉粒中的淀粉,造成水稻转基因花粉不育,有效阻止转基因作物通过花粉将转基因元件传播给其他野生作物品种。
综上所述,本发明所披露的影响水稻雄性生育力的蛋白质α-淀粉酶来源于普通野生型玉米b73材料,并且能够降解花粉粒中的淀粉,造成水稻转基因花粉不育,准确性高,有效阻止转基因作物通过花粉将转基因元件传播给其他野生作物品种,可用于保持雄性不育植株的纯合隐性状态;同时省去了杂交制种过程中去雄的步骤。
序列表
<110>深圳市作物分子设计育种研究院
深圳广三系农业科技有限公司
<120>一种玉米α-淀粉酶及其编码基因与应用
<160>14
<170>siposequencelisting1.0
<210>1
<211>1287
<212>dna
<213>玉米(zeamays)
<400>1
atggcgaacaggggcttgcatctggctctgttcctcgtccttctcgggctgtcgtccaat60
ttggcagccgggcagatcctgttccagggcttcaactgggagtcgtggaagcagaacggg120
ggatggtacaacttcctgatgggcaaggtggacgacatcgccgaggccggcatcacgcac180
gtctggctccctccggcgtcacactctctcgccgagcaaggctacctgccggggcgcctg240
tacgaccttgacgcgtccaagtacggcaacgaggcgcagctcaagtccctgatcgaggcg300
ttccacagcaagggcgtgaaggtcatcgccgacatcgtcatcaaccaccgcacggcggag360
caccaggacggccgcggcatctactgcatcttcgagggcggcacgccggactcccgcctc420
gactggggcccccacatgatctgcagcgacgacagggcgtactccgacggcacggggaac480
cccgacaccggcgccgacttcggcggcgcgccggacatcgaccacctgaacccgcgcgtc540
cagcaggagctcaccggctggctcaactggctcaagacggacgtcggcttcgacgcgtgg600
cgcctcgacttcgccaagggctactccgccgacgtcgccaaggtctacatcgacggcacc660
cagccctgcttcgccgtcgccgagatatggacctcgctggcctacggcggcgacggcaag720
cccttctacgaccagaacgcgcaccggcaggagctggtgagctggctggaccgcgtcggc780
ggcaaggccagcccggccaccacgttcgacttcaccaccaagggcatcctcaacgtggcc840
gtcgacggcgagctgtggcggctgcgcggcgctgacggcaaggcacccggtttgatcggg900
tggtggccggccaaggccgtcaccttcgtcgacaaccacgacactggctccacgcagcac960
atgtggccgttccccgccgacaaggtcatgcagggctacgcctacatcctcacgcacccc1020
gggaacccatccatcttctacgatcacttcttcgactggggcctcaagaacgagatcgcg1080
cacctggtgtccatcagggaccgccacgggatccaggcggacagtgagctgcgcatcatc1140
gaggccgacgccgacctctacctcgctgagatcgacggcaaggtcatcgtgaagattgga1200
tcaagatacgactgcgggcacctcatcccagaaggcttccaggtcgtggcgcacggagat1260
ggctatgccgtctgggagaaaaactga1287
<210>2
<211>428
<212>prt
<213>玉米(zeamays)
<400>2
metalaasnargglyleuhisleualaleupheleuvalleuleugly
151015
leuserserasnleualaalaglyglnileleupheglnglypheasn
202530
trpglusertrplysglnasnglyglytrptyrasnpheleumetgly
354045
lysvalaspaspilealaglualaglyilethrhisvaltrpleupro
505560
proalaserhisserleualagluglnglytyrleuproglyargleu
65707580
tyraspleuaspalaserlystyrglyasnglualaglnleulysser
859095
leuileglualaphehisserlysglyvallysvalilealaaspile
100105110
valileasnhisargthralagluhisglnaspglyargglyiletyr
115120125
cysilephegluglyglythrproaspserargleuasptrpglypro
130135140
hismetilecysseraspaspargalatyrseraspglythrglyasn
145150155160
proaspthrglyalaasppheglyglyalaproaspileasphisleu
165170175
asnproargvalglnglngluleuthrglytrpleuasntrpleulys
180185190
thraspvalglypheaspalatrpargleuaspphealalysglytyr
195200205
seralaaspvalalalysvaltyrileaspglythrglnprocysphe
210215220
alavalalagluiletrpthrserleualatyrglyglyaspglylys
225230235240
prophetyraspglnasnalahisargglngluleuvalsertrpleu
245250255
aspargvalglyglylysalaserproalathrthrpheaspphethr
260265270
thrlysglyileleuasnvalalavalaspglygluleutrpargleu
275280285
argglyalaaspglylysalaproglyleuileglytrptrpproala
290295300
lysalavalthrphevalaspasnhisaspthrglyserthrglnhis
305310315320
mettrppropheproalaasplysvalmetglnglytyralatyrile
325330335
leuthrhisproglyasnproserilephetyrasphisphepheasp
340345350
trpglyleulysasngluilealahisleuvalserileargasparg
355360365
hisglyileglnalaaspsergluleuargileileglualaaspala
370375380
aspleutyrleualagluileaspglylysvalilevallysilegly
385390395400
serargtyraspcysglyhisleuileprogluglypheglnvalval
405410415
alahisglyaspglytyralavaltrpglulysasn
420425
<210>3
<211>225
<212>dna
<213>玉米(zeamays)
<400>3
atggcggcgacaatggcagtgacgacgatggtgacgaggagcaaggagagctggtcgtca60
ttgcaggtcccggcggtggcattcccttggaagccacgaggtggcaagaccggcggcctc120
gagttccctcgccgggcgatgttcgccagcgtcggcctcaacgtgtgcccgggcgtcccg180
gcggggcgcgacccgcgggagcccgatcccaaggtcgtccgggcg225
<210>4
<211>2783
<212>dna
<213>玉米(zeamays)
<400>4
agcttgcatgcctgcaggtcgactctagaggatctgcaccggacactgtctggtggcata60
ccagacagtccggtgtgccagatcagggcacccttcggttcctttgctcctttgcttttg120
aaccctaactttgatcgtttattggtttgtgttgaacctttatgcacctgtggaatatat180
aatctagaacaaactagttagtccaatcatttgtgttgggcattcaaccaccaaaattat240
ttataggaaaaggttaaaccttatttccctttcaatctccccctttttggtgattgatgc300
caacacaaaccaaagaaaatatataagtgcagaattgaactagtttgcataaggtaagtg360
cataggttacttagaattaaatcaatttatacttttacttgatatgcatggttgctttct420
tttattttaacattttggaccacatttgcaccacttgttttgttttttgcaaatcttttt480
ggaaattctttttcaaagtcttttgcaaatagtcaaaggtatatgaataagattgtaaga540
agcattttcaagatttgaaatttctccccctgtttcaaatgcttttcctttgactaaaca600
aaactccccctgaataaaattctcctcttagctttcaagagggttttaaatagatatcaa660
ttggaaatatatttagatgctaattttgaaaatataccaattgaaaatcaacataccaat720
ttgaaattaaacataccaatttaaaaaatttcaaaaagtggtggtgcggtccttttgctt780
tgggcttaatatttctccccctttggcattaatcgccaaaaacggagactttgtgagcca840
tttatactttctccccattggtaaatgaaatatgagtgaaagattataccaaatttggac900
agtgatgcggagtgacggcgaaggataaacgataccgttagagtggagtggaagccttgt960
cttcgccgaagactccatttccctttcaatctacgacttagcatagaaatacacttgaaa1020
acacattagtcgtagccacgaaagagatatgatcaaaggtatacaaatgagctatgtgtg1080
taatgtttcaatcaaagtttcgagaatcaagaatatttagctcattcctaagtttgctaa1140
aggttttatcatctaatggtttggtaaagatatcgactaattgttctttggtgctaacat1200
aagcaatctcgatatcacccctttgttggtgatccctcaaaaagtgataccgaatgtcta1260
tgtgcttagtgcggctgtgttcaacgggattatccgccatgcagatagcactctcattgt1320
cacataggagagggactttgctcaatttgtagccatagtccctaaggttttgcctcatcc1380
aaagtaattgcacacaacaatgtcctgcggcaatatacttggcttcggcggtagaaagag1440
ctattgagttttgtttctttgaagtccaagacaccagggatctccctagaaactgacaag1500
tccctgatgtgctcttcctatcaattttacaccctgcccaatcggcatctgaatatccta1560
ttaaatcaaaggtggatcccttggggtaccaaagaccaaatttaggagtgtaaactaaat1620
atctcatgattcttttcacggccctaaggtgaacttccttaggatcggcttggaatcttg1680
cacacatgcatatagaaagcatactatctggtcgagatgcacataaatagagtaaagatc1740
ctatcatcgaccggtataccttttggtctacggatttacctcccgtgtcgaggtcgagat1800
gcccattagttcccatgggtgtcctgatgggcttggcatccttcattccaaacttgttga1860
gtatgtcttgaatgtactttgtttggctgatgaaggtgccatcttggagttgcttgactt1920
gaaatcctagaaaatatttcaacttccccatcatagacatctcgaatttcggaatcatga1980
tcctactaaactcttcacaagtagatttgttagtagacccaaatataatatcatcaacat2040
aaatttggcatacaaacaaaacttttgaaatggttttagtaaagagagtaggatcggctt2100
tactgactctgaagccattagtgataagaaaatctcttaggcattcataccatgctgttg2160
gggcttgcttgagcccataaagcgcctttgagagtttataaacatggttagggtactcac2220
tatcttcaaagccgagaggttgctcaacatagacctattcaccccatttgatcacttttt2280
tggtccttcaggatctaatagttatgtataatttagagtctcttgtttaatggccagata2340
tttctaattaatctaagaatttatgatattttttaattttttatcatgtctgatgagaat2400
taacataaaggctcaattgggtcctgaattaataatagagtgaaaattaatccagaggct2460
ctattagaaccttcaattagtaataccaagatatatataagatagtagagtatagtttaa2520
atgttggcattgttcattctttcttttgttatttaatttatgctttccacggtggttagt2580
ggttacttctgaagggtccaaataatgcatgaagagtttgaggacaagaagtctgcccta2640
aaaatagcgatgcaaaggcatggtgtccaagccatacatatagcgcactaattttatcag2700
cagaacaatggtatttataggtcctagtgcccaggcaacaagagacacgaataaagcatc2760
gatcacgacacgaattccggaac2783
<210>5
<211>23
<212>dna
<213>人工合成(artificialsynthesized)
<400>5
atggcgaacaggggcttgcatct23
<210>6
<211>23
<212>dna
<213>人工合成(artificialsynthesized)
<400>6
tcagtttttctcccagacggcat23
<210>7
<211>41
<212>dna
<213>人工合成(artificialsynthesized)
<400>7
ccatgattacgaattcagcttgcatgcctgcaggtcgactc41
<210>8
<211>35
<212>dna
<213>人工合成(artificialsynthesized)
<400>8
tcgccgccatggtgtcgtgatcgatgctttattcg35
<210>9
<211>35
<212>dna
<213>人工合成(artificialsynthesized)
<400>9
tcacgacaccatggcggcgacaatggcagtgacga35
<210>10
<211>35
<212>dna
<213>人工合成(artificialsynthesized)
<400>10
ccaaattggacgcccggacgaccttgggatcgggc35
<210>11
<211>35
<212>dna
<213>人工合成(artificialsynthesized)
<400>11
cgtccgggcgtccaatttggcagccgggcagatcc35
<210>12
<211>41
<212>dna
<213>人工合成(artificialsynthesized)
<400>12
taccgagctcgaattctcagtttttctcccagacggcatag41
<210>13
<211>18
<212>dna
<213>人工合成(artificialsynthesized)
<400>13
cagcgtctccgacctgat18
<210>14
<211>18
<212>dna
<213>人工合成(artificialsynthesized)
<400>14
cttctgcgggcgatttgt18
- 还没有人留言评论。精彩留言会获得点赞!