一种利用微液滴催化芦丁产异槲皮苷的酶催化反应体系的制作方法
本发明属于生物化工领域,具体涉及一种利用微液滴催化芦丁产异槲皮苷的酶催化反应体系。
背景技术:
微液滴是指两种互不相融的液体所形成直径在微米或纳米级的液滴。它利用流体剪切力和表面张力之间的相互作用将连续的液体分离成微型液滴(微纳电子技术,2016,53:108-113.)。微液滴技术具有许多优点,微液滴可作为一个小体积的反应体系,将反应物料包封在微滴内,可显著加快混合的速率和物质之间的反应;反应时间可控,液滴尺寸也可精确控制,同时微液滴芯片可重复使用(chemicalengineeringscience,2016,169:273-283)。此外,液滴反应器提供的匀质效应可大大提高反应效率,如微液滴可将常规反应器中仅60%的水解反应效率提高至100%(chempluschem,2016,81:629-636),显示了微液滴系统应用于酶催化反应的巨大优势。
芦丁(rutin),能够为α-l-鼠李糖苷酶催化转化为异槲皮苷和l-鼠李糖(现代食品科技,2015(1):107-114.)。异槲皮苷属黄酮类化合物,具有抗氧化、抗肿瘤、抗抑郁、降压、降脂等众多药理作用(海峡药学,2015:223-225),临床上用于治疗心肌缺血、缺氧等,国际上将其加工成食品添加剂和辅助药物,可作为药物有效成分而直接用于药物生产,比前体物芦丁(含量5~20%)具有更强的抗氧化性和抗癌活性(biotech,2016,6:3),更是合成新型食品着色剂emiq(enzymaticallymodifiedisoquercitrin)的中间体(neurochemistryinternational,2010,57:713-721),作用效果显著,应用面广。
自然界中的鼠李糖苷酶有α-l-鼠李糖苷酶和β-l-鼠李糖苷酶两类(中国酿造,2010,29:11-15)。截至目前,由于条件限制,α-l-鼠李糖苷酶尚未进行规模化生产,导致纯酶价格偏高,酶的应用发展受到制约。hfm-rha78是从健康人体粪便宏基因组dna中获得的新型细菌源α-l-鼠李糖苷酶基因,在37℃下随酶浓度增加芦丁转化率增大,作用10h时芦丁转化率为41.8%(中国生物化学与分子生物学报,2018,34(12))。
重组菌株表达的α-l-鼠李糖苷酶比野生菌株更有利于芦丁催化为异槲皮苷的定向反应(江苏科技大学,2017)。酶法催化合成异槲皮苷存在一大问题,芦丁及其水解产物异槲皮苷和槲皮素均具有强抗氧化性,受热不稳定,长时间会导致氧化或其他反应物生成。因此,一个封闭体系用于α-l-鼠李糖苷酶催化芦丁生成异槲皮苷,有望解决产物、底物不稳定、容易被氧化等技术瓶颈。
技术实现要素:
本发明针对水解芦丁的生物催化剂α-l-鼠李糖苷酶来源稀少且价格昂贵,造成了生产异槲皮苷的成本过高的问题,提供了一种利用微液滴催化芦丁产异槲皮苷的酶催化反应体系,该酶催化反应体系反应条件温和、底物选择性强、环境友好,可处理仅有少量液体的全新技术,提高胞内酶与底物接触几率。
一种利用微液滴催化芦丁产异槲皮苷的酶催化反应体系,所述酶催化反应体系通过以下步骤构建:
步骤1,构建重组菌株e.colibl21(de3)-pet21a-rhab1,培养并诱导表达,诱导表达结束后,离心使得细胞破碎,取上清液,即粗酶液备用;
步骤2,用ph4.0~8.0的pbs缓冲液配制浓度为0.01~1g/l的芦丁溶液,再取浓度为30.00u/mg的粗酶液,等体积混合得微液滴形成所需水相即分散相,粘度为5cs的聚二甲基硅氧烷甲基硅油作为微液滴形成所需油相即连续相;
步骤3,应用微液滴芯片,选取分散相压力为25~200mbar,连续相压力为25~200mbar,操作微液滴形成装置形成微液滴,待液滴稳定、均一后,收集于密封ptfe中进行酶催化反应,待反应结束后,用恒流泵冲洗出来产物异槲皮苷,并进行含量检测。
作为改进的是,所述微液滴芯片的选型为流动聚焦型芯片。
进一步改进的是,所述流动聚焦型芯片的长22.5mm,宽15.0mm,厚度4.0mm,两相交融处,两相微通道内径均为250μm,交融处后部分内径400μm。
作为改进的是,分散相压力为125mbar,连续相压力为150mbar,调控制备液滴,稳定后收集于密封ptfe导管。
作为改进的是,步骤3中酶催化反应的反应温度为25~60℃;反应ph为4.0~8.0;反应时间为0.1~5h。
有益效果:
本发明采用微液滴技术,运用流动聚焦型芯片,其反应条件温和、底物选择性强、环境友好,可处理仅有少量液体的全新技术,提高胞内酶与底物接触几率。相对于传统的酶催化反应的时空效率低、酶用量大且过程难以放大,造成成本高,产物率低的现象,采用微液滴技术,有助于解决上述问题,从而扩大微液滴酶催化反应体系的应用范围。并且利用ptfe导管收集时,增加导管长度收集液滴,对酶催化反应结果影响不显著,故可将微液滴酶催化反应体系线性放大应用于平台制备活性产物。重组菌株e.colibl21(de3)-pet21a-rhab1表达的α-l-鼠李糖苷酶比野生菌株更有利于芦丁催化为异槲皮苷的定向反应。利用该微液滴酶催化反应体系在生物转化芦丁上的应用,降低了成本,提高了产物得率,并且具有良好的产业化前景。
附图说明
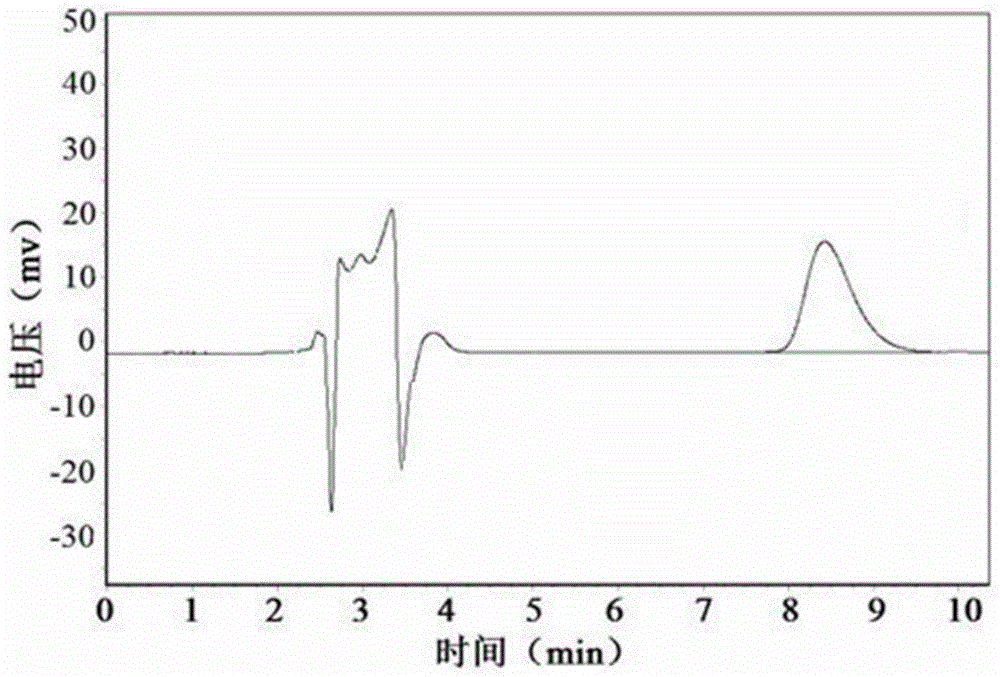
图1为异槲皮苷标准品的hplc色谱图;
图2为经微液滴酶催化后体系中的芦丁、异槲皮苷量的hplc色谱图,其中,1-异槲皮苷,2-芦丁。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
本发明实施例中制备微液滴酶催化反应体系方法为:使用成功构建的微液滴形成系统,油相采用稳定性好、无毒性的粘度为5cs的聚二甲基硅氧烷甲基硅油,水相为芦丁与α-l-鼠李糖苷酶混合液,通过操作微液滴形成系统调节连续相和分散相压力值,使体系所形成的液滴稳定性好、形成频率高、大小尺寸适当,用ptfe导管收集液滴,既得微液滴。
本发明实施例中使用检测芦丁和异槲皮苷定性定量的测定方法为高效液相色谱法,条件为:h&epumpp3000a恒流泵,uv-vis检测器,色谱柱型号alltimac18,长度为25mm,内径为5μm,采用hplc-uv分离和测定芦丁和异槲皮苷,柱温维持在30℃。流动相为乙腈:(0.02%)磷酸(体积比20:80),流速1.0ml·min-1,检测波长360nm。进样量为20μl。进样前,样品均通过0.45μm过滤器过滤。
其中,芦丁转化率和异槲皮苷得率计算方法为:
实施例1
重组菌株e.colibl21(de3)-pet21a-rhab1,采用pcr方法从大象粪便中获得目的基因rhab1(大小为3081bp)。
使用的引物为:上游引物序列:5’-cgggtcgacagatgttcggaaagg-3’(下划线为sali酶切位点),下游引物序列:5’-ccgaagcttatagctgaaggtgtaatg-3’(下划线为hindiii酶切位点)。经sali和hindiii双酶切的pcr产物rhab1和质粒pet21a,然后用t4dna连接酶将pcr产物连入pet21a,获得重组质粒pet21a-rhab1。采用双酶切和pcr验证。将经验证正确的重组菌株转染至e.colidh5α中进行目的基因的克隆。参考感受态细胞制备试剂盒制备感受态细胞e.colibl21(de3),然后将克隆获得的重组质粒转染进感受态细胞e.colibl21(de3)。37℃摇床培养e.colibl21至od600=0.5~0.6,菌液于塑料管中冰上放置5~10min,4℃、5000rpm离心5min,菌体沉淀用预冷的btbuffera轻柔重悬,冰上放置10~15min,4℃、5000rpm离心5min,菌体沉淀用预冷的btbufferb轻柔重悬,分装至冰上预冷的离心管中放置超低温冰箱保存。感受态细胞置冰上融化,加入10ng待转化dna,轻柔混匀,冰上放置30min,将离心管置42℃水浴锅中孵育90s,然后立即冰上放置2~3min,加入1ml预热至37℃不含抗生素的lb培养基,颠倒混匀后于37℃摇床缓慢振荡培养60min,取适量菌液涂布至氨苄抗性的lb平板中,37℃培养箱中倒置培养过夜,然后进行蓝白斑筛菌。挑取正确的单菌落,接种于含有氨苄青霉素抗性(50μg/ml)的lb液体培养基中(3~5ml),37℃振荡培养生长至指数期。分别进行菌液中抽提重组质粒验证和菌液为模板进行pcr验证。经验证正确以后按照2%的接菌量转接到含有氨苄青霉素抗性(50μg/ml)的lb液体培养基中(500ml),22℃恒温振荡培养至od600达到0.6~0.8时,然后添加400μm异丙基-β-d-硫代半乳糖苷(iptg),将温度降到17℃进行低温诱导表达16~20h。将诱导表达结束的菌液在4℃下8000rpm离心5min,收集菌体;用ph7.2~7.4pbs缓冲液清洗菌体两次;然后用超声缓冲液重悬菌体进行超声。超声缓冲液为:1.0mtris-hcl(ph8.0,30ml),超声波功率为0.6kw,超声时间为12min。超声结束后12000rpm离心30min,收集上清即为rhab1粗酶液。
利用柠檬酸-磷酸氢二钠缓冲液ph5.5配制0.01g/l的芦丁溶液,使用所得粗酶液,按相比1:1(v/v)混合液为水相,以聚二甲基硅氧烷甲基硅油为油相,微芯片制备酶催化反应液滴的过程。应用流动聚焦型芯片,分散相压力25mbar,连续相压力25mbar,操作微液滴形成装置,液滴稳定后,收集于密封ptfe导管。
将含微液滴酶的导管置于30℃恒温箱内,10min后取出,使用压力泵将导管内的微液滴收集于ep管内,离心3min,处理结束后取上层油相和下层水相稀释于甲醇溶液中,进行hplc检测,经处理数据得知,当反应环境温度为35℃时,异槲皮苷得率取得最大值,芦丁的转化率为50.33±0.13%,异槲皮苷的得率为9.80±1.2%。
实施例2
除所用柠檬酸-磷酸氢二钠缓冲液的ph5.62配制0.02g/l的芦丁溶液,分散相压力125mbar,连续相压力150mbar外,其余同实施例1。
将含微液滴的导管置于35℃恒温箱内,120min后取出,使用压力泵将导管内的微液滴收集于ep管内,离心3min,处理结束后取上层油相和下层水相稀释于甲醇溶液中,进行hplc检测,经处理数据得知,芦丁的转化率为65.21±0.06%,异槲皮苷的得率为41.38±0.37%,产物异槲皮苷的得率提高了4.22倍。
实施例3
除所用柠檬酸-磷酸氢二钠缓冲液的ph7.5配制0.03g/l的芦丁溶液,分散相压力200mbar,连续相压力200mbar外,其余同实施例1。
将含微液滴的导管置于60℃恒温箱内,300min后取出,使用压力泵将导管内的微液滴收集于ep管内,离心3min,处理结束后取上层油相和下层水相稀释于甲醇溶液中,进行hplc检测,经处理数据得知,芦丁的转化率为50.51±0.28%,异槲皮苷的得率为14.47±0.04%,产物异槲皮苷的得率提高了1.48倍。
序列表
<120>一种利用微液滴催化芦丁产异槲皮苷的酶催化反应体系
<160>2
<170>siposequencelisting1.0
<210>1
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>1
cgggtcgacagatgttcggaaagg24
<210>2
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>2
ccgaagcttatagctgaaggtgtaatg27
- 还没有人留言评论。精彩留言会获得点赞!