一种R-(-)-盐酸阿托莫西汀的制备方法与流程
本发明涉及医药领域,具体涉及一种r-(-)-盐酸阿托莫西汀的制备方法。
背景技术:
:公开该
背景技术:
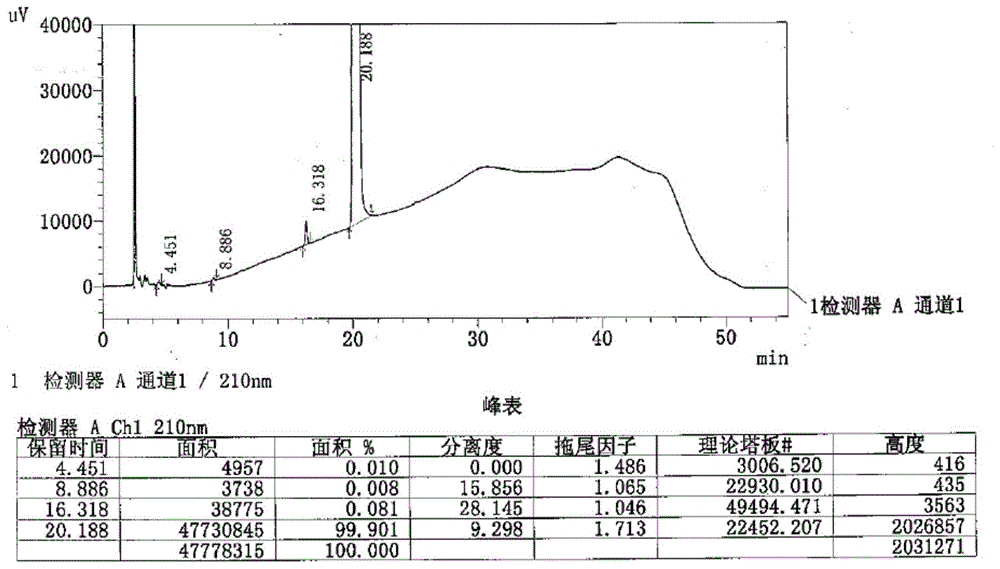
部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。儿童注意缺陷多动障碍(attentiondeficithyperactivitydisorder,adhd)在我国称为多动症,是儿童期常见的一类心理障碍,表现为与年龄和发育水平不相称的注意力不集中和注意时间短暂、活动过度和冲动,常伴有学习困难、品行障碍和适应不良。该症状多起病于7岁前,对患儿的认知、情绪、行为、生活质量及社会功能持续影响,同时大多数共患其他类行为或情绪问题/障碍。盐酸托莫西汀(cas:82248-59-7),化学名称为(-)-n-甲基-3-苯基-3-(o-氧甲苯)-丙胺盐酸盐,结构式如下所示。该药由lilly公司开发,于2002年7月获美食品药品管理局(fda)批准,2003年1月在美国上市,为一种选择性去甲肾上腺素重吸收抑制剂,用于儿童、青少年及成人患者注意力缺陷障碍(多动症)的治疗,是近十几年来fda在此领域批准的第一种非中枢兴奋性药物。作用机制是抑制神经细胞对5-羟色胺(5-ht)的再摄取,提高5-ht在突触间隙中的浓度,从而改善病人的情绪。该类药物选择性强,胆碱能副作用小,其疗效与三环类药物相当,而不良反应明显小于三环类药物。目前adhd市场主要由兴奋剂类药品所垄断,如诺华公司/celgene公司的哌甲酯(methylphenidate,ritalin)。盐酸托莫西汀作为一种选择性去甲肾上腺素重吸收抑制剂,为患者提供了第一种可代替精神兴奋剂,可以不定期使用的备选药物,具有较好的市场前景。关于盐酸托莫西汀的制备,主要有化学合成以及微生物合成两大类,其中化学合成法由于其手性中心,主要有消旋体拆分法和不对称合成法两条路径;微生物合成也是先制备手性中心:n取代的γ-手性胺基醇,包括脂肪酶拆分、全细胞转化等,然后再经过醚化或其他化学反应得到。微生物催化法具有安全、环保等优势,但目前相关研究还处于基础应用研究,大规模产业化方面还有较多问题待解决;化学法中不对称合成法由于采用手性配体,价格较为昂贵,产业化方面也存在一定不足。发明人发现,目前盐酸托莫西汀产业化路线还是以化学拆分法为主,先制备得到盐酸托莫西汀消旋体,然后经l-扁桃酸等手性拆分得到,主要有以下几条路线:路线一:u.s.pat.no.4314081、中国药物化学杂志,2005(15)5:282-284以3-氯苯丙烷为起始物料,采用n-溴代丁二酰亚胺(nbs)溴代制备γ-溴代物,与邻家苯酚醚化反应,然后在140℃下与甲胺水溶液反应12h,得到盐酸托莫西汀消旋体,经拆分、成盐得到成品。但是该路线由于胺化为高温、高压反应,操作安全性存在较大风险;同时在强碱条件下卤代物可能出现脱除反应,生成副产物。路线二:u.s.pat.no.4314081采用n,n-二甲胺基苯丙酮为起始物料,经还原、氯代、亲核取代、去甲基化,得到了托莫西汀消旋体,经拆分、成盐得到成品。但是该过程中去甲基化采用剧毒品溴化氰,在操作上存在较大安全风险。路线三:wo2015001565以3-氯-1-苯基-1-丙酮为起始物料,经还原得到3-氯-1-苯基-1-丙醇,然后与甲胺水溶液制备得到3-甲胺基-1-苯基-1-丙醇,该步产物的纯度较低(约为85%),造成后续纯化较为困难,同时低温胺化所需的时间较长,高温时需要高压反应;然后与邻家苯酚或者邻氟甲苯醚化,醚化采用有机碱(比如叔丁醇)催化;以及该路线中以n,n-二甲基乙酰胺、n-甲基吡咯烷酮为溶剂,所采用的溶媒毒性较强(n-甲基吡咯烷酮具有一定的皮肤毒性),且价格昂贵,造成成本较高。路线四:中国药学杂志,2010,45(14):1104-1106.广州化工,2015,(22):51-53.以价廉的苯乙酮为原料,经曼尼希反应、还原所得,但该路线副产物较多,特别在曼尼希反应制备3-甲胺基-1-苯基-1-丙酮盐酸盐过程中,较为容易形成三级曼尼希碱副产物,如下路线所示,虽然可以经过水蒸气蒸馏将三级曼尼希碱副产物转化为甲胺苯丙酮,但是过程中耗能较高,收率也仅仅为85%左右。三级曼尼希碱副产物生成路线在上述路线的醚化反应中,均需要在强碱条件下进行,文献报道的主要有两种,一种是采用有机强碱,如叔丁醇钾、甲醇钠等;一种为采用无机强碱,如使用固体naoh或koh等。中国专利cn201210329697.8以(e)-3-(n-甲基氨基)-1-苯基-2-丙烯-1-酮为原料,经过还原、与2-卤代甲苯醚化反应生成托莫西汀,但该起始物料1-苯基丙炔酮经检索发现无市售产品,来源不易得,产业化存在一定难度;同时采用pd-c/h2、pd(oh)2-c/h2、raneyni/h2作为催化剂对不饱和双键进行氢气高压还原,安全性操作存在较高风险。u.s.pat.no.6541668报道了一种以1,3二甲基-2-咪唑啉酮或者n-甲基吡咯烷酮为溶媒,在有机碱的作用下醚化,所采用的溶剂具有较强的毒性(1,3二甲基-2-咪唑啉酮具有生殖毒性、n-甲基吡咯烷酮具有皮肤毒性),且反应时间较长、操作步数多、溶剂用量较大。浙江海洋大学学报(自然科学版),2017,36(06):546-550;河北科技大学学报,2008,29(4):328-331采用无机强碱与3-甲氨基-1-苯基丙醇进行非均相反应,以非质子极性溶剂dmf为反应溶剂,为了促进氧负离子浓度加大,使其裸露程度增加,采用与冠醚性质类似的peg-6000作为催化剂,缩短了反应时间,提高了反应收率,取得了较好效果,消旋体总收率达到了75%,但由于高温反应,所采用的溶剂dmf或dmac易于与甲胺苯丙醇的n-h发生置换反应(org.processres.dev.2014,18,875-885),生成酰胺化物杂质,结构式如下所示:(r=h或ch3)。u.s.pat.no.7317127b2采用非质子极性溶剂二甲基亚砜为醚化反应溶媒,但是dmso具有一定的毒性,对人体皮肤有渗透性、对眼有刺激作用,且该反应需要长时间高温(145-147℃)反应,反应釜中dmso在120℃以上会发生分解,产生有毒气体,有头晕症状、气味非常难闻。技术实现要素:针对现有技术存在的诸多不足之处,本发明提供了一种r-(-)-盐酸阿托莫西汀的制备方法,以廉价易得的1-苯基-2-丙烯基-1-酮为起始原料,与甲胺的醇溶液发生aza-michael反应,在反应结束液中分批加入还原剂硼氢化钠,一锅法制备得到了3-甲胺基-1-苯基-1-丙醇,然后在低毒性、高沸点溶媒下,以甲苯为携水剂,在无机碱环境下与邻卤甲苯醚化,经l-扁桃酸(l-(+)-扁桃酸)直接拆分成盐(r-(-)-托莫西汀-s-(+)-扁桃酸盐)、精制、转盐酸盐得到r-(-)-盐酸阿托莫西汀成品。本发明的方法省掉了中间草酸盐精制一步,减少了反应步骤,具有原辅料廉价易得、副反应少、反应溶媒毒性低、收率高、纯度高、成本低等优点,适合产业化生产。具体地,本发明的技术方案如下所示:本发明提供了一种r-(-)-盐酸阿托莫西汀的制备方法,本发明的方法以化合物1即1-苯基-2-丙烯基-1-酮为起始原料制备得到化合物2即3-甲胺基-1-苯基-1-丙醇,然后3-甲胺基-1-苯基-1-丙醇在无机碱环境下与化合物3即邻卤甲苯醚化,经l-(+)-扁桃酸拆分得到化合物4即r-(-)-托莫西汀-s-(+)-扁桃酸盐、然后精制r-(-)-托莫西汀-s-(+)-扁桃酸盐、转盐酸盐即得r-(-)-盐酸阿托莫西汀。在本发明的实施方式中,所述以1-苯基-2-丙烯基-1-酮为起始原料制备3-甲胺基-1-苯基-1-丙醇(一锅法)的步骤包括:1-苯基-2-丙烯基-1-酮与甲胺的醇溶液发生aza-michael加成反应,待无1-苯基-2-丙烯基-1-酮残留时,分批加入硼氢化钠,控制反应温度,即得3-甲胺基-1-苯基-1-丙醇。在本发明的一些实施方式中,所述3-甲胺基-1-苯基-1-丙醇涉及纯化的步骤,比如可在反应结束后在反应体系中加入纯化水和盐酸,纯化水和盐酸的体积比为5:1(比如10l纯化水和2l2n的盐酸),搅拌20-40min后,加入萃取剂比如甲苯进行萃取,萃取可进行1至多次比如2次,合并有机相后,使用纯化水水洗,即得3-甲胺基-1-苯基-1-丙醇溶液。在本发明的实施方式中,所述分批加入即非一次性的全部加入,比如可以分2至多次加入,加入方式可以为每次均等份或者逐次递加,每次加入的时间间隔可以相同或者逐渐缩短。在本发明的一些实施方式中,所述甲胺的醇溶液为甲胺的乙醇溶液或甲胺的甲醇溶液。在又一些实施方式中,所述甲胺的醇溶液为浓度为33%(质量浓度)的甲胺的乙醇溶液。在本发明的一些实施方式中,所述aza-michael加成反应的温度为20-40℃,在又一些实施方式中,该温度为25-30℃。在本发明的一些实施方式中,所述甲胺的醇溶液与1-苯基-2-丙烯基-1-酮的摩尔比为1.0-1.5:1;在又一些实施方式中,该摩尔比为1.2-1.4:1。在本发明的一些实施方式中,分批加入硼氢化钠,控制反应温度为-5-5℃;在又一些实施方式中,控制反应温度为-2~2℃,比如该温度可以控制为-1-1℃、0-2℃或者-2-0℃。在本发明的一些实施方式中,1-苯基-2-丙烯基-1-酮与硼氢化钠总量的摩尔比为1:1.0-1.2,在又一些实施方式中,该摩尔比可以为1:1.0、1:1.05、1:1.08、1:1.2。在本发明的实施方式中,所述托莫西汀扁桃酸盐(即r-(-)-托莫西汀-s-(+)-扁桃酸盐)的制备包括:3-甲胺基-1-苯基-1-丙醇与邻卤甲苯在反应溶剂中,以甲苯为携水剂,在无机碱环境中醚化,经扁桃酸盐(即l-(+)-扁桃酸)拆分成盐得到r-(-)-托莫西汀-s-(+)-扁桃酸盐。在本发明的一些实施方式中,邻卤甲苯中的卤素可以为f、cl、br等,较为优选为邻氟甲苯。在本发明的一些实施方式中,3-甲胺基-1-苯基-1-丙醇与邻卤甲苯的反应溶剂为低毒性、高沸点溶媒,选自乙二醇二甲醚、乙二醇二乙醚、二乙二醇二甲醚、二乙二醇二乙醚、二乙二醇二丁醚和三乙二醇二甲醚中的一种或多种;在又一些实施方式中,该反应溶剂为三乙二醇二甲醚。在本发明的一些实施方式中,上述选自低毒性、高沸点溶媒的反应溶剂与3-甲胺基-1-苯基-1-丙醇的质量比为1-5:1;在又一些实施方式中,该质量比为2-4:1。在本发明的一些实施方式中,邻卤甲苯与3-甲胺基-1-苯基-1-丙醇的摩尔比为0.8-4:1;在又一些实施方式中,该摩尔比为1-3:1。在本发明的一些实施方式中,所述无机碱选自氢氧化钠、氢氧化钾和碳酸钾中的一种或多种;优选为氢氧化钾。在本发明的一些实施方式中,所述醚化的反应温度为100-140℃;在又一些实施方式中,该温度为120-130℃。在本发明的一些实施方式中,加扁桃酸盐拆分得到r-(-)-托莫西汀-s-(+)-扁桃酸盐的过程包括在醚化反应结束后加入l-(+)-扁桃酸进行高温重结晶的操作,包括加入l-(+)-扁桃酸,搅拌加热至75-80℃后,降温至65-70℃加入晶种(即纯的r-(-)-托莫西汀-s-(+)-扁桃酸盐),缓慢降至室温,然后0-5℃冰水浴养晶,抽滤,用冷得乙酸乙酯洗涤滤饼除去甲苯,得到r-(-)-托莫西汀-s-(+)-扁桃酸盐。在本发明的实施方式中,对r-(-)-托莫西汀-s-(+)-扁桃酸盐的精制步骤包括将r-(-)-托莫西汀-s-(+)-扁桃酸盐在有机溶剂中高温重结晶。在本发明的一些实施方式中,所述精制过程中的有机溶剂为乙酸乙酯和/或乙酸丁酯;较为优选的为乙酸乙酯。在本发明的一些实施方式中,精制过程中使用的有机溶剂与待精制的r-(-)-托莫西汀-s-(+)-扁桃酸盐的质量比为5-10:1;在又一些实施方式中,该质量比为7-9:1。在本发明的一些实施方式中,所述高温重结晶的温度为60-80℃;在某些实施方式中,该温度为先升温至75-80℃,然后再降温至65-70℃。在本发明的一些实施方式中,所述精制r-(-)-托莫西汀-s-(+)-扁桃酸盐的步骤包括:加入r-(-)-托莫西汀-s-(+)-扁桃酸盐和有机溶剂,先将温度升温至75-80℃,然后降温至65-70℃加入晶种(即纯的r-(-)-托莫西汀-s-(+)-扁桃酸盐),缓慢降温析晶。在一些实施方式中,缓慢降温至5℃析出晶体养晶,抽滤,用冷得乙酸乙酯淋洗滤纸,真空干燥得到精制的r-(-)-托莫西汀-s-(+)-扁桃酸盐。在本发明的实施方式中,所述转盐酸盐的步骤即r-(-)-盐酸阿托莫西汀的制备步骤包括:精制后的r-(-)-托莫西汀-s-(+)-扁桃酸盐经碱化、萃取、干燥、滴加浓盐酸成盐即得r-(-)-盐酸阿托莫西汀粗品,粗品于溶媒体系中高温溶析结晶得r-(-)-盐酸阿托莫西汀。在本发明的一些实施方式中,所述转盐酸盐的过程中,萃取使用的萃取剂选自乙酸乙酯和/或乙酸仲丁酯;较为优选的为乙酸仲丁酯。在本发明的一些实施方式中,所述萃取剂与r-(-)-托莫西汀-s-(+)-扁桃酸盐的质量比为3-7:1;在又一些实施方式中,该质量比为4-6:1。在本发明的一些实施方式中,上述溶媒体系包括良溶剂和非良溶剂,其中,所述良溶剂选自二氯甲烷、甲醇和乙醇中的一种或多种;所述非良溶剂选自乙酸乙酯和/或乙酸仲丁酯。在又一些实施方式中,所述溶媒体系包括二氯甲烷和乙酸乙酯。在本发明的一些实施方式中,所述良溶剂与r-(-)-盐酸阿托莫西汀粗品的质量比为8-12:1;在又一些实施方式中,该质量比为9-11:1。在本发明的一些实施方式中,所述非良溶剂与r-(-)-盐酸阿托莫西汀粗品的质量比为6-12:1;在又一些实施方式中,该质量比为9-11:1。在本发明的一些实施方式中,所述高温溶析结晶的温度范围20-50℃;在又一些实施方式中,该温度为30-40℃。在本发明的某些实施方式中,所述r-(-)-盐酸阿托莫西汀的制备方法包括:以1-苯基-2-丙烯基-1-酮为起始原料与甲胺的醇溶液发生aza-michael加成反应,待无1-苯基-2-丙烯基-1-酮残留时,分批加入硼氢化钠,控制反应温度,制得3-甲胺基-1-苯基-1-丙醇;制得的3-甲胺基-1-苯基-1-丙醇与邻卤甲苯在反应溶剂中,以甲苯为携水剂,在无机碱环境中醚化,经l-(+)-扁桃酸直接拆分成盐得到r-(-)-托莫西汀-s-(+)-扁桃酸盐;将得到的r-(-)-托莫西汀-s-(+)-扁桃酸盐在有机溶剂中高温重结晶进行精制,精制后的r-(-)-托莫西汀-s-(+)-扁桃酸盐经碱化、萃取、干燥、滴加浓盐酸成盐即得r-(-)-盐酸阿托莫西汀粗品,粗品于溶媒体系中高温溶析结晶得r-(-)-盐酸阿托莫西汀。在本发明的某些实施方式中,所述r-(-)-盐酸阿托莫西汀的制备方法包括以下步骤:在甲胺的醇溶液中缓慢滴加1-苯基-2-丙烯基-1-酮,控制温度在20-40℃搅拌反应,取样检测至无1-苯基-2-丙烯基-1-酮残留时,分批加入硼氢化钠,控制体系温度-5-5℃,1-苯基-2-丙烯基-1-酮与硼氢化钠总量的摩尔比为1:1.0-1.2,搅拌反应结束后加入纯化水、盐酸,搅拌,加入甲苯萃取2至多次,合并有机相,加入纯化水水洗,得到3-甲胺基-1-苯基-1-丙醇甲苯溶液。室温条件下,向该3-甲胺基-1-苯基-1-丙醇甲苯溶液中加入低毒性、高沸点溶媒作为反应溶剂,比如三乙二醇二甲醚,该反应溶剂与3-甲胺基-1-苯基-1-丙醇的质量比为1-5:1,加入无机碱比如氢氧化钾,搅拌升温至体系温度为100-140℃,回流分水,加入邻卤甲苯(比如邻氟甲苯),邻卤甲苯与3-甲胺基-1-苯基-1-丙醇的摩尔比为0.8-4:1,hplc检测反应终点。反应结束后,停止加热,降温至90℃,向体系中加入纯化水,分液,有机相用水洗涤,分液,得到红棕色有机层。转移出油相,加入l-(+)-扁桃酸,搅拌加热至75-80℃,然后降温至65-70℃加入晶种(即纯的r-(-)-托莫西汀-s-(+)-扁桃酸盐),缓慢降至室温,然后0-5℃冰水浴养晶,抽滤,用冷的乙酸乙酯洗涤滤饼除去甲苯,得到白色r-(-)-托莫西汀-s-(+)-扁桃酸盐固体。取该r-(-)-托莫西汀-s-(+)-扁桃酸盐,加入有机溶剂(比如乙酸乙酯),搅拌升温至75-80℃,然后降温至65-70℃加入晶种(即纯的r-(-)-托莫西汀-s-(+)-扁桃酸盐),缓慢降温至5℃养晶,抽滤,用冷得乙酸乙酯淋洗,45℃真空干燥,得到精制的r-(-)-托莫西汀-s-(+)-扁桃酸盐。取该精制的r-(-)-托莫西汀-s-(+)-扁桃酸盐进行碱化,(碱化过程比如可以为加入氢氧化钠水溶液40-45℃搅拌),加入萃取剂萃取,萃取剂比如可以为乙酸仲丁酯,萃取完毕后分液,用水洗涤油相后干燥抽滤后使用乙酸仲丁酯洗涤滤饼,合并有机相后常温下缓慢滴加浓盐酸,搅拌至晶体析出,缓慢降温至0-5℃养晶,抽滤,用冷得乙酸乙酯淋洗滤饼,真空干燥得到r-(-)-盐酸阿托莫西汀粗品。取该r-(-)-盐酸阿托莫西汀粗品,用良溶剂比如二氯甲烷溶解后,良溶剂与r-(-)-盐酸阿托莫西汀粗品的质量比为8-12:1,缓慢加热至30-40℃,保持温度不变,直至加入非良溶剂(比如乙酸乙酯),非良溶剂与r-(-)-盐酸阿托莫西汀粗品的质量比为6-12:1,非良溶剂滴加完毕后,降温至室温,再用冰水浴降温,0-5℃下养晶,抽滤,用乙酸乙酯洗涤滤饼,真空干燥,得到r-(-)-盐酸阿托莫西汀成品。相较于现有技术,本发明的优势在于:本发明采用l-扁桃酸直接拆分成盐的方法,省去了草酸盐精制过程,缩短反应步骤的同时提高了收率,本发明的总收率达到了35-37%,相较于文献报道的30%左右有明显提高。此外,本发明采用廉价易得的1-苯基-2-丙烯基-1-酮为起始物料,采用“一锅煮”法,制备得到了3-甲胺基-1-苯基-1-丙醇,然后在高沸点、低毒性的溶媒比如三乙二醇二甲醚中与邻卤甲苯(比如邻氟甲苯)醚化,加入l-扁桃酸直接拆分成盐,经精制、转盐酸盐等步骤得到目标产物,该发明所提供的制备方法简单、高效,具有原料来源广泛、副反应少、收率高(35-37%)、成本低等优点,适合产业化生产。附图说明构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。以下,结合附图来详细说明本发明的实施方案,其中:图1为实施例1的产品中有关物质ⅰ的检测图谱;其中8.8min及16.3min处为杂质b、d;图2为实施例1的产品中有关物质ⅱ的检测图谱。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本发明所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本发明所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。在本发明的实施方式中,所述r-(-)-盐酸阿托莫西汀的制备方法包括以下步骤:(1)在甲胺的醇溶液中缓慢滴加化合物1即1-苯基-2-丙烯基-1-酮(甲胺的醇溶液与1-苯基-2-丙烯基-1-酮的摩尔比为1.0-1.5:1,比如可以为1.2:1、1.3:1或1.4:1),控制温度在20-40℃(比如可以为25℃或30℃)搅拌反应,取样检测至无1-苯基-2-丙烯基-1-酮残留时,分批加入硼氢化钠,控制体系温度-5-5℃(该温度可以为-1-1℃、0-2℃或者-2-0℃),1-苯基-2-丙烯基-1-酮与硼氢化钠总量的摩尔比为1:1.0-1.2(该摩尔比可以为1:1.0、1:1.05、1:1.08、1:1.2),搅拌反应结束后加入纯化水、盐酸,搅拌,加入甲苯萃取2至多次,合并有机相,加入纯化水水洗,得到化合物2即3-甲胺基-1-苯基-1-丙醇甲苯溶液,待用。(2)室温条件下,向步骤(1)中得到的化合物2溶液即3-甲胺基-1-苯基-1-丙醇甲苯溶液中加入低毒性、高沸点溶媒作为反应溶剂,比如三乙二醇二甲醚,该反应溶剂与3-甲胺基-1-苯基-1-丙醇的质量比为1-5:1(比如1:1、1.5:1、2:1、3:1、4:1或5:1),加入无机碱比如氢氧化钾,搅拌升温至体系温度为100-140℃(比如该温度为120℃、125℃或130℃),回流分水,加入邻卤甲苯(比如邻氟甲苯),邻卤甲苯与3-甲胺基-1-苯基-1-丙醇的摩尔比为0.8-4:1(比如可以为0.8:1、1:1、1.5:1、2:1、3:1或4:1),hplc检测反应终点。反应结束后,停止加热,降温至90℃,向体系中加入纯化水,分液,有机相用水洗涤,分液,得到红棕色有机层。转移出油相,加入l-(+)-扁桃酸,搅拌加热至75-80℃(比如该温度可以为75℃、78℃或80℃),然后降温至65-70℃(比如该温度为65℃、66℃、68℃或70℃)加入晶种(即纯的r-(-)-托莫西汀-s-(+)-扁桃酸盐),缓慢降至室温,然后0-5℃冰水浴养晶,抽滤,用冷的乙酸乙酯洗涤滤饼除去甲苯,得到白色r-(-)-托莫西汀-s-(+)-扁桃酸盐固体。(3)取该r-(-)-托莫西汀-s-(+)-扁桃酸盐,加入有机溶剂(比如乙酸乙酯),搅拌升温至75-80℃(比如该温度可以为75℃、78℃或80℃),然后降温至65-70℃(比如该温度为65℃、66℃、68℃或70℃)加入晶种(即纯的r-(-)-托莫西汀-s-(+)-扁桃酸盐),缓慢降温至5℃养晶,抽滤,用冷得乙酸乙酯淋洗,45℃真空干燥,得到精制的r-(-)-托莫西汀-s-(+)-扁桃酸盐。(4)取该精制的r-(-)-托莫西汀-s-(+)-扁桃酸盐进行碱化,(碱化过程比如可以为加入氢氧化钠水溶液40-45℃搅拌),加入萃取剂萃取,萃取剂比如可以为乙酸仲丁酯,萃取完毕后分液,用水洗涤油相后干燥抽滤后使用乙酸仲丁酯洗涤滤饼,合并有机相后常温下缓慢滴加浓盐酸,搅拌至晶体析出,缓慢降温至0-5℃养晶,抽滤,用冷得乙酸乙酯淋洗滤饼,真空干燥得到r-(-)-盐酸阿托莫西汀粗品。取该r-(-)-盐酸阿托莫西汀粗品,用良溶剂比如二氯甲烷溶解后,良溶剂与r-(-)-盐酸阿托莫西汀粗品的质量比为8-12:1(该质量比比如为9:1、10:1或11:1),缓慢加热至30-40℃(比如30℃、35℃或40℃),保持温度不变,直至加入非良溶剂(比如乙酸乙酯),非良溶剂与r-(-)-盐酸阿托莫西汀粗品的质量比为6-12:1(比如该质量比为7.2:1、8:1或8.8:1),非良溶剂滴加完毕后,降温至室温,再用冰水浴降温,0-5℃下养晶,抽滤,用乙酸乙酯洗涤滤饼,真空干燥,得到r-(-)-盐酸阿托莫西汀成品。为了更好地呈现本发明的技术方案,以下将提供制备的具体示例。本发明所述晶种r-(-)-托莫西汀-s-(+)-扁桃酸盐的制备方法如下:将33%的甲胺乙醇溶液1.36kg加入反应釜中,搅拌下缓慢滴加1-苯基-2-丙烯基-1-酮1.58kg,控温25℃搅拌反应,取样检测原辅料无残留时,分批加入硼氢化钠0.48kg,控制体系温度-1~1℃,搅拌反应结束后加入纯化水10l、2l2n盐酸,搅拌30min后,加入10l甲苯萃取两次,合并有机相,20l纯化水水洗,得3-甲胺基-1-苯基-1-丙醇甲苯溶液,待用。室温条件下,向上述装有3-甲胺基-1-苯基-1-丙醇甲苯溶液的反应釜中加入三乙二醇二甲醚4.4kg,koh2.39kg加入反应釜,搅拌升温至体系温度到120℃,回流分水1h,加入邻氟甲苯1.32kg,反应大约3h,hplc检测反应终点。反应结束后,停止加热,降温至90℃,向体系中加入纯化水10kg,分液,有机相用10kg水洗涤2次,分液,得到红棕色有机层。转移油相至反应釜中,加入l-(+)-扁桃酸1.10kg,搅拌加热至75℃,然后缓慢降至室温,然后0~5℃冰水浴养晶1h,抽滤,用冷的乙酸乙酯洗涤滤饼除去其中的甲苯,得白色r-(-)-托莫西汀-s-(+)-扁桃酸盐粗品。向反应釜中加入扁桃酸盐粗品1.8kg和乙酸乙酯12.6kg,搅拌升温至75℃,然后缓慢降至5℃养晶1h,抽滤,用冷的乙酸乙酯淋洗滤,45℃真空干燥3h以上,得到r-(-)-托莫西汀-s-(+)-扁桃酸盐,按照试验例中有关物质的检测方法进行检测,各杂质均不得大于0.1%,主成分纯度大于99.9%,若是不合格,按照上述精制办法重复精制,即得晶种r-(-)-托莫西汀-s-(+)-扁桃酸盐。实施例1将33%的甲胺乙醇溶液1.36kg加入反应釜中,搅拌下缓慢滴加1-苯基-2-丙烯基-1-酮1.58kg,控温25℃搅拌反应,取样检测原辅料无残留时,分批加入硼氢化钠0.48kg,控制体系温度-1~1℃,搅拌反应结束后加入纯化水10l、2l2n盐酸,搅拌30min后,加入10l甲苯萃取两次,合并有机相,20l纯化水水洗,得3-甲胺基-1-苯基-1-丙醇甲苯溶液,待用。室温条件下,向上述装有3-甲胺基-1-苯基-1-丙醇甲苯溶液的反应釜中加入三乙二醇二甲醚4.4kg,koh2.39kg加入反应釜,搅拌升温至体系温度到120℃,回流分水1h,加入邻氟甲苯1.32kg,反应大约3h,hplc检测反应终点。反应结束后,停止加热,降温至90℃,向体系中加入纯化水10kg,分液,有机相用10kg水洗涤2次,分液,得到红棕色有机层。转移油相至反应釜中,加入l-(+)-扁桃酸1.10kg,搅拌加热至75℃,65℃加入晶种(经纯化的托莫西汀扁桃酸盐),缓慢降至室温,然后0~5℃冰水浴养晶1h,抽滤,用冷的乙酸乙酯洗涤滤饼除去其中的甲苯,得白色r-(-)-托莫西汀-s-(+)-扁桃酸盐固体,收率:42%。向反应釜中加入扁桃酸盐1.8kg和乙酸乙酯12.6kg,搅拌升温至75℃,然后降至65℃,加入晶种(经纯化的托莫西汀扁桃酸盐),缓慢降至5℃养晶1h,抽滤,用冷的乙酸乙酯淋洗滤,45℃真空干燥3h以上,得到r-(-)-托莫西汀-s-(+)-扁桃酸盐精品,收率:93%。向反应釜中加入1.62kgr-(-)-托莫西汀-s-(+)-扁桃酸盐,11.34kg纯化水(7倍体积质量比),再用1.62kg水溶解0.24kgnaoh,将其加入反应釜中,40~45℃搅拌10分钟,加入6.48kg乙酸仲丁酯,分液,油相分别用2kg纯化水洗3次,转移油相至反应釜,加入0.9kg无水硫酸镁搅拌干燥30min,抽滤,分别用1kg乙酸仲丁酯洗涤滤饼两次,合并有机相,转入反应釜中,常温下缓慢滴加浓盐酸,1h内滴加完毕,搅拌至晶体析出,缓慢降温,降温到0℃~5℃养晶1小时,抽滤,用冷乙酸乙酯淋洗滤饼2遍,50℃真空干燥3h,得白色的r-(-)-盐酸阿托莫西汀粗品,收率:94%。向反应釜中加入1.05kg上述粗品,用9.45kg二氯甲烷溶解,缓慢加热30℃,保持温度不变,直接加入乙酸乙酯1.89kg,加入晶种(经纯化的r-(-)-盐酸阿托莫西汀),然后缓慢滴加7.56kg乙酸乙酯,2h内滴加完毕,滴加完毕之后,降温至室温,再用冰水浴降温,0~5℃下养晶1h,抽滤,用乙酸乙酯洗涤滤饼两次,50℃真空干燥3h,得到r-(-)-盐酸阿托莫西汀成品,收率:95%。实施例2将33%的甲胺乙醇溶液1.36kg加入反应釜中,搅拌下缓慢滴加1-苯基-2-丙烯基-1-酮1.58kg,控温25℃搅拌反应,取样检测原辅料无残留时,分批加入硼氢化钠0.49kg,控制体系温度0-2℃,搅拌反应结束后加入纯化水10l、2l2n盐酸,搅拌30min后,加入15l甲苯萃取两次,合并有机相,20l纯化水水洗,得3-甲胺基-1-苯基-1-丙醇甲苯溶液,待用。室温条件下,向上述装有3-甲胺基-1-苯基-1-丙醇甲苯溶液的反应釜中加入三乙二醇二甲醚6.6kg,koh2.39kg加入反应釜,搅拌升温至体系温度到125℃,回流分水1h,加入邻氟甲苯2.6kg,反应大约2h,hplc检测反应终点。反应结束后,停止加热,降温至90℃,向体系中加入纯化水10kg,分液,有机相用10kg水洗涤2次,分液,得到红棕色有机层。转移油相至反应釜中,加入l-(+)-扁桃酸1.10kg,搅拌加热至78℃,66℃加入晶种,缓慢降至室温,然后0~5℃冰水浴养晶1h,抽滤,用冷的乙酸乙酯洗涤滤饼除去其中的甲苯,得白色r-(-)-托莫西汀-s-(+)-扁桃酸盐固体,收率:44%。向反应釜中加入扁桃酸盐1.8kg和乙酸乙酯14.4kg,搅拌升温至78℃,然后降至68℃,加入晶种(经纯化的托莫西汀扁桃酸盐),缓慢降至5℃养晶1h,抽滤,用冷的乙酸乙酯淋洗滤饼,45℃真空干燥3h以上,得到r-(-)-托莫西汀-s-(+)-扁桃酸盐精品,收率:92%。向反应釜中加入1.62kgr-(-)-托莫西汀-s-(+)-扁桃酸盐,11.34kg纯化水(7倍体积质量比),再用1.62kg水溶解0.24kgnaoh,将其加入反应釜中,40~45℃搅拌10分钟,加入8.1kg乙酸仲丁酯,分液,油相分别用2kg纯化水洗3次,转移油相至反应釜,加入0.9kg无水硫酸镁搅拌干燥30min,抽滤,分别用1.25kg乙酸仲丁酯洗涤滤饼两次,合并有机相,转入反应釜中,常温下缓慢滴加浓盐酸,1h内滴加完毕,搅拌至晶体析出,缓慢降温,降温到0℃~5℃养晶1小时,抽滤,用冷乙酸乙酯淋洗滤饼2遍,50℃真空干燥3h,得白色的r-(-)-盐酸阿托莫西汀粗品,收率:92%。向反应釜中加入1.05kg上述粗品,用10.5kg二氯甲烷溶解,缓慢加热35℃,保持温度不变,直接加入乙酸乙酯2.1kg,加入晶种(经纯化的r-(-)-盐酸阿托莫西汀),然后缓慢滴加8.4kg乙酸乙酯,2h内滴加完毕,降温至室温,再用冰水浴降温,0~5℃下养晶1h,抽滤,用乙酸乙酯洗涤滤饼两次。50℃真空干燥3h,得到r-(-)-盐酸阿托莫西汀成品,收率:96%。实施例3将33%的甲胺乙醇溶液1.36kg加入反应釜中,搅拌下缓慢滴加1-苯基-2-丙烯基-1-酮1.58kg,控温25℃搅拌反应,取样检测原辅料无残留时,分批加入硼氢化钠0.49kg,控制体系温度-2~0℃,搅拌反应结束后加入纯化水10l、2l2n盐酸,搅拌30min后,加入20l甲苯萃取两次,合并有机相,40l纯化水水洗,得3-甲胺基-1-苯基-1-丙醇甲苯溶液,待用。室温条件下,向上述装有3-甲胺基-1-苯基-1-丙醇甲苯溶液的反应釜中加入三乙二醇二甲醚8.8kg,koh2.39kg加入反应釜,搅拌升温至体系温度到130℃,回流分水1h,加入邻氟甲苯6.66kg,反应大约1.5h,hplc检测反应终点。反应结束后,停止加热,降温至90℃,向体系中加入纯化水10kg,分液,有机相用10kg水洗涤2次,分液,得到红棕色有机层。转移油相至反应釜中,加入l-(+)-扁桃酸1.10kg,搅拌加热至80℃,70℃加入晶种(经纯化的托莫西汀扁桃酸盐),缓慢降至室温,然后0~5℃冰水浴养晶1h,抽滤,用冷的乙酸乙酯洗涤滤饼除去其中的甲苯,得白色r-(-)-托莫西汀-s-(+)-扁桃酸盐固体,收率:45%。向反应釜中加入扁桃酸盐1.8kg和乙酸乙酯16.2kg,搅拌升温至80℃,然后降至70℃,加入晶种(经纯化的托莫西汀扁桃酸盐),缓慢降至5℃养晶1h,抽滤,用冷的乙酸乙酯淋洗滤饼,45℃真空干燥3h以上,得到r-(-)-托莫西汀-s-(+)-扁桃酸盐精品,收率:92%。向反应釜中加入1.62kgr-(-)-托莫西汀-s-(+)-扁桃酸盐,11.34kg纯化水(7倍体积质量比),再用1.62kg水溶解0.24kgnaoh,将其加入反应釜中,40~45℃搅拌10分钟,加入9.72kg乙酸仲丁酯,分液,油相分别用2kg纯化水洗3次,转移油相至反应釜,加入0.9kg无水硫酸镁搅拌干燥30min,抽滤,分别用1kg乙酸仲丁酯洗涤滤饼两次,合并有机相,转入反应釜中,常温下缓慢滴加浓盐酸,1h内滴加完毕,搅拌至晶体析出,缓慢降温,降温到0℃~5℃养晶1小时,抽滤,用冷乙酸乙酯淋洗滤饼2遍,50℃真空干燥3h,得白色的r-(-)-盐酸阿托莫西汀粗品,收率:91%。向反应釜中加入1.05kg上述粗品,用11.55kg二氯甲烷溶解,缓慢加热40℃,保持温度不变,直接加入乙酸乙酯2.31kg,加入晶种(经纯化的r-(-)-盐酸阿托莫西汀),然后缓慢滴加9.24kg乙酸乙酯,2h内滴加完毕,滴加完毕之后,降温至室温,再用冰水浴降温,0~5℃下养晶1h,抽滤,用乙酸乙酯洗涤滤饼两次。50℃真空干燥3h,得到r-(-)-盐酸阿托莫西汀成品,收率:94%。对比例对比例参照樊振.盐酸托莫西汀原料药制备工艺及放大试验研究[d].2015.中所述方法进行,具体过程如下:将3-甲氨基-1-苯丙醇20g溶于100ml二氯甲烷中,加入28.8g二碳酸二叔丁酯,35℃搅拌反应1小时。蒸除二氯甲烷,加入300ml甲苯溶解,依次加入23.0g偶氮二甲酸二乙酯,14.3g邻氟甲苯,缓慢加入43.6g三苯基膦,室温下搅拌反应24h,有大量白色粉末产生,停止反应,抽滤得白色粉末固体和浅黄色溶液,抽滤后的溶液用碳酸钠溶液洗两遍,稀盐酸溶液洗两遍,正己烷洗涤三遍,饱和食盐水洗一遍,无水硫酸钠干燥,浓缩,冷却析出白色晶体35.4g,收率83.6%。取前一步的产品15g置于100ml圆底烧瓶中,加入水50ml,用碳酸钠溶液调节至ph8-9,二甲苯提取(30ml×3),二甲苯提取液中用饱和氯化钠洗涤(15ml×2),无水硫酸镁干燥,过滤,滤液中加入含l(+)扁桃酸的二甲苯,室温搅拌3h,后加入乙醚析出固体,过滤,洗涤,干燥,即得白色(+)-[r-托莫西汀-s-扁桃酸盐]结晶9.3g,收率38.8%。将(+)-[r-托莫西汀-s-扁桃酸盐]结晶8g放入100ml反应瓶中,加水30ml,用naoh固体调节ph至9,乙醚萃取(30ml×3),合并萃取液,用饱和食盐水洗涤(15ml×3),无水硫酸镁干燥,过滤,乙醚滤液中加入30%的hcl-乙醚溶液,调节ph至2~3,在0~5℃温度下,放置1h,收集白色固体;用二氯甲烷和乙酸乙酯重结晶,真空干燥,得白色盐酸托莫西汀成品4.8g,收率84.0%。试验例已知的r-(-)-盐酸阿托莫西汀的主要杂质为a-e,化学名称及结构式如下所示:有关物质ⅰ:杂质a、杂质e的检测条件及方法色谱柱:c18柱,250mm×4.6mm,粒径5μm检测波长:210nm柱温:30℃流速:1ml/min进样体积:20μl运行时间:55min缓冲溶液:配制12.8g/l的磷酸二氢钠水溶液,向1l上述溶液中,加入4.3g辛烷基磺酸钠,用磷酸调节ph至2.8,过滤、超声、即得。流动相a:乙腈:缓冲液=3:5流动相b:乙腈:甲醇:缓冲液=8:5:6溶解相:流动相a:流动相b=3:1洗脱方式:梯度洗脱表1有关物质ⅰ分析方法梯度洗脱程序时间(min)溶液a(%)溶液b(%)09010106040155050204060253070403070459010559010系统适用性试液:盐酸托莫西汀样品及杂质a、杂质d、杂质e适量,用溶解相制成每1ml约含1.0mg盐酸托莫西汀与其各杂质的混合溶液(杂质的量分别为各杂质的限度)作为系统适用性试验溶液。供试品溶液:称取盐酸托莫西汀供试品约10mg,精密称定,置10ml量瓶中,加溶解相稀释溶解并定容至刻度。对照溶液:精密吸取供试品溶液0.5ml,置50ml容量瓶中,加溶解相稀释溶解并定容至刻度;再精密移取上述溶液1.0ml,置10ml容量瓶中,加溶解相稀释溶解并定容至刻度,即得。系统适用性试验取溶解相及上述系统适用性试液各20μl进样,分别注入液相色谱仪;主峰与相邻峰(杂质d)的分离度r≥1.5,杂质a峰与杂质e峰之间的分离度r≥1.5,主峰理论塔板数n≥3000,主峰拖尾因子t≤2.0。测定法:分别取供试品溶液及对照溶液各20μl注入液相色谱仪,记录色谱图;扣除空白溶剂及杂质d色谱峰,杂质a、杂质e均不得大于对照溶液主峰面积的1.0倍(0.10%);其他单个杂质峰面积不得大于对照溶液主峰面积的1.0倍(0.10%);各杂质校正后峰面积的和不得大于对照溶液主峰面积的5倍(0.50%)。上述公式中:fi:杂质a、杂质e的相对响应因子;ai:供试品溶液中杂质a、杂质e的峰面积;a对照液:对照溶液中主峰峰面积;a其他总杂:除空白溶剂、杂质a、杂质d、杂质e后,所有杂质峰面积之和。有关物质ⅱ:杂质b、c、d、s-异构体的检测条件及方法色谱柱:chiralcelad-h4.6mm*250mml粒径5μm检测波长:273nm柱温:25℃进样量:20μl流速:1.0ml/min流动相:正己烷:正丙醇:无水乙醇:二乙胺=95:3:2:0.3溶解相:无水乙醇:正己烷=28:72分别精密称取杂质b、杂质c、杂质d、s-异构体工作对照品适量,用溶解相溶解并稀释制成每1ml中约含杂质b、杂质c、杂质d各约为20μg,s-异构体的量约为30μg的杂质对照品混合溶液。取盐酸托莫西汀供试品约20mg,精密称定,置10ml量瓶中,精密吸取对照品储备液1ml至同一量瓶中,用溶解相溶解稀释并定容至刻度作为系统适用性溶液。取盐酸托莫西汀供试品约20mg,精密称定,至10ml量瓶中,用溶解相溶解稀释并定容至刻度作为供试品溶液。精密吸取供试品溶液0.5ml,置50ml容量瓶中,加溶解相稀释溶解并定容至刻度;再精密移取上述溶液1.0ml,置10ml容量瓶中,加溶解相稀释溶解并定容至刻度,即得对照溶液。系统适用性试验取溶解相及上述系统适用性试液各20μl进样,分别注入液相色谱仪;主峰与相邻峰(s-异构体)的分离度r≥1.5,主峰拖尾因子t≤2.0。测定法:分别取供试品溶液及对照溶液各20μl注入液相色谱仪,记录色谱图;扣除空白溶剂色谱峰,杂质b、杂质c均不得大于对照溶液主峰面积的1.0倍(0.1%);杂质d、s-异构体分别均不得大于对照溶液主峰面积的1.0倍(0.10%)、1.5倍(0.15%)。上述公式中:fi:杂质b、杂质c、杂质d、s-异构体的相对响应因子,分别为1.18、1.22、1.0、1.0;ai:供试品溶液中质b、杂质c、杂质d、s-异构体的峰面积;a对照液:对照溶液中主峰峰面积。按照上述检测方法及条件对实施例1-3以及对比例中制备得到的r-(-)-盐酸阿托莫西汀成品进行了检测,结果如下:表2r-(-)-盐酸阿托莫西汀有关物质检测结果其中,实施例1中成品的有关物质i和有关物质ii的检测图谱如图1和图2所示。从表2可以看出,对于有关物质ⅰ(杂质a和杂质e),实施例1-3与对比例无明显差异,但对于有关物质ⅱ(杂质b、c、d),对比例与实施例1-3相比较,对比例中检测出了杂质c,且杂质b、d的量也高于实施例1-3;对于正相检测结果,按照上述检测方法,对比例的收率为27.2%、纯度为99.69%,与文献报道的收率约30%、纯度99.85%基本一致;从收率上来看,本发明的制备方法总收率比对比例提高7-9%左右,有效降低了生产成本,整体具有明显的优势。以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1