2-甲基-1,8-萘啶类化合物及其制备方法与应用与流程
本发明涉及合成技术领域,特别涉及2-甲基-1,8-萘啶类化合物,还涉及其制备方法与应用。
背景技术:
近年来,含氮的杂环化合物在现代药物研发中具有至关重要的作用,发展高效的含氮杂环化合物的构建方法也吸引了越来越多的关注。萘啶氮杂环化合物是一类非常重要的杂环体系,常见于药物中间体、天然产物中,具有潜在的生物活性。其中,1,8-萘啶也是一种重要的杂环体系,在有机中间体、医药、农药、材料科学等领域都有广泛的应用。
随着有机化学以及材料、医药等交叉学科的发展,科学家们从含氮杂环化合物中发现了大量新颖的药物和功能材料。据相关报道,在含氮杂环化合物的结构与功能的对应关系中,甲基化的影响是很有意义的。例如,dna和rna核碱基之间的区别仅在于一个甲基(即dna的胸腺嘧啶和rna的尿嘧啶),而尿嘧啶甲基化成胸腺嘧啶可以调节许多生物过程。此外,在20种天然氨基酸中,甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸的生物活性受甲基数量和位置变化的调节,这意味着甲基在生物功能微调中的意义重大。
除了这些生物学作用外,近年来,在药物化学和制药工业中也认识到在候选药物中甲基化所带来的益处,而这被人们称之为“神奇的甲基化作用”。甲基化候选药物由于溶解度、构象和代谢活性的变化而表现出独特的性质。例如,p38a作为map3激酶的抑制剂,甲基化后p38a的效力显著增强,ic50由原来的大于2500nm变为约12nm。然而,对于2-甲基-1,8-萘啶的合成,大多数的方法仍需要采用金属催化,并且需要在高温条件下实现反应,具有原子利用率不高、副反应复杂、主反应收率不高等缺点。因此我们希望通过一种无金属催化、室温下的、绿色的、高效的、操作简单的甲基化策略来合成2-甲基-1,8-萘啶类化合物。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种2-甲基-1,8-萘啶类化合物及其制备方法与应用。本发明的2-甲基-1,8-萘啶类化合物结构新颖,具有高的生物活性。本发明的制备方法不需要添加金属催化剂,条件温和、绿色环保、效率高、操作简单安全,所制备的2-甲基-1,8-萘啶类化合物可进一步应用于抗肿瘤药物。
本发明采用以下技术方案:
2-甲基-1,8-萘啶类化合物,具有式ⅰ所示的结构:
其中,r1选自苯基、取代苯基、噻唑基、吡嗪基、呋喃基、苯并噻吩基和1,3-苯并二氧基组成的组,r2为氢或烷基;或r1和r2形成环状结构;
所述取代苯基为硝基苯基、卤代苯基、甲氧基苯基或三氟甲基苯基;
所述烷基为c1-6烷基。
优选地,所述硝基苯基选自2-硝基苯基、3-硝基苯基或4-硝基苯基;进一步优选地,所述硝基苯基为4-硝基苯基。
优选地,所述卤代苯基选自2-卤代苯基、3-卤代苯基或4-卤代苯基;其中,卤素选自氟、氯、溴或碘;进一步优选地,所述卤代苯基为4-溴代苯基。
优选地,所述甲氧基苯基选自2-甲氧基苯基、3-甲氧基苯基或4-甲氧基苯基;进一步优选地,所述甲氧基苯基为3-甲氧基苯基。
优选地,所述噻唑基选自噻唑-2-基、噻唑-4-基或噻唑-5-基;进一步优选地,所述噻唑基为噻唑-2-基。
优选地,所述吡嗪基选自吡嗪-2-基。
优选地,所述三氟甲基苯基选自2-三氟甲基苯基、3-三氟甲基苯基或4-三氟甲基苯基;进一步优选地,所述三氟甲基苯基为4-三氟甲基苯基。
优选地,所述呋喃基选自呋喃-2-基或呋喃-3-基;进一步优选地,所述呋喃基为呋喃-2-基。
优选地,所述苯并噻吩基选自2-苯并噻吩基或3-苯并噻吩基;进一步优选地,所述苯并噻吩基为2-苯并噻吩基。
优选地,所述1,3-苯并二氧基选自1,3-苯并二氧-4-基或1,3-苯并二氧-5-基;进一步优选地,所述1,3-苯并二氧基为1,3-苯并二氧-5-基。
优选地,所述c1-6烷基选自甲基、乙基、丙基、丁基、戊基或己基;进一步优选地,所述,所述c1-6烷基为甲基。
优选地,所述r1和r2形成环状结构,具体地,2-甲基-1,8-萘啶类化合物具有如下结构:
上述的2-甲基-1,8-萘啶类化合物的制备方法,包括以下步骤:
将1,8-萘啶类化合物、碱、醇、甲基化试剂混合均匀,在80-160℃下反应5-24小时,即得到2-甲基-1,8-萘啶类化合物。
优选地,反应在保护性气氛中进行;进一步优选地,反应在氮气气氛中进行。
优选地,所述1,8-萘啶类化合物具有式ⅱ所示的结构:
其中,其中,r1选自苯基、取代苯基、噻唑基、吡嗪基、呋喃基、苯并噻吩基和1,3-苯并二氧基组成的组,r2为氢或烷基;或r1和r2形成环状结构;
所述取代苯基为硝基苯基、卤代苯基、甲氧基苯基或三氟甲基苯基;
所述烷基为c1-6烷基。
优选地,所述硝基苯基选自2-硝基苯基、3-硝基苯基或4-硝基苯基;进一步优选地,所述硝基苯基为4-硝基苯基。
优选地,所述卤代苯基选自2-卤代苯基、3-卤代苯基或4-卤代苯基;其中,卤素选自氟、氯、溴或碘;进一步优选地,所述卤代苯基为4-溴代苯基。
优选地,所述甲氧基苯基选自2-甲氧基苯基、3-甲氧基苯基或4-甲氧基苯基;进一步优选地,所述甲氧基苯基为3-甲氧基苯基。
优选地,所述噻唑基选自噻唑-2-基、噻唑-4-基或噻唑-5-基;进一步优选地,所述噻唑基为噻唑-2-基。
优选地,所述吡嗪基选自吡嗪-2-基。
优选地,所述三氟甲基苯基选自2-三氟甲基苯基、3-三氟甲基苯基或4-三氟甲基苯基;进一步优选地,所述三氟甲基苯基为4-三氟甲基苯基。
优选地,所述呋喃基选自呋喃-2-基或呋喃-3-基;进一步优选地,所述呋喃基为呋喃-2-基。
优选地,所述苯并噻吩基选自2-苯并噻吩基或3-苯并噻吩基;进一步优选地,所述苯并噻吩基为2-苯并噻吩基。
优选地,所述1,3-苯并二氧基选自1,3-苯并二氧-4-基或1,3-苯并二氧-5-基;进一步优选地,所述1,3-苯并二氧基为1,3-苯并二氧-5-基。
优选地,所述c1-6烷基选自甲基、乙基、丙基、丁基、戊基或己基;进一步优选地,所述,所述c1-6烷基为甲基。
优选地,所述r1和r2形成环状结构,具体地,所述1,8-萘啶类化合物具有如下结构:
优选地,所述碱为碳酸钠、氢氧化钠、氢化钠、甲醇钠、叔丁醇钾、叔丁醇钠和三乙胺中的一种或多种。
所述醇为甲醇、乙醇、苯乙醇和苯甲醇中的一种或多种。
优选地,所述甲基化试剂为二甲基亚砜。
优选地,所述1,8-萘啶类化合物、碱、醇的摩尔(mol)与甲基化试剂的体积(l)的比例为1:1-2:1:2。
甲基化试剂以二甲基亚砜为例,上述制备方法涉及的反应如下:
具体地,本发明的反应机理如下:
在本发明中,1,8-萘啶类化合物在碱、醇作用下,邻位产生自由基;同样地,二甲基亚砜作为甲基化试剂,在同样的环境下产生甲基自由基,两者产生的自由基发生自由基偶联,形成2-甲基-1,8-萘啶类化合物。本发明控制适当的反应条件,促使反应物有效产生自由基并进行反应,所采用的原料低廉、安全无毒、反应效率高。
优选地,所述反应结束后对粗产物进行提纯;所述提纯为柱层析提纯。
进一步优选地,所述柱层析提纯的洗脱液为石油醚:二氯甲烷:乙酸乙酯的体积比为0.5-50:0-20:1的混合溶液。
具体地,上述的2-甲基-1,8-萘啶类化合物的制备方法,包括以下步骤:
在反应容器中,将相应结构的1,8-萘啶类化合物、碱、醇、甲基化试剂混合均匀,在80-160℃下反应5-24小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯得到2-甲基-1,8-萘啶类化合物。
上述的2-甲基-1,8-萘啶类化合物在制备抗肿瘤细胞药物中的应用。
优选地,所述的2-甲基-1,8-萘啶类化合物的应用,在抗人癌k562细胞、hl-60细胞、hela细胞、bgc-823细胞的试剂或药物中的应用。
本发明的有益效果:
(1)本发明通过在1,8-萘啶类化合物中引入甲基官能团,提高了1,8-萘啶类化合物的生物活性,使得到的2-甲基-1,8-萘啶类化合物具有新颖的结构并且具有抗肿瘤活性。
(2)本发明的制备方法不需要添加金属催化剂,条件温和、绿色环保、效率高、操作简单安全、原料无毒且价廉易得;本发明的化合物在制备过程中选择性好,原子利用率高、副反应简单、主反应收率高,为1,8-萘啶类化合物的甲基化提供一种经济简单的有效制备方法;得到的双氮杂环产物结构新颖,可进一步开发其生物活性。
(3)在复杂的双氮杂环的合成中,本发明通过高效简单的制备方法即得到结构新颖且具有生物活性的双氮杂环化合物,带来经济效益的同时,也符合绿色化学的理念,为双氮杂环的合成提供新思路。
(4)本发明的2-甲基-1,8-萘啶类化合物对人癌k562细胞、hl-60细胞、hela细胞、bgc-823细胞具有抑制作用,因此,该类化合物可作为抗肿瘤试剂用于体外抗肿瘤活性筛选中,在抗肿瘤细胞药物中具有一定的潜在应用价值。
附图说明
图1a和图1b分别为实施例1所得化合物2a的氢谱图和碳谱图;
图2a和图2b分别为实施例2所得化合物2b的氢谱图和碳谱图;
图3a和图3b分别为实施例3所得化合物2c的氢谱图和碳谱图;
图4a和图4b分别为实施例4所得化合物2d的氢谱图和碳谱图;
图5a和图5b分别为实施例5所得化合物2e的氢谱图和碳谱图;
图6a和图6b分别为实施例6所得化合物2f的氢谱图和碳谱图;
图7a和图7b分别为实施例7所得化合物2g的氢谱图和碳谱图;
图8a和图8b分别为实施例8所得化合物2h的氢谱图和碳谱图;
图9a和图9b分别为实施例9所得化合物2i的氢谱图和碳谱图;
图10a和图10b分别为实施例10所得化合物2j的氢谱图和碳谱图。
具体实施方式
下面通过实施例详细说明本发明。
实施例1
2-甲基-7-苯基-1,8-萘啶具有如下结构:
2-甲基-7-苯基-1,8-萘啶的制备方法如下:
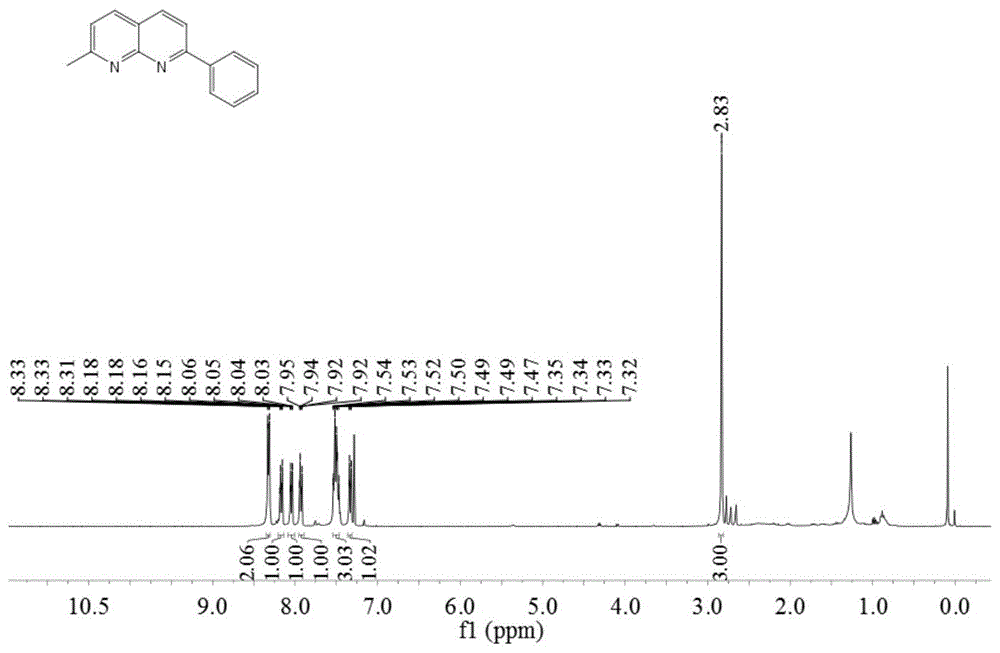
在反应容器中,将2-苯基-1,8-萘啶(5mmol,1g)、叔丁醇钾(10mmol,1.1g)、甲醇(5mmol,0.02g)、二甲基亚砜(10ml)混合均匀,在80℃下反应24小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-甲基-7-苯基-1,8-萘啶,即化合物2a。化合物2a为白色固体,熔点(m.p.):108.9-109.7℃。
反应路线如下:
所得化合物2a的氢谱图和碳谱图分别如图1a和图1b所示,结构表征数据如下:
1hnmr(400mhz,cdcl3)δ8.35-8.30(m,2h),8.17(dd,j=8.4,3.0hz,1h),8.05(dd,j=8.2,2.9hz,1h),7.93(dd,j=8.4,2.9hz,1h),7.56-7.46(m,3h),7.33(dd,j=8.2,2.5hz,1h),2.83(s,3h);
13cnmr(101mhz,cdcl3)δ163.3,160.0,155.9,138.7,137.4,136.6,129.9,128.7,127.9,122.6,119.7,118.8,25.7。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2a的分子量:c15h13n2[m+h]+的理论值(calcd):221.1073;实际测得值(found):221.1064。
实施例2
2-(3-甲氧基苯基)-7-甲基1,8-萘啶,具有如下结构:
2-(3-甲氧基苯基)-7-甲基1,8-萘啶的制备方法如下:
在反应容器中,将2-(3-甲氧基苯基)-1,8-萘啶(5mmol,1.2g)、叔丁醇钾(10mmol,1.1g)、乙醇(5mmol,0.02g)、二甲基亚砜(10ml)混合均匀,在160℃下反应5小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-(3-甲氧基苯基)-7-甲基1,8-萘啶,即化合物2b,化合物2b为白色固体,熔点(m.p.):136.2-137.9℃。
反应路线如下:
所得化合物2b的氢谱图和碳谱图分别如图2a和图2b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ8.13(d,j=8.4hz,1h),8.02(d,j=8.2hz,1h),7.96-7.91(m,1h),7.89(d,j=8.4hz,1h),7.79(d,j=7.7hz,1h),7.39(t,j=7.9hz,1h),7.31(d,j=8.2hz,1h),7.01(dd,j=8.2,2.6hz,1h),3.91(s,3h),2.81(s,3h);
13cnmr(126mhz,cdcl3)δ163.3,160.1,159.8,155.7,140.1,137.4,136.7,129.6,122.7,120.3,119.8,119.1,116.5,112.6,55.6,25.7。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2b的分子量:c16h15n2o[m+h]+的理论值(calcd):251.1179;实际测得值(found):251.1169。
实施例3
2-(7-甲基-1,8-萘啶-2-基)噻唑,具有如下结构:
2-(7-甲基-1,8-萘啶-2-基)噻唑的制备方法如下:
在反应容器中,将2-(1,8-萘啶-2-基)噻唑(5mmol,1.1g)、叔丁醇钾(10mmol,1.1g)、苯乙醇(5mmol,0.6g)、二甲基亚砜(10ml)混合均匀,在100℃下反应8小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-(7-甲基-1,8-萘啶-2-基)噻唑,即化合物2c。化合物2c为棕色固体,熔点(m.p.):123.4-125.1℃;
反应路线如下:
所得化合物2c的氢谱图和碳谱图分别如图3a和图3b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ8.41-8.33(m,1h),8.21(dd,j=9.6,5.5hz,1h),8.10-8.03(m,1h),7.97(d,j=1.8hz,1h),7.53(dd,j=3.6,2.6hz,1h),7.38-7.29(m,1h),2.81(s,3h);
13cnmr(126mhz,cdcl3)δ169.0,163.9,155.4,154.0,144.2,137.9,136.8,123.4,123.2,121.4,118.1,25.7。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2c的分子量:c12h10n3s[m+h]+的理论值(calcd):228.0590;实际测得值(found):228.0582。
实施例4
2-甲基-7-(吡嗪-2-基)-1,8-萘啶,具有如下结构:
2-甲基-7-(吡嗪-2-基)-1,8-萘啶的制备方法如下:
在反应容器中,将2-(吡嗪-2-基)-1,8-萘啶(5mmol,1g)、叔丁醇钾(10mmol,1.1g)、苯乙醇(5mmol,0.6g)、二甲基亚砜(10ml)混合均匀,在120℃下反应12小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-甲基-7-(吡嗪-2-基)-1,8-萘啶,即化合物2d。化合物2d为黄色油状(37.3毫克,56%产率)。
反应路线如下:
所得化合物2d的氢谱图和碳谱图分别如图4a和图4b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ10.03(t,j=3.7hz,1h),8.65-8.58(m,2h),8.54(d,j=8.4hz,1h),8.25(d,j=8.4hz,1h),8.08(d,j=8.3hz,1h),7.37(d,j=8.2hz,1h),2.83(d,j=8.6hz,3h);
13cnmr(126mhz,cdcl3)δ163.9,157.1,155.4,150.5,145.1,144.6,143.4,137.9,136.8,123.6,121.2,119.1,25.8。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2d的分子量:c13h11n4[m+h]+的理论值(calcd):223.0978;实际测得值(found):223.0971。
实施例5
10-甲基-5,6-二氢萘酚[1,2-b][1,8]萘啶,具有如下结构:
10-甲基-5,6-二氢萘酚[1,2-b][1,8]萘啶的制备方法如下:
在反应容器中,将5,6-二氢萘酚[1,2-b][1,8]萘啶(5mmol,1.2g)、叔丁醇钾(10mmol,1.1g)、苯乙醇(5mmol,0.5g)、二甲基亚砜(10ml)混合均匀,在110℃下反应14小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到10-甲基-5,6-二氢萘酚[1,2-b][1,8]萘啶,即化合物2e。化合物2e为棕色固体,熔点(m.p.):140.4-141.7℃。
反应路线如下:
所得化合物2e的氢谱图和碳谱图分别如图5a和图5b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ8.77(d,j=7.5hz,1h),7.94(s,1h),7.84(d,j=9.2hz,1h),7.38(dd,j=14.0,6.7hz,2h),7.30-7.24(m,2h),3.09(d,j=5.3hz,2h),2.98(d,j=5.5hz,2h),2.80(d,j=4.9hz,3h);
13cnmr(126mhz,cdcl3)δ162.1,156.1,155.3,139.4,136.1,134.4,134.2,130.9,130.3,127.9,127.3,127.1,122.4,120.2,28.4,28.2,25.6。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2e的分子量:c17h15n2[m+h]+的理论值(calcd):247.1230;实际测得值(found):247.1219。
实施例6
2-甲基-7-(4-三氟甲基苯基)-1,8-萘啶,具有如下结构式:
2-甲基-7-(4-三氟甲基苯基)-1,8-萘啶的制备方法如下:
在反应容器中,将2-(4-三氟甲基苯基)-1,8-萘啶(5mmol,1.4g)、叔丁醇钾(10mmol,1.1g)、苯乙醇(5mmol,0.6g)、二甲基亚砜(10ml)混合均匀,在80℃下反应24小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-甲基-7-(4-三氟甲基苯基)-1,8-萘啶,即化合物2f。化合物2f为灰色固体,熔点(m.p.):163.8-164.3℃。
反应路线如下:
所得化合物2f的氢谱图和碳谱图分别如图6a和图6b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ8.40(d,j=7.9hz,2h),8.21(dd,j=8.2,3.8hz,1h),8.08(dd,j=8.1,3.5hz,1h),7.93(dd,j=8.2,3.9hz,1h),7.74(d,j=8.1hz,2h),7.37(dd,j=8.2,3.0hz,1h),2.84(s,3h);
13cnmr(126mhz,cdcl3)δ163.8,158.3,155.6,141.8,137.9,136.7,131.52(d,j=32.4hz),128.1,125.63(q,j=3.1hz),125.2,123.2,120.1,118.8,25.7;
19fnmr(471mhz,cdcl3)δ-62.6。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2f的分子量:c16h12f3n2[m+h]+的理论值(calcd):289.0947;实际测得值(found):289.0935。
实施例7
2-(呋喃-2-基)-7-甲基-1,8-萘啶,具有如下结构式:
2-(呋喃-2-基)-7-甲基-1,8-萘啶的制备方法如下:
在反应容器中,将2-(呋喃-2-基)-1,8-萘啶(5mmol,1.0g)、叔丁醇钾(10mmol,1.1g)、苯乙醇(5mmol,0.6g)、二甲基亚砜(10ml)混合均匀,在80℃下反应24小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-(呋喃-2-基)-7-甲基-1,8-萘啶,即化合物2g。化合物2g为黄色固体,熔点(m.p.):123.4-125.1℃。
反应路线如下:
所得化合物2g的氢谱图和碳谱图分别如图7a和图7b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ8.10(dd,j=8.3,6.1hz,1h),7.98(dd,j=8.1,6.0hz,1h),7.88(dd,j=8.3,6.1hz,1h),7.69-7.57(m,1h),7.51(dd,j=3.1,2.6hz,1h),7.27(dd,j=7.5,4.7hz,1h),6.59(td,j=3.3,1.7hz,1h),2.78(s,3h);
13cnmr(126mhz,cdcl3)δ163.4,155.7,153.6,151.9,144.2,137.4,136.6,122.4,119.6,117.3,112.8,111.5,25.6。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2g的分子量:c13h11n2o[m+h]+的理论值(calcd):211.0866;实际测得值(found):211.0859。
实施例8
2-(苯并噻吩-2-基)-7-甲基-1,8-萘啶,具有如下结构:
2-(苯并噻吩-2-基)-7-甲基-1,8-萘啶的制备方法如下:
在反应容器中,将2-(苯并噻吩-2-基)-1,8-萘啶(5mmol,1.3g)、甲醇钠(5mmol,0.5g)、苯甲醇(5mmol,0.5g)、二甲基亚砜(10ml)混合均匀,在150℃下反应18小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-苯并噻吩基-7-甲基-1,8-萘啶,即化合物2h。化合物2h为黄色固体,熔点(m.p.):210.6-212.7℃。
反应路线如下:
所得化合物2h的氢谱图和碳谱图分别如图8a和图8b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ8.12(d,j=8.4hz,1h),8.06(s,1h),8.01(d,j=8.2hz,1h),7.91(t,j=7.4hz,2h),7.86-7.78(m,1h),7.40-7.34(m,2h),7.32(d,j=8.2hz,1h),2.83(s,3h);
13cnmr(126mhz,cdcl3)δ163.7,155.7,155.3,144.7,141.6,140.3,137.3,136.6,125.6,124.5,124.5,123.7,122.8,122.8,120.1,118.2,77.3,77.1,76.8,25.7。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2h的分子量:c17h13n2s[m+h]+的理论值(calcd):277.0794;实际测得值(found):277.0788。
实施例9
2-(1,3-苯并二氧-5-基)-7-甲基-1,8-萘啶,具有如下结构:
2-(1,3-苯并二氧-5-基)-7-甲基-1,8-萘啶的制备方法如下:
在反应容器中,将2-(1,3-苯并二氧-5-基)-1,8-萘啶(5mmol,1.5g)、氢氧化钠(10mmol,0.4g)、苯甲醇(5mmol,0.5g)、二甲基亚砜(10ml)混合均匀,在160℃下反应16小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-(1,3-苯并二氧-5-基)-7-甲基-1,8-萘啶,即化合物2i。化合物2i为黄色固体,熔点(m.p.):182.2-183.5℃。
反应路线如下:
所得化合物2i的氢谱图和碳谱图分别如图9a和图9b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ8.13(d,j=8.5hz,1h),8.03(d,j=8.2hz,1h),7.94(d,j=1.8hz,1h),7.85(d,j=8.5hz,1h),7.80(dd,j=8.2,1.8hz,1h),7.32(d,j=8.2hz,1h),6.93(d,j=8.2hz,1h),6.05(s,2h),2.83(s,3h);
13cnmr(126mhz,cdcl3)δ163.28,159.29,155.81,149.37,148.41,137.27,136.54,133.09,122.41,122.27,119.43,118.44,108.32,108.22,101.50,25.72。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2i的分子量:c16h13n2o2[m+h]+的理论值(calcd):265.0972;实际测得值(found):265.0961。
实施例10
2-(4-溴苯基)-3,7-二甲基-1,8-萘啶,具有如下结构:
2-(4-溴苯基)-3,7-二甲基-1,8-萘啶的制备方法如下:
在反应容器中,将2-(4-溴苯基)-3-甲基-1,8-萘啶(5mmol,1.5g)、叔丁醇钾(5mmol,1.1g)、乙醇(5mmol,0.02g)、二甲基亚砜(10ml)混合均匀,在140℃下反应24小时,反应结束后冷却至室温,过滤、减压旋蒸除去未反应物即得到粗产物,粗产物经过柱层析提纯即得到2-(4-溴苯基)-3,7-二甲基-1,8-萘啶,即化合物2j。化合物2j为灰色固体,熔点(m.p.):158.0-160.7℃。
反应路线如下:
所得化合物2j的氢谱图和碳谱图分别如图10a和图10b所示,结构表征数据如下:
1hnmr(500mhz,cdcl3)δ7.99(d,j=8.3hz,1h),7.96(d,j=3.4hz,1h),7.57(d,j=2.9hz,4h),7.31(d,j=8.2hz,1h),2.77(s,3h),2.48(s,3h);
13cnmr(126mhz,cdcl3)δ162.6,161.6,154.3,139.0,137.8,135.9,131.2,131.1,129.4,123.1,122.9,119.9,25.6,20.5。
通过电喷雾电离(esi)的高分辨质谱(hrms)测定所得化合物2j的分子量:c16h14brn2[m+h]+的理论值(calcd):313.0335;实际测得值(found):313.0335。
实验例
对实施例1-10所得产物进行抗肿瘤细胞活性测试。
(1)测试方法:将各化合物配制成100μg·ml-1的甲醇溶液,阳性对照药5-氟尿嘧啶(5-fu)和多烯紫杉醇(docetaxol)分别配成100μg·ml-1的二甲基亚砜(dmso)溶液,分别以甲醇和dmso溶剂为空白对照,采用mtt法测试各化合物对k562细胞、hl-60细胞、hela细胞、bgc-823细胞的抑制作用。
(2)细胞培养液的配制:将一袋rpmi-1640培养基粉末(netwt10.4g)倒入干净的烧杯中,用900ml超净水将其溶解,并加入100mg·ml-1的链霉素1ml、青霉素0.5ml及nahco32g。磁力搅拌均匀后,于超净台中用已高压灭菌的蔡氏(zeiss)滤器经0.22μm滤膜过滤除菌,滤液直接保存于湿热灭菌后的玻璃瓶中(450ml/瓶)。培养基使用前,取冷冻保藏的血清,56℃灭活30min后,加入已配好rpmi-1640培养液中(450ml培养基中加入50ml血清),轻轻摇匀后,加盖,用锡箔纸封口,于4℃冰箱中保存。mtt溶液配制:50mg的mtt(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)粉末溶解于10ml的pbs溶液中,用0.22μm的滤膜过滤,于4℃冰箱中保存。
(3)抗肿瘤细胞活性测试:分别取生长对数期的k562细胞、hl-60细胞、hela细胞、bgc-823细胞,于4℃、3000rpm离心机上离心3min,吸去上清液,加入新鲜的rpmi-1640培养基稀释成1×105个/毫升的细胞悬液。每孔200μl接种于96孔板中,于37℃、5%co2的细胞培养箱中培养1h后,每孔各加样品溶液2μl,每个样品设3个平行孔,另设两组各三孔的空白对照,加样后以相同条件培养24h。24h后,在光学显微镜下观察细胞有无形态变化,初步判断样品有无细胞毒活性,必要时进行拍照。每孔加入5mg·ml-1的mtt溶液各20μl,培养箱中继续培养4h。取出96孔板离心(4℃、2000rpm,20min)除去上清液,每孔各加150μldmso,充分振荡使紫色沉淀物完全溶解。在酶标仪上于570nm下测定其光密度od值,每组样品取平均值并按ir%=(od空白-od样品)/od空白×100%公式计算抑制率(ir%)。
利用mtt法测试化合物2a-2j对四种肿瘤细胞的增殖抑制活性,结果见表1。
表1化合物2a-2j对四种肿瘤细胞的增殖抑制活性的mtt法测试结果
由表1可知,本发明制备的2-甲基-1,8-萘啶类化合物对k562细胞、hl-60细胞、hela细胞、bgc-823细胞具有一定的抑制作用,表明了其具有一定的抗肿瘤细胞活性,在抗肿瘤细胞药物中具有潜在应用价值。其中,化合物如2i、2j对k562细胞的增值抑制作用与现有药物5-氟尿嘧啶、多烯紫杉醇相当。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!