一种藜麦皂苷的分离方法和泡沫分离装置与流程
本发明涉及化工技术领域,尤其涉及一种藜麦皂苷的分离方法和泡沫分离装置。
背景技术:
藜麦(学名:chenopodiumquinoawilld),原产于南美洲安第斯山区,是印加土著居民的主要传统食物,有5000-7000多年的食用和种植历史,其具有独特的营养价值。藜麦种子颜色主要有白、黑、红等几种颜色系,营养成分相差不大,其中白色口感最好,黑、红色口感相对差些,籽粒也较小。藜麦按皂苷含量分为甜藜麦和苦藜麦;藜麦含有蛋白质和人体必须的多种氨基酸,不含麸质,富含b族维生素及微量元素,属于碱性食品,然而其具有一项需要后天改善的缺陷,即含有藜麦皂苷。
皂苷是藜麦籽粒外部一层防护性物质,皂苷还是藜麦中主要的抗营养物质,会阻碍某些营养素的吸收,味苦,有微毒。因此,在食用藜麦前需要将其中皂苷去除。
传统皂苷的提取纯化工艺主要采用有机溶剂提取,大孔吸附树脂分离精制,但存在选择性差,有机溶剂消耗量大,环境污染较严重,成本较高等缺点。
技术实现要素:
有鉴于此,本发明实施例提供了一种藜麦皂苷的分离方法和泡沫分离装置,主要目的是解决分离藜麦皂苷污染大、成本高及不易操作的问题。
为达到上述目的,本发明主要提供了如下技术方案:
一方面,本发明实施例提供了一种藜麦皂苷的分离方法,所述方法是采用泡沫分离技术对藜麦皂苷进行分离提取;其中,所述泡沫分离技术中原料液的的浓度为0.4413-0.6620mg/ml,温度为15-25℃,通气流速20-40ml/min,原料液体积为150-250ml。
作为优选,所述泡沫分离技术中原料液的浓度为0.4815-0.5884mg/ml,温度为20-25℃,通气流速20-35ml/min,原料液体积为200-250ml。
作为优选,所述泡沫分离技术中原料液的浓度为0.4815-0.5296mg/ml,温度为21-25℃,通气流速20-30ml/min,原料液体积为210-250ml。
作为优选,所述泡沫分离技术中原料液的浓度为0.4996-0.5296mg/ml,温度为22-25℃,通气流速21-25ml/min,原料液体积为220-250ml。
作为优选,所述泡沫分离技术中原料液的浓度为0.5092-0.5296mg/ml,温度为23-25℃,通气流速21-23ml/min,原料液体积为230-250ml。
作为优选,所述泡沫分离技术中原料液的浓度为0.5192-0.5296mg/ml,温度为24-25℃,通气流速21-22ml/min,原料液体积为240-250ml。
作为优选,所述泡沫分离技术中原料液的浓度为0.5296mg/ml,温度为25℃,通气流速22ml/min,原料液体积为250ml。
作为优选,所述泡沫分离技术中,藜麦皂苷富集比为2.0-2.6,回收率为42%-52%。
作为优选,所述原料液的ph值为3-5;所述藜麦的品种为青藜一号。
作为优选,所述原料液的ph值为5。
另一方面,本发明实施例提供了一种泡沫分离装置,包括:
一方面,本发明实施例提供了一种泡沫分离装置,包括:
泡沫分离单元,其由泡沫分离塔和循环水夹套管组成,所述泡沫分离塔设于所述循环水夹套管的内部,所述泡沫分离塔的外壁与所述循环水夹套管的内壁之间形成用于容纳循环水的腔体;所述泡沫分离塔用于将藜麦皂苷粗提液中的泡沫和溶液分离开;所述循环水夹套管的上部设有循环水出水口,下部设有循环水入水口;所述泡沫分离塔的顶部设有泡沫出口,底部设有进气口;
送气单元,其由空气压缩机、气体安全瓶及气体流量计依次通过软管连接组成,所述气体流量计通过软管连接至所述泡沫分离塔的进气口;
循环水单元,所述循环水单元的出水口与所述循环水夹套管的循环水入水口连通,所述循环水夹套管的循环水出水口与所述循环水单元的入水口连通,所述循环水单元为所述泡沫分离塔提供恒温水浴;
泡沫收集单元,其由收集弯头和收集器皿组成;使用状态下,所述收集弯头的一端插入所述泡沫分离塔顶部的泡沫出口并形成紧密连接,所述收集器皿用于收集容纳分离出的泡沫;
分离液抽出单元,其由无油真空泵和液体安全瓶组成;使用状态下,所述液体安全瓶通过软管从所述泡沫分离塔顶部的泡沫出口处插入所述泡沫分离塔的内部,所述泡沫分离塔内的分离液被抽出至液体安全瓶内。
作为优选,所述收集弯头由内管和外管组成,外管设于所述内管的外面,外管与内管之间形成腔体,内管与外管在收集弯头的两个端口处闭合,泡沫分离塔顶的泡沫从所述收集弯头的内管中流出。
作为优选,所述收集弯头的第一弯折处夹角为90°,所述收集弯头的第二弯折处夹角为90°。
作为优选,所述泡沫分离塔底的通气口处设有气体分布板,其是孔径为30微米的微孔砂芯滤板,由烧结玻璃料制成。
作为优选,所述收集弯头的出口处直径为20mm,所述循环水夹套管的直径为60mm,所述泡沫分离塔的直径为40mm;所述通气口处设有阀门;所述收集弯头、所示泡沫分离塔、所述循环水夹套管的材质均为玻璃。
与现有技术相比,本发明的有益效果是:
本发明为皂苷的分离精制引入泡沫分离技术,利用该技术的绿色环保、设备简单、操作简便、运行成本低且特别适于处理低浓度药液等特点,在三萜皂苷分离精制工艺方面进行大胆创新和尝试;本发明通过考察不同气流速度、进料质量浓度、液面高度、温度等因素对藜麦皂苷泡沫分离过程的影响,并通过响应面试验设计优化泡沫分离工艺条件,为开发藜麦皂苷的清洁生产工艺提供理论依据。
附图说明
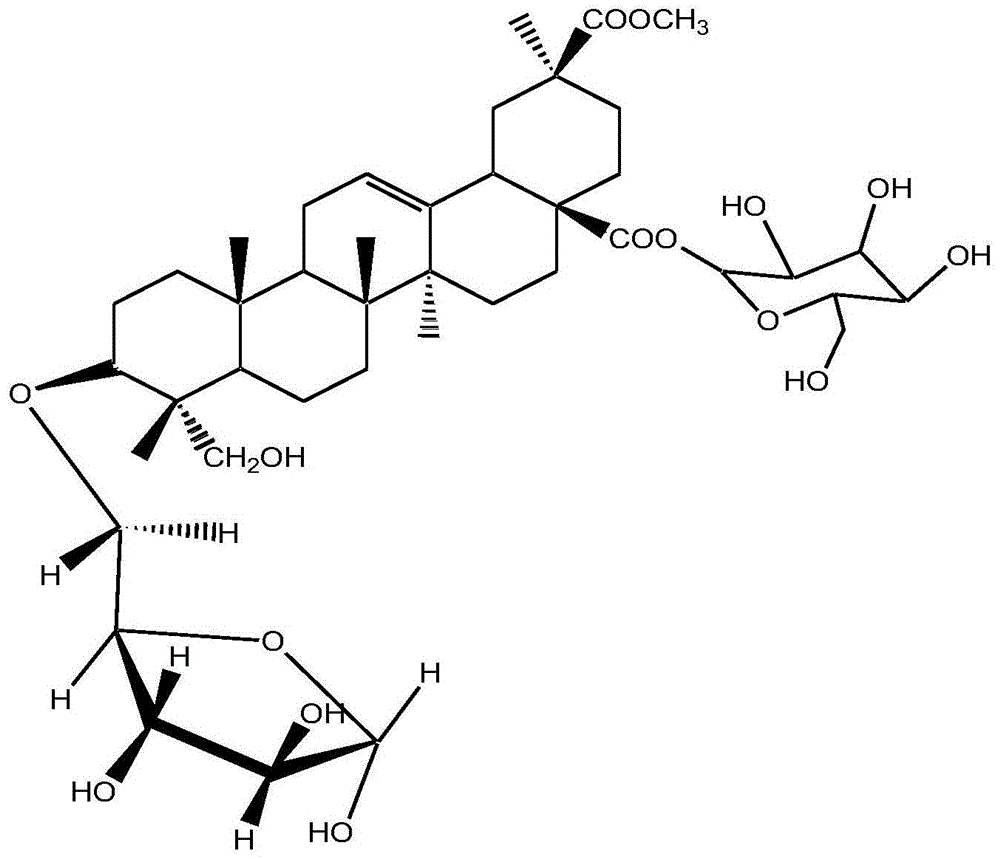
图1是本发明实施例提供的藜麦皂苷a化学分子结构式;
图2是本发明实施例提供的原料溶液稀释倍数对藜麦皂苷泡沫分离效果影响曲线图;
图3是本发明实施例提供的温度对藜麦皂苷泡沫分离效果影响曲线图;
图4是本发明实施例提供的气体流量对藜麦皂苷泡沫分离效果影响曲线图;
图5是本发明实施例提供的不同液体体积对藜麦皂苷泡沫分离效果影响曲线图;
图6是本发明实施例提供的不同ph对藜麦皂苷泡沫分离效果影响曲线图;
图7是本发明实施例提供的泡沫分离装置结构示意图;
图8是本发明实施例提供的泡沫分离单元结构示意图;
图9是本发明实施例提供的收集弯头结构示意图;
图10是本发明实施例提供的分离液抽出单元示意图。
附图标记:
1泡沫分离单元,101泡沫分离塔,102循环水夹套,103循环水入水口,104循环水出水口,105泡沫出口,106进气口,107气体分布板;
2送气单元,201空气压缩机,202气体安全瓶,203气体流量计;
3循环水单元,301出水口,302入水口;
4泡沫收集单元,401收集弯头,402收集器皿;
5分离液抽出单元,501无油真空泵,502液体安全瓶。
具体实施方式
为更进一步阐述本发明为达成预定发明目的所采取的技术手段及功效,以下以较佳实施例,对依据本发明申请的具体实施方式、技术方案、特征及其功效,详细说明如后。下述说明中的多个实施例中的特定特征、结构、或特点可由任何合适形式组合。
实施例1
材料与试剂:
藜麦产自青海省海西州都兰县海拔3200米,青藜一号,由青海高远锦禾生态农牧科技有限公司提供;藜麦皂苷a对照品(含量≥98%),由青海高远锦禾生态农牧科技有限公司自制;高氯酸(分析纯),香草醛(分析纯),冰醋酸(分析纯),乙醇(分析纯),实验用水为去离子水。
仪器与设备:
752型紫外可见分光光度计(上海舜宇恒平科学仪器有限公司),
re-52aa旋转蒸发仪(上海亚荣生化仪器厂),
jp-030s超声波清洗机(深圳市洁盟清洗设备有限公司),
fa2004分析天平(上海舜宇恒平科学仪器有限公司),
101-1s电热鼓风干燥箱(邦西仪器科技(上海)有限公司),
hh-2水浴锅(常州智博瑞仪器制造有限公司),
泡沫分离装置,可选用本发明实施例2自制分离设备(效果更优),也可采用现有设备。
lzb-fb玻璃转子流量计(苏州化工仪表有限公司),
ots-1500无油空气压缩机(台州市奥突斯工贸有限公司),
hh-501超级恒温水浴(金坛市城东新瑞仪器厂)。
实验方法:
(1)绘制藜麦皂苷标准曲线:藜麦籽实中的皂苷为三萜皂苷,以往在没有藜麦皂苷对照品的情况下通常选用齐墩果酸为对照品,但藜麦皂苷因含有糖苷配基分子量一般在700以上,而齐墩果酸不含糖苷配基分子量为456.71,故实验室通过高效液相色谱纯化制备了藜麦皂苷a,分子结构如下,分子量810.44,并以藜麦皂苷a为对照品建立含量测定方法。
准确称取藜麦皂苷a对照品6.60mg,置25ml量瓶中加甲醇溶解并稀释至刻度,制成0.264mg/ml的标准储备溶液。
分别精密量取藜麦皂苷a标准储备溶液各0、400、600、800、1000、1200、1400μl置于干燥的具塞试管中,60℃蒸干,取出放冷,依次加入5%香草醛冰醋酸溶液0.2ml和高氯酸0.8ml,摇匀,于60℃水浴中保温15min,取出,用冰水浴冷却10min,加入4ml冰醋酸,摇匀。选取藜麦皂苷a800μl的标准溶液,于400~760nm范围进行扫描,选定最大吸收波长为测定波长;在最大吸收波长处测定各标准溶液的吸光度a,以吸光度a为纵坐标,以相应对照品浓度(mg/ml)为横坐标,绘制标准曲线,得回归方程为:y=10.206x-0.0236,r=0.9994,线性范围:0.02112~0.07392mg/ml。
(2)制备样品溶液:取藜麦种皮粉末,称取25g,加水250ml,超声波提取1h,静置2h,取上层溶液离心后再取上清液过滤,制得样品溶液(药液含生药0.1g/ml)。
(3)将不同倍数稀释的样品溶液作为原料液加入泡沫分离装置中,再从塔底通气,富集得到的泡沫由塔顶排出,而经泡沫分离后的残留液则由塔底排出;分别测定原料液、泡沫液和残留液中藜麦皂苷,计算回收率、富集比以筛选出藜麦总皂苷的最佳泡沫分离工艺条件。
(4)评价指标:以回收率、富集比评价泡沫分离效果
回收率/%=泡沫液中藜麦皂苷的总质量/原料液中藜麦皂苷的总质量×100%;
富集比=泡沫液中藜麦皂苷的质量浓度/原料液中藜麦皂苷的质量浓度。
(5)泡沫分离法纯化藜麦皂苷单因素试验:分别以初始浓度、温度、气流速度、装入液体体积、ph值和离子强度为单因素进行单因素试验,考察各单因素对泡沫分离法纯化藜麦皂苷效果的影响,重复3次。
(6)响应面试验设计:根据box-behnken原理设计试验,在单因素试验的基础上采用四因素三水平的响应面分析方法进一步试验;选择稀释倍数、温度、气体流量、液体体积4个因素为自变量,以藜麦皂苷回收率和富集比为响应值,确定这4个自变量对藜麦皂苷回收率和富集比的影响,以及最佳工艺条件组合;试验因素与水平设计见表1。
藜麦中三萜皂苷含量较高,提取后的水溶液起泡性好,由于藜麦皂苷化合物分子结构中含有羧基和羟基造成水溶液偏酸性,ph值为5.0左右,考虑到实际操作时溶液ph对泡沫分离结果的影响和调节溶液ph值需使用酸碱物质容易带入杂质等原因,最终选取稀释倍数、温度、气体流量、液体体积4个因素进行响应面试验。
表1.box-behnken试验设计因素及水平
结果与分析-单因素试验结果:
(1)原料溶液稀释倍数对皂苷泡沫分离效果的影响:在相同泡沫分离装置上,加入不同稀释倍数的样品溶液200ml,浮选温度20℃,浮选气流量30ml/min的条件下进行间歇式浮选操作,至不再有泡沫溢出时停止浮选,测定经泡沫分离后残留溶液和泡沫液的体积,并测定两种溶液中藜麦皂苷的浓度,考察初始浓度对分离效果的影响。
由图2可知,藜麦皂苷富集比随原料溶液稀释倍数的增加而增大,回收率随样品溶液稀释倍数的增加先增大而后减小;随着样品溶液稀释倍数的增加料液中皂苷的质量浓度减小,使泡沫的稳定性减小,泡沫所夹带的液体量减少,因此藜麦皂苷富集比升高而回收率先升高在稀释倍数为20倍时达到最大,再随着稀释倍数的增加逐渐减小;综合考虑,当稀释倍数在50倍左右时,泡沫分离效果较好。
(2)温度对藜麦皂苷泡沫分离的影响:在相同泡沫分离装置上,加入50倍稀释的样品溶液200ml,浮选气流量30ml/min,不同温度的条件下进行间歇式浮选操作,至不再有泡沫溢出时停止浮选,测定经泡沫分离后残留溶液和泡沫液的体积,并测定两种溶液中藜麦皂苷的浓度,考察温度对分离效果的影响。
由图3可见,随着温度升高,藜麦皂苷回收率随之降低,富集比却随之增大,当温度达到30℃时不再会有泡沫溢出。实验过程中,温度的升高会降低泡沫液膜的表面黏度,减小了扩散阻力,吸附阻力降低,吸附量增大,但表面黏度是泡沫稳定性的主要影响因素,当黏度减小时,泡沫液膜易变薄,泡沫不稳定,容易破裂,富集比增加同时回收率降低;温度的降低会使泡沫液膜的表面黏度增加泡沫挟带的过多的液体使富集比降低同时回收率增加,过高或过低的温度都不利于泡沫分离操作,只有温度适宜才能得到好的泡沫分离效果。综合考虑操作成本与富集比和回收率之间关系,当原料液温度为20℃左右时,分离效果较好。
(3)气体流量对藜麦皂苷泡沫分离的影响:在相同泡沫分离装置上,加入50倍稀释的样品溶液200ml,浮选温度20℃,不同气体流量的条件下进行间歇式浮选操作,至不再有泡沫溢出时停止浮选,测定经泡沫分离后残留溶液和泡沫液的体积,并测定两种溶液中藜麦皂苷的浓度,考察气体流量对分离效果的影响。
由图4可见,随着气体流量的增大,藜麦皂苷富集比降低,回收率却随之增加。较低的气体流量条件下,由于泡沫到达塔顶的时间较长,泡沫排水时间较长,使泡沫挟带的液体量减少,导致富集比增加同时回收率降低;在较高的气体流量下,泡沫中挟带的液体量增加,使吸附于泡沫中的藜麦皂苷浓度降低,使富集比降低同时回收率增加。综合考虑,当气体流量为30ml/min时泡沫分离效果较好。
(4)液体体积对藜麦皂苷泡沫分离的影响:在相同泡沫分离装置上,加入50倍稀释的样品溶液200ml,浮选温度20℃,浮选气流量30ml/min,不同液体体积的条件下进行间歇式浮选操作,至不再有泡沫溢出时停止浮选,测定经泡沫分离后残留溶液和泡沫液的体积,并测定两种溶液中藜麦皂苷的浓度,考察液体体积对分离效果的影响。
由图5可知,回收率随着液体体积的增加呈现先上升后下降的趋势,当液体体积为300ml时回收率达到最大,富集比随着液体体积的增加呈下降趋势。这是因为随着液体体积的增大,鼓泡区变大相应的泡沫分离区减小,泡沫中挟带的液体在尚未回流前即被鼓出,因此回收率在300ml之前呈现增加的趋势,当液体体积超过300ml后由于泡沫在上升过程中与液体的接触时间延长使皂苷扩散进入液体富集比降低,虽然鼓出的泡沫量增加但和液体体积的增加量相比回收率仍呈下降的趋势。综合考虑两个指标,当装入的液体体积在200ml时,泡沫分离效果较好。
(5)ph值对藜麦皂苷泡沫分离的影响:在相同泡沫分离装置上,加入50倍稀释的样品溶液200ml,浮选温度20℃,浮选气流量30ml/min,不同ph值液体的条件下进行间歇式浮选操作,至不再有泡沫溢出时停止浮选,测定经泡沫分离后残留溶液和泡沫溶液的体积,并测定两种溶液中藜麦皂苷的浓度,考察溶液ph值对分离效果的影响。
由图6可知,回收率随着溶液ph值的增大呈现波动下降的趋势,当ph值为3.0时回收率达到最大值71.7%,富集比随着溶液ph值的增大呈现波动变化,当ph值为5.0时达到最大值2.22。50倍稀释的样品溶液ph值未经调整时为5.0,此ph值下回收率为50.6%。考虑到操作成本、后期处理和环保等因素,泡沫分离以不调整溶液ph值为好。
响应面试验结果:
(1)响应面试验设计及结果:选择稀释倍数、温度、气体流量、液体体积4个因素进行响应面试验,响应面box-behnken试验设计及结果见表2。
表2.box-behnken试验设计及结果
(2)回归模型的建立与检验:对表2试验数据进行多元回归拟合后,得到藜麦皂苷富集比、回收率与稀释倍数、温度、气体流量、液体体积的回归方程:
富集比=+1.75+0.16*a+0.41*b-0.39*c-0.026*d+0.002250*a*b+
0.018*a*c+0.018*a*d+0.019*b*c+0.087*b*d-0.029*c*d+0.012*a2-0.018*b2-0.014*c2+0.015*d2;
回收率=+0.53-0.053*a-0.035*b+0.087*c+0.066*d+0.000*a*b-0.004.250*a*c+0.003750*a*d+0.010*b*c+0.010*b*d+0.018*c*d-0.007458*a2-0.010*b2+0.005542*c2-0.016*d2;
其中,a表示稀释倍数;b表示温度,单位℃;c表示气体流量,单位ml/min;d表示液体体积,单位ml。
对两回归方程进行方差分析:结果见表3、表4。
表3.富集比的回归方差分析
注:*显著差异(p<0.05),**极显著差异(p<0.01)。
由表3可知,该模型达到极显著水平(p<0.01),模型的调整确定系数r2=0.9843,该模型能解释98.43%响应值的变化,校正决定系数r2adj=0.9674,可知该回归方程拟合度和可信度均很高,因而该模型拟合程度比较好,试验误差小,故可用于设计范围内的预测。对表3回归模型系数的显著性分析可见,一次项中,a、b、c极显著;交互项中bd显著,说明bd之间存在显著的交互作用。
表4.回收率的回归方差分析
由表4可知,该模型达到极显著水平(p<0.01),模型的调整确定系数r2=0.9720,该模型能解释97.20%响应值的变化,校正决定系数r2adj=0.9418,可知该回归方程拟合度和可信度均很高,因而该模型拟合程度比较好,试验误差小,故可用于设计范围内的预测。对表4回归模型系数的显著性分析可见,一次项中,a、b、c、d极显著。
通过以上实验数据可知:藜麦皂苷富集比随着稀释倍数、温度、气体流量的变化会产生较大变化;稀释倍数越大,温度越高,气体流量越小藜麦皂苷富集比越高。同理,藜麦皂苷回收率随着稀释倍数、温度、气体流量和液体体积的变化会产生较大变化;稀释倍数越小,温度越低,气体流量越大,液体体积越大,藜麦皂苷回收率越高。
上述实施例中,当原料液稀释倍数为40-60倍时,换算成原料液浓度为0.4413-0.6620mg/ml;当稀释倍数为45-55倍时,原料液浓度为0.4815-0.5884mg/ml;当稀释倍数为50-55倍时,原料液浓度为0.4815-0.5296mg/ml;当稀释倍数50-53倍时,原料液浓度为0.4996-0.5296mg/ml;当稀释倍数为50-52时,原料液浓度为0.5092-0.5296mg/ml;当稀释倍数为50-51时,原料液浓度为0.5192-0.5296mg/ml;当稀释倍数为50倍时,原料液浓度为0.5296mg/ml。
本发明根据上述确立的响应面模型,通过design-expert软件得出泡沫分离藜麦皂苷皂苷的最优分离条件(确立最大富集比的前提下,优选回收率较大):稀释倍数50.78、温度25.00℃、气体流量21.73ml/min、液体体积250.00ml;预测藜麦皂苷的最优富集比为2.56,回收率为45.00%。
本发明为验证上述试验确立的最佳工艺条件,结合实际需求,控制稀释倍数50(原料液浓度0.5296mg/ml)、温度25℃、气体流量22ml/min、液体体积250ml;在上述条件下,平行实验3次,得到藜麦皂苷富集比为2.53,回收率为46.08%,充分说明本发明的上述试验优化的工艺条件可靠可行,可工业化生产。
本发明为藜麦皂苷的分离精制引入泡沫分离技术,利用该技术的绿色环保、设备简单、操作简便、运行成本低且特别适于处理低浓度药液等特点,在三萜皂苷分离精制工艺方面进行大胆创新和尝试。
其中,泡沫分离技术为现有技术,其是一种基于溶液中溶质组分间表面活性的差异进行分离的新型技术,由于泡沫分离法具有设备简单、操作方便、运行成本低、环境友好和适于大规模工业化生产等优点;泡沫分离技术中涉及的工艺参数包括进料浓度、溶液ph值、分离温度、通气气流速度、液体体积等;泡沫分离设备一般采用泡沫分离塔,入口为原料液体,气体进料口在塔底部,泡沫液由塔顶排除,经泡沫分离后的料液由塔底出料口排出,泡沫分离装置可采用现有技术中常用分离设备。
泡沫分离技术中,溶液中含有表面活性物质是泡沫分离的必要条件之一,本发明发现藜麦皂苷具有亲水性的糖基和疏水性的皂苷元,是一种优良的天然非离子型表面活性成分,具有良好的起泡性,因此本发明认为藜麦皂苷粗提液具备了泡沫分离的必要条件,可以利用泡沫分离技术对皂苷进行分离,本发明采用该技术可大幅度减少常规技术中有机溶剂的使用量,同时也降低了废水排放量,可实现藜麦皂苷高效、简便和环境友好的分离提取。本发明利用泡沫分离法提取藜麦中皂苷的构思在本领域中还未曾有人公开或使用。
实施例2
一种泡沫分离装置,包括:
泡沫分离单元,其由泡沫分离塔和循环水夹套管组成,所述泡沫分离塔设于所述循环水夹套管的内部,所述泡沫分离塔的外壁与所述循环水夹套管的内壁之间形成用于容纳循环水的腔体;所述泡沫分离塔用于将藜麦皂苷粗提液中的泡沫和溶液分离开;所述循环水夹套管的上部设有循环水出水口,下部设有循环水入水口;所述泡沫分离塔的顶部设有泡沫出口,底部设有进气口;
送气单元,其由空气压缩机、气体安全瓶及气体流量计依次通过软管连接组成,所述气体流量计通过软管连接至所述泡沫分离塔的进气口;
循环水单元,所述循环水单元的出水口与所述循环水夹套管的循环水入水口连通,所述循环水夹套管的循环水出水口与所述循环水单元的入水口连通,所述循环水单元为所述泡沫分离塔提供恒温水浴;
泡沫收集单元,其由收集弯头和收集器皿组成;使用状态下,所述收集弯头的一端插入所述泡沫分离塔顶部的泡沫出口并形成紧密连接,所述收集器皿用于收集容纳分离出的泡沫;
分离液抽出单元,其由无油真空泵和液体安全瓶组成;使用状态下,所述液体安全瓶通过软管从所述泡沫分离塔顶部的泡沫出口处插入所述泡沫分离塔的内部,所述泡沫分离塔内的分离液被抽出至液体安全瓶内。
作为上述实施例的优选,所述收集弯头由内管和外管组成,外管设于所述内管的外面,外管与内管之间形成腔体,内管与外管在收集弯头的两个端口处闭合,泡沫分离塔顶的泡沫从所述收集弯头的内管中流出。设计双层管的优点是为了使泡沫流经收集弯头时,加快泡沫流速,促使泡沫破裂,减少泡沫体积便于容器的收集,否则收集容器需要很大的容积。
作为上述实施例的优选,所述收集弯头的第一弯折处夹角为90°,所述收集弯头的第二弯折处夹角为90°。设计90度夹角的优点是因为连续的两个90°弯头改变了泡沫的流动方向,是泡沫由下向上的运动变为由上向下的运动,便于在重力的作用下将泡沫收集进入收集器皿中。
作为上述实施例的优选,所述泡沫分离塔底的通气口处设有气体分布板,其是孔径为30微米的微孔砂芯滤板,由烧结玻璃料制成。
作为上述实施例的优选,所述收集弯头的出口处直径为20mm,所述循环水夹套管的直径为60mm,所述泡沫分离塔的直径为40mm;所述通气口处设有阀门;所述收集弯头、所示泡沫分离塔、所述循环水夹套管的材质均为玻璃。
上述泡沫分离装置的使用方法:使用时,先不安装收集弯管,将需要分离的皂苷提取液从塔顶的泡沫出口处加入到泡沫分离塔内;打开循环水单元,设定水温,使循环水达到设定的温度,并使温度保持恒定5min以上;再将收集弯管插入所述泡沫出口并插紧,放好收集器皿,打开送气单元,启动空气压缩机,调节气体流量计使送气速度稳定在规定的气体流量值,开始泡沫分离过程;待泡沫收集弯管出口处不再有泡沫溢出时取下泡沫收集器皿和收集弯头;将连接有无油真空泵和液体安全瓶的塑料软管从分离塔顶部的泡沫出口处插入泡沫分离塔内的分离液中并将分离液抽出至液体安全瓶内,完成皂苷提取液的泡沫分离过程;使用结束后需要再加入纯净水清洗泡沫分离塔两次。
本发明实施例中未尽之处,本领域技术人员均可从现有技术中选用。
以上公开的仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以上述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!