一种从毛蚶中提取两种金属硫蛋白的方法与流程
本发明涉及生物技术和蛋白质工程领域,尤其是涉及一种从毛蚶中提取两种金属硫蛋白的方法。
背景技术:
金属硫蛋白(metallothionein,mt)是一类低分子量、高巯基含量、能结合金属离子具有独特性能的一类金属结合蛋白质,作为一类高度可诱导性的内源性蛋白,广泛存在于从细菌到哺乳动物的多种生物体内。
mt的生物学功能主要与细胞核组织的应激反应有关,mt的生物学功能主要与细胞核组织的应激反应有关,表现为体内必需金属元素(cu,zn,co,ni等)的储运、代谢和精细调节以及非必需金属元素(cd,hg,ag,pb等)的解毒,清除自由基、抗辐射和紫外线照射,防止细胞癌变等;另外,由于mt广泛存在动物、植物、微生物中,且与重金属结合的性质,不仅可以用于监测海洋环境重金属污染状况,也可作为衡量环境重金属污染状况的一个生物指标,除此之外还可用于重金属的回收和清除环境中的重金属污染等方面。mt也将有望通过基因工程技术来治理重金属污染,如通过植物自身mt的表达或外源基因导入来实现植土壤的重金属污染,另一方面通过水生生物富集作用减少水体中的重金属含量从而维持生态系统稳定。
国内市场上常见的mt主要是从兔肝中提取,有关兔肝mt的提取技术通常采用缓冲液提取、有机溶剂沉淀除杂、热变性除杂、乙醇沉淀mt等工艺,由于工艺中使用大量乙醇和氯仿,不但生产工艺繁琐,产品成本居高不下,而且会污染环境,另外采用兔肝提取mt,由于mt原料需求特别,且生产工艺复杂,生产量存在着严重的不足、资源有限,从而使其应用和研究受到限制。
现在也有采用匀浆离心法提取海洋动物mt,而毛蚶属于滤食性双壳贝类,体内易富集重金属,且价格低廉易于养殖,是提取金属硫蛋白的理想原料,但是目前尚未见到关于从毛蚶中提取金属硫蛋白的研究报道。
申请公布号cn109206507a,申请公布日2019.01.15的中国专利公开了一种从虾夷扇贝中同时提取两种亚型金属硫蛋白的方法,通过氯化锌诱导、多次离心提取、用填料为聚甲基丙烯酸酯的分子筛预装柱一次纯化及阴离子交换层析二次纯化的方法从虾夷扇贝内脏中提取金属硫蛋白。该方法存在以下不足:(1)由于从不同的水生物中提取金属硫蛋白的方法和参数不尽相同,因此该方法不适用从毛蚶中提取金属硫蛋白;(2)该方法中通过滤膜去除杂蛋白和非蛋白物质,但去除不彻底,导致残留有少量小分子多肽及无机盐小分子,会影响产物的纯度;(3)对原料进行直接匀浆,不易溶出,提取率较低。
技术实现要素:
本发明的发明目的是为提供了一种原料来源广泛,制备工艺简单,操作简便,高效快速,提取率与mt纯度高,能降低工业生产成本,适合工厂化、规模化生产的从毛蚶中提取两种金属硫蛋白的方法。
为了实现上述目的,本发明采用以下技术方案:
本发明的一种从毛蚶中提取两种金属硫蛋白的方法,包括以下步骤:
(1)诱导
将毛蚶在海水中暂养后暴露于氯化锌海水中进行诱导。毛蚶应选取生长活力良好的毛蚶个体,擦洗去除粘附的杂物,海水为充氧后的天然海水。
(2)粗提
将诱导后的毛蚶解剖、匀浆,得匀浆组织,在匀浆组织中加入tris-hcl缓冲液及促蛋白溶解剂,得提取液;将提取液进行超声提取,超声提取期间通入氮气进行微气泡曝气,提取后离心取上清液,上清液经水浴加热后快速冷却,加入乙醇沉淀后,将沉淀物收集加入tris-hcl缓冲液中重新溶解,离心分离取上清液,经冷冻干燥,得粗提物。本发明中在提取时加入了促蛋白溶解剂,同时采用超声以促进mt溶出,并配合微气泡曝气,使得微气泡能在超声作用下瞬间破裂形成微射流,不仅能实现提取液各组分之间的均匀混合,还能大大提高mt提取率及提取效率;通过水浴加热、醇沉及tris-hcl缓冲液复溶多个步骤之间的相互配合,以充分去除杂蛋白、小分子多肽及无机盐小分子等杂质,不仅有利于提高产物的纯度,而且有利于减少后续处理压力。
(3)凝胶过滤柱层析初步纯化
取上述粗提物溶于tris-hcl缓冲液中,基于全自动蛋白纯化仪,选用enrichsec70分子筛预装柱进行凝胶过滤柱层析,等度洗脱,洗脱液用全自动收集器收集,每管收集2ml,根据色谱图收集主要组分,真空冷冻干燥后收集该组分,将其命名为mts。
(4)deae阴离子交换层析分离毛蚶mt-ii、毛蚶mt-i
基于全自动蛋白纯化仪,选用弱阴离子交换剂进行柱层析,梯度洗脱,洗脱液用全自动收集器收集,每管收集3ml,根据色谱图中的保留时间收集两种主要组分,真空冷冻干燥后将两组分分别命名为毛蚶mt-i、毛蚶mt-ii,真空冷冻干燥后低温冻存。
(5)脱盐
选用sephadexg-25凝胶介质对毛蚶mt-i和毛蚶mt-ii分别进行脱盐,根据色谱图收集主要组分,最后将收集的样品冷冻干燥后低温冻存。mt经离子交换层析之后,其中还含有较多的盐分,因此需要进一步脱盐处理,以保证口mt的纯度。
作为优选,步骤(1)中,海水条件为盐度24±1,ph8.0±0.2,水温23±1℃,暂养2d,期间不投喂饵料,每天更换氯化锌海水,诱导7天。
作为优选,所述氯化锌海水中氯化锌的浓度为50~55μmol/l。
作为优选,步骤(2)中,在0~4℃条件下对毛蚶进行解剖、匀浆。
作为优选,步骤(2)中,所述tris-hcl缓冲液浓度为0.15~0.2mol/l,ph为8.15~8.45,所述促蛋白溶解剂为氯化钠,提取料液比为1:(5~7),提取液中氯化钠浓度为0.13~0.15mol/l;超声提取温度为30~35℃,提取时间30~40min,水浴加热温度为70~80℃,乙醇体积为上清液体积3~4倍,2~4℃沉淀10~12h。nacl在190~200nm处有紫外吸收,因此对结合zn的金属硫蛋白的紫外吸收峰不存在干扰,因此本发明中促蛋白溶解剂为氯化钠;在上述条件下,毛蚶组织mt可获得较佳提取效果,平均提取含量达0.695mg/g。
作为优选,步骤(3)中,凝胶过滤柱层析的具体步骤为:称取50mg粗提物,溶于5mlph8.15~8.45的0.01~0.015mol/ltris-hcl缓冲溶液中;取1ml上样,等度洗脱,流动相为0.01~0.015mol/ltris-hcl缓冲溶液,流速1.0ml/min,检测波长220nm。
作为优选,步骤(4)中,柱层析的具体步骤为:层析柱填料deae-sepharosetmfastflow,层析柱规格为1.6×80cm的中高压玻璃柱,称取20mgmts,溶于2mlph8.15~8.45的0.01mol/ltris-hci缓冲溶液中,选用梯度洗脱,流动相a超纯水,流动相b0.5mol/lnac1,流速2.0ml/min,检测波长220nm。
作为优选,步骤(4)中,洗脱梯度条件为:0~10%流动相a,100%~90%流动相b,洗脱柱体积1cv;10%~50%流动相a,90%~50%流动相b,洗脱柱体积2cv;50%~100%流动相a,50%~0%流动相b,洗脱柱体积2cv;0%流动相a,100%流动相b,洗脱柱体积1cv。
作为优选,步骤(5)中,脱盐的具体步骤为:层析柱规格为1.5×50cm的中高压玻璃柱,分别称取适量mt-i、mt-ii溶于超纯水,流动相为超纯水,流速1.0ml/min,检测波长220nm,洗脱液用全自动收集器收集,每管收集3ml。
作为优选,步骤(4)、步骤(5)中低温为-20℃及以下。
因此,本发明具有如下有益效果:以毛蚶为原料,开发设计了一种从毛蚶中提取两种金属硫蛋白的方法,原料来源广泛,制备工艺简单,操作简便,高效快速,提取率与mt纯度高,能降低工业生产成本,适合工厂化、规模化生产。
附图说明
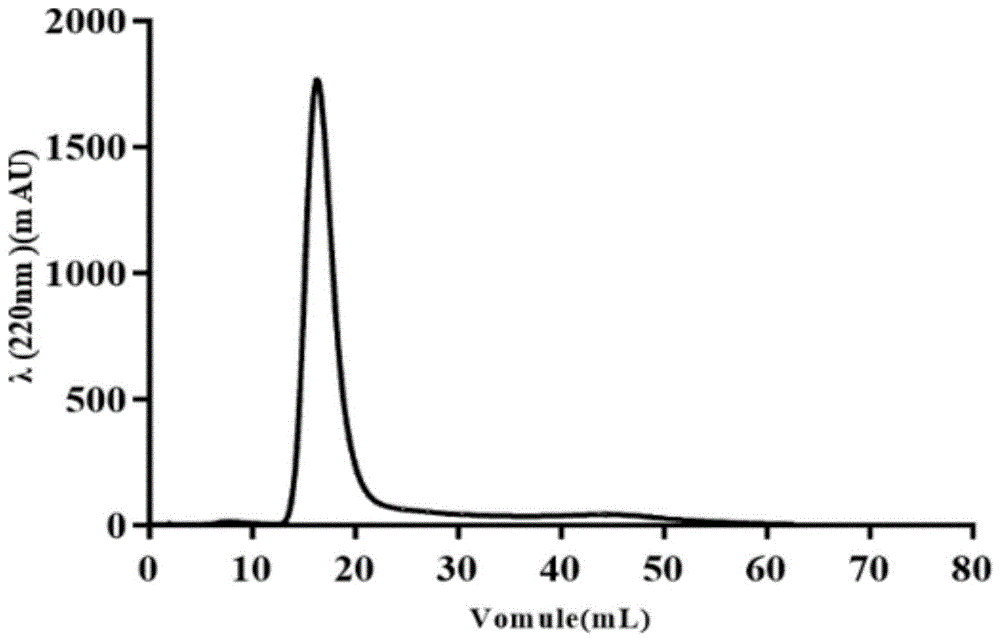
图1为实施例1中的凝胶过滤柱层析色谱图。
图2为实施例1中的阴离子交换柱层析色谱图。
图3为实施例1中的脱盐色谱图。
图4为实施例1中的电泳图谱。
图中:m:预染超低分子量蛋白marker电泳谱带;1兔肝mt对照品谱带;2毛蚶mt-i谱带;3毛蚶mt-ⅱ谱带;4毛蚶mts谱带;5毛蚶粗提物谱带。
具体实施方式
下面结合附图和具体实施方式对本发明做进一步的描述。
实施例1
(1)诱导
毛蚶选取生长活力良好的毛蚶个体,擦洗去除粘附的杂物,将毛蚶在充氧的天然海水(盐度24±1,ph8.0±0.2,水温23±1℃)中暂养2d,期间不投喂饵料;将暂养后的毛蚶放入玻璃养殖箱中,20只/箱,每天更换50μmol/l氯化锌海水,诱导7d后,取出毛蚶个体,在0~4℃条件下解剖毛蚶,将其组织匀浆后进行提取。
(2)粗提
将诱导后的毛蚶解剖、匀浆,得匀浆组织,在匀浆组织中加入浓度为0.18mol/l、ph为8.45的tris-hcl缓冲液及促蛋白溶解剂氯化钠,得提取液,提取料液比为1:6,提取液中氯化钠浓度为0.15mol/l;将提取液进行超声提取,超声提取期间通入氮气进行微气泡曝气,提取后离心取上清液,上清液经水浴加热后快速冷却,加入乙醇沉淀后,将沉淀物收集加入浓度为0.18mol/l、ph为8.45的tris-hcl缓冲液中重新溶解,离心分离取上清液,经冷冻干燥,得粗提物,超声提取温度为35℃,提取时间30min,水浴加热温度为80℃,乙醇体积为上清液体积3倍,4℃沉淀12h。
(3)凝胶过滤柱层析初步纯化
取上述粗提物溶于tris-hcl缓冲液中,基于全自动蛋白纯化仪,选用enrichsec70分子筛预装柱进行凝胶过滤柱层析,凝胶过滤柱层析的具体步骤为:称取50mg粗提物,溶于5mlph8.45的0.01mol/ltris-hcl缓冲溶液中;取1ml上样,等度洗脱,每管收集2ml,流动相为0.01mol/ltris-hcl缓冲溶液,流速1.0ml/min,检测波长220nm;洗脱液用全自动收集器收集,每管收集2ml,凝胶过滤柱层析色谱图如图1所示,根据色谱图收集主要组分,真空冷冻干燥后收集该组分,将其命名为mts。
(4)deae阴离子交换层析分离mt-ii、mt-i
基于全自动蛋白纯化仪,选用弱阴离子交换剂进行柱层析,柱层析的具体步骤为:层析柱填料deae-sepharosetmfastflow,层析柱规格为1.6×80cm的中高压玻璃柱,称取20mgmts,溶于2mlph8.45的0.01mol/ltris-hci缓冲溶液中,选用梯度洗脱,梯度洗脱条件见表1,流动相a超纯水,流动相b0.5mol/lnac1,流速2.0ml/min,检测波长220nm;洗脱液用全自动收集器收集,每管收集3ml,根据色谱图中的保留时间收集两种主要组分,阴离子交换柱层析色谱图见图2,真空冷冻干燥后将两组分分别命名为毛蚶mt-i、毛蚶mt-ii,真空冷冻干燥后-20℃冻存。
表1阴离子交换层析洗脱梯度
(5)脱盐
选用sephadexg-25凝胶介质对mt-i和mt-ii分别进行脱盐,脱盐的具体步骤为:层析柱规格为1.5×50cm的中高压玻璃柱,分别称取适量mt-i、mt-ii溶于超纯水,流动相为超纯水,流速1.0ml/min,检测波长220nm,洗脱液用全自动收集器收集,每管收集3ml,脱盐色谱图见图3,根据色谱图收集主要组分,最后将收集的样品冷冻干燥后-20℃冻存。
采用tricine-sds-page测定毛蚶mt不同纯化阶段的相对分子质量,通过与对照品兔肝zn-mt进行比较鉴定。采用圆二色谱(cd)和傅里叶变换红外光谱(ft-ir)技术对毛蚶mt在水溶液中的二级结构进行了表征,确定了毛蚶zmt在溶液状态的二级结构。
(1)tricine-sds-page测定毛蚶中mt的相对分子质量
选用15.5%的分离胶、夹层胶及5%的浓缩胶。分别取30μl毛蚶mt粗提液、分子筛初步纯化产物,mt-i、mt-ⅱ溶液于2ml离心管中,浓度均为1μg/μl,加入10μl4×的上样缓冲液,充分混匀,100℃水浴5min,冷却至室温后上样。
电泳过程:将电泳槽置于4℃水浴中,向外槽中加入阳极缓冲溶液,在内槽中加入阴极缓冲溶液,在30v下电泳预15分钟。将样品加入到点样孔中后,在50v下进行电泳1小时,随后在100v下电泳直至溴酚蓝到达凝胶底部。停止电泳并进行后续的考马斯蓝染色。
染色、脱色:电泳结束后,关掉电源,取出玻璃板,在长短两块玻璃板下角空隙内,用塑料刀片轻轻撬动,即将胶面与一块玻璃板分开,然后轻轻将胶片托起,放入大培养皿中染色,使用0.25%的考马斯亮蓝染液,45℃染色30分钟,弃去染色液,用蒸馏水把胶面漂洗几次,然后加入脱色液,进行扩散脱色,每隔20min换脱色液,直至蛋白质带清晰为止。
选用bio-rad-2500凝胶成像仪拍照,电泳图谱见图4。通过tris-tricine-sds-page凝胶电泳测得毛蚶与兔肝中的金属硫蛋白相对分子量较为接近。毛蚶初步纯化产物mts相对分子量为17.79kda,阴离子交换层析分离得到的毛蚶mt-i、毛蚶mt-ⅱ相对分子量分别为17.63kda、17.16kda,制备的毛蚶mt-i、毛蚶mt-ⅱ电泳杂条带少,蛋白纯度高。
实施例2
(1)诱导
毛蚶选取生长活力良好的毛蚶个体,擦洗去除粘附的杂物,将毛蚶在充氧的天然海水(盐度24±1,ph8.0±0.2,水温23±1℃)中暂养2d,期间不投喂饵料;将暂养后的毛蚶放入玻璃养殖箱中,20只/箱,每天更换52μmol/l氯化锌海水,诱导7d后,取出毛蚶个体,在0~4℃条件下解剖毛蚶,将其组织匀浆后进行提取。
(2)粗提
将诱导后的毛蚶解剖、匀浆,得匀浆组织,在匀浆组织中加入浓度为0.15mol/l、ph为8.30的tris-hcl缓冲液及促蛋白溶解剂氯化钠,得提取液,提取料液比为1:5,提取液中氯化钠浓度为0.14mol/l;将提取液进行超声提取,超声提取期间通入氮气进行微气泡曝气,提取后离心取上清液,上清液经水浴加热后快速冷却,加入乙醇沉淀后,将沉淀物收集加入浓度为0.15mol/l、ph为8.30的tris-hcl缓冲液中重新溶解,离心分离取上清液,经冷冻干燥,得粗提物,超声提取温度为32℃,提取时间35min,水浴加热温度为75℃,乙醇体积为上清液体积3.5倍,3℃沉淀11h。
(3)凝胶过滤柱层析初步纯化
取上述粗提物溶于tris-hcl缓冲液中,基于全自动蛋白纯化仪,选用enrichsec70分子筛预装柱进行凝胶过滤柱层析,凝胶过滤柱层析的具体步骤为:称取50mg粗提物,溶于5mlph8.30的0.012mol/ltris-hcl缓冲溶液中;取1ml上样,等度洗脱,每管收集2ml,流动相为0.012mol/ltris-hcl缓冲溶液,流速1.0ml/min,检测波长220nm;洗脱液用全自动收集器收集,每管收集2ml,凝胶过滤柱层析色谱图与图1基本相同,故不赘述,根据色谱图收集主要组分,真空冷冻干燥后收集该组分,将其命名为mts。
(4)deae阴离子交换层析分离mt-ii、mt-i
基于全自动蛋白纯化仪,选用弱阴离子交换剂进行柱层析,柱层析的具体步骤为:层析柱填料deae-sepharosetmfastflow,层析柱规格为1.6×80cm的中高压玻璃柱,称取20mgmts,溶于2mlph8.30的0.012mol/ltris-hci缓冲溶液中,选用梯度洗脱,梯度洗脱条件见实施例1中表1,流动相a超纯水,流动相b0.5mol/lnac1,流速2.0ml/min,检测波长220nm;洗脱液用全自动收集器收集,每管收集3ml,根据色谱图中的保留时间收集两种主要组分,阴离子交换柱层析色谱图与图2基本相同,故不赘述,真空冷冻干燥后将两组分分别命名为毛蚶mt-i、毛蚶mt-ii,真空冷冻干燥后-20℃冻存。
(5)脱盐
选用sephadexg-25凝胶介质对mt-i和mt-ii分别进行脱盐,脱盐的具体步骤为:层析柱规格为1.5×50cm的中高压玻璃柱,分别称取适量mt-i、mt-ii溶于超纯水,流动相为超纯水,流速1.0ml/min,检测波长220nm,洗脱液用全自动收集器收集,每管收集3ml,脱盐色谱图与图3基本相同,故不赘述,根据色谱图收集主要组分,最后将收集的样品冷冻干燥后-20℃冻存。
实施例3
(1)诱导
毛蚶选取生长活力良好的毛蚶个体,擦洗去除粘附的杂物,将毛蚶在充氧的天然海水(盐度24±1,ph8.0±0.2,水温23±1℃)中暂养2d,期间不投喂饵料;将暂养后的毛蚶放入玻璃养殖箱中,20只/箱,每天更换55μmol/l氯化锌海水,诱导7d后,取出毛蚶个体,在0~4℃条件下解剖毛蚶,将其组织匀浆后进行提取。
(2)粗提
将诱导后的毛蚶解剖、匀浆,得匀浆组织,在匀浆组织中加入浓度为0.2mol/l、ph为8.15的tris-hcl缓冲液及促蛋白溶解剂氯化钠,得提取液,提取料液比为1:7,提取液中氯化钠浓度为0.13mol/l;将提取液进行超声提取,超声提取期间通入氮气进行微气泡曝气,提取后离心取上清液,上清液经水浴加热后快速冷却,加入乙醇沉淀后,将沉淀物收集加入浓度为0.2mol/l、ph为8.15的tris-hcl缓冲液中重新溶解,离心分离取上清液,经冷冻干燥,得粗提物,超声提取温度为30℃,提取时间40min,水浴加热温度为70℃,乙醇体积为上清液体积4倍,2℃沉淀10h。
(3)凝胶过滤柱层析初步纯化
取上述粗提物溶于tris-hcl缓冲液中,基于全自动蛋白纯化仪,选用enrichsec70分子筛预装柱进行凝胶过滤柱层析,凝胶过滤柱层析的具体步骤为:称取50mg粗提物,溶于5mlph8.15的0.015mol/ltris-hcl缓冲溶液中;取1ml上样,等度洗脱,每管收集2ml,流动相为0.015mol/ltris-hcl缓冲溶液,流速1.0ml/min,检测波长220nm;洗脱液用全自动收集器收集,每管收集2ml,凝胶过滤柱层析色谱图与图1基本相同,故不赘述,根据色谱图收集主要组分,真空冷冻干燥后收集该组分,将其命名为mts。
(4)deae阴离子交换层析分离mt-ii、mt-i
基于全自动蛋白纯化仪,选用弱阴离子交换剂进行柱层析,柱层析的具体步骤为:层析柱填料deae-sepharosetmfastflow,层析柱规格为1.6×80cm的中高压玻璃柱,称取20mgmts,溶于2mlph8.15的0.015mol/ltris-hci缓冲溶液中,选用梯度洗脱,梯度洗脱条件见实施例1中表1,流动相a超纯水,流动相b0.5mol/lnac1,流速2.0ml/min,检测波长220nm;洗脱液用全自动收集器收集,每管收集3ml,根据色谱图中的保留时间收集两种主要组分,阴离子交换柱层析色谱图与图2基本相同,故不赘述,真空冷冻干燥后将两组分分别命名为毛蚶mt-i、毛蚶mt-ii,真空冷冻干燥后-20℃冻存。
(5)脱盐
选用sephadexg-25凝胶介质对mt-i和mt-ii分别进行脱盐,脱盐的具体步骤为:层析柱规格为1.5×50cm的中高压玻璃柱,分别称取适量mt-i、mt-ii溶于超纯水,流动相为超纯水,流速1.0ml/min,检测波长220nm,洗脱液用全自动收集器收集,每管收集3ml,脱盐色谱图与图3基本相同,故不赘述,根据色谱图收集主要组分,最后将收集的样品冷冻干燥后-20℃冻存。
本发明以毛蚶为原料,开发设计了一种从毛蚶中提取两种金属硫蛋白的方法,原料来源广泛,制备工艺简单,操作简便,高效快速,提取率与mt纯度高(达98.1%左右),能降低工业生产成本,适合工厂化、规模化生产。
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
- 还没有人留言评论。精彩留言会获得点赞!