一种多能干细胞诱导产生小胶质细胞的方法及试剂盒与流程
本发明涉及干细胞生物学领域,特别是一种多能干细胞诱导产生小胶质细胞的方法及试剂盒。
背景技术:
干细胞(stemcell)是存在于多细胞生物体内的一类未充分分化的细胞。干细胞可以通过有丝分裂进行自我更新产生更多的干细胞,也可以通过分裂及分化形成多种不同特化类型的细胞、组织与器官。诱导性多能干细胞(inducedpluripotentstemcell,ipsc),是一类利用在哺乳动物体细胞内转入转录因子或小分子化合物等手段而获得的新型干细胞,通常也具有与胚胎干细胞类似的三胚层分化能力,理论上可以分化为成体所有的组织器官。
诱导性多能干细胞理论上都具有分化为所有类型特化细胞的能力,非常适合通过细胞替代疗法,替换因疾病而受损的细胞或补充功能性细胞,实现功能重建。在体外培养的条件下,诱导性多能干细胞可以在特定的诱导条件下,具有分化成各种类型特化细胞的潜能。诱导性多能干细胞的分化潜能为干细胞治疗提供了基础。通过多能干细胞分化获得的特化细胞类型,有利于进行进一步的基因功能鉴定及靶标药物的筛选。
小胶质细胞是一种先天免疫细胞,作为一种位于中枢神经系统的组织特异性吞噬细胞存在。在胚胎发育过程中,小胶质细胞由胚外卵黄囊血岛组织内通过初级造血作用形成的红髓系祖细胞(erythromyeloidprogenitorcell,emp)沿神经管迁移至胚胎神经组织,经过a1及a2两个前体阶段,最终发育形成树杈状的成熟形态。在正常生理条件下,小胶质细胞发挥着监视微环境变化,维持神经系统稳态,损伤应答及病原吞噬的功能,对维持神经元的健康及神经系统的稳定至关重要。在阿尔兹海默症、帕金森氏综合症、亨延顿氏病、肌萎缩侧索硬化、创伤性脑损伤等多种神经退行性疾病中,小胶质细胞的过度激活导致吞噬功能的异常及炎症因子的过度释放,无法发挥正常功能的同时,还会导致神经元的进一步损伤和死亡。因此获得具有良好功能的小胶质细胞对于神经疾病的预防与治疗具有重要意义。
多能干细胞在体外分化体系中通过以下程序分化形成小胶质细胞:拟胚体、中胚层纤维状细胞、初级造血干细胞、小胶质细胞前体细胞及形态功能的成熟。由于这种复杂性,来自干细胞的小胶质细胞模型建立至关重要。此外,由于小胶质细胞分化方案发展较晚,分化方案较少,其分化结果依然难以控制,同时花费时间也较长,甚至可能超过60天。
因此,需要提供一种简单且便利的方法来分化并获得小胶质细胞。
技术实现要素:
本发明所要解决的技术问题为如何通过简单且便利的方法诱导产生小胶质细胞。
为解决上述技术问题,本发明首先提供了一种用于诱导产生小胶质细胞的试剂盒,包括培养基iii、培养基iv、培养基v、培养基vi和培养基vii;
所述培养基iii为在hpc分化培养基中添加骨形态发生蛋白4、成纤维细胞生长因子-2、激活素a、y-27632和氯化锂得到;其中,所述骨形态发生蛋白4在所述培养基iii中的含量为50ng/ml;所述成纤维细胞生长因子-2在所述培养基iii中的含量为50ng/ml;所述激活素a在所述培养基iii中的含量为12.5ng/ml;所述y-27632在所述培养基iii中的含量为1μm;所述氯化锂在所述培养基iii中的含量为2mm;
所述培养基iv为在hpc分化培养基中添加血管内皮生长因子和成纤维细胞生长因子-2得到;其中,所述血管内皮生长因子在所述培养基iv中的含量为50ng/ml;所述成纤维细胞生长因子-2在所述培养基iv中的含量为50ng/ml;
所述培养基v为在培养基iv中添加血小板生成素、白介素-6、白介素-3和干细胞因子得到;其中,所述血小板生成素在所述培养基v的含量为50ng/ml;所述白介素-6在所述培养基v的含量为50ng/ml;所述白介素-3在所述培养基v的含量为10ng/ml;所述干细胞因子在所述培养基v的含量为10ng/ml;
所述培养基vi为在facs缓冲液中添加人干细胞因子得到;其中,所述人干细胞因子在所述培养基vi的含量为10ng/ml;
所述培养基vii为在mgl分化培养基中添加巨噬细胞集落刺激因子、转化生长因子β1、白介素-34、人粒细胞-巨噬细胞集落刺激因子和人fms样的酪氨酸激酶3配体得到;其中,所述巨噬细胞集落刺激因子在所述培养基vii中的含量为25ng/ml;所述转化生长因子β1在所述培养基vii中的含量为50ng/ml;所述白介素-34在所述培养基vii中的含量为100ng/ml;所述人粒细胞-巨噬细胞集落刺激因子在所述培养基vii中的含量为50ng/ml;所述人fms样的酪氨酸激酶3配体在所述培养基vii中的含量为25ng/ml。
上述试剂盒中,所述hpc分化培养基为以imdm培养基和ham’sf12培养基(体积比为1∶1)为基础添加its-x、l-抗坏血酸2-磷酸倍半镁盐水合物、1-硫代甘油、聚(乙烯醇)、glutamax-i添加剂、化学成分确定的脂质浓缩物、mem非必须氨基酸溶液和青霉素/链霉素溶液得到;其中,所述its-x在hpc分化培养基的体积百分含量为2%,所述l-抗坏血酸2-磷酸倍半镁盐水合物在hpc分化培养基的含量为64μg/ml,所述1-硫代甘油在hpc分化培养基的含量为400μm,所述聚(乙烯醇)在hpc分化培养基的含量为10μg/ml,所述glutamax-i添加剂在hpc分化培养基的体积百分含量为1%,所述化学成分确定的脂质浓缩物在hpc分化培养基的体积百分含量为1%,所述mem非必须氨基酸溶液在hpc分化培养基的体积百分含量为1%,所述青霉素/链霉素溶液在hpc分化培养基的体积百分含量为1%。
上述试剂盒中,所述facs缓冲液为以1×磷酸盐缓冲液为基础添加牛血清白蛋白和乙二胺四乙酸得到;其中,所述牛血清白蛋白在facs缓冲液的体积百分含量为2%,所述乙二胺四乙酸在facs缓冲液的含量为0.05mm。
上述试剂盒中,所述mgl分化培养基是以dmem/f-12培养基(含hepes,不含酚红)为基础添加its-g、b-27添加剂、n-2添加剂、1-硫代甘油、glutamax-i添加剂、mem非必须氨基酸溶液、青霉素/链霉素溶液和人胰岛素蛋白得到;其中,所述its-g在mgl分化培养基的体积百分含量为2%,所述b-27添加剂在mgl分化培养基的体积百分含量为2%,所述n-2添加剂在mgl分化培养基的体积百分含量为0.5%,所述1-硫代甘油在mgl分化培养基的含量为200μm,所述glutamax-i添加剂在mgl分化培养基的体积百分含量为1%,所述mem非必须氨基酸溶液在mgl分化培养基的体积百分含量为1%,所述青霉素/链霉素溶液在mgl分化培养基的体积百分含量为1%,所述人胰岛素蛋白在mgl分化培养基的含量为5μg/ml。
上述试剂盒还包括培养基viii,所述培养基viii为在mgl分化培养基中添加巨噬细胞集落刺激因子、转化生长因子β1、白介素-34、白细胞分化抗原-200和人趋化因子fractalkine得到;其中,所述巨噬细胞集落刺激因子在所述培养基viii的含量为25ng/ml;所述转化生长因子β1在所述培养基viii的含量为50ng/ml;所述白介素-34在所述培养基viii的含量为100ng/ml;所述白细胞分化抗原-200在所述培养基viii的含量为100ng/ml;所述人趋化因子fractalkine在所述培养基viii的含量为100ng/ml。
上述试剂盒还包括培养基i和培养基ii;
所述培养基i为干细胞培养基;
所述培养基ii为在培养基i中添加y-27632得到;其中,所述y-27632在培养基ii中的含量为10μm。
上述试剂盒中,所述干细胞培养基为人多潜能干细胞培养基(pgm1培养基)。
上述试剂盒在诱导产生小胶质细胞中的应用也在本发明的保护范围之内。
上述应用中,是以多能干细胞为出发细胞诱导产生小胶质细胞。
本发明进一步提供了一种多能干细胞诱导产生小胶质细胞的方法。
本发明诱导产生小胶质细胞的方法,包括以下步骤:
1)将多能干细胞接种在上述培养基iii,培养2天,收集细胞;
2)将步骤1)收集的细胞转移至上述培养基iv中,培养2天,收集细胞;
3)将步骤2)收集的细胞转移至上述培养基v中,培养6天,收集细胞;
4)将步骤3)收集的细胞转移至上述培养基vi中,收集cd43+造血祖细胞;
5)将步骤4)收集的cd43+造血祖细胞转移至上述培养基vii中,培养25天,收集细胞,得到小胶质细胞。
上述方法中,所述步骤2)中使用的培养基iv是经过脱氧处理的。
上述方法中,所述步骤3)每天需要补充培养基v。
上述方法还包括:
6)将步骤5)收集的小胶质细胞转移至上述培养基viii中,培养3天,收集细胞,得到成熟的小胶质细胞。
上述方法中,在步骤1)之前包括以下步骤:
a1)将多能干细胞接种于上述培养基i中,培养4-5天,收集细胞;
a2)将步骤a1)收集的细胞接种于上述培养基ii中,培养1天,收集细胞,得到用于接种上述培养基iii的多能干细胞。
上述方法中,所述步骤a1)培养至细胞贴壁生长至50%-70%,收集细胞;且培养期间每天更换一次培养基。
上述方法中,在步骤a1)之后、步骤a2)之前加入accutase细胞消化液在37℃,5%co2的加湿培养箱静置4分钟。
上述方法中,所述步骤a2)的接种密度为50000细胞/cm2。
上述方法中,所述步骤1)和步骤2)所述培养的条件均为37℃,5%co2,5%o2;步骤a1)、步骤a2)、步骤3)、步骤4)、步骤5)、步骤6)所述培养的条件均为37℃,5%co2。
上述方法中,所述多能干细胞可包括但不限于诱导性多能干细胞(hipsc)、成体(adult)干细胞、体性(somatic)干细胞、癌症干细胞或具有分化能力的任何其他细胞。
本发明多能干细胞诱导产生小胶质细胞的方法分为两步,经过初级造血祖细胞,成功将多能干细胞诱导分化为能产生大量具有特殊形态、表达特异性标志物和良好吞噬功能的成熟小胶质细胞,不需要共培养技术及基因重组技术,通过单一细胞类型的体外培养方式,自多能干细胞获得成熟小胶质细胞仅需花费35-40天,方法简单、便利,有效地控制多能干细胞向功能性小胶质细胞的诱导,减少诱导时间并降低成本,使得研究小胶质细胞的基因功能、发掘小胶质细胞发育过程关键节点及新的治疗靶点成为可能,也为构建具有特定疾病防治功能的小胶质细胞提供了基础,为小胶质细胞的细胞替代疗法提供来源。
附图说明
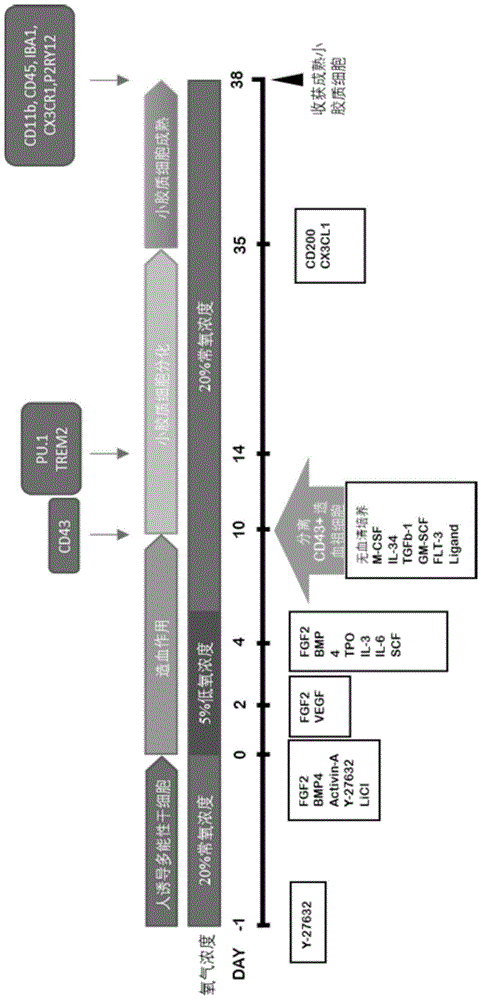
图1为人多能干细胞诱导产生成熟小胶质细胞的流程图。
图2为多能干细胞诱导产生造血祖细胞第10天免疫流式分析结果。
图3为造血祖细胞诱导产生小胶质细胞第4天免疫荧光染色结果。
图4为成熟小胶质细胞的流式分析和免疫荧光染色结果;其中,a为表面标志蛋白的流式分析结果;b为p2ry12免疫荧光染色结果;c为iba1、aβ免疫荧光染色结果;d为cx3cr1、aβ免疫荧光染色结果;e为p2ry12、iba1、cx3cr1阳性率统计结果。
图5为成熟小胶质细胞与小鼠原代神经元共培养免疫荧光染色结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
1、下述实施例中所用的试剂:
(1)人多潜能干细胞培养基(pgm1)(北京赛贝生物技术有限公司,#ca1007500)
(2)1×磷酸盐缓冲液(pbs)(不含ca2+或mg2+)(invitrogen/gibco,#10010023)
(3)accutase细胞消化液(bd,#561527)
(4)imdm培养基(thermofisher/gibco,#12440053)
(5)ham’sf12培养基(thermofisher/gibco,#11765054)
(6)dmem/f-12培养基(含hepes,不含酚红)(thermofisher/gibco,#11039021)
(7)基质胶(matrigel,corning,#356234)
(8)人成纤维细胞生长因子-2(humanfgf-basic,peprotech,#af-100-18b)
(9)人干细胞因子(humanscf,peprotech,#300-07)
(10)人血管内皮生长因子(humanvegf,peprotech,#100-20)
(11)人血小板生成素(humantpo,peprotech,#300-18)
(12)人巨噬细胞集落刺激因子(humanm-csf,peprotech,#300-25)
(13)人白介素-6(humanil-6,peprotech,#200-06)
(14)人白介素-3(humanil-3,peprotech,#200-03)
(15)人白介素-34(humanil-34,peprotech,#200-34)
(16)人转化生长因子β1(humantgf-beta1-mammalian,peprotech,#100-21)
(17)人趋化因子fractalkine(humanfractalkine,peprotech,#300-31)
(18)激活素a(humanactivin-a,peprotech,#120-14)
(19)人白细胞分化抗原-200(humancd200,novoprotein,#c311)
(20)胰岛素-转铁蛋白-硒(its-g)(1003)(thermofisher/gibco,#41400045)
(21)胰岛素-转铁蛋白-硒-乙醇胺(its-x)(1003)(thermofisher/gibco,#51500056)
(22)l-抗坏血酸2-磷酸倍半镁盐水合物(sigma-aldrich,#a8960)
(23)1-硫代甘油(sigma-aldrich,#m1753)
(24)聚(乙烯醇)(sigma-aldrich,#p8136)
(25)氯化锂(sigma-aldrich,#l7026)
(26)化学成分确定的脂质浓缩物(thermofisher/gibco,#11905031)
(27)mem非必须氨基酸溶液(thermofisher/gibco,#11140050)
(28)glutamax-i添加剂(thermofisher/gibco,#35050061)
(29)b-27添加剂(thermofisher/gibco,#17504044)
(30)n-2添加剂(thermofisher/gibco,#17502048)
(31)青霉素/链霉素溶液(thermofisher/gibco,#15140122)。该青霉素/链霉素溶液中,青霉素的含量为10,000u/ml的青霉素和链霉素的含量为10,000μg/ml链霉素。
(32)apc-cd43抗体(clonecd43-10g7)(biolegend,#343206)
(33)人胰岛素蛋白(sigma-aldrich,#91077c)
(34)y-27632(selleck,#s1049)
(35)4%多聚甲醛溶液(北京润泽康生物科技有限公司,#b1057-100)
(36)牛血清白蛋白(bsa,easybio,#be6254)
(37)tritonx-100(sigma-aldrich,#hpa014518)
(38)叠氮化钠(sigma-aldrich,#s2002)
(39)兔抗人p2ry12抗体(sigma-aldrich,#s2002)
(40)兔抗人pu.1抗体(scellsignalingtechnology,#2266s)
(41)羊抗人trem2抗体(r&dsystems,#af1828)
(42)兔抗人cx3crl抗体(bio-rad/abdserotec,#ahp1589)
(43)leaf标记鼠抗人cd11b抗体(biolegend,#301312)
(44)apc-cyanine7标记鼠抗人cd45(hi30)抗体(tonbobiosciences,#25-0459-t10)
(45)alexafluor488标记驴抗兔igg(h+l)二抗(jackson,#711-545-152)
(46)alexafluor488标记驴抗鼠igg(h+l)二抗(jackson,#711-545-150)
(47)alexafluor594标记驴抗兔igg(h+l)二抗(jackson,#711-585-152)
(48)alexafluor568标记驴抗羊igg(h+l)二抗(thermofisher/gibco,#a-11057)
(49)alexafluor647标记驴抗羊(h+l)二抗(thermofisher/gibco,#a32849)
(50)人trustainfcxtm封闭剂(biolegend,#422301)
(51)鼠抗人nuclei抗体(sigma-aldrich,#fcmab306)
(52)羊抗人doublecortin抗体(santacruz,#sc-8066)
(53)人粒细胞-巨噬细胞集落刺激因子(humangm-csf,peprotech,#300-03)
(54)人fms样的酪氨酸激酶3配体(humanflt-3ligand,peprotech,#300-19)
(55)0.5m乙二胺四乙酸(edta,thermofisher/gibco,#15575020)
(56)兔抗人ibal抗体(wako,#019-19741)
(57)人诱导性多能干细胞(北京赛贝生物技术有限公司,#ca4027106)。
2、下述实施例中所用的培养基:
hpc分化培养基
所述hpc分化培养基为以imdm培养基和ham’sf12培养基(体积比为1∶1)为基础添加its-x、l-抗坏血酸2-磷酸倍半镁盐水合物溶液、1-硫代甘油溶液、聚(乙烯醇)溶液、glutamax-i添加剂、化学成分确定的脂质浓缩物、mem非必须氨基酸溶液和青霉素/链霉素溶液得到;其中,所述its-x在hpc分化培养基的体积百分含量为2%,所述l-抗坏血酸2-磷酸倍半镁盐水合物在hpc分化培养基的含量为64μg/ml,所述1-硫代甘油在hpc分化培养基的含量为400μm,所述聚(乙烯醇)在hpc分化培养基的含量为10μg/ml,所述glutamax-i添加剂在hpc分化培养基的体积百分含量为1%,所述化学成分确定的脂质浓缩物在hpc分化培养基的体积百分含量为1%,所述mem非必须氨基酸溶液在hpc分化培养基的体积百分含量为1%,所述青霉素/链霉素溶液在hpc分化培养基的体积百分含量为1%。
配置方法如下:
1、将imdm培养基与ham’sf12培养基按体积比一比一混合均匀后备用;
2、称取0.64gl-抗坏血酸2-磷酸倍半镁盐水合物溶于10ml水中,0.22μm过滤器过滤,得到溶液,4℃保存;
3、称取0.1g聚(乙烯醇)溶于10ml水中,0.22μm过滤器过滤,得到溶液,4℃保存;
4、吸取100μl1-硫代甘油加入11.4ml水中,0.22μm过滤器过滤,得到溶液,4℃保存;
5、取40ml步骤1中培养基,加入1mlits-x,0.5mlglutamax-i添加剂,0.5ml化学成分确定的脂质浓缩物,0.5mlmem非必须氨基酸溶液,0.5ml青霉素/链霉素溶液,50μl步骤2中溶液,50μl步骤3中溶液,200μl步骤4中溶液;
6、加入步骤1中培养基定容至50ml,混合均匀后0.22μm过滤器过滤,4℃保存。
facs缓冲液
所述facs缓冲液为以1×磷酸盐缓冲液为基础添加牛血清白蛋白(bsa)和乙二胺四乙酸(edta)得到,其中,所述bsa在facs缓冲液的体积百分含量为2%,所述edta在facs缓冲液的含量为0.05mm。
配置方法如下:
取40mll×磷酸盐缓冲液,称取1g牛血清白蛋白,振荡混匀至完全溶解后,加入0.5ml0.5m乙二胺四乙酸,加入1×磷酸盐缓冲液定容至50ml,混合均匀后0.22μm过滤器过滤,4℃保存。
mgl分化培养基
mgl分化培养基是以dmem/f-12培养基(含hepes,不含酚红)为基础添加its-g、b-27添加剂、n-2添加剂、1-硫代甘油溶液、glutamax-i添加剂、mem非必须氨基酸溶液、青霉素/链霉素溶液和人胰岛素蛋白溶液得到;其中,所述its-g在mgl分化培养基的体积百分含量为2%,所述b-27添加剂在mgl分化培养基的体积百分含量为2%,所述n-2添加剂在mgl分化培养基的体积百分含量为0.5%,所述1-硫代甘油在mgl分化培养基的含量为200μm,所述glutamax-i添加剂在mgl分化培养基的体积百分含量为1%,所述mem非必须氨基酸溶液在mgl分化培养基的体积百分含量为1%,所述青霉素/链霉素溶液在mgl分化培养基的体积百分含量为1%,所述人胰岛素蛋白在mgl分化培养基的含量为5μg/ml。
配置方法如下:
1、吸取100μl1-硫代甘油加入11.4ml水中,0.22μm过滤器过滤,得到溶液,4℃保存;
2、称取100mg人胰岛素白蛋白,加入7ml水中,缓慢将溶液ph值调至3.0左右(25℃),人胰岛素白蛋白完全溶解后加入水定容至10ml,22μm过滤器过滤,得到溶液,-20℃保存;
3、取40mldmem/f-12培养基(含hepes,不含酚红),加入1mlits-g,1ml2%b-27添加剂,0.25mln-2添加剂,0.5mlglutamax-i添加剂,0.5mlmem非必须氨基酸溶液,0.5ml青霉素/链霉素溶液,1ml100μl步骤1中溶液,25μl步骤2中溶液;
6、加入dmem/f-12培养基(含hepes,不含酚红)定容至50ml,混合均匀后0.22μm过滤器过滤,4℃保存。
培养基i
培养基i为人多潜能干细胞培养基(pgm1培养基)。
培养基ii
培养基ii为在上述培养基i中添加y-27632得到;其中,所述y-27632在培养基ii中的含量为10μm。
培养基iii
培养基iii为在hpc分化培养基中添加骨形态发生蛋白4、成纤维细胞生长因子-2、激活素a、y-27632和氯化锂得到;其中,所述骨形态发生蛋白4在所述培养基iii中的含量为50ng/ml;所述成纤维细胞生长因子-2在所述培养基iii中的含量为50ng/ml;所述激活素a在所述培养基iii中的含量为12.5ng/ml;所述y-27632在所述培养基iii中的含量为1μm;所述氯化锂在所述培养基iii中的含量为2mm。
培养基iv
培养基iv为在所述hpc分化培养基中添加血管内皮生长因子和成纤维细胞生长因子-2得到;其中,所述血管内皮生长因子在所述培养基iv中的含量为50ng/ml;所述成纤维细胞生长因子-2在所述培养基iv中的含量为50ng/ml。
培养基v
培养基v为在上述培养基iv中添加血小板生成素、白介素-6、白介素-3和干细胞因子得到;其中,所述血小板生成素在所述培养基v的含量为50ng/ml;所述白介素-6在所述培养基v的含量为50ng/ml;所述白介素-3在所述培养基v的含量为10ng/ml;所述干细胞因子在所述培养基v的含量为10ng/ml。
培养基vi
培养基vi为在facs缓冲液中添加人干细胞因子得到;其中,所述人干细胞因子在所述培养基vi的含量为10ng/ml。
培养基vii
培养基vii为在mgl分化培养基中添加巨噬细胞集落刺激因子、转化生长因子β1、白介素-34、人粒细胞-巨噬细胞集落刺激因子和人fms样的酪氨酸激酶3配体得到;其中,所述巨噬细胞集落刺激因子在所述培养基vii中的含量为25ng/ml;所述转化生长因子β1在所述培养基vii中的含量为50ng/ml;所述白介素-34在所述培养基vii中的含量为100ng/ml;所述人粒细胞-巨噬细胞集落刺激因子在所述培养基vii中的含量为50ng/ml;所述人fms样的酪氨酸激酶3配体在所述培养基vii中的含量为25ng/ml。
培养基viii
培养基viii为在mgl分化培养基中添加巨噬细胞集落刺激因子、转化生长因子β1、白介素-34、白细胞分化抗原-200和人趋化因子fractalkine得到;其中,所述巨噬细胞集落刺激因子在所述培养基viii的含量为25ng/ml;所述转化生长因子β1在所述培养基viii的含量为50ng/ml;所述白介素-34在所述培养基viii的含量为100ng/ml;所述白细胞分化抗原-200在所述培养基viii的含量为100ng/ml;所述人趋化因子fractalkine在所述培养基viii的含量为100ng/ml。
神经元培养基
神经元培养基以neurobasal培养基为基础添加b-27添加剂、glutamax-i添加剂和青霉素/链霉素溶液得到;其中,所述b-27添加剂在神经元培养基的体积百分含量为2%,glutamax-i添加剂在神经元培养基的体积百分含量为1%,青霉素/链霉素溶液在神经元培养基的体积百分含量为1%。
配置方式如下:
取40mlneurobasal培养基,加入1mlb-27添加剂,0.5mlglutamax-i添加剂添加剂,0.5ml青霉素/链霉素溶液,再加入neurobasal培养基定容至50ml,混合均匀后0.22μm过滤器过滤,4℃保存。
封闭液
封闭液以1×磷酸盐缓冲液为基础添加bsa、tritonx-100和叠氮化钠得到;其中,所述bsa在封闭液的体积百分含量为2%,tritonx-100在封闭液的体积百分含量为0.3%,叠氮化钠在封闭液的体积百分含量为0.03%。
配制方法如下:
取40ml1×磷酸盐缓冲液,称取1g牛血清白蛋白,振荡混匀至完全溶解后,加入0.15mltritonx-100及0.15g叠氮化钠,再加入1×磷酸盐缓冲液定容至50ml,混合均匀后0.22μm过滤器过滤,4℃保存。
实施例1多能干细胞诱导产生功能性小胶质细胞的方法
一、人诱导性多能干细胞诱导至cd43+造血祖细胞,流程如图1所示:
1、将人诱导性多能干细胞培养在matrigel包被过的六孔板上,采用培养基i(即人多潜能干细胞维持培养基(pgm1培养基)),37℃,5%co2的加湿培养箱中培养至细胞贴壁生长至50%-70%(培养4-5天),期间每天更换一次培养基,每次2ml。
2、吸出上层液并用1×pbs冲洗六孔板后,每孔加入0.5mlaccutase细胞消化液,37℃,5%co2的加湿培养箱静置4分钟,然后加入0.5mlpgm1培养基终止消化,200g离心5分钟收集细胞。
3、吸出上层液并用培养基ii重悬,按50000细胞/cm2将细胞接种在新的六孔板中,37℃,5%co2的加湿培养箱中培养1天,轻轻拍打收集细胞,200g离心5分钟收集细胞。
4、吸出上层液并用培养基iii重悬,接种在新的六孔板中,37℃,5%co2,5%o2的加湿培养箱中培养2天,轻轻拍打收集细胞,200g离心5分钟收集细胞。
5、吸出上层液并用已经过脱氧处理的培养基iv,接种在新的六孔板中,37℃,5%co2,5%o2的加湿培养箱中培养2天,轻轻拍打收集细胞,200g离心5分钟收集细胞。上述脱氧处理是将培养基iv置于37℃,5%co2,5%o2的加湿培养箱中脱氧1h。
6、吸出上层液并用培养基v重悬,接种在新的六孔板中,置于37℃,5%co2的加湿培养箱中培养6天,每天每个孔补充1ml培养基,轻轻拍打收集细胞,200g离心5分钟收集细胞。
7、吸出上层液并用培养基vi重悬。利用70μm筛网过滤大的细胞团块,按1∶100加入apc-cd43抗体(clonecd43-10g7),4℃避光孵育1个小时。200g离心5分钟收集细胞,用facs缓冲液洗涤一次,最后用500-700μlfacs缓冲液重悬。重悬细胞通过流式细胞仪(beckman公司mofolxdp)分选cd43+造血祖细胞,利用培养基vii收集cd43+造血祖细胞。
apc-cd43抗体标记的小胶质细胞与未进行抗体(apc-cd43抗体)标记的细胞对照组相比,94.5%的细胞具有apc通道的荧光信号。结果如图2所示,人多能干细胞向造血祖细胞分化第10天,分化获得的cd43+造血祖细胞阳性率超过90%,证明利用本发明人多能干细胞向造血祖细胞分化的方法,能够大量获得cd43阳性的造血祖细胞。
二、cd43+造血祖细胞诱导至成熟小胶质细胞,流程如图1所示:
1、将cd43+造血祖细胞按20000细胞/cm2接种在预先用matrigel包被的带细胞爬片24孔板中,加入500μl培养基vii,于37℃,5%co2的加湿培养箱中培养12天,每两天补充250μlmgl分化培养基。
第4天,进行免疫荧光染色:吸弃上清培养基,加入500μl4%多聚甲醛溶液固定20分钟。用500μl1×磷酸盐缓冲液漂洗三次,每次5分钟,吸弃上清。加入500μl封闭液,室温封闭1小时。吸弃封闭液,加入200μl新的封闭液,按1∶1000加入兔抗人pu.1抗体,按1∶40加入羊抗人trem2抗体,4℃孵育12小时。吸弃上清,用500μl1×磷酸盐缓冲液漂洗三次,每次5分钟。吸弃上清,加入200μl新的封闭液,按1∶500加入dapi,alexafluor488标记驴抗兔igg(h+l)二抗及alexafluor568标记驴抗羊igg(h+l)二抗,避光孵育两小时后,吸弃上清,用500μl1×磷酸盐缓冲液避光漂洗三次,每次5分钟。将玻片挑起,用抗淬灭封片剂封片后,利用荧光显微镜观察染色情况,其中绿色荧光代表pu.1阳性,红色荧光代表trem2阳性。
结果如图3所示,cd43+造血祖细胞向小胶质细胞分化第4天,细胞表达小胶质细胞前体标志蛋白trem2及pu.1,证明细胞分化到小胶质细胞前体细胞阶段。
2、吸弃1ml培养基,再补充1mlmgl分化培养基,继续于37℃,5%co2的加湿培养箱中培养13天。每两天补充250μlmgl分化培养基。
3、吸弃所有上清培养基,加入2ml培养基viii,于37℃,5%co2的加湿培养箱中培养3天,获得成熟小胶质细胞。
吸出上层液并用含4℃无菌mgl分化培养基重悬。利用70μm筛网过滤大的细胞团块,按1∶100加入trustainfcxtm,冰浴孵育15分钟后,200g离心5分钟收集细胞,用无菌mgl分化培养基洗涤2次,用500μl无菌mgl分化培养基重悬细胞,按1∶100加入leaf标记鼠抗人cd11b抗体及apc-cyanine7标记鼠抗人cd45(hi30)抗体,4℃避光孵育1个小时。200g离心5分钟收集细胞,用无菌mgl分化培养基洗涤2次,最后用500无菌mgl分化培养基重悬。重悬细胞通过流式细胞仪(beckman公司mofolxdp)分选成熟小胶质细胞。
1)对成熟小胶质细胞的表面标志蛋白进行流式分析,fitc通道代表cd11b阳性细胞,apc-cy7代表cd45阳性细胞,结果如图4中a所示,cd43+造血祖细胞向成熟小胶质细胞分化第28天,抗体标记的小胶质细胞与未进行抗体标记的细胞对照组相比,表达cd45及cd11b表面抗原。
2)对成熟小胶质细胞进行免疫荧光染色,染色前加入5umalexafluor555-labeledaβ1-42孵育2小时,吸弃上清培养基,加入500μl4%多聚甲醛溶液固定20分钟。用500μl1×磷酸盐缓冲液漂洗三次,每次5分钟,吸弃上清。加入500μl封闭液,室温封闭1小时。吸弃封闭液,加入200μl新的封闭液,按1∶1000加入兔抗人p2ry12抗体或兔抗人iba1抗体或兔抗人cx3cr1抗体,4℃孵育12小时。吸弃上清,用500μl1×磷酸盐缓冲液漂洗三次,每次5分钟。吸弃上清,加入200μl新的封闭液,按1∶500加入dapi,alexafluor488标记驴抗兔igg(h+l)二抗,避光孵育两小时后,吸弃上清,用500μl1×磷酸盐缓冲液避光漂洗三次,每次5分钟。将玻片挑起,用抗淬灭封片剂封片后,利用荧光显微镜观察染色情况,其中绿色荧光代表p2ry12或iba1或cx3cr1阳性,红色荧光代表555-labeledaβ1-42阳性。结果如图4所示,成熟小胶质细胞具有树杈状结构,超过95%细胞表达iba1(图4中b和e所示),p2ry12(图4中c和e所示),cx3cr1(图4中d和e所示)等小胶质细胞特异性标志物;如图4中c和d所示,加入5umalexafluor555-labeledaβ1-42孵育2小时,小胶质细胞内含大量alexafluor555-labeledaβ1-42(图中以“aβ”表示),证明小胶质细胞具有对aβ的吞噬功能。
实施例2小胶质细胞与小鼠原代神经元共培养实验
分离小鼠原代神经元按40000/cm2接入预先用pdl包被的带细胞爬片24孔板中,加入500μl神经元培养基,每两天吸弃200μl神经元培养基并补充300μl新鲜的神经元培养基。
14天后按3∶1接入成熟小胶质细胞,加入250μl神经元培养基及250μl培养基viii,再继续共培养三天。吸弃上清培养基,加入500μl4%多聚甲醛溶液固定20分钟。用500μl1×磷酸盐缓冲液漂洗三次,每次5分钟,吸弃上清。加入500μl封闭液,室温封闭1小时。吸弃封闭液,加入200μl新的封闭液,按1∶500加入兔抗人ibal抗体,鼠抗人nuclei抗体,羊抗人doublecortin抗体,4℃孵育12小时。吸弃上清,用500μl1×磷酸盐缓冲液漂洗三次,每次5分钟。吸弃上清,加入200μl新的封闭液,按1∶500加入dapi,alexafluor594标记驴抗兔igg(h+l)二抗,alexafluor488标记驴抗鼠igg(h+l)二抗,alexafluor647标记驴抗羊(h+l)二抗,避光孵育两小时后,吸弃上清,用500μl1×磷酸盐缓冲液避光漂洗三次,每次5分钟。将玻片挑起,用抗淬灭封片剂封片后,利用荧光显微镜观察染色情况。结果如图5所示,小胶质细胞与小鼠原代神经元能够相互作用,并具有小胶质细胞特有的树杈状形态。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
- 还没有人留言评论。精彩留言会获得点赞!