胃癌诊断及预后评估血液循环miRNA生物标志物检测试剂盒的制作方法
本发明属于试剂盒技术领域,尤其涉及一种胃癌诊断及预后评估血液循环mirna生物标志物检测试剂盒。
背景技术:
目前,业内常用的现有技术是这样的:
胃癌是消化系统常见恶性肿瘤,在我国胃癌发病率和死亡率较高。据统计分析,2012年我国胃癌发病率为31.28/10万,死亡率为22.04/10万。胃癌发病多无明显特异性的临床表现且预后不良,五年生存率仅有20-30%,因此,寻找胃癌血清特异性标志物用于胃癌的早期诊断及治疗具有重要的意义。传统肿瘤标志物cea,ca199,ca724在胃癌中的诊断特异性与灵敏性不高。比如cea合成部位在胎儿的胃肠和血液,主要在结直肠癌患者中表达,其他肿瘤包括胃癌,肺癌,肺癌,肝癌,乳腺癌,胰腺癌等肿瘤中也可表达,非恶性肿瘤病变如肾衰,肺气肿,直肠息肉,结肠炎时cea表达可以升高,还会受到其他因素影响,如吸烟与唾液污染。microrna是一类长度约为22个核苷酸的内源性非编码小分子rna,能通过与靶标mrna3’端非编码区完全或部分互补结合引起靶mrna降解或抑制其翻译,从而对靶基因进行转录后调控。microrna作为癌基因或抑癌基因在肿瘤形成中扮演着重要作用,microrna涉及一系列肿瘤生物过程包括肿瘤的增值,侵袭,转移。
而微小核酸是一类在真核生物中发现的内源性的非编码rna,其进化上高度保守,通过与调控靶标互补配对而在转录后水平对基因的表达进行稳定而精细的调节。由于mirna血液中表达,由于其片段较短仅19-22个核苷酸,且受到risc复合体的保护,不易降解具有高度的稳定性,经测试在反复冻融及ph值等剧烈变化的环境中保持稳定能够保持稳定,因此是一种较为理想的肿瘤标志物。
mirna变化与肿瘤的密切关系已经得到科学家的共识,形成了一个研究的热点。胃癌是全球高发的恶性肿瘤之一,其中三分之一的胃癌在发现时已属晚期,失去手术根治的机会,即使是手术根治的胃癌,60%-70%发生局部复发或远处转移。临床早期诊断率每增加1%,全球就有约76万人免于死亡,中国约有16万人可获得新生,可挽回数以10亿的损失。因此,推进早期诊断技术的发展,具有非常紧迫的经济和社会意义。mirna的表达谱及遗传表达模式可能将发展成为新的生物学标志,有助于实现肿瘤的早期诊断、来源分型及预后判断。mirna主要是在mrna的水平上调节基因的表达,调节机制巧妙,因此mirna用于基因功能研究,药物靶点验证,基因沉默、有目的的基因表达调控甚至用于基因治疗,都具有广阔前景。
综上所述,现有技术存在的问题是:传统肿瘤标志物cea,ca199,ca724在胃癌中的诊断特异性与灵敏性不高。
解决上述技术问题的难度:
由于肿瘤标志物cea,ca199,ca724在体内合成部位的非特异性,导致其在多种肿瘤组织中表达。比如,cea在其他非恶性肿瘤病变如肾衰,肺气肿,直肠息肉,结肠炎时cea表达可以升高,还会受到吸烟与唾液污染因素影响而表达升高。cea表达的为蛋白质,由于其自身生物特性的原因,蛋白质不够稳定,保存不当易降解,也是导致这类肿瘤标志物特异性与灵敏性不高的原因,临床检测中无法克服其弊端。因此需要继续开发更理想的肿瘤标志物。
解决上述技术问题的意义:
寻找更好的事宜作为肿瘤标志物的分子标记物将会提高检测的灵敏度与特异度,给临床医生提供有效治疗的依据。理想的肿瘤标志物一个具有如下特点:
1.它必须由恶性肿瘤细胞产生,并可以在血液、组织液、分泌液或肿瘤组织中测出;
2.它不应该存在于正常组织或在良性疾病中测出;
3.某一肿瘤标记物应改在该肿瘤的大多数病人中测出来;
4.最好能在临床上尚无肿瘤证据前就能检测出,即比现有影像学手段更加灵敏;
5.肿瘤标记物的量最好能与肿瘤的大小成正相关;
6.在一定程度上能有助于评估疗效,预测肿瘤的复发和转移。
技术实现要素:
针对现有技术存在的问题,本发明提供了胃癌诊断及预后评估血液循环mirna生物标志物检测试剂盒。
本发明是这样实现的,一种胃癌诊断及预后评估血液循环mirna生物标志物检测试剂盒,包括核苷酸序列mir-30c,内参;
进一步,mir-30c核苷酸序列:5′-tgtaaacatcctacactctcagc-3′。
进一步,u6snrna作为内参:u6引物上下游的引物序列
5’-ctcgcttcggcagcaca-3’与5’-aacgcttcacgaatttgcgt-3’。
进一步,mir-30c相对表达量的计算方法:2-δct循环值计算,δct=ctmir-30c-ctu6。
本发明的另一目的在于提供一种胃癌诊断及预后评估血液循环mirna生物标志物检测试剂盒检测方法,具体包括以下步骤:
步骤一:血清样本的处理,采血、离心、保存备用;
步骤二:总rna的提取,提取得到的总rna放于-80℃冰箱保存备用;
步骤三:进行吸光度检测,利用rna甲醛变性胶电泳判断rna的质量;
步骤四:进行反转录获得cdna,将得到的cdna进行荧光定量检测;
步骤五:采用相对定量法对检测结果进行分析。
进一步,步骤一中,血清样本的处理具体为:
所有纳入人群均取清晨空腹静脉血3ml,并立即用水平离心机以2000rpm离心8min分离血清,吸出的上清置于离心管中,于4℃条件下14000xrpm离心10min,吸出的上清液置新的离心管中,放到-80℃冰箱低温保存以便用于总rna的提取。
进一步,步骤二中,总rna的提取,具体步骤为:
(1)提取总rna;
(2)加入10倍体积的裂解/结合缓冲液(1ml裂解/结合缓冲液/0.1g组织)匀浆器彻底混匀;
(3)加入1/10体积的匀浆液添加物,涡旋混匀,冰上放置10分钟;以上操作均在冰上进行;
(4)加入与裂解液(不计匀浆液添加物)相同体积的酸性-苯酚:氯仿)(300ul裂解液/300ul酸性-苯酚:氯仿),涡旋30-60秒,室温10,000g离心5分钟,分相不好,重新离心;取上清置一新管中,记体积;
(5)加入1.25倍体积100%乙醇,涡旋混均,反复过纯化柱,体积不超过700ul,10,000g离心约15秒;
(6)加入350ul洗液1,离心5-10秒,清洗纯化拄,10,000g离心约15秒,弃过滤液;
(7)dnasei10μl和bufferrdd70μl加入膜上(qiagen#79254),20-30℃放置15分钟;
(8)加入350ul洗液1,离心5-10秒,清洗纯化拄,10,000g离心15秒,弃过滤液;
(9)加入500ul,洗液,2/3,离心5-10,秒,清洗纯化柱二次,10,000g离心15秒,弃过滤液,离心1分钟;
(10)将离心柱放置到新的收集管中,柱中心加入100μl95℃预热的清洗剂elutionsolution或无rna酶的水中,室温最高转速离心20-30秒,收集管中液体即为提取的总rna,放置在-80℃保存。
进一步,步骤三中,吸光度检测方法:
(1)取2ul溶解的rna,加入98ulrnase-freeddh2o;
(2)用核酸分析仪检测rna的产量;
(3)测定在260mm处的吸光度,1od=40ug/ml,按如下公式计算:
总rna的浓度为:a260×40×稀释倍数。
进一步,步骤三中,利用rna甲醛变性胶电泳判断rna的质量,具体步骤为:
(1)2.5%琼脂糖凝胶板的制备
将琼脂糖粉末2.5g加入0.5×tbe100ml于微波炉中热溶直至粉末状琼脂糖完全溶解;冷却至60℃-70℃时,加入10mg/ml溴化乙锭5ul,倒入封好的凝胶槽,厚度约3-5mm,插入齿状梳;待冷却成型后小心拔出齿状梳,放入琼脂糖水平电泳槽中,0.5xtbe淹没过胶面1cm为止;
(2)取0.3μg的总rna,加入1/5体积的5×加样缓冲液,65℃加热5min,冰上骤冷,以消除rna的二级结构;上样前在rna样品中加入0.5-1.0μl的溴化乙锭etbr,浓度1.0mg/ml;配好的1.2%的甲醛变性胶先在1×甲醛变性胶电泳缓冲液中预电泳15min;rna样品在5-10v/cm的电压降下电泳30min。
进一步,步骤四中,反转录为:
解冻2×mirnartreactionbuffer并混匀,mirnartenzymemix放于冰中备用,在冰上预冷的反应管内加入2×mirnartreactionbuffer10μl、mirnartenzymemix2μl,总rna5μl,rnase-freeddh2o3μl至总体积20μl后进行反应,得到的cdna进行荧光定量检测。
进一步,mirna的实时荧光定量pcr反应:按照mircuteplusmirnaqpcrdetectionkit说明书进行操作,每次实验设置3个副孔,使用abi7500实时荧光定量pcr仪进行检测。
进一步,步骤五中,采用相对定量法进行分析,mirna表达量以2-△ct表示;2-δct循环值计算,δct=(ctmir-30c实验组-ctu6内参)。
综上所述,本发明的优点及积极效果为:
与传统肿瘤标志物在脑胶质瘤中的诊断特异性与灵敏性不高相对比,本发明对于胃癌的组织采用荧光定量pcr对胃癌患者,早期胃癌及健康体检者的血清进行表达量检测,分析比较血清mir-30c,的相对表达量对胃癌早期诊断的意义。为胃癌的早期诊断提供新的肿瘤检测标志物。
本发明与传统肿瘤标志物cea,ca199,ca724在诊断中的效能做了评估,发现mir-30c的诊断效能优于传统肿瘤标志物,mir-30c低表达预示患者预后不良。mir-30c的检测适合作为为胃癌的诊断标志物,并为胃癌诊断开发为新的肿瘤检测标志物诊断试剂盒,用于疗效评价及预后判断,具有很好的应用前景。
附图说明
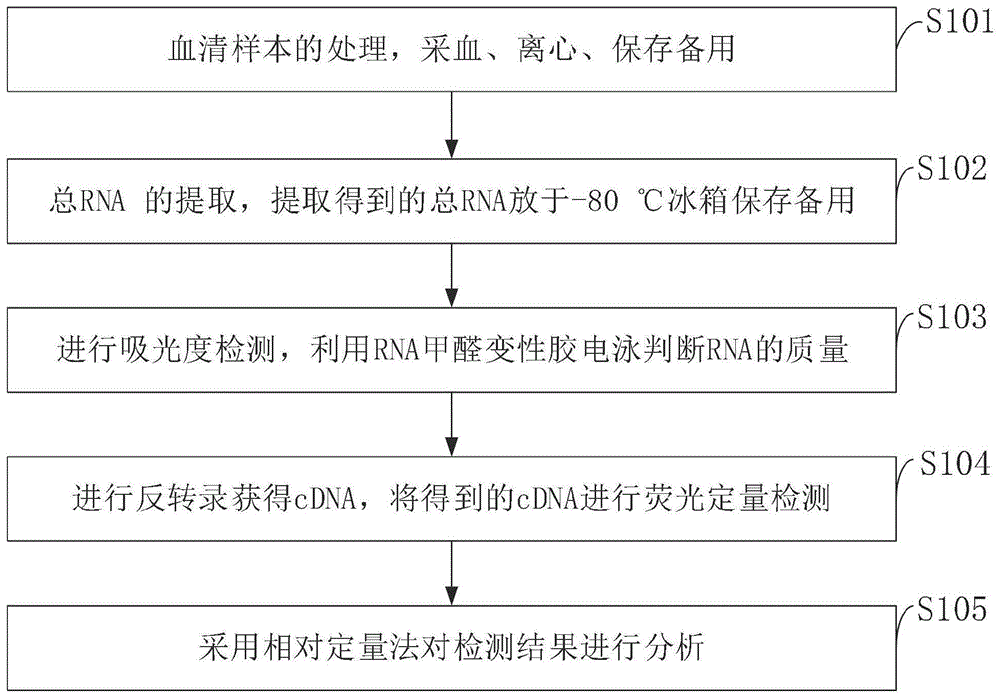
图1是本发明实施例提供的胃癌诊断及预后评估血液循环mirna生物标志物检测试剂盒检测方法示意图。
图2是本发明实施例提供的循环肿瘤标志物mir-30c在胃癌组及健康组中的表达量示意图。
图3是本发明实施例提供的循环肿瘤标志物mir-30c与传统肿瘤标志物ca72-4,ca19-9和cea的曲线示意图。
图4是本发明实施例提供的kaplan-meier生存曲线示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明实施例提供的胃癌诊断及预后评估血液循环mirna生物标志物检测试剂盒,包括核苷酸序列mir-30c,内参;
本发明实施例提供的mir-30c核苷酸序列:
5′-tgtaaacatcctacactctcagc-3′。
本发明实施例提供的u6snrna作为内参:u6引物上下游的引物序列
5’-ctcgcttcggcagcaca-3’与5’-aacgcttcacgaatttgcgt-3’。
本发明实施例提供的mir-30c相对表达量的计算方法:2-δct循环值计算,δct=ctmir-30c-ctu6。
下面结合附图对本发明的应用原理进行进一步说明;
如图1所示,本发明实施例提供的胃癌诊断及预后评估血液循环mirna生物标志物检测试剂盒检测方法,具体包括以下步骤:
s101:血清样本的处理,采血、离心、保存备用;
s102:总rna的提取,提取得到的总rna放于-80℃冰箱保存备用;
s103:进行吸光度检测,利用rna甲醛变性胶电泳判断rna的质量;
s104:进行反转录获得cdna,将得到的cdna进行荧光定量检测;
s105:采用相对定量法对检测结果进行分析。
步骤s101中,本发明实施例提供的血清样本的处理具体为:
所有纳入人群均取清晨空腹静脉血3ml,并立即用水平离心机以2000rpm离心8min分离血清,吸出的上清置于离心管中,于4℃条件下14000xrpm离心10min,吸出的上清液置新的离心管中,放到-80℃冰箱低温保存以便用于总rna的提取。
步骤s102中,本发明实施例提供的总rna的提取,具体步骤为:
(1)提取总rna;
(2)加入10倍体积的裂解/结合缓冲液(1ml裂解/结合缓冲液/0.1g组织)匀浆器彻底混匀;
(3)加入1/10体积的匀浆液添加物,涡旋混匀,冰上放置10分钟;以上操作均在冰上进行;
(4)加入与裂解液(不计匀浆液添加物)相同体积的酸性-苯酚:氯仿)(300ul裂解液/300ul酸性-苯酚:氯仿),涡旋30-60秒,室温10,000g离心5分钟,分相不好,重新离心;取上清置一新管中,记体积;
(5)加入1.25倍体积100%乙醇,涡旋混均,反复过纯化柱,体积不超过700ul,10,000g离心约15秒;
(6)加入350ul洗液1,离心5-10秒,清洗纯化拄,10,000g离心约15秒,弃过滤液;
(7)dnasei10μl和bufferrdd70μl加入膜上(qiagen#79254),20-30℃放置15分钟;
(8)加入350ul洗液1,离心5-10秒,清洗纯化拄,10,000g离心15秒,弃过滤液;
(9)加入500ul,洗液,2/3,离心5-10,秒,清洗纯化柱二次,10,000g离心15秒,弃过滤液,离心1分钟;
(10)将离心柱放置到新的收集管中,柱中心加入100μl95℃预热的清洗剂elutionsolution或无rna酶的水中,室温最高转速离心20-30秒,收集管中液体即为提取的总rna,放置在-80℃保存。
步骤s103中,本发明实施例提供的吸光度检测方法:
(1)取2ul溶解的rna,加入98ulrnase-freeddh2o;
(2)用核酸分析仪检测rna的产量;
(3)测定在260mm处的吸光度,1od=40ug/ml,按如下公式计算:
总rna的浓度为:a260×40×稀释倍数。
步骤s103中,本发明实施例提供的利用rna甲醛变性胶电泳判断rna的质量,具体步骤为:
(1)2.5%琼脂糖凝胶板的制备
将琼脂糖粉末2.5g加入0.5×tbe100ml于微波炉中热溶直至粉末状琼脂糖完全溶解;冷却至60℃-70℃时,加入10mg/ml溴化乙锭5ul,倒入封好的凝胶槽,厚度约3-5mm,插入齿状梳;待冷却成型后小心拔出齿状梳,放入琼脂糖水平电泳槽中,0.5xtbe淹没过胶面1cm为止;
(2)取0.3μg的总rna,加入1/5体积的5×加样缓冲液,65℃加热5min,冰上骤冷,以消除rna的二级结构;上样前在rna样品中加入0.5-1.0μl的溴化乙锭etbr,浓度1.0mg/ml;配好的1.2%的甲醛变性胶先在1×甲醛变性胶电泳缓冲液中预电泳15min;rna样品在5-10v/cm的电压降下电泳30min。
步骤s104中,本发明实施例提供的反转录为:
解冻2×mirnartreactionbuffer并混匀,mirnartenzymemix放于冰中备用,在冰上预冷的反应管内加入2×mirnartreactionbuffer10μl、mirnartenzymemix2μl,总rna5μl,rnase-freeddh2o3μl至总体积20μl后进行反应,得到的cdna进行荧光定量检测。
本发明实施例提供的mirna的实时荧光定量pcr反应:按照mircuteplusmirnaqpcrdetectionkit说明书进行操作,每次实验设置3个副孔,使用abi7500实时荧光定量pcr仪进行检测。
步骤s105中,本发明实施例提供的步骤五中,采用相对定量法进行分析,mirna表达量以2-△ct表示;2-δct循环值计算,δct=(ctmir-30c实验组-ctu6内参)。
下面结合具体实施例对本发明的应用原理仅进行进一步说明;
实施例1;
胃癌检测试剂盒
(1)核苷酸序列mir-30c,具体的mir-30c核苷酸序列:
5′-tgtaaacatcctacactctcagc-3′。
(2)u6snrna作为内参:u6引物上下游的引物序列为:
5’-ctcgcttcggcagcaca-3’,
5’-aacgcttcacgaatttgcgt-3’。
(3)mir-30c相对表达量的计算方法:2-δct循环值计算,δct=ctmir-30c-ctu6
一、仪器
主要仪器如下
二、试剂盒检测步骤
1.试剂盒检测:
1.1血清样本的处理所有纳入人群均取清晨空腹静脉血3ml,并立即用水平离心机以2000rpm离心8min分离血清,吸出的上清置于离心管中,于4℃条件下14000xrpm离心10min,吸出的上清液置新的离心管中,放到-80℃冰箱低温保存以便用于总rna的提取。总rna的提取:按mircuteserum/plasmamirnaisolationkit说明书进行操作,提取得到的总rna放于-80℃冰箱保存备用。
1.2总rna提取采用mircuteserum/plasmamirna分离试剂盒,反转录及cdna扩增采用mircuteplusmirnafirst-strandcdnasynthesiskit和mircuteplusmirnaqpcrdetectionkit(北京天根公司),引物、mirna标准品均由北京天根生物公司合成,采用abi7500实时荧光定量pcr仪进行检测。
北京天根公司提取试剂盒的成分
1.3具体过程
(1)提取总rna。
(2)加入10倍体积的裂解/结合缓冲液(1ml裂解/结合缓冲液/0.1g组织)匀浆器彻底混匀。
(3)加入1/10体积的匀浆液添加物,涡旋混匀,冰上放置10分钟。以上操作均在冰上进行。
(4)加入与裂解液(不计匀浆液添加物)相同体积的酸性-苯酚:氯仿)(300ul裂解液/300ul酸性-苯酚:氯仿),涡旋30-60秒,室温10,000g离心5分钟,分相不好,重新离心。取上清置一新管中,记体积。注意:回收水相上清液时将管子中的上层水相小心转移至新管中,切忌不要混到下面的油相。
(5)加入1.25倍体积100%乙醇,涡旋混均,反复过纯化柱,体积不超过700ul,10,000g离心约15秒。
(6)加入350ul洗液1,离心5-10秒,清洗纯化拄,10,000g离心约15秒,弃过滤液。
(7)dnasei10μl和bufferrdd70μl加入膜上(qiagen#79254),20-30℃放置15分钟。
(8)加入350ul洗液1,离心5-10秒,清洗纯化拄,10,000g离心15秒,弃过滤液。
(9)加入500ul,洗液,2/3,离心5-10,秒,清洗纯化柱二次,10,000g离心15秒,弃过滤液,离心1分钟。
(10)将离心柱放置到新的收集管中,柱中心加入100μl95℃预热的清洗剂elutionsolution或无rna酶的水中,室温最高转速离心20-30秒,收集管中液体即为提取的总rna,可放置在-80℃保存。
1.4吸光度检测
(1)取2ul溶解的rna,加入98ulrnase-freeddh2o,用核酸分析仪检
测rna的产量,在260mm处的吸光度,1od=40ug/ml,按如下公式计算总rna的浓度为:a260×40×稀释倍数。
(2)根据在260mm和280mm处的吸光值,检测rna的纯度,纯rna的od260/od280比值应接近2.0(比值最好在1.8-2.1之间);若od260/od280比值小于1.8,则表明蛋白杂质较多;若od260/od280比值大于2.2,则表明rna已降解。
1.5rna甲醛变性胶电泳
提取样品的总rna后,一般根据rna的凝胶电泳图来判断rna的质量。由于rna容易形成二级结构,因此常用甲醛变性胶来进行rna电泳,得到的电泳图能真实反映rna的质量状况。
1.6甲醛变性胶试剂配制
(1)depc水的制备:用量筒量取ddh2o2l,在通风橱中,加入2mldepc到2升ddh2o中,终浓度为0.1%的depc。迅速盖上盖子,混匀,然后放在摇床中中速摇荡至少4hr,再高压灭菌。灭菌时将瓶盖松开,15磅灭菌20min。
(2)75%的乙醇配制:用100ml量筒量取无水乙醇75ml,加灭菌过的depc水定容至100ml,装入rna专用试剂瓶中,标签,4℃冰箱保存。
(3)50×tae的配制:配制1升50倍tae缓冲液需称取tris242g,na2edta·2h2o37.2g然后加入800ml的ddh2o,充分搅拌溶解,加入57.1ml的醋酸,充分混匀,加去ddh2o定容至1l,室温保存。需要使用的时候,稀释为1×tae,例如:需要使用200ml的1×tae,则量4ml的50×tae,196ml的ddh2o,混匀即可。
(4)10×fabuffer(formaldehydeagarosebuffer:200mm的mops,50mm的naac,10mm的edta):配制500ml,称取3.4gnaac·3h2o放入1000ml烧杯中,加入400mldepc处理过的去离子水,加入搅拌子,放在磁力搅拌器上溶解。然后加入20.9gmops,放在磁力搅拌器上溶解。再加1.86gna2edta·2h2o,放在磁力搅拌器上溶解。用1m灭过菌的naoh调ph至7.0(约用naoh40ml),用depc处理过的去离子水定容至500ml,装入棕色瓶中,写好标签,室温避光保存。
(5)5×甲醛变性胶加样缓冲液(5×loadingbuffer):配制10ml。预先配制
水饱和的溴酚蓝溶液:在1.5ml离心管中加入约0.1mg溴酚蓝,加入1mldepc水溶解,充分振荡溶解,离心,可见离心管底部有溴酚蓝粉末剩余,上层液体即水饱和的溴酚蓝液。在15ml灭菌离心管中,依次加入以下各种成分:
混匀,分装,-20℃保存,常用放4℃保存。
(6)1×甲醛变性胶电泳缓冲液(1×runningbuffer):20ml10×fagelbuffer,4.0ml37%的甲醛,176ml水,放入电泳槽中使用,一般在3次电泳结束后需更换此电泳缓冲液。
(7)1.2%的甲醛变性胶:称0.4克琼脂糖,加入3.34ml10×fagelbuffer,加入30mldepc水,微波炉融化,肉眼观察无颗粒状悬浮物。冷却至约50-60℃,再加入600μl甲醛,倒入7.5×5.0cm的凝胶模具中。插入合适长度和宽度的梳子,室温放置约30min后即可使用。
1.7实验方法
(1)2.5%琼脂糖凝胶板的制备
将琼脂糖粉末2.5g加入0.5×tbe100ml于微波炉中热溶直至粉末状琼脂糖完全溶解。冷却至60℃-70℃时,加入10mg/ml溴化乙锭5ul,倒入封好的凝胶槽,厚度约3-5mm,插入齿状梳。待冷却成型后小心拔出齿状梳,放入琼脂糖水平电泳槽中,0.5xtbe淹没过胶面1cm为止。
(2)一般取0.3μg的总rna,加入1/5体积的5×加样缓冲液,65℃加热5min,冰上骤冷,以消除rna的二级结构。建议上样前在rna样品中加入0.5-1.0μl的溴化乙锭(etbr,浓度1.0mg/ml),而不在胶中加etbr,这样电泳后的背景较低。配好的1.2%的甲醛变性胶先在1×甲醛变性胶电泳缓冲液中预电泳15min。rna样品在5-10v/cm的电压降下电泳30min。
注:表达谱芯片rna送样要求
(1)rna总量大于4ug。
(2)rna浓度大于50ng/ul,浓度没有上限。
(3)rna体积大于30ul。
(4)送样前自检,确定rna的吸光度260/280比值在1.8-2.1之间;琼脂糖电泳有两条明亮条带,上下条带亮度比值在2:1左右。比值在规定的范围内表示rna的纯度较好,两条明亮条带说明rna完整性较好。
1.8反转录:解冻2×mirnartreactionbuffer并混匀,mirnartenzymemix放于冰中备用,在冰上预冷的反应管内加入2×mirnartreactionbuffer10μl、mirnartenzymemix2μl,总rna5μl,rnase-freeddh2o3μl至总体积20μl后进行反应,得到的cdna进行荧光定量检测,所有实验操作均在冰上进行。mirna的实时荧光定量pcr反应:按照mircuteplusmirnaqpcrdetectionkit说明书进行操作,每次实验设置3个副孔,使用abi7500实时荧光定量pcr仪进行检测。
1.9计算方法
所得实验结果采用相对定量法进行分析,mirna表达量以2-△ct表示。2-δct循环值计算,
δct=(ctmir-30c实验组-ctu6内参)。
实施例2;
2.1样本收集:
在中国内蒙古自治区展开临床样本研究。收集到内蒙古医学院第一附属医院从2006年1月到2011年10月共计240例住院胃癌手术患者样本,取下的胃癌组织样本立即放入液氮中冷冻,然后将其贮存于-80℃的冰箱中。以上手术切除样本均由两位资深的病理医师独立地确诊为胃癌,病理学检测之后收集病理资料。肿瘤浸润深度按照uicc(国际抗癌联盟标准)分类[19],淋巴结转移状况,分化程度按照who(世界卫生组织)标准评判[20],肿瘤位置以病理组织报告为准。
选择性别,年龄与胃癌相匹配的非癌样本取自内蒙古医学院附属医院胃镜中心门诊病例,并经过上消化但胃镜的检测,病理活检诊断为慢性浅表性胃炎或是慢性萎缩性胃炎,胃癌或者复发性肿瘤患者除外。总计162例,其中平均年龄为(62.12±12.06)岁,年龄范围(24-82)岁每人取5毫升edta钾抗凝静脉血,样本存于-20℃冰箱备用。幽门螺旋杆菌hpylori感染状态可通过尿素呼气试验确定为幽门螺旋杆菌感染。病例-对照样本的临床信息通过查阅内蒙古医学院第一附属医院的病案获得。所有参与者均签订了由内蒙古医学院伦理委员会制定的科研知情同意书。
2.2rna提取步骤同上
(1)提取总rna。
(2)加入10倍体积的裂解/结合缓冲液(1ml裂解/结合缓冲液/0.1g组织)匀浆器彻底混匀。
(3)加入1/10体积的匀浆液添加物,涡旋混匀,冰上放置10分钟。以上操作均在冰上进行。
(4)加入与裂解液(不计匀浆液添加物)相同体积的酸性-苯酚:氯仿)(300ul裂解液/300ul酸性-苯酚:氯仿),涡旋30-60秒,室温10,000g离心5分钟,分相不好,重新离心。取上清置一新管中,记体积。注意:回收水相上清液时将管子中的上层水相小心转移至新管中,切忌不要混到下面的油相。
(5)加入1.25倍体积100%乙醇,涡旋混均,反复过纯化柱,体积不超过700ul,10,000g离心约15秒。
(6)加入350ul洗液1,离心5-10秒,清洗纯化拄,10,000g离心约15秒,弃过滤液。
(7)dnasei10μl和bufferrdd70μl加入膜上(qiagen#79254),20-30℃放置15分钟。
(8)加入350ul洗液1,离心5-10秒,清洗纯化拄,10,000g离心15秒,弃过滤液。
(9)加入500ul,洗液,2/3,离心5-10,秒,清洗纯化柱二次,10,000g离心15秒,弃过滤液,离心1分钟。
(10)将离心柱放置到新的收集管中,柱中心加入100μl95℃预热的清洗剂elutionsolution或无rna酶的水中,室温最高转速离心20-30秒,收集管中液体即为提取的总rna,可放置在-80℃保存。
2.3吸光度检测
(1)取2ul溶解的rna,加入98ulrnase-freeddh2o,用核酸分析仪检测rna的产量,在260mm处的吸光度,1od=40ug/ml,按如下公式计算总rna的浓度为:a260×40×稀释倍数。
(2)根据在260mm和280mm处的吸光值,检测rna的纯度,纯rna的od260/od280比值应接近2.0(比值最好在1.8-2.1之间);若od260/od280比值小于1.8,则表明蛋白杂质较多;若od260/od280比值大于2.2,则表明rna已降解。
2.4血清ca724,ca199和cea的检测
应用rochecobase601(roche)电化学发光仪器检测血清ca724,ca199和cea的浓度,ca724,ca199和cea的试剂盒由罗氏公司提供(roche)。根据说明书要求进行检测,ca724,cea和ca199的检测阈值(cutoffvalues)分别为6.9ng/ml,6.5ng/ml,和27ng/ml。
2.5统计学方法
使用spss13.0统计软件对数据进行分析,计量资料采用
2、结果:
如图2所示,本发明实施例提供的循环肿瘤标志物mir-30c在胃癌组及健康组中的表达量示意图。
如图2所示,循环肿瘤标志物mir-30c在胃癌组及健康组中的表达量不相同(0.41±0.13vs.0.59±0.12,t=6.7,p<0.01)。
表1循环肿瘤标志物mir-30c表达量与临床病理移速的关系
abbreviation:uicc:unionforinternationalcancercontrol,tnm:tumornodemetastasis.
如表2可知,常用肿瘤标志物ca-724,ca-199和cea与循环肿瘤标志物mir-30c通过灵敏度,特异度,截断值数据指标评估在诊断中的效能发现mir-30c的诊断效果最好,灵敏度80.0%,特异度为89.3%,截断值0.497。优于传统肿瘤标志物。
表2ca-724,ca-199和cea与循环肿瘤标志物mir-30c通过灵敏度,特异度,截断值数据指标评估在诊断中的效能结果。
se,standarderror;ci,confidenceinterval,roc,receiver-operatingcharacteristic
如图3所示,本发明实施例提供的循环肿瘤标志物mir-30c与传统肿瘤标志物ca72-4,ca19-9和cea的曲线示意图。
如图3所示,循环肿瘤标志物mir-30c与传统肿瘤标志物ca72-4,ca19-9和cea的曲线下面积(theareaundercurves,aucs)发现mir-30c,ca72-4,ca19-9和cea分别为0.898(95%ci:0.829–0.967),0.756(95%ci:0.639–0.872),0.641(95%ci:0.536–0.724)和0.662(95%ci:0.544–0.780),mir-30c曲线下面积最大。
如图4所示,本发明实施例提供的kaplan-meier生存曲线示意图。
如图4所示,曲线显示mir-30c低表达(n=17)和高表达(n=28)提示患者预后不同,地表达者预后不良。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>内蒙古医科大学附属人民医院(内蒙古自治区肿瘤医院)
<120>胃癌诊断及预后评估血液循环mirna生物标志物检测试剂盒
<160>3
<170>siposequencelisting1.0
<210>1
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>1
tgtaaacatcctacactctcagc23
<210>2
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctcgcttcggcagcaca17
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
aacgcttcacgaatttgcgt20
- 还没有人留言评论。精彩留言会获得点赞!