二甲双胍-吡格列酮盐及其制备方法和应用与流程
本发明属于医药化工领域,具体涉及二甲双胍-吡格列酮晶体形态的盐、其制法及其药物组合物与应用。
背景技术:
据统计,大约70-80%的药物候选物最终由于理化性质的缺陷,导致失败而不能上市,所以改善药物的理化性质对于新药研发具有十分重要的意义。在药物临床前研发阶段,新药研发公司通常会将药物活性有效成分通过成盐的方式来改善药物的溶解度、溶出速率、吸湿性、稳定性及生物利用度等药学性质。2017年上半年美国食品药品监督管理局(fda)共批准23个新药,包括16个新分子实体和7个新生物制品,在16个化学药品中有8个药物是以盐的形式上市。药物盐型是指通过质子转移引入了新的物质(salt-former),在选择这些新物质的时候,传统的方式是将钠、钾、钙、铵根离子等引入到酸性药物中,将盐酸、硫酸、马来酸等引入碱性药物中成盐用以改善成药性,如提高药物的稳定性从而延长货架期,提高药物的溶解性从而提高生物利用度。但是大多数情况下,这些引入的新物质对于患者来说是多余的、不具备药理活性的。
吡格列酮(c19h20n2o3s)为噻唑烷二酮类抗2型糖尿病药物的主要品种,其为促胰岛素增敏剂,可激动过氧化物酶体-增殖体活化受体γ,增加脂肪细胞、肝细胞及骨骼肌细胞对胰岛素的敏感性,促进胰岛素靶细胞对血糖的提取、转运和氧化作用,同时降低血糖及游离脂肪酸的水平。但是吡格列酮为生物药剂学分类系统中ii类药物(bcsii),具有低溶解性,因此其药学性质不佳。
二甲双胍(c4h11n5)为抗2型糖尿病的双胍类口服降糖药,其与吡格列酮不同,主要是增加葡萄糖的无氧酵解和利用,增加骨骼肌和脂肪组织的葡萄糖氧化和代谢,减少肠道对葡萄糖的吸收,同时抑制肝糖的产生和输出,改善胰岛素抵抗,但是二甲双胍不稳定,极易吸湿,不利于药品的储存与运输,因此常见其盐酸盐形式。吡格列酮与二甲双胍均为糖尿病患者的常用药物,当其中一种药物的疗效不足以满足患者需求时,临床上通常会将二者联合使用。但是这两种药物自身存在的问题仍然不能避免。若以联合用药为出发点,去掉传统二甲双胍盐酸盐中无药理活性的酸碱离子,将两个组分结合形成新的盐型化合物,不仅保存了两种药物各自的疗效,还有利于改善单一药物的稳定性以及溶解性,并且新的盐型化合物的成功研制能够打破药物的专利壁垒,在糖尿病治疗领域将具有重大的价值。
技术实现要素:
本发明的目的之一在于:提供了一种新的、结晶性的、稳定的、高溶解性的二甲双胍-吡格列酮盐。
本发明的目的之二在于:提供了一种简便的、可重复制备的、适于工业生产的二甲双胍-吡格列酮盐的制备方法。
为解决上述技术问题,本发明通过如下的技术方案实现:
一种二甲双胍-吡格列酮盐,其特征在于,所述盐的分子式为c23h31n7o3s,分子量为485.61,化学结构式如下:
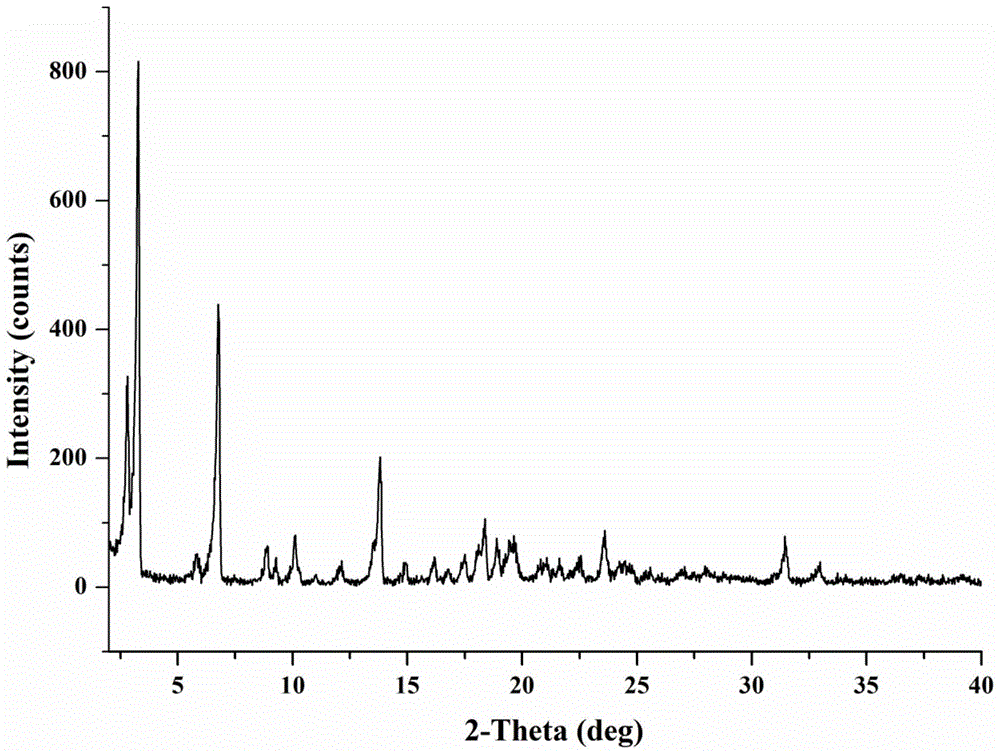
根据本发明的二甲双胍-吡格列酮盐,其特征在于,所述盐以2θ角表示的衍射角在2.80±0.20°、3.26±0.20°、5.80±0.20°、6.76±0.20°、8.88±0.20°、10.10±0.20°、13.80±0.20°、16.18±0.20°、18.10±0.20°、18.36±0.20°、18.88±0.20°、19.68±0.20°、23.56±0.20°、31.46±0.20°处具有特征峰。
所述盐的液态核磁共振氢谱1h-nmr(dmso-d6)δ:8.36(d,1h),7.57(dd,1h),7.27(d,1h),7.20(s,2h),7.08(d,2h),6.80(d,2h),6.63(s,4h),4.28(t,2h),4.14(dd,1h),3.29(dd,1h),3.12(t,2h),2.92(s,6h),2.64(dd,1h),2.58(m,2h),1.17(t,3h)。
所述盐的差示扫描量热分析图谱在163.7±5℃有特征熔融峰。
本发明还提供一种二甲双胍-吡格列酮盐的制备方法,其特征在于,所述方法包含以下步骤:
(1)将吡格列酮与二甲双胍原料按照摩尔比1:0.8~1:1.2溶于单一溶剂或混合溶剂中;
(2)将步骤(1)中得到的混合物于15-60℃条件下反应结晶12-48小时;
(3)将步骤(2)所得产物固液相分离,25-60℃干燥,即得二甲双胍-吡格列酮盐的固体样品。
步骤(1)中所述所述单一溶剂为乙酸乙酯、丙酮、乙腈、二氧六环、乙酸甲酯、乙酸异丙酯;所述混合溶剂为上述溶剂中的两种或两种以上按照任意比例混合而成。
本发明提供的二甲双胍-吡格列酮盐同样是二甲双胍和吡格列酮,二者的药效基团分别为胍基和噻唑烷二酮,且其在所述盐中依然存在,而二甲双胍和吡格列酮在防治或治疗糖尿病药物中具有一定的应用,由于其作用已经公开,二甲双胍-吡格列酮盐在上述疾病中的应用在此就不再赘述。
根据本发明的一种药物组合物,所述药物组合物包括上述二甲双胍-吡格列酮盐,加入药学上可接受的载体/赋形剂制成口服剂型。
一种二甲双胍-吡格列酮盐在制备用于预防和治疗糖尿病的药物中的应用。
本发明的有益效果是:
本发明提供的二甲双胍-吡格列酮盐,相较于二甲双胍单品的吸湿稳定性有很大的提高:在95%相对湿度时所述盐引湿增重为33%,而二甲双胍单品在此条件下引湿增重为86%;相较于吡格列酮单品的溶解性能有很大的改善:所述二甲双胍-吡格列酮盐在纯水中的溶解度为1824微克/毫升,吡格列酮单品在纯水中的溶解度小于1微克/毫升;同时所述盐的制备方法操作简单,结晶过程易于控制,且盐的重现性好。
附图说明
图1是本发明提供的二甲双胍-吡格列酮盐的x-射线粉末衍射(xrpd)图;
图2是本发明提供的二甲双胍-吡格列酮盐的动态水分吸附(dvs)图;
图3是本发明提供的二甲双胍-吡格列酮盐在动态水分吸附后的xrpd图;
图4是本发明提供的二甲双胍的动态水分吸附(dvs)图;
图5是本发明提供的在乙酸异丙酯中制备二甲双胍-吡格列酮盐的x-射线粉末衍射(xrpd)图;
图6是本发明提供的在丙酮中制备二甲双胍-吡格列酮盐的x-射线粉末衍射(xrpd)图;
图7是本发明提供的在乙腈-乙酸乙酯混合溶剂中制备二甲双胍-吡格列酮盐的x-射线粉末衍射(xrpd)图;
图8是本发明提供的在乙腈-丙酮混合溶剂中制备二甲双胍-吡格列酮盐的x-射线粉末衍射(xrpd)图;
图9是本发明提供的二甲双胍-吡格列酮盐的热失重分析(tg)图;
图10是本发明提供的二甲双胍-吡格列酮盐的差示扫描量热分析(dsc)图;
图11是本发明提供的二甲双胍-吡格列酮盐的液态核磁(1h-nmr)图;
图12是本发明提供的二甲双胍-吡格列酮盐与吡格列酮原料在纯水中240分钟内的粉末溶出;
具体实施方式
以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。任何在本发明基础上做出的改进和变化,仍然在本发明的保护范围之内。
实施例1
取28.5mg吡格列酮及10.8mg二甲双胍(摩尔比是1:1)置于4ml样品瓶中,加入2ml乙腈,超声,使其溶解并呈过饱和态,于室温下反应结晶24小时,将混悬液离心,弃去上清液,将离心后的固体于40℃鼓风干燥箱干燥3小时,即可获得二甲双胍-吡格列酮盐,其xrpd结果如图1。
实施例2
取实施例1中制备所得二甲双胍-吡格列酮盐的固体样品约3mg进行动态水分吸附分析,采用美国ta仪器公司vti-sa+型动态水分吸附仪测定。温度为25℃,相对湿度范围是1-95%。结果显示从1%相对湿度到70%相对湿度时,所述盐的含水量的质量百分数无明显增加。当达到95%相对湿度时,所述盐的含水量的质量分数百分比增加到33%,如图2。且所述盐保持不变,dvs后的xrpd图谱如图3。而已知的二甲双胍原型药物在达到95%相对湿度时引湿增重明显,已高达86%。如说明书附图4。
实施例3
取28.5mg吡格列酮及9.6mg二甲双胍(摩尔比是1:0.92)置于4ml样品瓶中,加入2ml乙酸异丙酯,超声,使其溶解并呈过饱和态,于50℃下反应结晶12小时,将混悬液离心,弃去上清液,将离心后的固体于60℃鼓风干燥箱干燥1小时,即可获得二甲双胍-吡格列酮盐,其xrpd结果如图5。
实施例4
取28.5mg吡格列酮及12.4mg二甲双胍(摩尔比是1:1.19)置于4ml样品瓶中,加入2ml丙酮,超声,使其溶解并呈过饱和态,于室温下反应结晶48小时,将混悬液离心,弃去上清液,将离心后的固体于室温25℃干燥12小时,即可获得二甲双胍-吡格列酮盐,其xrpd结果如图6。
实施例5
取28.5mg吡格列酮及10.8mg二甲双胍(摩尔比是1:1)置于4ml样品瓶中,加入2ml乙腈-乙酸乙酯混合溶剂,超声,使其溶解并呈过饱和态,于室温下反应结晶24小时,将混悬液离心,弃去上清液,将离心后的固体于40℃鼓风干燥箱干燥3小时,即可获得二甲双胍-吡格列酮盐,其xrpd结果如图7。
实施例6
取28.5mg吡格列酮及10.8mg二甲双胍(摩尔比是1:1)置于4ml样品瓶中,加入2ml乙腈-丙酮混合溶剂,超声,使其溶解并呈过饱和态,于室温下反应结晶24小时,将混悬液离心,弃去上清液,将离心后的固体于40℃鼓风干燥箱干燥3小时,即可获得二甲双胍-吡格列酮盐,其xrpd结果如图8。
本发明提供的二甲双胍-吡格列酮盐,通过x-射线粉末衍射(xrpd)、热失重分析(tg)、差示扫描量热分析(dsc)、动态水分吸附(dvs)、液态核磁(1h-nmr)等固态方法表征。
对实施例1、3、4、5、6制得的二甲双胍-吡格列酮盐固体样品进行x-射线粉末衍射分析,其采用日本理学公司d/max2500型的衍射仪,采用cu–kα射线(
对实施例1、3、4、5、6制得的二甲双胍-吡格列酮盐固体样品进行热失重分析,其采用瑞士梅特勒托利多tga/dsc1型热重分析仪,气氛为氮气,升温速率为10℃/分钟。
结果表明,本发明二甲双胍-吡格列酮盐的热失重分析图谱在加热至分解前无明显失重现象。如说明书附图9。
对实施例1、3、4、5、6制得的二甲双胍-吡格列酮盐固体样品进行差示扫描量热分析,其采用瑞士梅特勒托利多的dsc1型差示量热仪检测,气氛为氮气,加热速度为10℃/分钟。
结果表明,本发明二甲双胍-吡格列酮盐的差示扫描量热分析图谱在163.7±5℃有特征熔融峰。如说明书附图10。
所述盐的液态核磁共振氢谱1h-nmr(dmso-d6)δ:8.36(d,1h),7.57(dd,1h),7.27(d,1h),7.20(s,2h),7.08(d,2h),6.80(d,2h),6.63(s,4h),4.28(t,2h),4.14(dd,1h),3.29(dd,1h),3.12(t,2h),2.92(s,6h),2.64(dd,1h),2.58(m,2h),1.17(t,3h)。如说明书附图11。
实施例5
二甲双胍-吡格列酮盐的溶解度实验
实验条件:将吡格列酮及所述二甲双胍-吡格列酮盐,溶于10ml纯水中,控制转速200rpm,温度25℃,使其溶解并呈过饱和态,其中所使用的测试样品过80目筛,防止颗粒大小影响溶解结果。于24小时后取样,通过0.45μm微孔滤膜进行过滤,经过适当稀释后通过高效液相色谱法进行定量。结果显示,吡格列酮在纯水中的溶解度小于1微克/毫升,所述二甲双胍-吡格列酮盐在纯水中的溶解度为1824微克/毫升。
实施例6
二甲双胍-吡格列酮盐的粉末溶出实验
实验条件:使用rc-6型溶出度测试仪进行溶出度实验。溶出介质为纯水,200ml。控制转速100rpm,温度37℃。其中使用的样品分别是本发明中的二甲双胍-吡格列酮盐以及吡格列酮原料,过80目筛,防止颗粒大小影响溶出结果。于2min,5min,10min,15min,20min,30min,40min,60min,80min,100min,120min,150min,180min,210min,240min后取样1.5ml,所取样品通过0.45μm微孔滤膜进行过滤,经过适当稀释后通过高效液相色谱进行定量。结果如图12所示,本发明中所述二甲双胍-吡格列酮盐的溶出度远远大于吡格列酮原料。
实施例7
药物组合物的配方见下表:
先将二甲双胍-吡格列酮盐与淀粉混合均匀,再加入2g微晶纤维素钠及适量的水制成软材,过20目筛制粒,干燥,再过18目筛整粒,加入交联聚乙烯吡咯烷酮和硬脂酸镁,混匀,制成100粒胶囊。
根据本发明,所述该药物组合物中的载体/赋形剂包括稀释剂、粘合剂、润湿剂、崩解剂、润滑剂、助流剂。
稀释剂可以是淀粉、糊精、蔗糖、葡萄糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素、硫酸钙、磷酸氢钙、碳酸钙等。
润湿剂可以是水、乙醇、异丙醇等。
粘合剂可以是淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、微晶纤维素、阿拉伯胶浆、明胶浆、羟甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、丙烯酸树脂、卡波姆、聚乙烯吡咯烷酮、聚乙二醇等。
崩解剂可以是干淀粉、微晶纤维素、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠、羧甲基淀粉钠、碳酸氢钠与枸橼酸、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠等。
润滑剂和助流剂可以是滑石粉、二氧化硅、硬脂酸盐、酒石酸、液体石蜡、聚乙二醇等。
根据本发明的药物制剂,所述制剂包括片剂、胶囊、颗粒剂等剂型。更优选为胶囊剂。
本发明还提供一种药物制剂的制备方法,将本发明所述的药物组合物与赋形剂混合后制成片剂、胶囊、颗粒剂等不同的剂型。该药物组合物的片剂、胶囊、颗粒剂等剂型的制备方法与本领域常规的片剂、胶囊剂、颗粒剂等剂型的制备方法相同。
本发明提供的二甲双胍-吡格列酮盐同样是二甲双胍和吡格列酮,而二甲双胍和吡格列酮盐在防治或治疗糖尿病药物中具有一定的应用,由于其作用已经公开,二甲双胍-吡格列酮盐在上述疾病中的应用在此就不再赘述。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!