miRNA-30a及其靶基因在肺癌检测中的应用的制作方法
本发明涉及分子诊断领域,具体涉及miR-30a及其靶基因在检测肺癌中的应用。
背景技术:
miRNA是一类内源性、高度保守的、长度大约为22个核苷酸的非编码小分子RNA。miRNA通过其5'端可以与靶基因的3'端非翻译区(3'UTR)特异性结合,在转录后水平发挥调控作用。当miRNA与靶基因3'UTR以碱基完全互补配对的方式结合会引起靶mRNA的降解,而通过非完全互补配对结合的方式则会抑制mRNA的蛋白翻译。
肺癌是当前世界范围内最常见的恶性肿瘤,也是癌症死亡的首要原因,极大威胁着人类的健康和生命。过去30年间,我国的肺癌的死亡率逐年上升,肺癌每年致死患者约40万例,成为我国增长幅度最大、危害最为严重的恶性肿瘤。尽管近年在肺癌诊断方法、手术技术以及化疗药物方面均有新的发展,但肺癌患者总的5年生存率仍非常低,仅为15%左右。肺癌总体5年生存率之所以这么低,主要因为多数肺癌患者就诊时己处于晚期,或较早就出现播散转移失去了手术根治机会。目前常用的肺癌诊断方法包括胸部X线、低剂量螺旋CT、痰液细胞学检查、支气管镜下刷片或取活检、支气管肺泡灌洗液细胞学检查等,但各种检查手段在敏感性、特异性、适用度等方面均存在局限。虽然临床上也应用血清肿瘤标志物诊断肺癌。常见的标志物包括癌胚抗原(CEA)、细胞角蛋白21-1片段(CYFRA21-1)、糖类抗原125、153、199(CA125、CA153、CA199)、组织多肽抗原(TPA)等。但这些肿瘤标志物检测的敏感性和特异性均有限,寻找新型肺癌诊断相关的肿瘤标记物或新的治疗策略对于肺癌的控制显得至关重要。
本发明基于高通量测序方法,对3例肺腺癌患者的癌组织及癌旁组织进行二代测序,获得其miRNA和mRNA的表达数据,同时,结合生物信息学分析和文献调研,从候选的miRNA中挑选出miR-30a及其靶基因EFNA3、CTHRC1、RTKN2、JAM2,进行后续分析,结果显示miR-30a的靶基因组合可以很好的诊断肺癌,本发明为临床提供新的肺癌基因诊断标志物。
技术实现要素:
本发明的目的在于提供一种肺癌诊断试剂,所述肺癌诊断试剂能够检测样本中miR-30a的转录情况,或者检测样本中miR-30a的靶基因的转录或表达情况,靶基因选自下列基因中的一种或几种:EFNA3、CTHRC1、RTKN2或JAM2。
所述miR-30a序列为SEQ ID NO 1:5’-uguaaacauccucgacuggaag-3’。
进一步,肺癌为非小细胞肺癌,非小细胞肺癌包括肺鳞癌、肺腺癌、肺腺鳞癌、大细胞癌等;优选的,肺癌为肺腺癌。
所述的样本为肿瘤组织或外周血。
优选的,靶基因为EFNA3、CTHRC1、RTKN2或JAM2基因的两两组合;更优选的,靶基因为基因RTKN2和EFNA3的组合、RTKN2和JAM2的组合、EFNA3和JAM2的组合或者EFNA3和CTHRC1的组合。
优选的,靶基因为EFNA3、CTHRC1、RTKN2或JAM2基因的三三组合;更优选的,靶基因为基因RTKN2、EFNA3和CTHRC1的组合。
进一步,肺癌诊断试剂是采用高通量测序方法和/或定量PCR方法和/或探针杂交方法检测样本中miR-30a或其靶基因的转录。
优选采用二代测序法、谱芯片法、northern杂交方法、核酶保护分析技术、RAKE法、原位杂交、荧光定量PCR法检测样本中miR-30a或其靶基因的转录。
优选的,所述的定量PCR方法包括特异性扩增miR-30a或其靶基因的引物;所述的基于探针杂交方法包括与miR-30a或其靶基因的核酸序列杂交的探针。
进一步,肺癌诊断试剂是采用免疫方法检测样本中miR-30a的靶基因的表达情况的试剂。
优选所述免疫检测方法检测样本中miR-30a的靶基因的表达的为western blot和/或ELISA和/胶体金检测方法。
进一步,检测靶基因EFNA3、CTHRC1、RTKN2或JAM2的表达的ELISA法为使用ELISA检测试剂盒。所述试剂盒中的抗体可采用市售的EFNA3、CTHRC1、RTKN2或JAM2的单克隆抗体。进一步,所述的试剂盒包括:包被EFNA3、CTHRC1、RTKN2或JAM2的单克隆抗体的固相载体,酶标二抗,酶的底物,蛋白标准品,阴性对照品,稀释液,洗涤液,酶反应终止液等。
进一步,所述检测EFNA3、CTHRC1、RTKN2或JAM2蛋白的胶体金法为使用检测试剂盒,所述的抗体可采用市售的EFNA3、CTHRC1、RTKN2或JAM2单克隆抗体。进一步,所述的胶体金检测试剂盒采用胶体金免疫层析技术或胶体金渗滤法。进一步,所述的胶体金检测试剂盒硝酸纤维素膜上的检测区(T)喷点有抗EFNA3、CTHRC1、RTKN2或JAM2单克隆抗体、质控区(C)喷点有免疫球蛋白IgG。
本发明的目的还在于提供上述肺癌诊断试剂在制备肺癌诊断制剂中的应用。
定义:
现阶段检测miRNA的表达水平的方法主要包括基于高通量测序技术、基于核苷酸杂交和基于PCR的miRNA检测方法。基于探针杂交技术的miRNA检测方法是一种直接检测法,不需要对样本RNA进行预扩增,包括northern杂交方法、miRNA表达谱芯片、核酶保护分析技术、RAKE法、原位杂交、基于微球的流式细胞术等技术。
(1)Northern杂交
又称RNA印迹技术为最经典的检测真核生物RNA大小,估计其丰度的实验方法。基本原理如下:首先在载体(如硅片、微球或膜等)上固定miRNA样本,再与经过标记的探针杂交,洗涤多余的杂交探针后进行信号检测;也可以在载体上先固定与靶miRNA序列互补的DNA探针,然后与经过标记的样本miRNA杂交,再进行信号检测。信号标记的方法包括同位素标记、荧光标记和纳米金标记等。
(2)miRNA表达谱芯片
原理同样是使用标记探针检测固相支持物上的目标分子。通过设计芯片上miRNA基因及内参序列,可精确分析出样品中相应miRNA的表达水平。基因芯片具有高通量的优点,可以一次在同一样本中检测出几百个基因的全部表达。Luminex公司研制的液相芯片(Liquid chip)又称多功能悬浮点阵(Multi analyte suspension array,MASA),是出的新一代生物芯片技术。液相芯片体系由许多小球体为主要基质构成,每种小球体上固定有不同的探针分子,为了区分不同的探针,每一种用于标记探针的球形基质都带有一个独特的色彩编号,将这些小球体悬浮于一个液相体系中,就构成了液相芯片系统。该系统可以对同一个微量样本中的多个不同分子同时进行快速的定性、定量分析,这种检测技术被称为FMAP(Flexible multianalyte profiling)技术。分子杂交在悬浮溶液中进行,检测速度极快。
(3)核酶保护分析技术(RPA)
miRNA的检测还可以采用核酶保护分析技术,将标记好的探针和待测RNA样本混合,热变性后杂交,未杂交的RNA和多余的探针用单链核酸酶消化,热失活核酸酶后纯化受保护的RNA分子,最后通过变性PAGE电泳分离探针,显色。这种基于液相杂交的新方法简单快速,灵敏度高,但也只能用于分析已知miRNA。
(4)RAKE法
RAKE法(RNA primed array based Klenow emzyme)是在miRNA microarray的基础上利用DNA聚合酶I的Klenow片段,使miRNA与固定的DNA探针杂交的方法。RAKE可以敏感特异地检测miRNA,适用于大量快速的筛选所有己知的miRNA。能够在特定的细胞和肿瘤中检测miRNA表达谱情况。不仅如此,RAKE法还可以从由福尔马林固定了的石蜡包埋的组织中分离出miRNA并对其进行分析,为从存档标本中分析miRNA开启了希望之门。
(5)原位杂交(in situ hybridization)
原位杂交技术可直观了解miRNA表达方式,是观测miRNA时空表达的一种较简便的方法,常标记方式包括地高辛、生物素、荧光标记等。锁定核酸基础上的原位杂交(Locked Nucleic Acid(LNA)based in situ hybridization(LNA-ISH))是当前应用较多的探针方式。
(6)基于微球的流式细胞术(bead-based flow cytometry)
是一种液相芯片技术,该方法将流式细胞检测与芯片技术有机地结合起来,兼有通量大、检测速度快、灵敏度高和特异性好等特点。
(7)实时荧光定量PCR技术(Real-time PCR,RT-PCR)
荧光检测PCR仪可对整个PCR过程中扩增序列的累积速率绘制动态变化曲线。在反应混合体系中靶序列的起始浓度越大,要求获得扩增产物某特定产量的PCR循环数(一般用特定阈值循环数Ct来表达)越少。由于miRNA长度仅为22nt,传统的qRT-PCR不适合扩增如此短的片段。现今有几种用于miRNA的实时定量PCR方法,如加尾法、颈环法等。颈环法是一种理想的miRNA检测qRT-PCR方法:首先设计特殊的茎环结构引物,以待测miRNA为模板逆转录合成cDNA第一链,该cDNA一端为茎环状引物,茎环状结构被打开便增加了cDNA的长度,随后以合成的cDNA为模板设计引物进行实时定量PCR扩增。qRT-PCR具有特异性高、灵敏度好、快速简单等多种优点。
(8)测序法
大部分已知的miRNA都是通过cDNA克隆测序发现和鉴定的。该法需要先构建miRNA的cDNA文库,再进行PCR扩增,扩增产物随后克隆到表达载体上测序。Takada开发了一种改进的扩增克隆法(miRNA amplification profiling,mRAP),mRAP法先在miRNA的3’端连上接头,然后用与接头互补的反转录引物反转录。因为特定的反转录酶具有末端脱氧核苷酸酶活性,一些核苷酸(主要是脱氧胞苷酸)会连接到反转录出的cDNA链的3’末端。当5’端接头与cDNA链的poly(C)粘性末端退火后,加入一对共用引物即可实现对cDNA的PCR扩增。由于mRAP高度灵敏,可以直接用克隆和测序技术检测少量组织中miRNA的表达量。标签序列克隆法是一种在在基因表达系列分析(SAGE)技术的基础上发展了检测效率更高的miRAGE(miRNA SAGE)克隆法,该法通过生成大的串联子,通过单个测序反应可检测多个miRNA,明显提高了检测效率。
高通量测序(High-throughput sequencing)又称下一代测序技术(nextgeneration sequencing)是对传统测序一次革命性的改变,一次对几十万到几百万条DNA分子进行序列测定,极大提高了测序效率。这类大规模测序技术极大的提高了多个物种遗传信息的解读速度,为获取所有miRNA的序列信息,解密miRNA图谱提供了保证。同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能,所以又被称为深度测序(deep sequencing)。高通量测序平台的代表是罗氏公司(Roche)的454测序仪(Roch GSFLX sequencer),Illumina公司的Solexa基因组分析仪(Illumina Genome Analyzer)和ABI的SOLiD测序仪(ABI SOLiD sequencer)。
酶联免疫吸附实验(ELISA)即将已知的抗原或抗体吸附在固相载体表面,使酶标记的抗原抗体反应在固相表面进行的技术。ELISA检测试剂盒根据检测目的和操作步骤可分为间接法、双抗夹心法、竞争法、双位点一步法、捕获法测IgM抗体、应用亲和素和生物素的ELISA。ELISA检测试剂盒中生色底物可选择辣根过氧化物酶(HRP)或者碱性磷酸酶(AP)。
常用的免疫胶体金检测技术:(1)免疫胶体金光镜染色法细胞悬液涂片或外周血切片,可用胶体金标记的抗体进行染色,也可在胶体金标记的基础上,以银显影液增强标记,使被还原的银原子沉积于已标记的金颗粒表面,可明显增强胶体金标记的敏感性。(2)免疫胶体金电镜染色法可用胶体金标记的抗体或抗抗体与负染病毒样本或外周血超薄切片结合,然后进行负染。(3)斑点免疫金渗滤法应用微孔滤膜作载体,先将抗原或抗体点于膜上,封闭后加待检样本,洗涤后用胶体金标记的抗体检测相应的抗原或抗体。(4)胶体金免疫层析法,将特异性的抗原或抗体以条带状固定在膜上,胶体金标记试剂(抗体或单克隆抗体)吸附在结合垫上,当待检样本加到试纸条一端的样本垫上后,通过毛细作用向前移动,溶解结合垫上的胶体金标记试剂后相互反应,当移动至固定的抗原或抗体的区域时,待检物与金标试剂的结合物又与之发生特异性结合而被截留,聚集在检测带上,可通过肉眼观察到显色结果。该法现已发展成为诊断试纸条,使用十分方便。
附图说明
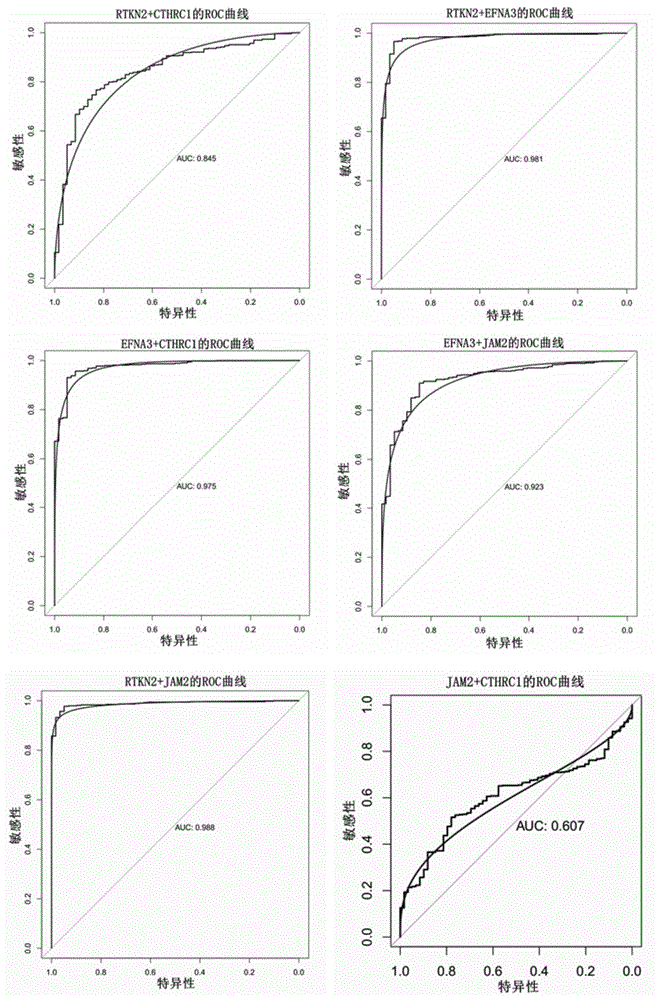
图1是miR-30a的靶基因两两组合诊断肺腺癌的ROC曲线图
图2是miR-30a的靶基因三三组合诊断肺腺癌的ROC曲线图
图3是miR-30a的靶基因联合诊断肺腺癌的ROC曲线图
具体实施方式
实施例1样本收集及总RNA的提取
3例肺腺癌组织及癌旁组织均来自医院手术切除的标本,所有标本均在离体10分钟以内放入液氮罐中,随后转移至-80℃冰箱中储存。
1提取方法:
1)取80mg组织块,加入800μl Lysis/Binding缓冲液,使用匀浆器对组织块进行匀浆。匀浆的过程中样品要置于冰上保持低温状态。
2)再加入1/10体积Homogenate Additive到上述已经匀浆的组织样品中,冰上放置10min。
3)加入与Lysis/Binding缓冲液等量体积的水饱和酚,震荡45s,10000×g室温离心5min。
4)小心取出上清到新的试管中,加入1.25倍体积的无水乙醇,混匀后,移入纯化柱中,10,000×g,离心15s,倒掉收集管中的液体。由于柱子的最大的体积只有700μl,因此重复此步操作,直到所有的上清都过滤完成。
5)向离心柱子中加入700μl miRNA洗脱液1,室温,10000×g,离心15s,倒掉收集液,换用新的收集管。
6)再用500μl洗脱液2/3加入离心柱中,10000×g,离心10s,重复这一步骤一次。
7)离心1min,10000×g,弃去多余的液体。
8)将上述液体转移到新的离心管,加100μl 95℃预热的DEPC处理30s,10000×g,离心。
9)使用nanodrop测定RN A浓度和260nm/280nm的比值。
10)得到的RNA保存于-80℃冰箱。
2提取标准:
测定RNA浓度和260nm/280nm的比值:总RNA的纯度要求是OD260/OD280值应在1.8至2.2之间;RNA完整性的检测:用1%琼脂糖凝胶电泳检测RNA的完整性;
根据测序公司的要求,小RNA测序总量3μg以上,浓度在300ng/μl以上。
实施例2测序及数据分析
由测序公司进行测序文库的建立及上机测序,所使用的测序仪为Illumina公司的HiSeq2000测序仪。
根据测序公司提供的数据进行统计学分析,FDR<0.001,log2(FC)绝对值>1,两组count平均值之差大于100。对差异表达miRNA人为挑选过滤中差异表达明显的miRNA,与肺癌相关性非常好的分子标志物miR-30a进入我们的研究范围,miR-30a在肺腺癌癌组织中的表达量高于癌旁组织。
识别miRNA靶基因是研究特定组织和细胞miRNA功能的非常重要的步骤。利用包括RNA22,miRanda,miRDB,miRWalk,PICTAR2及Targetscan这些算法预测差异表达miR-30a的靶基因,结合测序中mRNA差异表达的结果,从靶向基因的差异表达mRNA中挑选了效果较为突出的两个高表达基因EFNA3、CTHRC1,两个低表达基因RTKN2、JAM2,进行后续的实验。
实施例3诊断效能的评价分析
对于单个分子或是诊断模型的效能评价的方法为建立受试者工作特征(receiver operating characteristic,ROC)曲线,通过计算曲线下面积(Area UnderCurve)来判断诊断的能力。ROC曲线下的面积值在1.0和0.5之间,在AUC>0.5的情况下,AUC越接近于1,说明诊断效果越好,AUC在0.5-0.7时有较低准确性,AUC在0.7-0.9时有一定准确性,AUC在0.9以上时具有较高准确性。
我们将TCGA数据库中有关肺腺癌的数据下载,获得数据集(533例肺腺癌癌组织的mRNA数据,59例癌旁组织的mRNA数据),进而进行分析,结果显示,两两组合时RTKN2+EFNA3、RTKN2+JAM2、RTKN2+CTHRC1、EFNA3+JAM2、EFNA3+CTHRC1、JAM2+CTHRC1诊断肺腺癌的AUC值分别为0.981、0.988、0.845、0.923、0.975、0.607(见图1),三个基因联合诊断肺腺癌中RTKN2+EFNA3+JAM2、RTKN2+EFNA3+CTHRC1、EFNA3+JAM2+CTHRC1组合AUC为0.605、0.993、0.647(见图2),四个基因联合诊断肺腺癌中RTKN2+EFNA3+JAM2+CTHRC1组合AUC为0.871(见图3),上述两两组合中诊断效果较好的为RTKN2+EFNA3、RTKN2+JAM2、EFNA3+JAM2、EFNA3+CTHRC1,三三组合中诊断效果较好的是RTKN2+EFNA3+CTHRC1,但是随着基因的增加诊断准确率有所下降,不推荐四个基因的组合用于诊断,本申请探索寻找可用于临床肺腺癌诊断中的辅助分子诊断的基因组合物,具有很好的临床应用前景。
表1差异表达基因组合的ROC分析
上面具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!