一种含酰胺键的生物基二酚单体的制备方法与流程
本发明涉及生物化工技术领域,尤其涉及一种含酰胺键的生物基二酚单体的制备方法。
背景技术:
双酚a,常用于制备聚碳酸酯和环氧树脂,但双酚a存在许多问题,首先,双酚a是石油基来源的二酚单体,其面临着环保性差和上游原料不可再生及可持续性差的问题;其次,双酚a易导致内分泌失调,威胁胎儿和儿童的健康;再次,欧盟认为双酚a会诱发婴儿性早熟,已经于2011起,禁止生产含双酚a的婴儿奶瓶,因此寻找可以替代双酚a的新型二酚单体就显得十分必要。
为了减少对化石资源的依赖以及为了进一步保护环境,近年来,生物基来源的单体有逐步取代石油基来源单体的趋势。生物基单体一般利用生物质资源制备,其具有绿色、环境友好、原料可再生等众多优点。如公开号为cn109851595a的专利申请公开了一种甘蔗渣生产糠醛的工艺,其使用生物质的甘蔗制备化工单体糠醛。此外,利用生物基单体制备的高分子材料也已经在性能、资源和环境等多个方面显示出了明显的竞争优势。如公开号cn109651595a的专利申请公开了一种无卤阻燃生物基环氧树脂前驱体,其使用生物基单体香草醛制备了无卤阻燃环氧树脂。公开号为101121673a的专利公开了一种邻氯乙酰氨基酚的制备方法,但该专利公开的制备方法,酰化试剂的滴加温度为0~10℃,而反应温度更是高达45~85℃,这对于本申请中用的呋喃二甲酰氯而言,会引发严重的副反应,大大降低目标产物的产率。
双酚a作为一种重要的化工单体,非常有必要用生物基来源的二酚单体对其进行替代。
技术实现要素:
本发明的目的在于提供一种含酰胺键的生物基二酚单体的制备方法,制备的生物基二酚单体自身含有酰胺键并且制备的生物基二酚单体的产率较高。
为了实现上述发明目的,本发明提供以下技术方案:
本发明首先以生物基单体2,5-呋喃二甲酸为初始原料,其同氯化亚砜和少量n,n-二甲基甲酰胺反应,制备2,5-呋喃二甲酰氯,再采用2,5-呋喃二甲酰氯、对氨基酚、缚酸剂为原料制备含酰胺键的生物基二酚单体。
所述含酰胺键的生物基二酚单体的制备方法包括以下步骤:
(1)将2,6’-呋喃二甲酸、氯化亚砜和n,n-二甲基甲酰胺加热搅拌,反应生成针状晶体2,6’-呋喃二甲酰氯,溶于有机溶剂中得到2,6’-呋喃二甲酰氯的溶液;
(2)将对氨基酚溶于有机溶剂后冷却,并加入缚酸剂,得到对氨基酚溶液,并用惰性气体进行保护;
(3)将步骤(1)得到的2,6’-呋喃二甲酰氯的溶液加入到步骤(2)得到的对氨基酚溶液中,在惰性气体保护下进行低温反应,待反应结束后用不良溶剂进行沉析,得到含酰胺键的生物基二酚单体。
本发明提供的制备方法的反应方程式如下:
在步骤(1)中,所述加热搅拌的温度为75~95℃,时间为2~7h。加热搅拌的温度过低时,会导致生成的2,6’-呋喃二甲酰氯结块,因此为了保证2,6’-呋喃二甲酰氯不结块和反应充分,将温度设为此范围。
在步骤(1)中,所述2,5-呋喃二甲酸与氯化亚砜的摩尔比为1:2.5~1:10,为了保证2,6’-呋喃二甲酸反应完全,使氯化亚砜过量;同时为了避免后处理氯化亚砜时产生大量酸而导致对设备或仪器的腐蚀,因此也不能过量太多。优选的,所述2,5-呋喃二甲酸与氯化亚砜的摩尔比为1:3,此范围可以使2,6’-呋喃二甲酸反应完全,并且可以快速的减压蒸馏除去过量的氯化亚砜。
在步骤(1)中,所述的n,n-二甲基甲酰胺的用量为2,5-呋喃二甲酸用量的0.01~0.1wt.%。
在步骤(2)中,所述有机溶剂选自n,n-二甲基甲酰胺或二甲基亚砜或两者的组合,优选的,所述有机溶剂为n,n-二甲基甲酰胺。
在步骤(2)中,所述对氨基酚的加入量为2,5-呋喃二甲酰氯物质的量的2.5~10倍。
在步骤(2)中,所述缚酸剂选自三乙胺、吡啶或无水碳酸钾中的一种或至少两种的组合。优选的,所述缚酸剂为三乙胺。
在步骤(2)中,所述缚酸剂的加入量为2,5-呋喃二甲酰氯物质的量的2.5~4倍
在步骤(2)和步骤(3)中,所述的惰性气体选用本领域广义范围的惰性气体,可选用氮气、氩气或氦气等中的一种,从节约成本的角度考虑,优选氮气。
在步骤(3)中,所述不良溶剂为水。
在步骤(3)中,所述低温反应的温度为-20~-5℃、时间为2~6h。
酰氯作为一种化学反应活性极高的物质,为避免副反应的发生及有效提高目标产物的产率,因此,在步骤(3)中2,5-呋喃二甲酰氯与对氨基酚在低温下进行反应。
优选的,本发明提供的制备方法还包括:对步骤(1)生成的针状晶体2,6’-呋喃二甲酰氯进行升华提纯后再溶于有机溶剂。对步骤(3)所得的含酰胺键的生物基二酚单体于真空条件下在25~40℃下干燥。
优选的,所述含酰胺键的生物基二酚单体的制备方法包括以下步骤:
(1)将2,6’-呋喃二甲酸、氯化亚砜和n,n-二甲基甲酰胺加热到75~80℃搅拌2~3h,反应生成针状晶体2,6’-呋喃二甲酰氯,溶于有机溶剂中得到2,6’-呋喃二甲酰氯的溶液;其中,2,5-呋喃二甲酸与氯化亚砜的摩尔比为1:2.5~1:4。
(2)将对氨基酚溶于有机溶剂后冷却到-20~-15℃,并加入缚酸剂三乙胺或碳酸钾,得到对氨基酚溶液,并用惰性气体进行保护;其中,对氨基酚和缚酸剂的加入量为2,5-呋喃二甲酰氯物质的量的2.5~4倍。
(3)将步骤(1)得到的2,6’-呋喃二甲酰氯的溶液加入到步骤(2)得到的对氨基酚溶液中,在惰性气体保护下进行-20~-15℃反应2~2.5h,待反应结束后用不良溶剂进行沉析,得到含酰胺键的生物基二酚单体,产率为92~95%。
本发明提供的制备方法还包括:对步骤(1)生成的针状晶体2,6’-呋喃二甲酰氯进行升华提纯后再溶于有机溶剂。对步骤(2)所得的含酰胺键的生物基二酚单体于真空条件下在25~40℃条件下干燥。
本发明提供的含酰胺键的生物基二酚单体的制备方法以生物基单体2,5-呋喃二甲酸为初始原料,解决了现有技术中使用双酚a带来的原料环保性差、来源可持续性不足的问题;并且制备的生物基二酚单体自身含有酰胺键,制备的生物基二酚单体的产率至少为85%以上。
附图说明
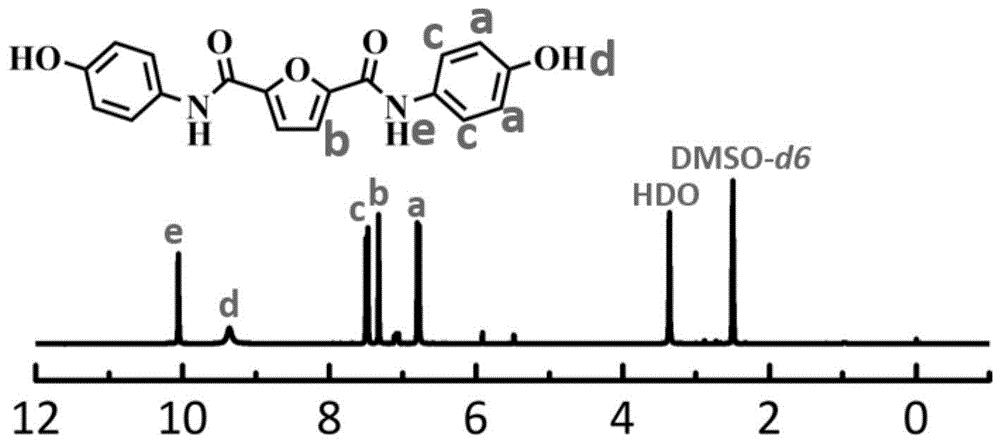
图1为本发明实施例1制得的含酰胺键的生物基二酚单体的核磁氢谱图。
具体实施方式
下面结合实施例对本发明提供的含酰胺键的生物基二酚制备方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
将0.01mol的2,5-呋喃二甲酸在75℃的恒温槽中,并向其中加入其质量0.01wt.%的n,n’-二甲基甲酰胺和0.025mol的氯化亚砜,随后保持该温度条件下继续恒温反应2h,待反应结束后,减压蒸馏除去过量的氯化亚砜,得白色针状晶体(2,5-呋喃二甲酰氯)。将上述制备的2,5-呋喃二甲酰氯粗产物,装入升华器,在75℃条件下进行升华提纯,得到白色针状的2,5-呋喃二甲酰氯。随后,将该纯化后的2,5-呋喃二甲酰氯溶于少量n,n-二甲基甲酰胺之中并装入滴液漏斗,并通过缓慢滴加的方式加入在氮气保护下且已经冷却到-20℃的对氨基酚、三乙胺的混合体系中,对氨基酚和三乙胺的加入量均为2,5-呋喃二甲酰氯物质的量的2.5倍,待2,5-呋喃二甲酰氯的n,n-二甲基甲酰胺溶液完全加入后,继续保持反应2h,反应结束后将反应体系用水进行沉析,得到粉末状含酰胺键的生物基二酚单体,随后,抽滤将所得粉末状含酰胺键的生物基二酚单体于真空条件下在45℃条件下干燥24h,得最终粉末状含酰胺键的生物基二酚单体,产率95%。
其核磁氢谱图如图1所示,由图1可知,所得含酰胺键的生物基二酚单体的化学结构正确。
实施例2
将0.01mol的2,5-呋喃二甲酸在80℃的恒温槽中,并向其中加入其质量0.02%wt.的n,n’-二甲基甲酰胺和0.04mol的氯化亚砜,随后保持该温度条件下继续恒温反应3h,待反应结束后,减压蒸馏除去过量的氯化亚砜,得白色针状晶体(2,5-呋喃二甲酰氯)。将上述制备的2,5-呋喃二甲酰氯粗产物,装入升华器,在80℃条件下进行升华提纯,得到细小白色针状的2,5-呋喃二甲酰氯。随后,将该纯化后的2,5-呋喃二甲酰氯溶于少量n,n-二甲基甲酰胺之中并装入滴液漏斗,并通过缓慢滴加的方式加入在氮气保护下且已经冷却到-15℃的对氨基酚、无水碳酸钾的混合体系中,对氨基酚和无水碳酸钾的加入量均为2,5-呋喃二甲酰氯物质的量的4倍,待2,5-呋喃二甲酰氯的n,n-二甲基甲酰胺溶液完全加入后,继续保持反应2.5h,反应结束后将反应体系用水进行沉析,得到粉末状含酰胺键的生物基二酚单体,随后,抽滤将所得粉末状含酰胺键的生物基二酚单体于真空条件下在45℃条件下干燥24h,得最终粉末状含酰胺键的生物基二酚单体,产率92%。
实施例3
将0.01mol的2,5-呋喃二甲酸在85℃的恒温槽中,并向其中加入其质量0.03%wt.的n,n’-二甲基甲酰胺和0.06mol的氯化亚砜,随后保持该温度条件下继续恒温反应4h,待反应结束后,减压蒸馏除去过量的氯化亚砜,得白色针状晶体(2,5-呋喃二甲酰氯)。将上述制备的2,5-呋喃二甲酰氯粗产物,装入升华器,在85℃条件下进行升华提纯,得到细小白色针状的2,5-呋喃二甲酰氯。随后,将该纯化后的2,5-呋喃二甲酰氯溶于少量二甲基亚砜之中并装入滴液漏斗,并通过缓慢滴加的方式加入在氮气保护下且已经冷却到-10℃的对氨基酚、三乙胺的混合体系中,对氨基酚和三乙胺的加入量均为2,5-呋喃二甲酰氯物质的量的5倍,待2,5-呋喃二甲酰氯的二甲基亚砜溶液完全加入后,继续保持反应2h,反应结束后将反应体系用水进行沉析,得到粉末状含酰胺键的生物基二酚,随后,抽滤将所得粉末状含酰胺键的生物基二酚于真空条件下在45℃条件下干燥24h,得最终粉末状含酰胺键的生物基二酚单体,产率89%。
实施例4
将0.01mol的2,5-呋喃二甲酸在95℃的恒温槽中,并向其中加入其质量0.05%wt.的n,n’-二甲基甲酰胺和0.1mol的氯化亚砜,随后保持该温度条件下继续恒温反应7h,待反应结束后,减压蒸馏除去过量的氯化亚砜,得白色针状晶体(2,5-呋喃二甲酰氯)。将上述制备的2,5-呋喃二甲酰氯粗产物,装入升华器,在95℃条件下进行升华提纯,得到白色针状的2,5-呋喃二甲酰氯。随后,将该纯化后的2,5-呋喃二甲酰氯溶于少量二甲基亚砜之中并装入滴液漏斗,并通过缓慢滴加的方式加入在氮气保护下且已经冷却到-5℃的对氨基酚、三乙胺的混合体系中,对氨基酚和三乙胺的加入量均为2,5-呋喃二甲酰氯物质的量的10倍,待2,5-呋喃二甲酰氯的二甲基亚砜溶液完全加入后,继续保持反应2h,反应结束后将反应体系用水进行沉析,得到粉末状含酰胺键的生物基二酚单体,随后,抽滤将所得粉末状含酰胺键的生物基二酚单体于真空条件下在45℃条件下干燥24h,得最终粉末状含酰胺键的生物基二酚单体,产率87%。
对比例1
将0.01mol的2,5-呋喃二甲酸在95℃的恒温槽中,并向其中加入其质量0.05%wt.的n,n’-二甲基甲酰胺和0.1mol的氯化亚砜,随后保持该温度条件下继续恒温反应7h,待反应结束后,减压蒸馏除去过量的氯化亚砜,得白色针状晶体(2,5-呋喃二甲酰氯)。将上述制备的2,5-呋喃二甲酰氯粗产物,装入升华器,在95℃条件下进行升华提纯,得到白色针状的2,5-呋喃二甲酰氯。随后,将该纯化后的2,5-呋喃二甲酰氯溶于少量二甲基亚砜之中并装入滴液漏斗,并在室温(25℃)条件下,通过缓慢滴加的方式加入在氮气保护下的对氨基酚、三乙胺的混合体系中,对氨基酚和三乙胺的加入量均为2,5-呋喃二甲酰氯物质的量的10倍,待2,5-呋喃二甲酰氯的二甲基亚砜溶液完全加入后,升温至50℃,继续保持反应2h,反应结束后将反应体系用水进行沉析,得到粉末状含酰胺键的生物基二酚单体,随后,抽滤将所得粉末状含酰胺键的生物基二酚单体于真空条件下在45℃条件下干燥24h,得最终粉末状含酰胺键的生物基二酚,产率67%。
对比例2
将0.01mol的2,5-呋喃二甲酸在95℃的恒温槽中,并向其中加入其质量0.05%wt.的n,n’-二甲基甲酰胺和0.1mol的氯化亚砜,随后保持该温度条件下继续恒温反应7h,待反应结束后,减压蒸馏除去过量的氯化亚砜,得白色针状晶体(2,5-呋喃二甲酰氯)。将上述制备的2,5-呋喃二甲酰氯粗产物,装入升华器,在95℃条件下进行升华提纯,得到白色针状的2,5-呋喃二甲酰氯。随后,将该纯化后的2,5-呋喃二甲酰氯溶于少量二甲基亚砜之中并装入滴液漏斗,并在室温(25℃)条件下,通过缓慢滴加的方式加入在氮气保护下的对氨基酚、三乙胺的混合体系中,对氨基酚和三乙胺的加入量均为2,5-呋喃二甲酰氯物质的量的10倍,待2,5-呋喃二甲酰氯的二甲基亚砜溶液完全加入后,升温至70℃,继续保持反应4h,反应结束后将反应体系用水进行沉析,得到粉末状含酰胺键的生物基二酚,随后,抽滤将所得粉末状含酰胺键的生物基二酚单体于真空条件下在45℃条件下干燥24h,得最终粉末状含酰胺键的生物基二酚单体,产率52%。
对比例3
将0.01mol的2,5-呋喃二甲酸在95℃的恒温槽中,并向其中加入其质量0.05%wt.的n,n’-二甲基甲酰胺和0.1mol的氯化亚砜,随后保持该温度条件下继续恒温反应7h,待反应结束后,减压蒸馏除去过量的氯化亚砜,得白色针状晶体(2,5-呋喃二甲酰氯)。将上述制备的2,5-呋喃二甲酰氯粗产物,装入升华器,在95℃条件下进行升华提纯,得到白色针状的2,5-呋喃二甲酰氯。随后,将该纯化后的2,5-呋喃二甲酰氯溶于少量n,n-二甲基甲酰胺之中并装入滴液漏斗,并在室温(25℃)条件下,通过缓慢滴加的方式加入在氮气保护下的对氨基酚、三乙胺的混合体系中,对氨基酚和三乙胺的加入量均为2,5-呋喃二甲酰氯物质的量的10倍,待2,5-呋喃二甲酰氯的n,n-二甲基甲酰胺溶液完全加入后,升温至85℃,继续保持反应4h,反应结束后将反应体系用水进行沉析,得到粉末状含酰胺键的生物基二酚单体,随后,抽滤将所得粉末状含酰胺键的生物基二酚单体于真空条件下在45℃条件下干燥24h,得最终粉末状含酰胺键的生物基二酚单体,产率53%。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种制备5-乙酰乙酰氨基苯并咪唑酮工艺过程中大颗粒物分离装置的制造方法
- 一种用于回收5-乙酰乙酰氨基苯并咪唑酮粉末的装置的制造方法
- 一种用于制备5-乙酰乙酰氨基苯并咪唑酮的氯苯与水分离装置的制造方法
- 对乙酰氨基酚的合成工艺的制作方法
- 聚谷氨酸修饰电极及其在检测药物对乙酰氨基酚含量中的应用
- 一种地西泮药物中间体2-氯乙酰氨基-5-氯二苯酮的合成方法
- 一种氨基甲酰尿嘧啶衍生物及其应用
- 2-乙酰氨基-1,5,-脱水-2-脱氧-d-葡萄糖醇在制备抗水稻白叶枯病菌活性药物中的应用
- 对乙酰氨基酚精制工段所产生的废活性炭的再利用工艺的制作方法
- 使用其中进行了调控使赖氨酰-tRNA合成酶被表达或不被表达的细胞或球状聚集的细胞 ...的制作方法
- 一种制备2,3,4‑三乙酰基‑1‑(2‑氯‑4‑硝基‑苯基)‑alpha‑L岩藻吡喃糖苷的方法与制造工艺
- 利用混酚制备有机磷配体并进一步制备己二腈的方法与制造工艺
- 一种左西孟旦药物中间体对乙酰氨基苯丙酮的合成方法与制造工艺
- 一种柳氨酚药物中间体N‑对羟基苯基水杨酰胺的合成方法与制造工艺
- 一种间尼索地平药物中间体乙酰乙酸异丁酯的合成方法与制造工艺
- 含有高剂量和低剂量药物的组合的口腔崩解片组合物的制造方法与工艺
- 一种新型甲氨基阿维菌素水分散粒剂及其制备方法与制造工艺
- 一种药物中间体邻乙酰氨基酚的合成方法与制造工艺
- 一种3‑氨基邻苯二甲酸二甲酯的制备方法与制造工艺
- 三芳胺端基含量可调的主链含S,S‑二氧‑二苯并噻吩的聚合物及其制备方法与应用与制造工艺