BCAS2基因用于判断圩公猪初情期启动时间的应用的制作方法
本发明涉及生物
技术领域:
,尤其涉及bcas2基因用于判断圩公猪初情期启动时间的应用,及甲基化bcas2基因用于判断圩公猪初情期启动时间的应用。
背景技术:
:动物初情期(青春期)一般是指动物发育到性成熟,并且具有繁殖能力的这一过程。当动物初情期开始启动,往往标志着其已经可以进行有性繁殖。动物初情期启动受到环境因素、代谢因素、季节因素和遗传因素等多种因素的影响。同卵双胞胎初情期启动时间的差异性要小于异卵双胞胎初情期启动的差异性,说明遗传因素对动物初情期启动的调控有着重要的作用。初情期启动机制非常复杂,已有人发现初情期性状的遗传并不遵循孟德尔的遗传定律。单基因无法独立控制初情期的启动,初情期启动过程中需要多个基因共同发挥作用,协同“作战”。公猪初情期的启动对于商业化养猪场来说具有重要作用。现在大型养猪场一般采用集约化方式饲养猪群,在实际生产过程中,饲养工作人员对猪的初情期启动时间鉴定比较困难,需要大量的学习成本。现有文献虽然指出bcas2基因参与小鼠精子的形成,在减数分裂过程中发挥了非常重要的作用,但是在公猪睾丸组织初情期启动期间发挥什么样的功能,暂时未知。技术实现要素:基于
背景技术:
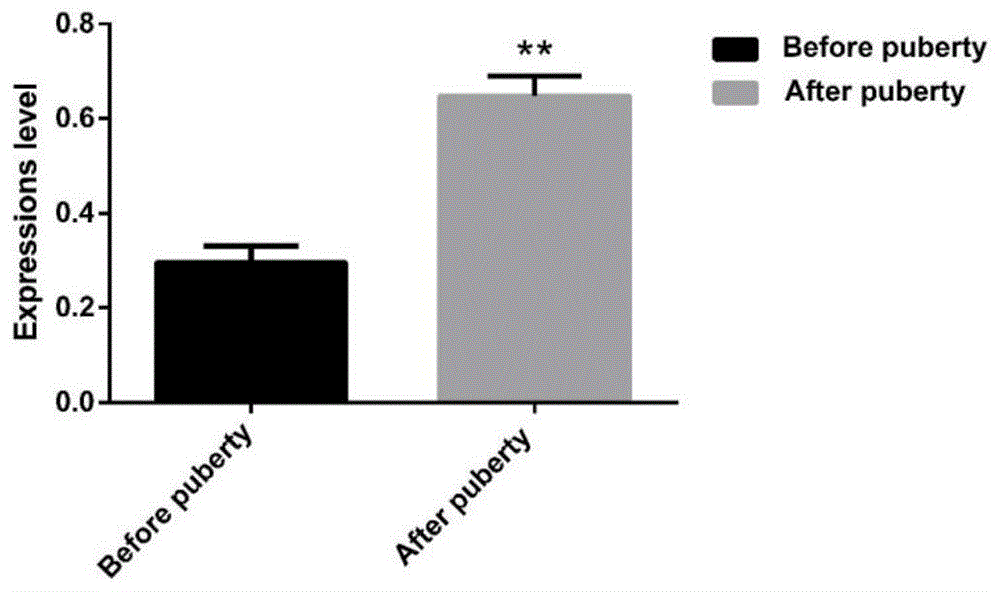
存在的技术问题,本发明提出了bcas2基因用于判断圩公猪初情期启动时间的应用,及甲基化bcas2基因用于判断圩公猪初情期启动时间的应用。本发明提出的bcas2基因用于判断圩公猪初情期启动时间的应用。优选地,通过检测bcas2基因的表达水平以判断圩公猪初情期启动时间。优选地,通过实时定量pcr检测bcas2基因的表达水平以判断圩公猪初情期启动时间。优选地,通过实时定量pcr判断圩公猪初情期启动时间检测bcas2基因的表达水平以判断圩公猪初情期启动时间过程中,至少包括一对特异性扩增bcas2基因的引物,所述引物如seqidno.1和seqidno.2所示。本发明提出的甲基化bcas2基因用于判断圩公猪初情期启动时间的应用。优选地,通过检测bcas2基因启动子区第2186bp处cpg岛甲基化程度以判断圩公猪初情期启动时间。优选地,采用甲基化特异性pcr、甲基化敏感性高分辨率溶解法或亚硫酸氢盐测序法对bcas2基因启动子区第2186bp处cpg岛甲基化程度进行检测以判断圩公猪初情期启动时间。优选地,采用序列如seqidno.3和seqidno.4所示的引物序列进行亚硫酸氢盐测序。在本发明的具体实施方案中,所述bcas2基因的核酸序列如seqidno.5所示【基因id为100154006】。在本发明的具体实施方案中,所述bcas2基因的编码核酸序列如seqidno.6所示【序列号为nm_001244424.1】。现有研究表明,可变剪接涉及精子形成的调节,并在精子生成过程中起重要作用,bcas2在可变剪接中发挥重要作用,bcas2的缺失可导致小鼠睾丸精子发生异常,无法繁育后代。参与精子发生过程中涉及的各种调控因素中,生精细胞内基因的特异表达起决定的作用。研究基因在初情期启动精子发生过程中所起到的作用,一般从该基因及其编码的蛋白在睾丸生精细胞中的表达情况开始。本发明通过对初情期启动前后圩公猪睾丸组织中bcas2mrna表达量检测发现,bcas2在圩公猪睾丸组织中有表达,在初情期启动后的表达量显著高于初情期启动前。westernblot检测发现bcas2基因编码蛋白的表达结果与其mrna表达规律一致,说明bcas2基因对圩公猪初情期启动可能具有一定的调控作用。为探讨bcas2蛋白表达是否具有细胞特异性,本试验采用免疫组织化学染色法检测初情期启动前后圩公猪睾丸组织中bcas2蛋白的表达,结果显示:初情期启动前bcas2蛋白在睾丸间质细胞、精原细胞中存在少量阳性表达,经初情期启动后,发现bcas2蛋白大量表达于生精细胞,由此可知,bcas2蛋白在参与精子的形成过程中可能起着重要的作用,且bcas2基因表达量的高低可能与生精数量有关。近年来大量研究表明,在动物初情期的调控中,dna甲基化通过影响初情期相关基因的表达,进而对初情期发挥显著的调控作用。dna甲基化启动子区cpg位点甲基化能够抑制转录因子与启动子的结合,基因的表达因此也受到抑制。cpg位点可以通过甲基化状态调节基因转录。而dna甲基化水平检测方法目前常用的有3中:甲基化特异性pcr(methylation-specificpcr,msp)、甲基化敏感性高分辨率溶解(methylation-sensitivehighresolutionmelting,ms-hrm)和亚硫酸氢盐测序(bisulfitesequencingpcr,bsp)。msp数据既不可重复也不敏感,并且由于引物的非特异性结合,故不是特异性的。ms-hrm具有高度可重复性,是将样品的甲基化状态分类为百分比范围的一步。bsp是关于每个cpg位点的甲基化百分比的最有信息的方法,虽然不完美,但它具有可重复性和灵敏性,因此bsp是检测dna甲基化水平的金标准。本申请人通过对bcas2基因启动子区进行生物信息学分析时发现,该区域有且只有一个cpg岛区域,以此推测该区域可能是调控bcas2基因表达的重要区域。使用bsp检测bcas2基因启动子区cpg岛的甲基化,测序结果发现,初情期启动前圩公猪睾丸组织中bcas2基因启动子区cpg岛的31个位点中有4个位点发生甲基化,初情期启动前甲基化程度显著高于初情期启动后。虽然初情期启动前呈现低甲基化状态,但本申请人推测这4个甲基化位点对初情期有重要作用。通过与mrna表达水平相结合来进行相关性分析,分析结果发现,bcas2基因启动子区cpg岛甲基化水平与其基因表达水平呈负相关,表面该区域的这4个位点的甲基化在一定程度上抑制了bcas2基因的表达。推测bcas2基因及其蛋白表达可能参与了圩公猪睾丸组织初情期的启动,bcas2启动子区cpg岛甲基化可能通过调控bcas2表达来参与初情期。附图说明图1为qrt-pcr检测bcas2mrna在圩公猪初情期期启动前后睾丸组织中的表达(n=6)。图2为qrt-pcr检测bcas2mrna在圩公猪初情期启动前后全同胞睾丸组织中的表达(其中a、c为全同胞,b、d为全同胞,n=3)。图3a为圩公猪初情期启动前后睾丸组织中bcas2蛋白的差异表达(westernblot图像,n=6)。图3b为圩公猪初情期启动前后睾丸组织中bcas2蛋白的差异表达(westernblot结果灰度值,n=6)。图4为圩公猪初情期启动前后全同胞睾丸组织中bcas2蛋白的免疫组织化学染色结果【其中a为初情期启动前染成结果(100×),b为初情期启动后染色结果(100×);lc为基质细胞,sps为精原干细胞,ss为次级精母细胞,sp为精细胞】。图5为圩公猪bcas2基因启动子区cpg岛预测结果(其中阴影部分为启动子区cpg岛预测范围)。图6为圩公猪bcas2基因启动子区cpg岛扩增电泳图(其中1为初情期启动前;2为初情期启动后)。图7为bcas2基因启动子区cpg岛在圩公猪睾丸组织中的甲基化表达状态(其中a为初情期启动前,b为初情期启动后;●代表甲基化,○代表未甲基化)。图8为bcas2基因启动子区cpg岛单个甲基化位点甲基化率。图9为bcas2基因cpg岛区域单个甲基化位点与mrna表达量相关性分析。具体实施方式由安徽省广德县安泰圩猪养殖公司提供试验猪,选取健康的且出生日龄一致的全同胞个体各6头(2窝,每窝6头),在相同环境和相同条件下饲养。在初情期启动前(75日龄)和启动后(初次射精)2个时间段,采取颈动脉放血处死方法,分别屠宰初情期前6头仔猪(每窝选3头)和初情期后6头,采取睾丸组织,剪碎,现场放入ep管并迅速投于液氮罐中,之后转入-80℃冰箱保存待用。取另一部分完整睾丸组织并将其放入固定液中保存。下述分离胶配比如下表所示:下述5%浓缩胶配比如下表所示:实施例1睾丸组织总rna的提取(1)剪取20mg于-80℃保存的睾丸组织,研磨后放在1mlrna-solv试剂中。每1mlrna-solv试剂添加20μl2-巯基乙醇;(2)将含有匀浆的管在室温下孵育5min;(3)加入200μl氯仿到匀浆中,闭合罐盖并涡旋20s;在室温下孵育2-3min;(4)放入离心机中,转速设置12000rpm,温度设置4℃,时间15min,以此来分离水相和有机相;(5)将上层水相(约500μl)移到新的1.5ml微量离心管中。向微量离心管加入等体积的70%乙醇并涡旋混匀,此时可能会形成沉淀,但不会干扰rna纯化;(6)将样品应用于插入2ml收集管中的rnamini柱。离心柱的最大容量为700μl,放入离心机中,温度25℃,转速1000rpm,时间1min,离心完成后丢弃滤液并在下一步重新使用收集管;(7)将500μlrna洗涤缓冲液(bufferi)直接应用于rnamini柱上,放入离心机中,温度25℃,转速设置1000rpm,时间1min;离心完成后丢弃滤液和收集管;(8)放置在一个新的2ml收集管序列,并添加500μlrna洗涤缓冲液ii(bufferii);放入离心机中,温度25℃,转速1000rpm,时间1min;丢弃滤液并在下一步重新使用收集管;(9)向rnamini柱中加500μlrna洗涤缓冲液ii;离心机转速设置10000rpm,时间1min,温度25℃,离心完成后弃去滤液;然后收集管放空,再以15000rpm,时间2min离心rnamini柱以完全干燥基质;(10)转移到一个干净的1.5ml微量离心管,并用50μldepc水洗脱rna;确保将水直接添加到色谱柱矩阵中心;10000rpm离心1min;实施例2rna浓度和纯度测定通过rna浓度测定仪定量rna浓度和纯度:使用移液器取2μlrna加入到定量板中,检测出od260/od280比值在1.8和2.0之间,这表明rna是纯的,可以认为rna已经抽提成功,每个试验重复三次。满足要求后,可进行逆转录试验或放在-80℃冰柜保存。实施例3pcr引物的设计引物设计及合成由通用生物公司提供,引物序列见下表所示:实施例4mrna逆转录合成cdnamrna逆转录过程严格按照easyone-stepgdnaremovalandcdnasynthesissupermix试剂盒的操作说明进行操作。以rna为模板,mrna逆转录反应体系如下:反应程序:42℃15min,42℃30min,85℃5min,-20℃保存。实施例5transtipgreen实时荧光定量pcr扩增实时荧光定量pcr过程严格按照transtipgreenqpcrsupermix试剂盒的操作说明进行操作。其qrt-pcr扩增反应体系如下:每个样本设置为3个重复;扩增程序为:94℃30s,94℃5s,60℃30s,荧光检测1次,共45个循环。实施例6westernblot检测试验1)睾丸组织蛋白提取(1)用冷pbs洗涤圩公猪睾丸组织块2到3次以除去血渍,用剪刀将其剪成小碎末,放到匀浆管中;向里面加入2个2mm磁珠,然后再加入一定量的蛋白裂解液(需要注意的是,在使用前几分钟内要加入蛋白酶抑制剂),使用均质匀浆机对睾丸组织进行彻底匀浆,匀浆时间调60s,匀浆过程中间歇性冷却,单次匀浆最长时间不要超过100s(如果需要提高蛋白浓度,可以适当减少蛋白裂解液);(2)取出样本管中匀浆完成的睾丸组织,放在冰水混合物中冰浴30min,冰浴过程中每隔5min摇动一次确保睾丸组织完全裂解;(3)将样本放置于离心机中,转速设置12000rpm,时间10min,温度25℃,离心完毕后,收集上清液,即为总蛋白溶液。2)蛋白变性将圩公猪睾丸组织蛋白溶液以4:1的比例向其中加入5×蛋白上样缓冲液,然后放在沸水浴中使蛋白变性,时间15min,之后放在-20℃的冰箱中储存。3)sds-page电泳(1)将玻璃板洗净(2)灌胶与上样(3)等玻璃板完全干燥后,将一对磨砂玻璃板和平板玻璃板成对;玻璃板之间的间隙用胶水填充,放入胶水制造机中,插入楔子以固定玻璃板,并检查底部以避免泄漏;(4)按照上表配置所需浓度的分离胶,向分离胶中加入temed过程中应晃动使其能充分混合,然后再填充适当的胶水。胶水灌注完毕后,再用蒸馏水将胶水间的缝隙填满,这里要注意的是,填充蒸馏水的过程中,避免水把胶水冲破。放置后等待20min,将分离凝胶固化以倒出上层水并用吸水纸吸去剩余的水;(5)根据上表制备浓度5%的浓缩凝胶;注意加入temed后要立即摇匀,以便凝胶可以充分填充;如果还有剩余空间,继续用浓缩凝胶填满,然后将梳子小心插入浓缩凝胶中,插入过程要缓慢,避免进入空气形成气泡;(6)当分离胶彻底凝固后,便可以取下制胶器;梳子要缓慢取出,避免损坏分离胶;(7)电泳过程:将制胶器放入电泳槽中,加入足够量的电泳液。将样品加入电泳孔中,浓缩胶电压设置为75v,分离胶电压设置为120v,接通电源开始电泳;直至出现溴酚蓝,便可断开电源,终止电泳并进行下一步转膜操作。4)转膜过程(1)试验前先准备9张滤纸,大小为8×10cm,再取出1张pvdf膜,将其浸润在甲醛中使其活化,待用;准备1个盆,向盆中倒入适量的转移液,把夹子放在盆里,再放入两块海绵垫,依次放入玻璃棒、滤纸和pvdf膜;(2)打开夹子,将海绵垫放在垫子上,再放上4张滤纸;(3)将剥下的分离胶放在滤纸上,pvdf膜缓缓从分离胶的一端开始覆盖,注意覆盖过程中不能有气泡产生。然后在pvdf膜上覆盖4张滤纸,方法同上,也不能产生气泡;最后将剩下的海绵垫小心盖在滤纸上;(4)转膜条件:快转:电流大小设置为200ma,转膜时间1h,转膜时间并非固定不变,可能根据试验情况做出适当调整,但是电流大小也要根据转膜时间做出相应变化;慢转:电压设置25v,时间24h。5)免疫反应(1)转膜顺利完成后,将膜放在脱色摇床上,使用5%浓度脱脂奶封闭脱色1h;(2)加入一抗【兔抗猪bcas2(稀释比1:1000)和鼠抗猪β-actin(稀释比1:3000)】,4℃孵育过夜(快转),二抗用tbst稀释3000倍,室温下孵育30min。在暗室中依次经显影、水洗、定影进行胶片曝光。6)曝光显影选择一个暗室,将ecla和eclb两种试剂放入到离心管中,等体积混合,将pvdf膜的蛋白面朝上放置,加入事先混合好的ecl溶液,反应时间大约1-2min,然后除去残留的液体并覆盖上部一层薄膜以开始曝光;曝光后的胶片用显影、定影试剂进行显影和定影。7)凝胶图像结果分析对胶片进行扫描和存档,采用photoshopcc2015软件对胶片做处理,去色,使用imagej1.8图像分析软件对目标带的光密度值进行分析。实施例7免疫组织化学检测试验(1)石蜡切片脱蜡至水步骤:依次将切片按以下顺序放入试剂中浸润:试剂时间,min二甲苯i15二甲苯ii15二甲苯iii15无水乙醇i5无水乙醇ii585%酒精575%酒精5蒸馏水2(水洗)(2)抗原修复步骤:在含有修复液的修复盒中加入柠檬酸至ph值为6.0,然后将组织切片置于盛其中,放在微波炉中,调中火,时间设置9min,注意观察修复液,出现沸腾时,立即停火冷却9min,然后再调中低火,时间设置为8min,在此过程中要防止缓冲液出现过度蒸发,切片不能变的干燥。待自然冷却后,将载玻片放置于ph值为7.5的pbs中,让后将其放在脱色摇床上晃动洗涤3次即可,时间设置为每次5min。(3)阻断内源性过氧化物酶的方法步骤:准备浓度为3%的h2o2,将切片放入其中,在试验室内寻找一处无太阳光直射的地方(切勿放在开着的空调下方),将含有切片的h2o2放置在此处孵育25min,孵育完成后,准备一份ph值为7.4的pbs溶液,将切片放入其中,然后通过脱色摇床上晃动洗涤4次,时间设置为每次4min。(4)血清封闭步骤:在组化圈内缓缓滴加3%bsa,要使组织完全被bsa覆盖,滴加完毕后后,25℃封闭28min。(5)加一抗:轻轻的擦去封闭液,使用pbs稀释一抗,然后加入适量的一抗,使其能够完全覆盖组织,切片放于湿盒内,要注意放平,置于环境温度4℃下孵育过夜。这里要注意湿盒内加入少量的蒸馏水,以防止抗体蒸发。(6)加二抗:将载玻片放置于ph值为7.5的pbs中,室温环境下放在脱色摇床上晃动洗涤4次,时间设置为每次4min;将切片稍微甩干燥,然后通过在圈内滴加hrp标记的二抗,直到覆盖组织,最后放在室温下孵育,时间50min。(7)dab显色步骤:将载玻片放置于ph值为7.5的pbs中,放在脱色摇床上晃动洗涤4次,时间设置为每次4min。将切片稍微甩干燥,然后在圈内滴加新鲜配制的dab显色液,放在显微镜下来控制显色时间,出现棕黄色即为阳性,最后用自来水冲洗切片以终止显色。(8)复染细胞核:将苏木素复染4min,用自来水洗涤,并将苏木素分化液分化5s,用自来水冲洗,使用苏木素返蓝液返蓝,最后用柔和的流水冲洗。(9)脱水封片:将切片按下表试剂顺序依次放入浸润:试剂时间,min75%酒精585%酒精5无水乙醇i5无水乙醇ii5二甲苯i5至切片透明后,将其从二甲苯中取出并稍微干燥,中性树胶封片。(10)显微镜镜检,图像采集分析。实施例8组织dna的提取采取组织dna提取试剂盒提取睾丸组织dna,严格按照说明书操作,步骤如下:(1)剪取20mg的睾丸组织材料,通过液氮冷冻将其研磨成粉末状,然后转移至1.5ml的离心管中;(2)然后向离心管中加入400μlaclsolution,震荡混匀1min后,再向离心管中加入20μlproteinasek,然后置于55℃,时间大约为20min~3h;在这段期间内,可以取出离心管混匀,有助于组织细胞充分裂解,裂解彻底的样品应该呈现澄清透明;(3)取出样品,待降至室温时轻轻震荡混匀;(4)在经过预处理好的样品中,依次加入100μlnab溶液,用力摇匀,至于70℃10min。(5)冷却到室温,加入250μl无水乙醇,混匀,如果有沉淀出现出现,用蓝枪头吹打混匀,加到吸附柱上;(6)放入离心机中,转速设置8000rpm,时间1min;离心完后取下gencleancolumn,丢弃收集管中的废液;(7)再将gencleancolumn放回收集管中,向其中加入500μlaw1solution,离心机转速设置8000rpm,温度设置25℃,时间1min,然后丢弃废液。(8)再将gencleancolumn放回收集管中,这次加入500μlaw2solution,离心机转速设置8000rpm,温度设置25℃,时间1min,丢弃废液;(9)重复步骤(8)一次;(10)取下gencleancolumn,丢弃收集管中的废液;将柱重新再放回收集管中,离心机转速设置12000rpm,温度设置25℃,时间1min,以除去残留的aw2solution;(11)将柱放入新的干净的1.5ml离心管中,在柱中央加入50~100μlaebuffer,室温或55℃温度下放置2min。然后离心机转速设置12000rpm,温度设置25℃,时间1min;离心完成后,离心管中剩余的液体即为所需基因组dna,-20℃保存;实施例9dna浓度和纯度测定用分光光度仪检测基因组dna质量,od260值为1相当于大约50μg/ml双链dna,并通过0.7%琼脂糖电泳凝胶鉴定dna样品的完整性和有无rna。实施例10引物设计及合成采用msp引物设计软件(http://www.urogene.org/cgibin/methprimer/methprimer.cgi)用于设计bcas2启动子区的cpg岛甲基化引物,引物序列如下表所示,由上海捷瑞生物工程有限公司合成。实施例11bsp方法检测基因启动子区甲基化状态采用epitectfastbisulfiteconversionkits试剂盒进行亚硫酸盐转化并纯化回收睾丸组织dna,严格按照操作说明进行操作,步骤如下:(1)解冻dna用于bsp反应,取2管bisulfitemix,每管中加800μl的rnase-free水,手动晃动试剂管,使其溶解;将bisulfitemix放置在涡旋振荡器上,涡旋时间6min,确保其彻底溶解(这里需注意:不要将bisulfitemix放在冰块上;如果需要,将亚硫酸氢盐溶液加热至60℃,然后再使用涡旋振荡器溶解全部沉淀物);(2)在200μlpcr管中制备亚硫酸氢盐反应液,按下表所列顺序添加每种组分。成分用量,μldna溶液(1-2μg)10variable*(maximum20μl)rnase-freewater10variable*bisulfitesolution85dnaprotectbuffer35totalvolume140*dna和无rnase水的总量必须为20μl。(3)盖上pcr管并彻底混合亚硫酸氢盐反应液,储存在室温(15-25℃)下(注:dnaprotectbuffer在加入bisulfitemix后有绿色变为蓝色,表明转化反应充分且ph正确);(4)使用热循环仪进行亚硫酸盐dna转化,总共30min,条件如下:步骤时间温度denaturation5min95℃incubation10min60℃denaturation5min95℃incubation10min60℃holdindefinite20℃(5)使用热循环仪孵育亚硫酸氢盐反应液;(6)待亚硫酸氢盐转化完成后,将其离心1min,然后将反应溶液转移到干净的1.5ml微量离心管中;(7)向每个样品中加入310μl含有carrierrna的新制备的缓冲液bl;使用涡旋来混合溶液,然后再短暂的离心;(8)向每个样品中加入250μl乙醇(96-100%);通过脉冲涡旋将溶液混合15s,然后使用离心机短暂离心,以除去盖子内部残留的液滴;(9)取所需数量的minelutedna离心柱和收集管,放入合适的架子中;将步骤8的每个管的整个混合物转移至相对应的minelutedna离心柱中;(10)最大转速离心1min;将收集管中的液体丢弃,然后再把离心柱放入收集管中;(11)向每个离心柱中加入500μl的缓冲液bw,离心机设置最大转速,离心时间设置为1min;离心完成后,将收集管中液体丢弃,再把离心柱放入收集管中;(12)再向每个离心柱中加入500μl缓冲液bd(脱磺酸缓冲液),放置在室温(15-25℃)环境下孵育,时间为15min(注意:如果缓冲液bd中发现有沉淀物,要避免沉淀物被转移到离心柱中;含有缓冲液bd的瓶子应在使用后立即关闭,以避免空气中的二氧化碳酸化);(13)最大转速,离心时间1min;然后把收集管中的液体丢弃,再将离心柱放入收集管中;(14)向每个离心柱中加入500μl的缓冲液bw,离心机设置最大转速,离心时间设置1min。将收集管中液体丢弃后,再把离心柱放入收集管中;(15)重复步骤(14)一次;(16)向每个离心柱中加入250μl乙醇(浓度大约96-100%),设置离心机为最大速度,时间1min;(17)将离心柱放入一个新的2ml收集管中,离心机设置最大速度,离心时间1min,以除去残留的液体;(18)将离心柱开盖,重新放入新的1.5ml离心管上,放置在56℃环境温度下,孵育时间5min(注:蒸发残余液体);(19)将离心柱放入干净的1.5ml微量离心管中。将15μlbuffereb(洗脱缓冲液)直接加到每个旋转柱膜的中心,轻轻关闭盖子;(20)在室温下孵育离心柱1min;(21)15000rpm离心1min以洗脱dna;注意:建议将纯化的dna保存在2-8℃下最多24h;当纯化的dna储存超过24h时,建议把它放在-20℃冰柜保存。pcr反应体系为30μl:成分用量模板dna2μl10×taqbuffer3μldntp1μl酶1μlh2o21μl上游引物1μl下游引物1μl反应条件:采用琼脂糖凝胶检测pcr产物,然后通过使用回收试剂盒回收目的片段,纯化后将其与ptg19-t载体连接、转化、克隆。通过使用xl10-gold感受态,严格按照产品说明书进行转化、复苏和涂板操作。采用酶切法来鉴定阳性菌落,选取10个阳性菌落并测序以分析靶基因cpg岛的甲基化状态。实施例12数据统计与结果分析采用2-δδct对qrt-pcr结果进行统计学分析。westernblot试验结果使用imagej1.8图像分析软件进行灰度值扫描测定。数据均用平均值±标准误(m±se)表示,采用spss23.0软件两独立样本t检验程序进行统计分析;bcas2基因在睾丸中的表达情况与甲基化程度的相关性分析采用spss23.0软件pearsoncorrelationcoefficient程序进行统计分析。p<0.05表示差异显著,p<0.01表示差异极显著。结果分析:1、bcas2基因在圩公猪初情期启动前后睾丸组织中的表达水平取初情期启动前后睾丸组织进行实时荧光定量pcr(qrt-pcr)检测,表达水平如图1所示。由图1可知:在初情期期启动前,bcas2基因在睾丸组织中呈现低表达状态,睾丸组织中bcas2基因随初情期启动表达升高,初情期启动后表达水平极显著高于初情期启动前。将非全同胞个体做表达差异比较,如图2所示。由图2可知:在同一生理发育阶段,非全同胞个体间,bcas2基因表达差异不显著,全同胞个体间,初情期启动后表达水平皆高于初情期启动前表达水平,差异极显著。2、bcas2蛋白在圩公猪初情期启动前后睾丸组织中的相对表达量由于bcas2基因的表达量并不能直接反应出该基因在初情期启动中发挥着作用,采用westernblot技术检测初情期启动前后圩公猪睾丸组织中bcas2蛋白的表达,结果如图3a所示,bcas2蛋白在初情期启动前后圩公猪睾丸组织中均有表达,但表达量存在差异。对bcas2蛋白表达量进行灰度值分析,结果如图3b所示,蛋白质总体表达趋势与其mrna类似:初情期启动后表达量极显著高于初情期启动前;同一生长阶段,非全同胞个体间蛋白表达差异不显著。3、bcas2蛋白在圩公猪初情期启动前后睾丸组织中的表达与定位通过免疫组织化学检测可确定bcas2蛋白在圩公猪睾丸组织中哪些细胞发挥着作用。对初情期启动前后全同胞圩公猪睾丸组织进行石蜡包埋切片,免疫组织化学染色如图4所示,图4显示bcas2是一个核蛋白,在睾丸基质细胞和精原干细胞中均有表达。值得注意的是,初情期启动后bcas2在曲细精管中央的次级精母细胞和精细胞中相对高表达。表明,初情期启动过程中bcas2在睾丸组织可能具有特定的表达模式。4、初情期启动前后睾丸组织中bcas2甲基化与其表达水平的相关性4.1生物信息学分析本申请人通过ncbi数据库找到了bcas2基因的相关信息,其启动子通常位于外显子1上游2186bp,使用promoterscan软件对其启动子区进行预测,通过methprimer软件分析结果如图5所示,bcas2基因启动子区2186bp只存在1个cpg岛(1778-2129bp),且该cpg岛有31个cpg位点,说明该区域可能是调控bcas2基因表达的重要区域,因此对该区域的甲基化水平与基因表达进行相关性分析。4.2目的片段的扩增根据对猪bcas2基因启动子区cpg岛的预测结果,用bsp引物扩增bcas2基因片段(384bp),琼脂糖凝胶电泳分析pcr扩增产物,结果见图6所示。本申请人发现扩增片段大小均与预期相符,且特异性较好,无杂带产生,可以用于进一步试验。4.3圩公猪bcas2基因启动子区cpg岛的甲基化状态bcas2基因启动子区cpg岛的甲基化状态结果由测序数据分析而得,测序结果如图7所示。初情期启动前,目的基因cpg岛在圩公猪睾丸组织中表现低甲基化,只有第10、18、19、23个位点出现甲基化(每个位点的甲基化率为20%),如图8所示,且这4个位点的甲基化率呈现高度一致性;随机挑选的10个克隆子中,4、5、6、7、9、10出现甲基化,其中,克隆子5、9的甲基化水平最高。通过对每个位点的甲基化频率进行计算,得到每个位点的甲基化频率,计算31个位点的甲基化频率平均值,得到bcas2基因启动子区在圩公猪初情期启动前睾丸组织中的平均甲基化频率为2.6%,在初情期启动后的睾丸组织中平均甲基化频率为0,且两组间甲基化水平差异极显著。4.4bcas2基因启动子区甲基化水平与mrna表达相关性分析圩公猪睾丸组织bcas2基因启动子区cpg岛10、18、19、23位点甲基化水平和bcas2基因mrna表达的相关性如图9所示,4个位点甲基化水平和mrna表达的相关系数均为-0.853,p值为0.002,说明圩公猪睾丸组织bcas2基因启动子区甲基化水平与bcas2基因表达量呈显著负相关关系。在圩公猪初情期启动前后,(1)初情期启动前睾丸组织中bcas2基因表达水平极显著高于初情期启动后表达水平;(2)初情期启动前睾丸组织中bcas2蛋白表达量极显著高于初情期启动后;(3)初情期启动前,bcas2蛋白主要位于睾丸基质细胞和精原干细胞,初情期启动后,大量表达于曲细精管中央的次级精母细胞和精细胞;(4)初情期启动前bcas2基因启动子区甲基化程度高于初情期启动后,且重要甲基化位点其甲基化水平与基因表达水平呈负相关。根据上述结果可以证实,bcas2基因表达与bcas2基因启动子区甲基化程度和圩公猪初情期启动具有相关性,其可以作为圩公猪初情期启动与否的标记物,辅助饲养工作人员鉴定圩公猪的初情期启动时间,甚至可以干预调节初情期启动时间,减少养殖成本。以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1