猪源杂合抗菌肽PP-1及其制备方法和应用与流程
本发明属于生物技术领域,具体涉及一种猪源杂合抗菌肽pp-1及其制备方法和应用。
背景技术:
传统抗生素提高了动物的生产性能,降低了疾病发生率,但同时也导致药物残留、耐药性菌株、环境污染等问题的产生。特别是近些年来滥用抗生素以及耐药性问题呈现日益加剧的趋势,由此可见研发高效且安全的新型饲料对传统抗生素进行替代具有重要意义。抗菌肽是生物体天然免疫防御系统的重要组成部分,不仅具有抑制、杀灭多种细菌、真菌、病毒、寄生虫的生物学功能,而且可以提高动物机体免疫能力,不存在残留、无任何副作用。因此,抗菌肽替代抗生素已成为近年来的研究热点。
猪源抗菌肽种类较多,其中pr-39研究较为广泛,是一种富含脯氨酸-精氨酸的由39个氨基酸残基组成的线性内源性抗菌肽。但是,其主要对革兰氏阴性菌具有抗菌作用,对部分革兰氏阳性菌,比如金黄色葡萄球菌和铜绿加单孢菌等,没有抑制作用。因此如何拓宽pr-39的抗菌谱具有重要的意义。
技术实现要素:
基于以上不足之处,本发明的目的在于提供一种猪源杂合抗菌肽pp-1,其序列如序列表seqidno.1所示,该多肽由猪源抗菌肽pr-39与猪源骨髓抗菌肽pmap-23杂合,安全性较好,具有广谱抗菌活性、低毒性和低溶血性。
本发明的另外一个目的在于提供一种猪源杂合抗菌肽pp-1的制备方法,该制备方法简单且技术成熟,合成成本低,适合应用于生产,方法步骤如下:
(1)根据猪源抗菌肽pr-39的氨基酸组成特点,截取其片段与猪源骨髓抗菌肽pmap-23或pmap-36的片段杂合而获得氨基酸长度19至22的3条杂合抗菌pp-1、pp-2和pp-3,其序列分别如序列表seqidno.1-3所示;
(2)采用固相化学合成法,通过多肽合成仪合成多肽;
(3)将合成的多肽使用反相高效液相色谱进行纯化,并利用电喷射质谱法对合成的多肽进行鉴定,完成多肽的制备;
(4)采用美国临床实验室标准化研究所推荐的测定最小抑菌浓度的方法,发现杂合抗菌pp-1的最小抑菌浓度平均值为3.56μm,且无溶血毒性,综合治疗指数达到144,从而选取猪源杂合抗菌肽pp-1。
本发明的另一目的在于提供如上所述的猪源杂合抗菌肽pp-1的在制备治疗革兰氏阳性菌或/和革兰氏阴性菌感染性疾病药物中的应用。
本发明的优点及有益效果:该多肽由猪源抗菌肽pr-39与猪源骨髓抗菌肽pmap-23杂合,安全性较好,具有广谱抗菌活性、低毒性和低溶血性;该多肽由19个氨基酸组成,肽链较短,制备方法简单且技术成熟,合成成本低,适合应用于生产。
附图说明
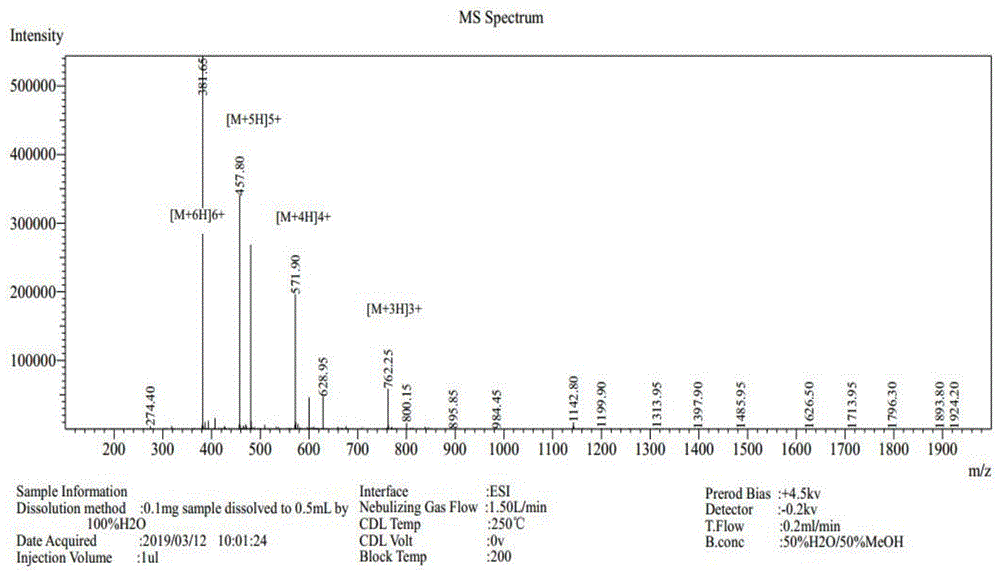
图1为抗菌肽pp-1的质谱图。
图2为抗菌肽pp-2的质谱图。
图3为抗菌肽pp-3的质谱图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1:猪源杂合抗菌肽的设计
通过ncbi获取猪源抗菌肽pr-39、pmap-23和pmap-36氨基酸全序列,通过生物信息学分析,获得三者的核心区域。通过杂合方式,获得氨基酸长度19和22的3条抗菌肽序列pp-1,pp-2,pp-3。如表1所示。
表1猪源杂合抗菌肽的氨基酸序列和分子量
实施例2:猪源杂合抗菌肽的合成
将表1所示三条多肽使用多肽合成仪合成,选用固相有机合成,采用fmoc保护合成法,合成方向从c端到n端逐一进行,具体步骤如下:
(1)选取已经和c端第一个氨基酸连接的wang树脂,即fmoc-a(trt)-wang(9-芴甲氧羧基-三甲基-a,其中a为c端第一个氨基酸),使用二甲基甲酰胺(dmf)浸泡15min左右以除去杂质;用含有20%哌啶的dmf脱除树脂上的fmoc保护,反应20min,洗涤树脂直至完全。用dmf清洗掉哌啶,剩余的固体悬浮物即是脱保护的a-wang。用印三酮检测剂检查a-wang脱保护的质量。
(2)将fmoc-b(trt)-oh(9-芴甲氧羧基-三甲基-b,b为每个抗菌肽c端第二个氨基酸)与上述得到的脱保护的wang树脂进行缩合反应;然后再脱去fmoc基团。按照这个程序依次从c端到n端逐个延伸,直至将整个肽链合成完毕,当最后一个氨基酸脱保护后,用dmf洗涤8次,再用乙醇和二氯甲烷(dcm)交叉洗涤8次。将三氟乙酸(tfa):三异丙基氯硅烷(tis):水=95:2.5:2.5(体积比)进行混合,配制成为切割试剂与上述得到的多肽20℃下反应2h,把多肽从树脂上切割下来。旋转蒸发仪蒸发tfa,再加入10倍左右体积的预冷无水乙醚沉淀多肽3h,析出白色粉末状固体。真空干燥,得到粗品多肽。
(3)将上述粗品多肽使用90%乙腈水溶液溶解,使用制备色谱柱进行纯化,分析型色谱柱检测纯度。半制备型高效液相色谱仪为watersdeltaprep4000,制备色谱柱为watersx-bridgec18、5μm反相柱。洗脱液a为含有0.1%tfa的水溶液,b为含有0.1%tfa的乙腈水溶液;检测波长220nm,洗脱方式为30%b~65%b的线性浓度梯度洗脱,流速为30ml/min。收集纯度高于95%的馏分,并冷冻干燥。分析型高效液相色谱仪为agilent1100,分析型色谱柱为sepaxgp-c18反相柱(4.6mm×150mm,5μm),洗脱液a液为0.1%tfa的水溶液,b液为含0.1%tfa的乙腈水溶液;检测波长220nm。洗脱方式为50%b~75%b的线性浓度梯度洗脱,流速为1.0ml/min。
(4)多肽的质谱鉴定:将上述得到的多肽经过电喷射质谱法分析,质谱图中显示的分子量与理论分子量一致。如附图所示。使用高效液相色谱进行纯化,使得抗菌肽的纯度大于95%。
实施例3:猪源杂合抗菌肽的抑菌活性和细胞毒性测定
采用美国临床实验室标准化研究所(clsi)推荐的测定最小抑菌浓度(mic)的方法,同时针对抗菌肽的阳离子性的特征,进行了相应的改进。以0.01%乙酸(含0.2%bsa)作为稀释液,使用二倍稀释法依次配置系列梯度的抗菌肽溶液。取上述溶液50μl置于96孔细胞培养板中,然后分别添加等体积的待测菌液(~105个/ml)于各孔中。分别设置阳性对照(含有菌液而不含有抗菌肽)和阴性对照(既不含菌液也不含抗菌肽)。37℃恒温培养20h,以肉眼未见孔底部有混浊现象的即为最小抑菌浓度。结果如表2所示,可以看出,pp-1的最小抑菌浓度为2-8μm,pp-2的为1-4μm,pp-3的为4-16μm。从表3可以看出,pp-1、pp-2、pp-3的最小抑菌浓度分别为3.56、2、7.13μm。
表2猪源杂合抗菌肽的抑菌活性
另外,通过利用人红细胞测定多肽的溶血活性,结果发现pp-1、pp-2、pp-3的最小溶血活性分别为>256、64、>256μm。综合最小抑菌浓度和最小溶血浓度,发现杂合肽pp-1、pp-2、pp-3的ti值依次为143.82、32和71.81,其中pp-1的ti值最大,显示出最高的治疗指数,更适宜于生产应用。
表3猪源杂合抗菌肽的溶血活性
备注:
gm:代表最小抑菌浓度的几何平均数
mhc:代表最低溶血浓度
ti:代表mhc/gm。
序列表
<110>东北农业大学
<120>猪源杂合抗菌肽pp-1及其制备方法和应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>19
<212>prt
<213>人工序列(artificialsequence)
<400>1
argargargproargproprotyrglyglyglylysphevalthrval
151015
trpvalarg
<210>2
<211>22
<212>prt
<213>人工序列(artificialsequence)
<400>2
argargargproargproprotyrglyglyglyargileileargleu
151015
leutrpargvalargarg
20
<210>3
<211>19
<212>prt
<213>人工序列(artificialsequence)
<400>3
argargargproargproprotyrglyglyglyileglylysvalleu
151015
lystrpile
- 还没有人留言评论。精彩留言会获得点赞!