一种可以预防肿瘤发生的免疫细胞及其制备方法与应用与流程
本发明是关于一种可以预防肿瘤发生的免疫细胞及其制备方法与应用,具体地说,是关于一种激活并扩增外周血单个核细胞制备得到的免疫细胞tpkt(tumorpreventionkillertcells)及其制备方法,以及在制备用于预防肿瘤发生、阻止肿瘤早期的发展的制剂中的应用,属于生物
技术领域:
。
背景技术:
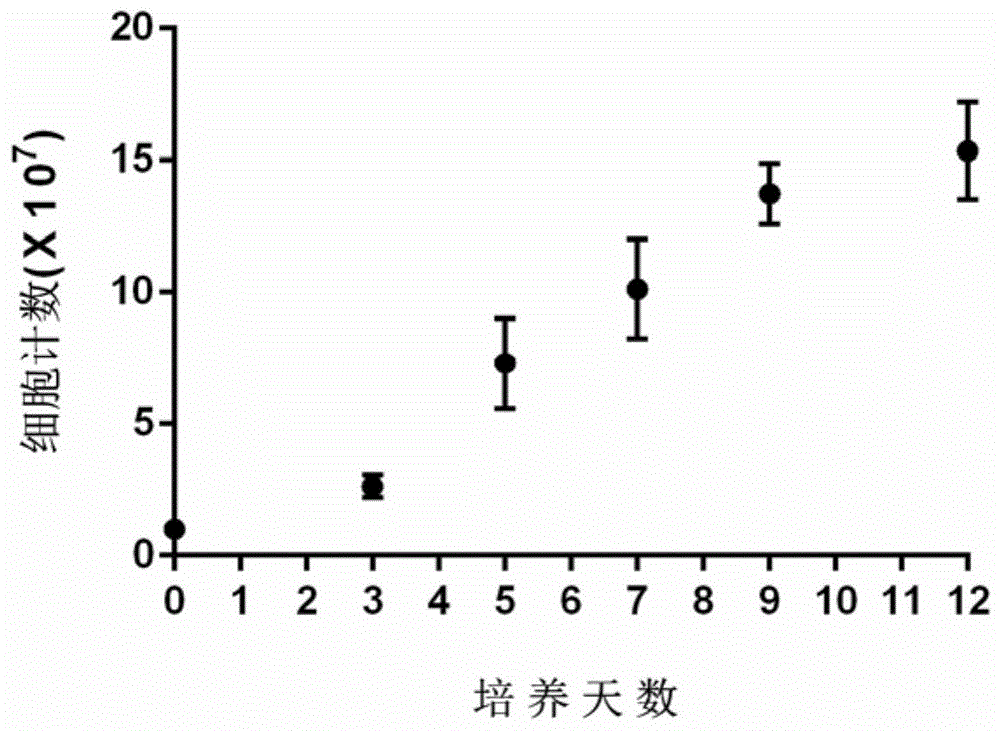
:肿瘤是机体在各种致瘤因素作用下,局部组织的细胞在基因水平上失去对其生长的正常调控而导致克隆性异常增生形成的,常表现为局部肿块。肿瘤是常见病,多发病,其中恶性肿瘤是目前危害人类健康最严重的一类疾病。恶性肿瘤的发生是一个多因子、多步骤的复杂过程,包括非常复杂的环境-基因之间的相互作用,它所涉及的不只是单基因的作用而是多基因联合作用。肿瘤是由一个转化细胞不断增生繁衍形成的,一个典型的恶性肿瘤的自然生长史可以分为几个阶段:一个细胞的恶性转化→转化细胞的克隆性增生→局部浸润→远处转移。肿瘤发生时具有永生性的特点。多数正常细胞的增殖周期有限,与之相反,肿瘤细胞则可无限增殖,提供可永不枯竭的前体细胞群。早中期肿瘤最主要的治疗手段就是手术切除,虽然手术切除的方法治疗彻底,但术后创伤性较大,若癌细胞入侵蔓延到邻近组织或远端转移,则手术切除的效果就会受到极大限制。这种方法也不适合对微小病灶的治疗,且肿瘤患者手术后肿瘤复发或转移率很高。化疗的方式能够对原发病灶、转移病灶均有一定的治疗作用,但杀灭肿瘤细胞的同时也能杀灭人体正常细胞,毒副作用比较大。而放射线治疗虽然能够对区域敏感性肿瘤产生较好的治疗效果,但受肿瘤部位局限性较大,容易对人体正常组织造成伤害。综上所述,目前的技术对于清除机体内由未知的易感因素造成的表达变异蛋白的肿瘤前体细胞及不可见微小肿瘤都不能进行准确的诊断,这对于早期癌症的预防及治疗造成了巨大的困难。肿瘤免疫治疗是通过重新启动并维持免疫系统对肿瘤细胞的识别和杀伤,恢复机体正常的抗肿瘤免疫反应,从而控制与清除肿瘤的一种治疗方法。这种疗法不仅效果好,而且还避免了对机体的损伤,因此近年来备受关注。肿瘤免疫治疗的主要方向之一是活化免疫细胞。关于活化免疫细胞的技术,当前已有较多报道。cn106754704a公开了一种免疫细胞体外诱导扩增的方法,cn106591233b公开了一种免疫细胞的体外诱导扩增和冻存的方法,cn106701681b公开了一种免疫细胞的体外诱导扩增、冻存和复苏的方法,这些文献中的免疫细胞的体外诱导扩增基本一致,包括:利用cd16抗体包被培养容器,得到包被后的培养容器;利用免疫细胞激活培养基将单个核细胞置于包被后的培养容器中进行免疫细胞激活培养基,得到初步诱导扩增的免疫细胞;利用免疫细胞扩增培养基将初步诱导扩增的免疫细胞进行第二诱导扩增培养,得到分化的免疫细胞;利用免疫细胞规模化扩增培养将分化的免疫细胞进行第三诱导扩增培养,获得大规模的功能激活的免疫细胞。其中,所述免疫细胞激活培养基为添加了血浆、白介素-2和沙培林的无血清淋巴细胞培养基;所述免疫细胞扩增培养基为添加了白介素-2和沙培林的无血清淋巴细胞培养基;所述免疫细胞规模化扩增培养为添加了白介素-2的无血清淋巴细胞培养基。该方法具有诱导效率高、扩增速度快、安全性高和成本低等优点,并且,冻存的大规模的免疫细胞,有效保存时间长,细胞回收率高。cn105505870b公开了一种免疫细胞培养方法以及人工滋养细胞在免疫细胞培养中的用途,其中在免疫细胞培养过程中加入表达细胞生长因子和共刺激分子的滋养细胞,所述滋养细胞表达的细胞生长因子为il-21细胞生长因子;所述滋养细胞表达的共刺激分子为4-1bbl共刺激分子,利用滋养细胞表面的免疫细胞生长因子和共刺激信号,不断刺激免疫细胞,而达到促使免疫细胞扩增的作用。由于直接加入滋养细胞,而非单独加入免疫细胞生长因子和细胞共刺激分子信号蛋白,因此,既延长细胞生长因子和共刺激信号的作用时间,又降低免疫细胞生产成本,而且培养的免疫细胞还具有增值效果好、抗原专一性的t细胞比例高、专一性高、杀伤肿瘤细胞的功能强等优点。cn105219708a公开了一种免疫细胞培养试剂盒、免疫细胞培养方法,所述的试剂盒包括培养液a,所述培养液a为向无血清淋巴细胞培养液中加入rhifn-γ、rhil-2、rhil-15和人转铁蛋白制得,所培养得到的免疫细胞,细胞数量可达100亿个细胞数左右,除了ctl细胞群外,还含有较多的nk细胞和nkt细胞群。技术实现要素:本发明的一个目的在于提供一种可预防肿瘤发生、阻止肿瘤早期的发展的免疫细胞。本发明的另一目的在于提供上述的免疫细胞的制备方法。本发明的另一目的在于提供上述的免疫细胞的应用。为了实现本发明的目的,本发明提供了一种预防肿瘤发生的免疫细胞的制备方法,从而得到一种免疫细胞,本发明中将所制备得到的免疫细胞称为tpkt细胞(tpkt(tumorpreventionkillertcells,tpkt)。tpkt细胞可通过抗原呈递细胞(antigen-presentingcells,apc)识别出隐形感染抗原,从而清除抗原;清除机体内由未知的易感因素造成的表达变异蛋白的肿瘤前体细胞;清除手术、放疗、化疗后残存的癌细胞及影像学不可见的微小病灶,降低肿瘤的转移和复发。从而可以阻止肿瘤早期的发展,预防肿瘤发生及复发。具体地,一方面,本发明提供了一种免疫细胞的制备方法,该方法包括:体外分离并纯化外周血单个核细胞(peripheralbloodmononuclearcells,pbmc);用细胞激活因子ⅰ(本发明中亦称为tpkt细胞激活因子i)激活外周血单个核细胞(激活后的细胞即成为tpkt细胞);其中,tpkt细胞激活因子ⅰ含有il-2、ifn-γ、gm-csf、tnf-α,以生理盐水配置;用细胞激活因子ⅱ(本发明中亦称为tpkt细胞激活因子ii)将激活后的细胞即tpkt细胞进行扩增;其中,tpkt细胞激活因子ⅱ含有il-2、ifn-γ、il-12,以生理盐水配置;收获免疫细胞(tpkt细胞)。根据本发明的具体实施方案,本发明的免疫细胞的制备方法中,体外分离并纯化外周血单个核细胞的过程包括:rpmi1640培养液等倍稀释血液,置于淋巴细胞分离液上,离心,取上层淋巴细胞层,加入rpmi1640培养基,离心,弃上清;加入rpmi1640培养基混悬细胞,离心,弃上清;加入完全培养基混悬细胞。根据本发明的一些具体实施方案,本发明的上述免疫细胞的制备方法中,所述的离心条件为1800rpm、5~15min。根据本发明的具体实施方案,本发明的免疫细胞的制备方法中,所述完全培养基是按照以下方法制备得到的:全血离心,弃上清,4℃静置过夜,再离心,取上清作为向rpmi1640培养基中添加的血浆;在本发明的一些具体实施方案中,其中所述离心条件为1500g离心15~20分钟;向rpmi1640培养基中加入血浆,并按100u/ml浓度加入庆大霉素,制成含10v/v%自身血浆的完全培养基。根据本发明的具体实施方案,本发明的免疫细胞的制备方法中,细胞激活因子ⅰ含有il-2浓度100-5000iu/ml、ifn-γ浓度200-10000iu/ml、gm-csf浓度150-1500iu/ml、tnf-α浓度0-500iu/ml,以生理盐水配置。根据本发明的具体实施方案,本发明的免疫细胞的制备方法中,细胞激活因子ⅱ含有il-2浓度300-10000iu/ml、ifn-γ浓度300-10000iu/ml、il-12浓度100-10000iu/ml,以生理盐水配置。在本发明的一些具体的实施方案中,细胞激活因子i含有il-2浓度2500-4000iu/ml、ifn-γ浓度2000-4000iu/ml、gm-csf浓度300-1000iu/ml、tnf-α浓度10-500iu/ml或者200-400iu/ml,以生理盐水配置;细胞激活因子ii含有il-2浓度5000-6500iu/ml、ifn-γ浓度2000-4000iu/ml、il-12浓度4500-6500iu/ml,以生理盐水配置。根据本发明的具体实施方案,本发明的免疫细胞的制备方法中,用tpkt细胞激活因子ⅰ激活外周血单个核细胞的过程包括:向每20ml细胞悬液中加入tpkt细胞激活因子ⅰ0.5ml,于38.5℃、6.5%co2的恒温培养箱中培养72小时。根据本发明的具体实施方案,本发明的免疫细胞的制备方法中,用tpkt细胞激活因子ⅱ将tpkt细胞进行扩增的过程包括:接种细胞72h后,将培养物转移至离心管中,离心(一些具体实施方案中的离心条件为1800rpm、5~15min);弃上清,rpmi1640培养基混悬细胞,并调整细胞密度0.5×106-1×106个/ml,加入tpkt细胞激活因子ⅱ;将细胞悬液加入到未包被的细胞培养瓶中,于38.5℃、6.5%co2的恒温培养箱中继续培养72小时。根据本发明的具体实施方案,本发明的免疫细胞的制备方法中,收获tpkt细胞的过程包括:将细胞培养产物离心(一些具体实施方案中的离心条件为1800rpm、5~15min),弃上清,并用含白蛋白的生理盐水或rpmi1640培养基混悬细胞,冻存。根据本发明的具体实施方案,本发明的免疫细胞的制备方法中,tpkt细胞的冻存步骤包括:将细胞培养产物离心(一些具体实施方案中的离心条件为1800rpm、5~15min),弃上清,加入预冷过的冻存液a重悬,充分混匀后置冰上,缓慢加入预冷过的冻存液b,充分混匀后立即转入冻存管中,-80℃保存;在本发明的一些具体实施方案中,所述冻存液a为:向浓度为200g/l的人血清白蛋白溶液每100ml中加入100mlph7.0的pbs缓冲液;混匀后-20℃保存;所述冻存液b为:ph7.0的pbs缓冲液与二甲基亚砜按照4:1体积比混匀即得。其中tpkt细胞的冻存步骤为:细胞离心(一些具体实施方案中的离心条件为1800rpm、5~15min)并用4ml冷冻液a重悬,充分混匀,置于冰上,缓慢加入4ml预冷的冷冻液b。充分混匀,分装于6支冷冻管中,细胞保存于液氮或-80℃低温冰箱,24小时后转入液氮保存。注意:①冻存液a、冻存液b,冻存液a为:向浓度为200g/l的人血清白蛋白溶液100ml中加入100mlph7.0的pbs缓冲液;混匀后-20℃保存;所述冻存液b为:ph7.0的pbs缓冲液与二甲基亚砜按照4:1体积比混匀即得。需要提前配置,放入4℃冰箱中预冷,或者配制好后分装放入-20℃冰箱中冻存备用。冻存液在取出时需上下晃动混匀。②冻存管、冻存管架、泡沫盒均需提前放入-20℃冰箱中预冷30min左右。另一方面,本发明还提供了一种免疫细胞,通过流式细胞仪检测所述免疫细胞表面白细胞分化抗原,其具有以下性能:cd3-fitc/cd4-pe/cd8-pecy5鉴定:cd3+细胞≥90%,cd3+/cd4+细胞≥40%,cd3+/cd8+细胞≥40%;cd3-fitc/cd16-pe/cd56-pecy5鉴定:cd3+/cd56+细胞≥10%,cd3-/cd56+及cd3-/cd16+细胞≥5%;lin-fitc/cd83-pe/cd1a-pecy5鉴定:lin-/cd83+/cd1a+细胞≥1%;foxp3-fitc/cd25-pe/-cd4-pecy5鉴定:foxp3+/cd25+/-cd4+细胞≤1%;cd3-fitc/cd14-pe/cd19-pecy5鉴定:cd3-/cd14+细胞≤1%,cd3-/cd19+细胞≤1%。根据本发明的具体实施方案,本发明的免疫细胞,其是根据本发明所述的方法制备得到的。本发明的免疫细胞,其他质量鉴定及合格标准:细胞培养终产品要求按照《中国生物制品》中的《生物制品无菌试验规程》进行实验,细胞终产品应经革兰氏阳性及革兰氏阴性细菌培养结果为阴性;经真菌培养鉴定结果为阴性;经支原体检测结果为阴性;经梅毒检测结果为阴性;经乙肝抗原检测结果为阴性;内毒素检测结果为阴性。另一方面,本发明还提供了所述的免疫细胞在制备用于预防肿瘤发生、阻止肿瘤早期的发展的制剂中的应用。根据本发明的一些具体实施方案,所述用于预防肿瘤发生、阻止肿瘤早期的发展的制剂是通过皮内注射、静脉注射、肌内注射或在所述肿瘤内部或周围给药,给药剂量为每次50万-3000万免疫细胞。根据本发明的一些具体实施方案,所述用于预防肿瘤发生、阻止肿瘤早期的发展的制剂是通过抗原呈递细胞识别出隐形感染抗原从而清除抗原,清除表达变异蛋白的肿瘤前体细胞,和/或阻止转化细胞的克隆性增生而清除影像学不可见微小肿瘤。根据本发明的具体实施方案,所述免疫细胞在具体应用时候,先经过复苏再回输。tpkt细胞的复苏步骤为:将需复苏的细胞冷冻管于37℃恒温水浴中化冻,并迅速移入预置10ml细胞复苏液的离心管中,离心(一些具体实施方案中的离心条件为1800rpm、5~15min),并用10ml生理盐水重悬,再离心。用2ml细胞复苏液重悬,准备回输。取样,进行台盼蓝染色,并计数、计算活率。其中复苏液的制备方法:95ml无菌生理盐水中加入浓度为200g/l的人血清白蛋白溶液5ml,混匀后用0.22μm滤器过滤,即得。其中tpkt细胞的回输步骤为:将复苏后的tpkt细胞通过皮内注射、静脉注射、肌内注射或在所述肿瘤内部或周围给药,以每次注射50万-3000万细胞的剂量给药。回输前一定获得细菌鉴定及其他质检报告,以防培养过程所致的感染。本发明的有益效果:(一)在细胞体外激活阶段使用了il-2、ifn-γ、gmcsf、tnf-α的特殊因子组合,在各组分共同作用下,能快速激活外周血单个核细胞成为tpkt细胞,使其通过apc的提呈作用而具有可识别隐性感染因素造成的表达变异蛋白的肿瘤前体细胞及影像学不可见得微小肿瘤的能力。(二)在细胞扩增阶段使用了il-2、ifn-γ、il-12的细胞因子组合,使tpkt细胞大量扩增,并使细胞群体中的记忆t杀伤细胞数量得到提升,从而保证了终产品的肿瘤特异性杀伤活性。(三)本方法扩增得到的tpkt细胞可清除表达变异蛋白的肿瘤前体细胞。(四)本方法扩增得到的tpkt细胞可清除影像学不可见微小肿瘤。附图说明图1为实施例2中tpkt细胞增殖情况检测图。图2为实施例5中tpkt细胞毒体外实验椎间盘美国生存时间的结果图。图3为实施例5中tpkt胞毒体外实验中肿瘤大小的结果图。具体实施方式以下通过具体实施例详细说明本发明技术方案的实施和所具有的有益效果,但不能认定为对本发明的可实施范围的任何限定。各实施例中未详细说明的方法和操作条件,按照所述领域的常规技术或是按照仪器制造商建议的操作进行,所用原料均为市售商品。实施例1.tpkt细胞的制备1.外周血淋巴细胞的分离(1)一次抽血量:150ml,肝素抗凝。150ml全血正常情况下可得1.5-2×108个细胞,可种一个75cm2培养瓶;肝素抗凝处理后的外周血分装至离心管中,1800rpm,15min离心,弃上清。(2)稀释血液:rpmi1640培养基等倍稀释血液。(3)25ml上述稀释的血液小心置于12.5ml淋巴细胞分离液上,1800rpm,15min离心,升降速调至最低。(4)取上层部分血浆留用,4℃冰箱保存。(5)取淋巴细胞层,置于50ml离心管中,加入rpmi1640培养基至总体积50ml,1800rpm,5min离心。(6)弃上清,加入一定量rpmi1640培养基,混悬细胞,取少量计数。(7)1800rpm,5min离心。(8)弃上清,获得外周血单个核细胞;加完全培养基混悬细胞。2.试剂及溶液配制培养基制备方法全血于1500g离心20分钟,弃上清,4℃静置过夜,再于1500g离心15分钟,取上清作为培养基中添加的血浆;向rpmi1640培养基中加入血浆,并按100u/ml浓度加入庆大霉素,制成含10v/v%自身血浆的完全培养基。3.细胞培养瓶处理吸出包被液,并每瓶加入30ml生理盐水,轻轻晃动,吸出生理盐水即可。4.tpkt细胞激活通过tpkt细胞激活因子ⅰ的培养将tpkt细胞激活的步骤为:细胞培养瓶处理后,立即加入20ml细胞悬液,加入tpkt细胞激活因子ⅰ0.5ml,于38.5℃,6.5%co2的恒温培养箱中培养72小时。其中tpkt细胞激活因子ⅰ含有il-2(3500iu/ml)、ifn-γ(3000iu/ml)、gm-csf(550iu/ml)、tnf-α(320iu/ml),以生理盐水配置。5.tpkt细胞的扩增(1)接种细胞72h后,将培养物转移至50ml离心管中,部分贴壁细胞无法吹下时,可加入15ml生理盐水,拍动瓶子或用细胞刮使其脱离瓶底,与原细胞悬液合并。1800rpm,5min离心。(2)弃上清,rpmi1640培养基混悬细胞,计数。(3)加入rpmi1640培养基,调整细胞密度0.5×106-1×106个/ml,加入tpkt细胞激活因子ⅱ0.5ml。(4)将细胞悬液加入到新的75cm2细胞培养瓶中(未包被),50ml左右/瓶。(5)将培养瓶于38.5℃,6.5%co2的恒温培养箱中继续培养72小时。其中tpkt细胞激活因子ⅱ含有il-2(5500iu/ml)、ifn-γ(3000iu/ml)、il-12(5800iu/ml),以生理盐水配置。6.tpkt细胞收获及冻存将细胞培养产物1800rpm,5min离心,弃上清,并用含白蛋白的生理盐水或rpmi1640培养基混悬细胞,计数。根据细胞数量,确定冻存数量,同时取样送质量控制检测。其中送检步骤为:通过流式细胞仪检测成品细胞表面白细胞分化抗原,通常用于荧光染色的抗体包含以下几组:(1)cd3-fitc/cd4-pe/cd8-pecy5,鉴定培养细胞终产品合格标准为:cd3+细胞≥90%,cd3+/cd4+细胞≥40%,cd3+/cd8+细胞≥40%;(2)cd3-fitc/cd16-pe/cd56-pecy5,鉴定培养细胞终产品合格标准为:cd3+/cd56+细胞≥10%,cd3-/cd56+及cd3-/cd16+细胞≥5%;(3)lin-fitc/cd83-pe/cd1a-pecy5鉴定培养细胞终产品合格标准为:lin-/cd83+/cd1a+细胞≥1%;(4)foxp3-fitc/cd25-pe/-cd4-pecy5鉴定培养细胞终产品合格标准为:foxp3+/cd25+/-cd4+细胞≤1%;(5)cd3-fitc/cd14-pe/cd19-pecy5鉴定培养细胞终产品合格标准为:cd3-/cd14+细胞≤1%,cd3-/cd19+细胞≤1%。其他质量鉴定及合格标准:细胞培养终产品要求按照《中国生物制品规程》中的《生物制品无菌试验规程》进行实验,细胞终产品应经革兰氏阳性及革兰氏阴性细菌培养结果为阴性;经真菌培养鉴定结果为阴性;经支原体检测结果为阴性;经梅毒检测结果为阴性;经乙肝抗原检测结果为阴性;内毒素检测结果为阴性。经检测,本实施例的成品细胞符合上述质检鉴定合格标准的要求。其中tpkt细胞的冻存步骤为:细胞离心并用4ml冷冻液a重悬,充分混匀,置于冰上,缓慢加入4ml预冷的冷冻液b。充分混匀,分装于6支冷冻管中,细胞保存于液氮或-80℃低温冰箱,24小时后转入液氮保存。注意:①冻存液a、冻存液b,冻存液a为:向浓度为200g/l的人血清白蛋白溶液100ml中加入100mlph7.0的pbs缓冲液;混匀后-20℃保存;所述冻存液b为:ph7.0的pbs缓冲液与二甲基亚砜按照4:1体积比混匀即得。需要提前配置,放入4℃冰箱中预冷,或者配制好后分装放入-20℃冰箱中冻存备用。冻存液在取出时需上下晃动混匀。②冻存管、冻存管架、泡沫盒均需提前放入-20℃冰箱中预冷30min左右。7.tpkt细胞的复苏将需复苏的细胞冷冻管于37℃恒温水浴中解冻,并移入预置10ml细胞复苏液的离心管中,离心,并用10ml生理盐水重悬,再离心,重复以上重悬、离心操作步骤3次。取样,进行台盼蓝染色,并计数。用2ml细胞复苏液重悬,准备回输capri细胞,用于肿瘤患者术后的治疗。其中复苏液的制备方法:95ml无菌生理盐水中加入浓度为200g/l的人血清白蛋白溶液5ml,混匀后用0.22μm滤器过滤,即得。其中tpkt细胞的回输步骤为:将复苏后的tpkt细胞通过皮内注射、静脉注射、肌内注射或在所述肿瘤内部或周围给药,以每次注射50万-3000万细胞的剂量给药。回输前一定获得细菌鉴定及其他质检报告,以防培养过程所致的感染。实施例2.tpkt细胞扩增能力检测采用实施例1的方法培养3例tpkt细胞,并取培养时间为第0、3、5、7、9、12天的tpkt细胞,检测细胞增殖情况,如图1。由图1可知采用本发明方法培养的tpkt细胞增殖情况较好。实施例3.tpkt细胞活力检测采用实施例1的方法培养,并取培养12天的细胞100μl,加入100μl0.4%台盼蓝染色液,活细胞不被染色,死细胞被染成蓝色,每个样品计数500个细胞计算细胞活力。如表1。由表1可知本发明制备的细胞活力大于95%,培养出的tpkt细胞活力较好。表1样品1样品2样品3活细胞百分比96.4%97.6%95.8%实施例4.tpkt细胞流式表型检测采用实施例1的方法培养,分别取培养0、4、7、10天100μl,浓度约106/ml的细胞,分别加入检测用鼠抗人cd3-percp/cd4-fitc/cd8-pe,cd3-percp/cd19-fitc/cd14-pe,cd3-percp/cd16-fitc/cd56-pe,cd4-percp/cd25-fitc/fox-p3-pe抗体组合,每种抗体10μl,室温环境下,避光孵育30min。之后用pbs洗涤两次,进行流式细胞检测,如表2。表2检测内容实施例1实施例2实施例3cd3+/cd19-/cd14-(t细胞)94.7%93.5%92.5%cd3+/cd8+/cd4-(t杀伤细胞)67.7%70.8%62.1%cd3+/cd4+/cd8-(t辅助细胞)28.0%23.5%30.2%cd3+/cd56+或cd16+(nkt细胞)21.4%16.8%20.2%cd3-/cd56+/cd16+(nk细胞)4.7%5.8%6.3%cd4+/cd25+/foxp3+(treg细胞)0.6%0.3%0.8%由表2可知,采用本发明方法培养的tpkt细胞中含有较多cd8+t杀伤细胞,较少cd4+t辅助细胞及起免疫负调节功能的treg细胞。具体地,本发明培养的细胞,cd3+/cd8+/cd4-(t杀伤细胞)在62.1%以上,符合tpkt细胞的性能50.4%±6.9%;cd3+/cd4+/cd8-(t辅助细胞)在30.2%以下,符合tpkt细胞的性能46.6%±4.3%;cd4+/cd25+/foxp3+(treg细胞)在0.8%以下,符合tpkt细胞的性能11.3%±4.1%。实施例5.tpkt细胞毒体外实验结果照实施例1方法用肺患者外周血单个核细胞培养tpkt细胞,分别按含1×106个细胞的0.1ml生理盐水每天尾静脉注射至6-8周龄裸鼠体(每组6只)内,连续给细胞一周。在给予tpkt细胞一周后,将肺患者自体肿瘤细胞1×105个通过皮下注射裸鼠体内,对照组小鼠在接种肿瘤前注射患者自体外周血淋巴细胞1×106个/只。记录小鼠存活时间(共观察21天),以统计学分析结果在21天后处死小鼠并记录瘤体积或小鼠死亡时测量肿瘤体积。图2是以tpkt细胞预防性免疫保护组对照自体外周血淋巴细胞保护组对于裸鼠自体肺癌肿瘤细胞系接种后生存时间的比较。由图2可知中位生存时间tpkt组为19.5天,外周血淋巴细胞组为11.00天,且有统计学意义(x2=5.335,p=0.0209<0.05),即tpkt组的生存时间比外周血淋巴细胞组的长,具有抗肿瘤作用。图3以tpkt细胞预防性免疫保护组对照自体外周血淋巴细胞保护组对于裸鼠自体肺癌肿瘤细胞系接种后肿瘤体积的比较。由图3可知tpkt组肿瘤平均体积为1.867+/-1.111cm3,对照组肿瘤平均体积为3.358+/-0.465cm3,且有统计学意义(t=3.034,p=0.0126<0.05),即tpkt组对肿瘤的杀伤效果比外周血淋巴细胞组的好。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1