表达可溶性PD-1的嵌合抗原受体CAR基因及应用的制作方法
本发明涉及生物医药领域,具体涉及一种表达可溶性pd-1的嵌合抗原受体car基因及应用。
背景技术:
肿瘤是一种严重威胁人类生命的疾病,其治疗方法一直受到医学及生物学界的高度关注。近年来,随着人们对肿瘤免疫微环境认识的不断深入,一种治疗肿瘤的新思路逐渐走入人们的视野,即“肿瘤免疫治疗”,2013年,美国fda称其为“突破性疗法”,足以见其重要性,而嵌合抗原受体t细胞治疗(car-t)是目前最具前景的肿瘤免疫治疗之一。
嵌合抗原受体car一般由一个抗原结合区/胞外区/跨膜区以及一个在结合抗原后能够活化t细胞的胞内信号区组成,car-t细胞较正常的t细胞具更高的潜能,因其是经一种非mhc分子依赖性的、特异性的、单一信号的途径激活。临床前和临床试验的一些深入研究显示car-t疗法在对多种癌症治疗中取得了令人鼓舞的治疗效果,特别是用cd19-car-t治疗b细胞恶性肿瘤。目前,car-t细胞免疫治疗恶性血液病已取得显著的临床反应。然而,用car-t细胞治疗实体瘤受到实体瘤组织结构强大的免疫抑制环境所限制,理想靶标的缺失也是治疗实体瘤的另外一个关键不足。因此寻找更有效的靶点从而推进car-t细胞治疗实体瘤是现阶段的一大重要挑战。
pd-1是程序性死亡受体1,是一种重要的免疫抑制分子,为cd28超家族成员。pd-1属ι型跨膜蛋白,由胞外段、跨膜锚定区以及胞内信号转导区三部分构成,主要诱导表达于活化的t淋巴细胞、b淋巴细胞表面。pd-1的配体是b7-h1(pd-l1)和b7-dc(pd-l2),二者结合后抑制t细胞增殖活化,对t细胞应答起负调节作用,属于抑制性受体。肿瘤细胞表面常表达pd-l1,与t细胞表面的pd-1结合,抑制t细胞增殖活化,实现免疫逃逸。目前市场上已经有pd-1和pd-l1抗体,阻断肿瘤细胞对t细胞的抑制作用。在人体内除了存在跨膜结合蛋白pd-1,也存在可溶性pd-1(spd-1),spd-1保留了模型分子的胞外igv-igc样结构域,能够结合于配体pd-l1和pd-l2。最初有关spd-1的研究多与自身免疫疾病相关,如类风湿关节炎、系统性红斑狼疮、重度肌无力等自身免疫疾病均被证明与spd-1有关,spd-1也被认为是在自身免疫疾病中,由免疫细胞在促炎症刺激因子的作用下产生。同样,spd-1具有与pd-l1结合的能力,起到抑制t细胞活性的功能。
目前,尚无将可溶性pd-1与嵌合抗原受体car共表达提高car-t细胞对肿瘤细胞杀伤力的产品。
技术实现要素:
针对现有技术中存在的缺陷,本发明的目的在于提供一种表达可溶性pd-1的嵌合抗原受体car基因及应用,本发明可使car-t细胞在肿瘤微环境内分泌spd-1,通过spd-1与肿瘤细胞表面pd-l1结合,竞争性抑制与car-t细胞表面跨膜pd-1结合,从而避免car-t细胞被抑制,提高car-t细胞对肿瘤细胞的杀伤治疗效果,达到对肿瘤尤其是实体瘤治疗目的。
为达到以上目的,本发明采取的技术方案是:
本发明首先提供了一种表达可溶性pd-1的嵌合抗原受体car基因,所述car基因包括依次顺序连接的抗原结合结构域(即一段胞外单链抗原可变区片段scfv)基因、跨膜结构域基因、胞内结构域基因和可溶性pd-1基因,所述可溶性pd-1为pd-1的胞外段区域,
优选的,所述可溶性pd-1包括seqidno.1所示的氨基酸序列,
更优选的,所述可溶性pd-1基因的序列如seqidno.2中的第1264-1713位所示。
一种优选的实施方式,在所述胞内结构域基因和所述可溶性pd-1基因之间连接有第一信号肽基因,以使pd-1的胞外段高效地表达并分泌到胞外而不是跨膜表达,
优选的,所述第一信号肽为如下蛋白的信号肽:cd19、cd20、cd30、cd4、cd8a、cd28、cd137或其组合;
更优选的,所述第一信号肽为cd8a的信号肽,其氨基酸序列如seqidno.3所示,更优选的,其基因序列如seqidno.2中的第1201-1263位所示。
一种优选的实施方式,在所述胞内结构域基因和所述第一信号肽基因之间连接有自剪切蛋白基因,优选的,所述自剪切蛋白选自t2a、p2a、e2a、f2a或其组合,更优选的,所述自剪切蛋白为t2a。
所述抗原结合结构域能够与肿瘤细胞表面的某个特定配体特异性结合,在本申请中,所述某个特定配体具体为nkg2d配体,优选的,所述抗原结合结构域为nkg2d受体胞外段,更优选的,所述抗原结合结构域基因的前端包括第二信号肽基因;
优选的,所述第二信号肽为如下蛋白的信号肽:cd19、cd20、cd30、cd4、cd8a、cd28、cd137或其组合;更优选的,所述第二信号肽为cd8a的信号肽,更优选的,其氨基酸序列如seqidno.3所示,更优选的,其基因序列如seqidno.2中的第1-63位所示;
nkg2d受体以一种“混杂”方式与一类与mhci类蛋白具有结构同源性的细胞表面糖蛋白家族结合。它是一种主要在细胞毒性免疫细胞上表达的活化受体,可以诱导直接杀死表达其应激诱导的配体的靶细胞。nkg2d的配体包括六个成员:mica、micb、ulbp1-6。dna损伤、癌基因激活、过度增殖等是癌症发生的重要标志,其细胞表面的nkg2d配体水平显著升高,而正常细胞表面低表达这些配体。因此将nkg2d受体胞外段设计入car结构中,当与配体结合时,便会激活t细胞,产生一系列的抗肿瘤反应。
一种优选的实施方式,所述跨膜结构域包括如下蛋白的跨膜区:cd3ε、cd4、cd8a、cd9、cd16、cd22、cd33、cd137、ctla-4、pd-1、lag-3或其组合,优选,cd8a;
一种优选的实施方式,所述胞内结构域包括共刺激信号分子和胞浆信号传导序列;优选的,所述共刺激信号分子选自如下蛋白的共刺激信号分子:ox40、cd28、cd30、cd40、cd70、cd134、4-1bb(cd137)、pd1、dap10、cds、icam-1或其组合,更优选,4-1bb;优选的,所述胞浆信号传导序列包括源于cd3ζ的胞浆信号传导序列。
一种优选的实施方式,所述表达可溶性pd-1的嵌合抗原受体car基因序列如seqidno.2所示。
另一方面,本发明还提供了一种重组载体,所述重组载体含有以上任一所述的car基因,所述重组载体优选为慢病毒载体,
在一种优选的实施方式中,本发明使用的所述慢病毒载体为pcdh-nkg2d-spd-1-car,该载体为在慢病毒表达载体pcdh的salⅰ和ecorⅰ酶切位点连接seqidno.2所示的car基因。
另一方面,本发明还提供了一种重组细胞或重组菌,所述重组细胞或所述重组菌中含有以上任一所述的car基因,或含有所述重组载体,
所述重组菌为工程菌,所述工程菌具体可为大肠杆菌,
优选的,所述重组细胞为免疫细胞,更优选的,所述重组细胞为car-t细胞。
另一方面,本发明还提供了以上任一所述的car基因、所述重组载体、所述重组细胞或所述重组菌在制备肿瘤治疗产品中的应用,所述产品具体可为试剂、试剂盒或药物。
在上述应用中,所述肿瘤治疗产品为选择性杀伤肿瘤细胞杀伤效果提高的肿瘤治疗产品。
在上述应用中,所述肿瘤为实体瘤,优选,骨肉瘤u2os、骨肉瘤mg-3、或肾癌细胞786o,更优选,骨肉瘤u2os。
另一方面,本发明还提供了一种提高选择性杀伤肿瘤细胞杀伤效果的方法,包括向靶细胞施用以上任一所述car基因、所述重组载体、或所述重组细胞的步骤。
在上述方法中,所述靶细胞为表达pd-l1的肿瘤细胞,优选的,所述靶细胞来源于骨肉瘤u2os、骨肉瘤mg-3、或肾癌细胞786o,更优选的,所述靶细胞来源于骨肉瘤u2os,其可同时高表达pd-l1和nkg2d配体。
在上述方法中,所述施用的效靶比为1:0.5-5,优选,1:1-4,更优选,1:3。
在上述应用和方法中,所述提高为相对于car基因中未连接所述可溶性pd-1基因或car-t细胞不表达或分泌可溶性pd-1的情况。
本发明的有益效果如下:
car-t技术是当今治疗肿瘤细胞的重要方式,然而用car-t细胞治疗实体瘤受到实体瘤组织结构,强大的免疫抑制环境所限制,理想靶标的缺失也是治疗实体瘤的另外一个关键不足。因此寻找更有效的靶点从而推进car-t细胞治疗实体瘤是现阶段的一大重要挑战。本发明创造性的将可溶性pd-1引入car-t细胞,使其具有自我分泌pd-1的功能,起到降低肿瘤细胞对car-t细胞抑制的作用。相比于pd-1抗体,可溶性pd-1具有更强的优势和效果,首先可溶性pd-1可以与肿瘤细胞表面的pd-l1结合来避免t细胞活性被抑制;其次相比pd-1抗体,可溶性pd-1在较低含量也可以保持持久高效的功效,因此可溶性pd-1所带来的副作用也会比pd-1抗体低;最后,由于pd-1抗体需要不断的注入,因此可溶性pd-1的小剂量具有更高的性价比。
本发明在nkg2d-car-t质粒上添加pd-1胞外段序列进而改造car-t细胞,使其具备分泌可溶性pd-1的功能,并能达到降低实体瘤细胞对car-t细胞抑制的目的。与不表达可溶性pd-1的nkg2d-car-t细胞相比,改造后的nkg2d-spd-1-car-t细胞对肿瘤细胞的杀伤效果是原nkg2d-car-t细胞的2倍以上。
附图说明
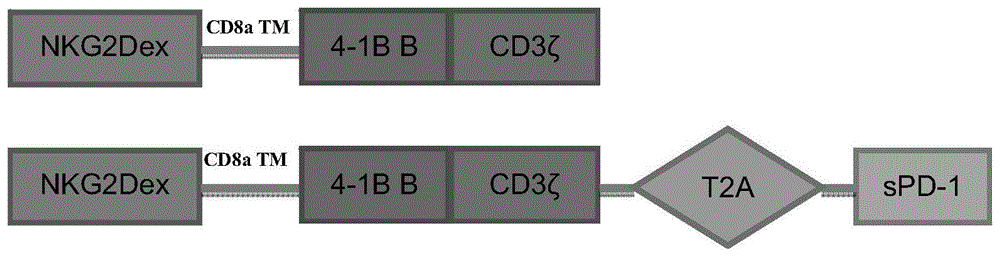
图1为载体pcdh-nkg2d-car(上图)和载体pcdh-nkg2d-spd-1-car(下图)中car元件的结构示意图,其中,nkg2dex为前端含有信号肽(该信号肽序列在现有的αcd19-car中效果显著)序列的表达nkg2d受体胞外段的元件,cd8atm为表达蛋白cd8a的跨膜区的元件,4-1bb为表达蛋白4-1bb的共刺激信号分子的元件,cd3ζ为表达cd3ζ胞浆信号传导序列的元件,t2a为来自一点褐翅蛾病毒(tav)的2a元件(自剪切蛋白,以t2a连接的基因在转入细胞后能正常翻译和共表达),spd-1为表达可溶性pd-1蛋白的元件。
图2为菌落pcr扩增spd-1的电泳结果。其中,样品1、3、5、6、8为阳性,其余为阴性。
图3为载体pcdh-nkg2d-spd-1-car的结构示意图。
图4为apc-hnkg2d抗体染色后流式检测car-t细胞阳性率结果。
图5为nkg2d-spd-1-car-t细胞的rt-pcr鉴定结果,其中,1为未感染病毒的t细胞结果,2为nkg2d-spd-1-car-t细胞结果,3为分子量标准。
图6为nkg2d-spd-1-car-t细胞的elisa鉴定结果。
图7为肿瘤细胞表面pd-l1筛选结果图。
图8为nkg2d-car-t和nkg2d-spd-1-car-t细胞杀伤肿瘤细胞结果图。
图9为nkg2d-car-t和nkg2d-spd-1-car-t细胞杀伤肿瘤细胞结果柱形图,其中,1:3组和1:1组中每组中的三个柱形图从左至右依次代表t细胞、nkg2d-car-t细胞和nkg2d-spd-1car-t细胞。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、人的pd-1基因胞外段序列的获取
通过网站https://www.ncbi.nlm.nih.gov/pubmed/查到pd-1基因胞外段序列的cds区,并且在https://www.uniprot.org/网站找到pd-1蛋白的胞外段区域。用snapgene软件设计并在公司合成引物(引物中包含cd8a的信号肽序列),以人的t细胞cdna为模板,通过pcr的方式扩增pd-1基因的胞外段,将扩增产物进行测序得到含有seqidno.2中第1201-1263位所示的cd8a的信号肽基因序列连接seqidno.2中第1264-1713位所示的pd-1胞外段基因序列,其氨基酸序列分别如seqidno.3和seqidno.1所示。
实施例2、pcdh-nkg2d-spd-1-car载体的构建
利用快切酶bamhi和salⅰ双酶切已经构建好的载体pcdh-nkg2d-car(为在载体pcdh的ecorⅰ和bamhi酶切位点间连接图1中上图所示的car元件),利用连接酶将该双酶切后的载体pcdh-nkg2d-car与实施例1的pcr扩增产物(含spd-1序列)和t2a基因片段(seqidno.2的第1141-1200位所示序列)连接,获得重组载体,将重组载体转化大肠杆菌,经菌落pcr以及测序鉴定后确定获得pcdh-nkg2d-spd-1-car载体(含有图1中下图所示的car元件)。
上述重组载体pcdh-nkg2d-spd-1-car是在慢病毒表达载体pcdh的salⅰ和ecorⅰ酶切位点间连接图1中下图所示的car元件编码基因(即seqidno.2所示car基因),
seqidno.2所示car基因中,第1-63位为cd8a信号肽基因序列,第64-471位为nkg2d受体胞外区基因序列,第472-1140位为蛋白cd8a的跨膜区基因、蛋白4-1bb的共刺激信号分子基因和cd3ζ胞浆信号传导序列基因,第1141-1200位为t2a基因序列,第1201-1263位为cd8a信号肽基因序列,第1264-1713位为可溶性pd-1(pd-1的胞外段区域)基因序列。
所述菌落pcr为挑取阳性单克隆菌落后用pcr扩增seqidno.2中第1201-1713位所示序列,以检验转化入大肠杆菌的质粒是否已成功连接有spd-1-car2,琼脂糖电泳跑胶得条带大小符合预期(图2),约500bp。对有条带的单克隆菌落提取质粒并进行测序鉴定,最终确认得到目的重组载体pcdh-nkg2d-spd-1-car(图3)。图3中的g2d-car2-t2a-sipd1即为图1中下图所示的car元件。
实施例3、病毒包装
1、质粒转染
通过三质粒转染系统将重组载体(实施例2的载体pcdh-nkg2d-spd-1-car或载体pcdh-nkg2d-car)作为目的载体送入293t细胞内,按照辅助质粒pspax2:辅助质粒pmd2.g:目的载体=5:3:3的质量比添加进入opti-mem培养基,加入50ulpei溶液,反复吹打20次吹打混匀后,室温静置20min,获得dna/pei混合物。取将1mldna/pei混合物慢慢滴入前一天铺好的293t培养皿中,轻轻混匀,37℃培养箱孵育,6-8h后更换新鲜培养基,放入37℃培养箱继续孵育。
2、病毒收集和浓缩
质粒转染48h后,收集上清后,添加10ml新鲜opti-mem培养基继续培养至72h,再次收集上清,与48h收集的上清混合后,置于4℃冰箱内待用;4℃,4000g离心10min,除去细胞碎片;以0.45μm滤器过滤得到的上清;将过滤后的病毒上清转入超速离心管中,25000转离心2h,用1/100上清体积的pbs进行稀释,反复吹打后转入密闭的离心管中4℃过夜,获得病毒液;将病毒液分装至合适的体积,置于-80℃中保存,并取200μl病毒液进行滴度测定。
3、病毒滴度测定
消化293t细胞,离心后计数,用含血清培养基制成细胞悬液,调整细胞密度为2×105/ml,向24孔培养板的每孔中加入0.5ml细胞悬液;用全培养基按以下比例稀释步骤2得到的病毒液:1:3、1:9、1:27,分别将100μl病毒液原液及按不同比例稀释后的病毒液稀释液,加入到已接种细胞的24孔板中;16h后弃去感染上清,添加0.5ml新鲜全培养基;48h后用nkg2d抗体染色后流式检测被感染细胞的目的基因表达。计算滴度,滴度=2×105×感染效率×稀释倍数。
结果:经步骤2收集和浓缩,转染载体pcdh-nkg2d-spd-1-car得到的病毒液(慢病毒nkg2d-spd-1-car)的滴度为t=1.89×109tu/ml,转染载体pcdh-nkg2d-car得到的病毒液(慢病毒nkg2d-car)的滴度为t=1.87×109tu/ml。
实施例4、car-t细胞制备和检测
1、car-t细胞制备
将实施例3制备的两种慢病毒nkg2d-car和nkg2d-spd-1-car分别按照moi(效靶比)=5:1的比例加入到含有人源t细胞的培养基(感染时细胞密度为1×106个/ml)中,16h后离心换液,加入新鲜的完全培养基继续培养,得到两种car-t细胞,分别命名为nkg2d-car-t和nkg2d-spd-1-car-t。
2、流式细胞检测
两种car-t细胞分别培养两天后,收集细胞,提取rna,通过rt-pcr检测spd-1的表达。用apc-hnkg2d抗体染色后流式检测car-t细胞阳性率。结果:如图4所示,两种car-t细胞的阳性率分别为80.3%和86.3%,未感染病毒的t细胞(阴性对照ut-t)结果为1.22%。
3、spd-1分泌鉴定
计数步骤1得到的nkg2d-spd-1-car-t细胞和未感染病毒的t细胞,按照1×106个/ml密度铺96孔板。培养24h后,取细胞抽提rna,利用反转录试剂盒将rna反转录成cdna,以cdna为模板进行pcr扩增,对比三种细胞内spd-1基因的mrna表达含量。结果如图5所示,nkg2d-spd-1-car-t细胞高表达spd-1的mrna。
将nkg2d-car-t和nkg2d-spd-1-car-t两种car-t细胞和未感染病毒的t细胞按照效靶比1:3接种至人骨肉瘤细胞株u2os中,同时设置不添加肿瘤细胞的仅含有nkg2d-spd-1-car-t的阴性对照,在37℃培养箱内共培养24h后,取上清培养液,用elisa试剂盒检验spd-1的表达水平。结果:如图6a所示,相比于nkg2d-car-t和未感染病毒的t细胞,nkg2d-spd-1-car-t细胞高表达spd-1,且nkg2d-spd-1-car-t组中spd-1的表达为94.19μg/ml;如图6b所示,添加人骨肉瘤细胞株u2os可以明显提高spd-1的分泌。
实施例5、car-t靶细胞的选择及两种car-t细胞的杀伤功能研究
通过查阅文献,利用抗体筛选高表达nkg2d配体以及pd-l1的肿瘤细胞,其中,pd-l1的表达量检测方法为对肿瘤细胞进行pd-l1抗体染色,室温染色15min后,通过流式细胞术检测阳性率,结果如图7所示,根据pd-l1的表达量最终确定car-t靶细胞株为人骨肉瘤细胞株u2os。
用荧光染料cfse标记靶细胞人骨肉瘤细胞株u2os,将nkg2d-car-t和nkg2d-spd-1-car-t两种car-t细胞和未感染病毒的t细胞分别按照效靶比1:3、1:1接种至靶细胞u2os中,每组设两个重复,每孔补液至200ul;将细胞混合后的培养板放至37℃培养箱中培养24h;24h后,收集每孔中所有细胞,将细胞转移至流式管中,在常温下用凋亡抗体annexinⅴ染色15min,通过流式细胞仪检测靶细胞的细胞凋亡比例变化。
结果:如图8和图9所示,随着效靶比的提高,nkg2d-spd-1-car-t相比未感染病毒的t细胞和nkg2d-car-t对靶细胞u2os有较好的杀伤效果。
当效靶比为1:3时,nkg2d-car-t治疗的靶细胞的细胞凋亡比例为22.3%,nkg2d-spd-1-car-t治疗的靶细胞的细胞凋亡比例为52.5%。
综上,本申请通过rt-pcr可以发现,nkg2d-spd-1-car-t细胞中pd-1的mrna相比于t细胞高表达,并且通过elisa直接检测出spd-1表达含量增高,即可以认为已构建出目的质粒。利用构建出的car-t细胞与高表达nkg2d配体和pd-l1配体的骨肉瘤细胞共培养,杀伤24h后可以观察到nkg2d-spd-1-car-t随着效靶比的增高有着更好的杀伤效果,符合实验预期;相比于nkg2d-car-t的杀伤效果,nkg2d-spd-1-car-t明显提高。同时值得注意的是,在肿瘤细胞的刺激作用下,nkg2d-spd-car-t细胞分泌spd-1明显增高,这说明该细胞需在肿瘤微环境中再进一步刺激发挥功效,相比于全身注射pd-1抗体,其毒副作用更低,拥有更加安全高效的优势。
本说明书中未作详细描述的内容属于本领域专业技术人员公知的现有技术。以上所述仅为本申请的实施例而已,并不用于限制本申请。对于本领域技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本申请的权利要求范围之内。
sequencelisting
<110>华东师范大学上海邦耀生物科技有限公司
<120>表达可溶性pd-1的嵌合抗原受体car基因及应用
<130>jh-cnp190581
<160>3
<170>patentinversion3.5
<210>1
<211>150
<212>prt
<213>homosapiens
<400>1
glytrppheleuaspserproaspargprotrpasnproprothrphe
151015
serproalaleuleuvalvalthrgluglyaspasnalathrphethr
202530
cysserpheserasnthrsergluserphevalleuasntrptyrarg
354045
metserproserasnglnthrasplysleualaalapheprogluasp
505560
argserglnproglyglnaspcysargpheargvalthrglnleupro
65707580
asnglyargaspphehismetservalvalargalaargargasnasp
859095
serglythrtyrleucysglyalaileserleualaprolysalagln
100105110
ilelysgluserleuargalagluleuargvalthrgluargargala
115120125
gluvalprothralahisproserproserproargseralaglygln
130135140
pheglnthrleuvalval
145150
<210>2
<211>1716
<212>dna
<213>人工序列
<400>2
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccagg60
ccgatgttattcaaccaagaagttcaaattcccttgaccgaaagttactgtggcccatgt120
cctaaaaactggatatgttacaaaaataactgctaccaattttttgatgagagtaaaaac180
tggtatgagagccaggcttcttgtatgtctcaaaatgccagccttctgaaagtatacagc240
aaagaggaccaggatttacttaaactggtgaagtcatatcattggatgggactagtacac300
attccaacaaatggatcttggcagtgggaagatggctccattctctcacccaacctacta360
acaataattgaaatgcagaagggagactgtgcactctatgcctcgagctttaaaggctat420
atagaaaactgttcaactccaaatacatacatctgcatgcaaaggactgtgaccacgacg480
ccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcacagcccctgtccctgcgc540
ccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcc600
tgtgatatctacatctgggcgcccttggccgggacttgtggggtccttctcctgtcactg660
gttatcaccctttactgcaaacggggcagaaagaaactcctgtatatattcaaacaacca720
tttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaa780
gaagaagaaggaggatgtgaactgagagtgaagttcagcaggagcgcagacgcccccgcg840
tacaagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtac900
gatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaag960
aaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagt1020
gagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggt1080
ctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgc1140
ggatccgagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccct1200
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccagg1260
ccgggatggttcttagactccccagacaggccctggaacccccccaccttctccccagcc1320
ctgctcgtggtgaccgaaggggacaacgccaccttcacctgcagcttctccaacacatcg1380
gagagcttcgtgctaaactggtaccgcatgagccccagcaaccagacggacaagctggcc1440
gccttccccgaggaccgcagccagcccggccaggactgccgcttccgtgtcacacaactg1500
cccaacgggcgtgacttccacatgagcgtggtcagggcccggcgcaatgacagcggcacc1560
tacctctgtggggccatctccctggcccccaaggcgcagatcaaagagagcctgcgggca1620
gagctcagggtgacagagagaagggcagaagtgcccacagcccaccccagcccctcaccc1680
aggtcagccggccagttccaaaccctggtggtttaa1716
<210>3
<211>21
<212>prt
<213>人工序列
<400>3
metalaleuprovalthralaleuleuleuproleualaleuleuleu
151015
hisalaalaargpro
20
- 还没有人留言评论。精彩留言会获得点赞!
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 一种全人源化EGFRvIII嵌合抗原受体T细胞及其制备方法与制造工艺
- 嵌合抗原受体及制备方法与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- CD20特异性嵌合抗原受体及其应用的制造方法与工艺
- 一种用于辣根过氧化物酶染色的染色剂及其制备方法、染色组合、应用及标记酶染色试剂盒与制造工艺
- 对SSEA4抗原具有特异性的嵌合抗原受体的制造方法与工艺
- 具有针对CD79和CD22的特异性的分子的制造方法与工艺
- 具有针对CD45和CD79的特异性的分子的制造方法与工艺
- 一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法与制造工艺