一种3-羟基黄酮类化合物及其应用的制作方法
本发明属于生物荧光分析技术领域,特别涉及一种3-羟基黄酮类化合物及其应用。
背景技术:
脂滴是由磷脂单层膜与内部包裹的中性酯核心(如甾醇酯或甘油酯)构成,其尺寸通常为1~100μm,其分布范围极广,从细菌到人类的几乎所有生物体内均有存在。脂滴作为细胞中独立的动态细胞器,能够沿着细胞骨架运动,同时,这种动态性也会影响其所发挥的功能。脂滴参与了脂类代谢与储存、生物膜构建、蛋白质代谢以及使细胞免受脂毒性的伤害等生命调节过程。
研究表明,如肥胖、高血糖、脂肪肝、动脉粥样化等代谢疾病,甚至是癌症都与脂质的储存异常有关,因此,发展脂滴的检测手段来判断脂滴是否异常十分关键。目前主要有四种脂滴检测方法,分别是脂滴膜蛋白的免疫组织法、脂肪酸链的拉曼散射法、核磁法和荧光成像法;前三种方法均存在一定的缺陷,如操作复杂、不能实现对脂滴的原位可视化等。荧光成像法与前三种传统的脂滴检测方法相比,具有操作简单、效率高、灵敏度高、检出限低及可以实现脂滴的可视化等优势,因此受到的关注越来越多。
针对荧光成像法,虽然已有多种可用于脂滴检测的荧光染料,如尼罗红、bodipy493/503、aiegens和两亲性的荧光染料,但这些荧光染料均存在一定的缺陷,这些缺陷均会影响脂滴检测效果,如尼罗红容易对细胞骨架造成着色;bodipy的stokes位移较小,信噪比偏低;aiegens在使用时普遍需要较大的浓度或较长的孵育时间;两亲性的荧光染料,由于结构中固有的正电荷,在对脂滴着色的同时,还会对线粒体造成着色。
基于上述研究背景和对本领域的技术知识,我们认为,一个较为理想的脂滴荧光染料应具备如下特点:1、stokes位移大;2、溶剂敏感性强;3、脂滴荧光染料在水中几乎无荧光;4、具有良好的油水分离效率。显然,现有技术中并没有任何一种脂滴荧光染料能够满足要求,因此,开发出一种新型的脂滴荧光染料用于脂滴检测,应用于细胞中的脂滴成像(如动态脂滴的成像、脂滴的成长成像和脂滴的3d成像)及组织中脂肪的成像,对于探究细胞中脂滴的功能及对因脂质含量异常所造成疾病的早期诊断是十分必要的;此外,未见3-羟基黄酮类化合物应用于脂滴成像技术领域的相关报道。
技术实现要素:
本发明为了解决上述问题,提供一种3-羟基黄酮类化合物及其应用,该3-羟基黄酮类化合物作为荧光染料用于脂滴检测时,同时具有如下特点:1、stokes位移大;2、溶剂敏感性强;3、脂滴荧光染料在水中几乎无荧光;4、具有良好的油水分离效率。
本发明采用以下技术方案来实现:
一种3-羟基黄酮类化合物,结构如通式ⅰ所示:
其中,n表示1、2或3;r为氢或共轭环状结构.
优选的,所述共轭环状结构为苯环或萘环。
一种如上述3-羟基黄酮类化合物作为荧光染料的应用。
优选的,所述作为荧光染料的应用是在脂滴检测中的应用。
优选的,所述3-羟基黄酮类化合物在应用时使用的溶剂包括油酸乙酯、辛酸乙酯和乙酸乙酯中的至少一种。
优选的,所述3-羟基黄酮类化合物作为荧光染料应用于活细胞中动态脂滴的成像方面。
优选的,所述3-羟基黄酮类化合物作为荧光染料应用于脂滴的成长成像和脂滴的3d成像方面。
优选的,所述3-羟基黄酮类化合物作为荧光染料应用于哺乳动物组织中脂肪的成像方面。
进一步优选的,所述哺乳动物为老鼠。
进一步优选的,所述哺乳动物组织包括白色脂肪组织、棕色脂肪组织、脂肪肝组织和骨骼肌组织。
本发明的有益效果是:
1、本发明的3-羟基黄酮类化合物,基于激发态电子内质子转移(esipt)效应作为荧光染料使用,其本身存在n*峰及t*峰,在不同极性的溶剂中表现出不同的荧光强度,当其溶解于水中时,其t*峰几乎没有荧光,当溶解于酯性溶剂中时,其t*峰的荧光很强,且会随着酯性溶剂极性的减小,荧光强度逐渐增强;同时具有良好的油水分离效率,在油水共存的复杂环境中,该化合物只分布于酯性溶剂中,在水中几乎不存在;
2、本发明的3-羟基黄酮类化合物作为荧光染料应用于脂滴检测时,stokes位移大于150nm,大大提升了荧光染料的信噪比,背景干扰低、检测灵敏度高;
3、本发明的3-羟基黄酮类化合物作为荧光染料应用于脂滴检测时,对脂滴具有超强的脂滴靶向特异性,使用低剂量浓度的3-羟基黄酮类化合物就可以实现胞内脂滴的快速成像,对脂滴的着色效率高;此外,还表现出低细胞毒性的特点;
4、本发明的3-羟基黄酮类化合物作为荧光染料应用于脂滴检测时,可以实现胞内脂滴的动态成像,直观地说明了脂滴的动态性。
附图说明
为了更清楚地说明发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
本说明书中,用flps表示指代3-羟基黄酮类化合物,相应的,实施例中的flp-1、flp-2、flp-3、flp-4均为属于该3-羟基黄酮类化合物某一特定分子结构的代称。
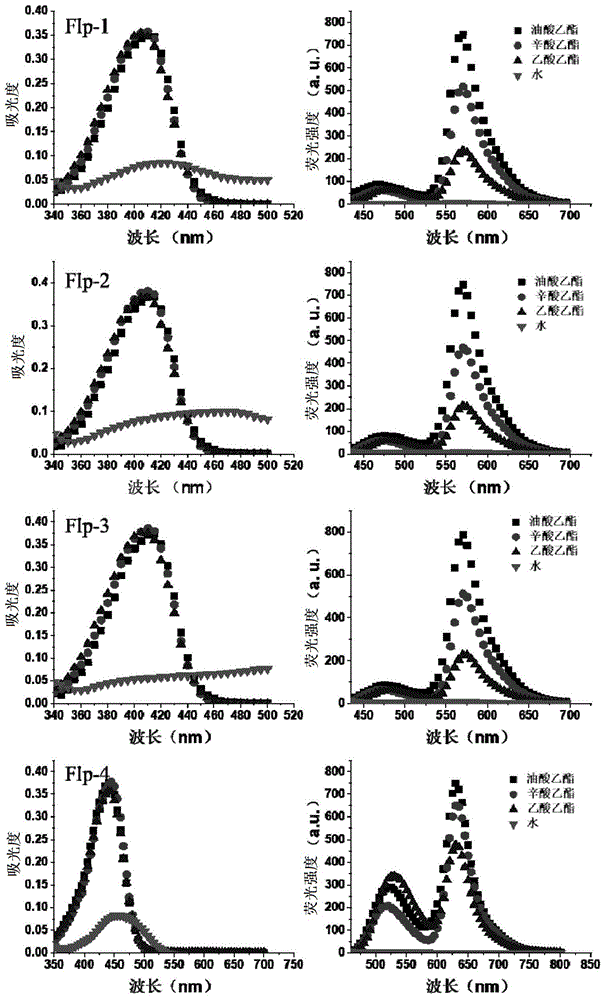
图1是5μm的flps在不同极性溶剂中的光学性质测定结果;
图2是不同浓度的flps加入到已孵育好的hepg2细胞中,采用mtt法测定hepg2细胞存活率的测定结果;
图3a是flps与亮场中脂滴的共定位成像得到的荧光照片;
图3b是flps与bodipy493/503的共定位成像得到的荧光照片;
图3c是flps着色脂滴与线粒体和内质网的共定位成像得到的荧光照片;
图4a是flp-2不同孵育时间对hepg2细胞激光共聚焦成像得到的荧光照片;
图4b是不同浓度的flp-2进行对hepg2细胞激光共聚焦成像得到的荧光照片;
图5a是flps在体外动态脂滴的成像得到的荧光照片;
图5b是flps在活细胞中动态脂滴的成像得到的荧光照片;
图6a是flps在不同浓度的油酸中的成像得到的荧光照片;
图6b是flps在不同孵育时间的油酸中成像得到的荧光照片;
图7是flps在脂滴中的3d成像得到的荧光照片;
图8是flps在前脂肪细胞和脂肪细胞中脂滴成像得到的荧光照片;
图9是flps在四种老鼠组织中脂肪的成像得到的荧光照片。
具体实施方式
下面结合实施例对本发明做进一步详细的描述,但不应理解为对本发明的限制,在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所做的修改或替换均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
本说明书中,用flps表示指代3-羟基黄酮类化合物,相应的,实施例中的flp-1、flp-2、flp-3、flp-4均为属于该3-羟基黄酮类化合物某一特定分子结构的代称。
实施例13-羟基黄酮类化合物(flps)及其合成路线
一种3-羟基黄酮类化合物,其结构如通式ⅰ所示:
其中,n表示1、2或3;r为氢或共轭环状结构。
(1)当r为氢时,合成路线如下:
包括:步骤a1、前驱体a合成;步骤b1、化合物flps合成;当n=1时,flps的合成只包含步骤b1,当n=2或3时,flps的合成还包括步骤a1,下面分别对步骤a1和步骤b1进行详细说明。
步骤a1、前驱体a合成:
s1,flp-(2,3)a的合成:取一个100ml茄形瓶,在其中加入1当量(3g)的苯胺,3当量的k2co3,用25ml的dmf溶解得到溶液,在搅拌条件下,将2.5当量的1-溴代正烷烃缓慢加入到溶液中混合均匀后,在120℃条件下加热7h,反应结束并冷却至室温后,将溶液旋干,并将剩余残渣用ch2cl2溶解,用纯净水萃取三次后,有机相用无水mgso4干燥、过滤、浓缩得到粗产物,采用柱层析分离的方法对粗产物进行纯化得到flp-(2,3)a系列化合物;
所述flp-(2,3)a系列化合物为无色或黄色油状液体,采用上述合成方式的产率为82%-96%,分析(2,3)a系列化合物:
s2,flp-(2,3)b的合成,取一个100ml茄形瓶,向1当量(2g)的flp-(2,3)a中加入20mldmf,将反应体系冷却至-4℃,在搅拌的条件下将pocl3逐滴滴入混合物中,在保持-4℃的温度条件下搅拌反应10min后,将反应体系温度升至100℃,直到溶液变为棕色,通过点板确定反应终点;反应结束后,将混合物冷却至室温,加入适量碎冰猝灭反应,将溶液旋干,剩余残渣用ch2cl2溶解,用纯净水萃取三次后,有机相先用饱和nahco3溶液萃取两次后,再用饱和nacl溶液萃取两次,有机相用无水mgso4干燥、抽滤、浓缩得到粗产物,采用柱层析分离的方法对粗产物进行纯化得到flp-(2,3)b系列化合物;
所述flp-b系列化合物为无色或黄色油状液体,采用上述合成方式的产率为71%-85%,分析flp-(2,3)b系列化合物:
步骤b1、flps化合物合成:
取一个100ml茄形瓶,在其中加入1.1当量(500mg)的邻羟基苯乙酮,1当量的对二乙氨基苯甲醛,用25ml甲醇溶解得到溶液,在搅拌的条件下,将10当量的naoh缓慢加入到溶液中混合均匀后,在72℃条件下回流12h,反应结束并冷却至室温后,将10当量的naoh配成0.5mol/l的水溶液,并在搅拌条件下缓慢加入上述混合物中混合均匀后,继续加入5当量的h2o2,在室温条件下(25℃)连续搅拌5h,反应结束后,加入100g冰水混合物猝灭反应,用6mol/l盐酸将反应体系的ph调节至中性,此时有大量固体析出,将固体抽滤,并用0℃的纯净水连续洗两次后,固体用油泵抽干,得到flp-1的纯产物,柱层析分离,得到flp-2和flp-3的纯产物;
在步骤b1中,所述前驱体a为对二乙氨基苯甲醛
(2)当r为共轭环状结构时,合成路线包括:步骤a2、前驱体合成;步骤b2、化合物flps合成;所述r基可以为苯环、萘环、类苯环结构或其他共轭环状结构,以所述r基为苯环为例,合成路线如下:
步骤a2,前驱体b合成:
首先,将5g(0.13mol)nah溶解于50ml的dmso中,在搅拌条件下,将溶液于80℃加热两个小时,反应结束后,将溶液冷却至室温,将10g(0.05mol)的邻羟基萘乙酮缓慢加入到反应液中,在剧烈搅拌条件下反应1h后,将反应液倒入2000ml的乙醚中,生成大量沉积物,将上层乙醚层倾倒掉,下层残渣用100ml水溶解,向其中加入50ml的冰醋酸酸化,生成大量黄色固体,抽滤。黄色固体继续进行下步反应,将之溶解于200ml的冰醋酸,在搅拌的条件下,将5g(0.08mol)锌粉缓慢加入到上述溶液中,之后在室温条件下搅拌12h,反应结束后,将溶液过滤,并用乙酸乙酯洗涤三次,滤液被浓缩得到flp-4c,所述flp-4c为亮黄色固体,产率为72%;
步骤b2,参考步骤b1的方式合成,将步骤b1中的邻羟基苯乙酮替换为flp-4c,将前驱体a与前驱体b进行合成即可,所述前驱体a为对二乙氨基苯甲醛
当所述前驱体a为对二乙氨基苯甲醛
实施例23-羟基黄酮类化合物(flps)的光学性质
(1)配制10mm及1mm储液:
s1,称取少量的化合物flp-1、flp-2、flp-3、flp-4,通过计算得到配制10mm储液所需要的dmso的体积,用移液枪移取相应体积的dmso分别与化合物flp-1、flp-2、flp-3、flp-4混匀后,得到10mm储液,在本过程中,若配制的10mm储液中有少量不溶解的现象,可采用超声仪使之溶解;
s2,取100μl的10mm储液,加入900μl的dmso混匀后,得到1mm储液;
(2)配置10μm待测液:
用移液枪移取10μl步骤s2配置好的1mm储液,加入990μl的溶剂混合均匀得到待测液1~4,所述待测液1~4对应的溶剂分别为水、乙酸乙酯、辛酸乙酯和油酸乙酯。
对待测液1~4的紫外吸收光谱、荧光发射光谱分别进行测定,测定结果如图1所示;
结果表明:
1、3-羟基黄酮类化合物具有大于150nm的stokes位移,背景干扰低、检测灵敏度高;
2、3-羟基黄酮类化合物对不同极性的溶剂表现出很强的溶剂敏感性;在水中均没有荧光发出,而在酯类溶剂中,随着酯类溶剂极性的减小,3-羟基黄酮类化合物的荧光强度逐渐增大;
3、在flp-1的基础上引入共轭结构苯环合成得到flp-4,flp-4的发射波长相较于flp-2表现出近60nm的红移,实现了荧光由黄到红的跨越,说明了3-羟基黄酮类化合物荧光染料可在flp-1、flp2、flp-3的基础上,引入其它如苯环等共轭结构,生成具有更大波长的3-羟基黄酮类化合物荧光染料。
实施例33-羟基黄酮类化合物(flps)的细胞毒性
将不同浓度(0、1、5、10、20μm)的flp-1、flp-2、flp-3、flp-4和商用脂滴荧光染料bodipy493/503分别加入到已孵育好的hepg2细胞中,孵育24h后应用mtt法检测hepg2细胞的增殖情况,成像结果如图2所示,测试结果表明:与荧光染料bodipy493/503相比,3-羟基黄酮类化合物在各个浓度梯度条件下,hepg2细胞均表现较好的增殖效果,反映出3-羟基黄酮类化合物具有较低的细胞毒性。
实施例43-羟基黄酮类化合物(flps)的脂滴靶向特异性
(1)3-羟基黄酮类化合物与亮场中脂滴的共定位成像;
分别使用2μm的flp-1、flp-2、flp-3和flp-4孵育hepg2细胞5min,将之直接用于激光共聚焦成像,成像结果如图3a所示;
结果表明,脂滴展现出明亮的荧光,此时几乎没有背景荧光,且荧光光点与亮场中的脂滴位置几乎完全重叠,证明了3-羟基黄酮类化合物具有脂滴靶向性;
(2)3-羟基黄酮类化合物与商用脂滴荧光染料bodipy493/503的共定位成像;
分别使用2μm的flp-1、flp-2、flp-3和flp-4与5μmbodipy493/503共同孵育hepg2细胞10min,用pbs润洗三遍后,使用5μg/ml的dapi孵育细胞10min,润洗三遍后,制成切片,进行激光共聚焦成像,成像结果如图3b所示,图3b是用photoshop软件将背景的黑色转化为白色后的效果图;
结果表明,3-羟基黄酮类化合物与bodipy493/503的荧光几乎共定位于一处,同样证明了3-羟基黄酮类化合物具有脂滴靶向性;
(3)3-羟基黄酮类化合物着色脂滴与线粒体和内质网的共定位成像;
由于esipt效应,在进行脂滴成像时,可能存在一个瞬态两亲性的状态,此时,线粒体的存在可能会对脂滴成像造成影响;此外,现在学界普遍认为脂滴是在内质网上生成的,因此,现有的脂滴荧光染料,如尼罗红等荧光染料一般都会对内质网造成着色;
将质粒载体与20μmdsred-mito(线粒体靶向荧光蛋白质粒)/eregfp(内质网靶向荧光蛋白质粒)加入到无血清的dmem中,后向混合液中加入50μmlipo8000并混合均匀,用于细胞转染实验,将hepg2细胞培养到密度合适后,根据转染手册对细胞进行转染。转染结束后,移除残余培养基,用无血清培养基稍清洗一遍细胞,清洗结束后,向其中加入1ml无血清培养基,并在其中加入含有200μm油酸的油酸培养基,于培养箱中培养24h。移除油酸培养基,用pbs清洗三遍,向其中加入固定液孵育15min对hepg2细胞进行固定。移除固定液,用pbs清洗三遍,用含有5μg/mldapi的pbs孵育10min进行hepg2细胞核染色,pbs润洗后,用含有2μmflp-2的pbs孵育细胞5min对hepg2细胞中脂滴进行着色,之后将之制成切片,进行激光共聚焦成像,成像结果如图3c所示,图3c是用photoshop软件将背景的黑色转化为白色后的效果图;
结果表明,flp-2几乎不会对线粒体和内质网造成着色,再次证明了3-羟基黄酮类化合物具有很强的脂滴靶向特异性;
所述油酸培养基采用如下方法配置而成:首先配制一定浓度的油酸与pbs的混合液及20%的无脂肪酸的bsa溶液(两者在配置时可用70℃水浴加热30min),两种溶液配好后,将其等体积混合均匀,将之与培养基以1:49的比例混合均匀生成相应浓度的油酸培养基。
实施例53-羟基黄酮类化合物(flps)的着色效率
(1)3-羟基黄酮类化合物孵育时间对脂滴成像的影响;
使用2μm的flp-2与5μmbodipy493/503对hepg2细胞着色不同的时间(0.5,1,2,3,5,10min),空白pbs润洗三遍后,对细胞进行激光共聚焦成像,成像结果如图4a所示;
结果表明,3-羟基黄酮类化合物在浓度为2μm、孵育时间低至30s时,就可以实现对细胞中脂滴的成像,且直到孵育时间为10min时还具有极佳的着色效果,3-羟基黄酮类化合物具有着色速度快的特点;而bodipy在浓度为5μm、孵育时间为2min时仍不能在多色成像中实现对胞内脂滴的成像,直到孵育时间为5min时,其成像效果才比较好;
(2)3-羟基黄酮类化合物孵育浓度对脂滴成像的影响;
分别使用不同浓度的flp-2(0.3,0.5,1,2,3,4,5,10μm)对hepg2细胞孵育2min,空白pbs润洗三遍后,对细胞进行激光共聚焦成像,成像结果如图4b所示;
结果表明,3-羟基黄酮类化合物在孵育时间为2min、浓度低至500nm时就可以实现对脂滴的成像。
综上所述,低剂量浓度的3-羟基黄酮类化合物就可以实现胞内脂滴的快速成像,对脂滴的着色效率高。
实施例73-羟基黄酮类化合物(flps)在动态脂滴中的成像方面的应用
(1)3-羟基黄酮类化合物在体外动态脂滴的成像;
将脂滴从活hepg2细胞中提取出来,在体外分别使用2μmflp-1、flp-2、flp-3和flp-4对其着色后,进行长时间的视频拍摄,成像结果如图5a所示,图5a是用photoshop软件将背景的黑色转化为白色后的效果图;
结果表明,脂滴以布朗运动的形式在不断移动。
(2)3-羟基黄酮类化合物在活hepg2细胞中动态脂滴的成像;
对合适密度的hepg2细胞使用2μm的flp-2孵育2min,将之用于激光共聚焦成像,对同一视野下细胞中的脂滴进行不同时间点(30,60,90,120,150s)的拍摄,拍摄结果如图5b所示;
结果表明,不同时间点的荧光叠加图中,亮点并未完全重叠,说明脂滴在30s的时间内发生了位移。
综上所述,3-羟基黄酮类化合物可以被用于细胞中脂滴的动态性研究,例如被用于动态脂滴的成像方面进行脂滴的动态性研究。
实施例83-羟基黄酮类化合物(flps)在脂滴中的生长成像方面的应用
为了模拟人体长胖的过程,使用hepg2细胞作为模型,研究flps在脂滴中的生长成像方面的应用效果。
(1)3-羟基黄酮类化合物在不同浓度的油酸中的成像效果;
将不同浓度的油酸(0,100,400,1000μm)孵育细胞6h,孵育结束后,移除油酸培养基,用pbs清洗三遍,向其中加入固定液孵育15min对细胞进行固定。移除固定液,用pbs清洗三遍,用含有5μg/mldapi的pbs孵育10min进行细胞核染色,清洗后,用含有2μmflp-2的pbs孵育细胞2min对细胞中脂滴进行着色,之后将之制成切片,进行激光共聚焦成像,成像结果如图6a所示;
结果表明,随着油酸浓度的增加,胞内脂滴的数量逐渐增多,体积逐渐增大,且存在一个由核膜周围向细胞质中扩散的趋势,表明400μm的油酸即可对脂滴形成较好的成像效果;
(1)3-羟基黄酮类化合物在不同孵育时间的油酸中的成像效果;
将400μm的油酸,孵育细胞不同的时间(0,1,2,3,4,5,6h),孵育结束后,移除油酸培养基,用pbs清洗三遍,向其中加入固定液孵育15min对细胞进行固定。移除固定液,用pbs清洗三遍,用含有5μg/mldapi的pbs孵育10min进行细胞核染色,清洗后,用含有2μmflp-2的pbs孵育细胞2min对细胞中脂滴进行着色,之后将之制成切片,进行激光共聚焦成像,成像结果如图6b所示;
结果表明,随着油酸孵育时间的延长,胞内脂滴的数量逐渐增多,体积逐渐增大,且存在一个由核膜周围向细胞质中扩散的趋势;
上述实验结果表明,3-羟基黄酮类化合物可以应用于脂滴生长成像中,并能够明确地反映出脂滴的生长状态,取得较好的成像效果。
实施例93-羟基黄酮类化合物(flps)在脂滴的3d成像方面的应用
使用4%中性甲醛固定液孵育hepg2细胞15min对细胞实现固定,移除固定液,用pbs清洗三遍,用含有5μg/mldapi的pbs孵育10min进行细胞核染色,清洗后,分别用含有2μmflp-1、flp-2、flp-3和flp-4的pbs孵育细胞2min对细胞中脂滴进行着色,然后制成切片,使用激光共聚焦显微镜对脂滴进行3d成像研究,成像结果如图7所示;
结果表明:
1、flp1、flp2、flp3和flp4四种染料对细胞中的脂滴着色后,都能够在空间上给出脂滴的分布;
2、从放大的区域,可以观测出脂滴是呈现椭球形的,而非在2d成像中的看到的圆形结构,说明了3-羟基黄酮类化合物能够被用于三维立体状态下的脂滴分布、形态及功能的研究,并取得较好的成像效果。
实施例103-羟基黄酮类化合物(flps)的普适性
用含有5μg/mldapi的pbs对前脂肪细胞(3t3-l1)和脂肪细胞(differentiated3t3-l1)的细胞核孵育10min,对细胞核实现着色,清洗三遍后,分别用含有2μmflp-1、flp-2、flp-3和flp-4的pbs孵育细胞2min后,对细胞中脂滴进行着色,清洗三遍后,进行激光共聚焦成像,成像结果如图8所示;
结果表明,3-羟基黄酮类化合物用于不同细胞系中的脂滴成像时,均能够具有良好的脂滴靶向性,3-羟基黄酮类化合物具有较好的普适性。
实施例113-羟基黄酮类化合物(flps)在老鼠组织中脂肪的成像方面的应用
将老鼠的白色脂肪组织(wat)、棕色脂肪组织(bat)、脂肪肝组织(fattyliver)和骨骼肌组织(skeletalmuscle)分别切成厚度为5μm的薄片,然后使用2μm的flp-2孵育老鼠组织5min,用清水冲洗三遍后,制成切片,用于激光共聚焦成像,成像结果如图9所示;
结果表明:
1、flp-2可以实现上述四种老鼠组织中脂肪的成像,且具有极佳的成像效果;
2、flp-2还可以对骨骼肌组织中的肌内脂肪、肌间脂肪实现同时成像,说明3-羟基黄酮类化合物可以很好的检测出哺乳动物中脂质含量异常的情况,能够应用于因脂质含量异常造成疾病的早期诊断中。
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!