一种仿生血管网络肿瘤细胞外渗迁移的装置的制作方法
本发明涉及一种仿生血管网络肿瘤细胞外渗迁移的装置。
背景技术:
约90%癌症相关死亡是由转移性疾病而非原发性肿瘤引起的。癌症转移是在原发性肿瘤中的上皮细胞完成一系列复杂的细胞生物学事件后形成的,这一系列事件统称为“侵袭-转移级联”,其包括原发性肿瘤上皮细胞:通过周围的细胞外基质和基质细胞层局部侵袭,渗入血管腔内(内渗),在血液循环中存活下来成为循环肿瘤细胞,后在远处器官位点停留,穿过血管渗入到远处组织中(外渗),在异质微环境中最初存活形成微转移,接着在转移部位重新开始其增殖程序,从而产生宏观的、临床可检测的肿瘤生长。癌症转移的过程比较复杂,至今未能找出完全抑制转移的药物。而在癌症转移过程中涉及到两次穿过血管的过程,分别是内渗和外渗,并且循环肿瘤细胞在癌症转移过程中起到“承上启下”的作用。所以,构建具有人体生理状态的自组织血管网络并建立类心脏驱动的血液流动模型,进而研究肿瘤细胞动态外渗过程并进行抗癌药物的筛选,对研究癌症转移具有重要意义。
技术实现要素:
本发明的主要目的在于克服现有技术的不足,提供一种仿生血管网络肿瘤细胞外渗迁移的装置。
为实现上述目的,本发明采用以下技术方案:
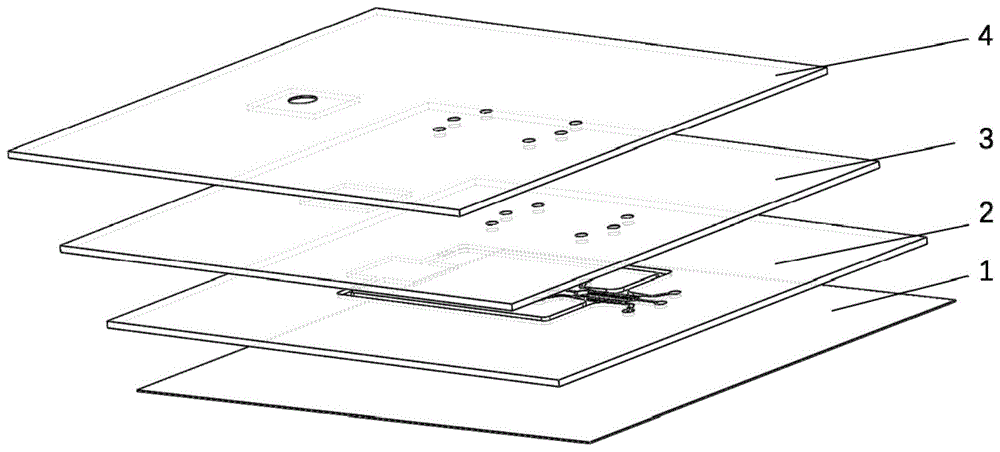
一种仿生血管网络肿瘤细胞外渗迁移的装置,包括由下而上依次叠加的支撑层(1)、流体流动层(2)、泵送层(3)、气体驱动层(4);其中,所述流体流动层(2)设有串联连接形成循环流体回路的第一主流道(5)、微血管腔室(7)、第二主流道(6)和液体腔室(8),所述微血管腔室(7)、所述第一主流道(5)和所述第二主流道(6)内分别设有单向阀(9),所述气体驱动层(4)通过所述泵送层(3)向所述液体腔室(8)施加周期性外力,以驱动流体在所述流体回路中单向流动,模拟人体血液循环;所述微血管腔室(7)与所述第一主流道(5)和所述第二主流道(6)通过防溢出微柱阵列隔开,所述微血管腔室(7)设置有用于注入正常组织细胞混合液的进液口(10、11),正常组织细胞混合液被所述防溢出微柱阵列限制在所述微血管腔室(7)内,凝胶并自组织生成微血管网络,所述第一主流道(5)和/或所述第二主流道(6)上设置有用于注入培养液和肿瘤细胞悬液的进液口(13、14),肿瘤细胞通过所述防溢出微柱阵列间隙的微血管开口处进入所述微血管腔室(7)中,并参与到系统循环中。
本发明中所称的正常组织细胞混合液一般含有正常组织细胞(如骨组织正常细胞、肺部正常细胞)、纤维蛋白原、凝血酶和人脐静脉内皮细胞(huvecs)混合液。
进一步地,所述第一主流道(5)和所述第二主流道(6)与所述微血管腔室(7)相连的部位分别形成有相对于主流道的横向尺寸扩大的外部腔室,所述进液口(13、14)分别设置所述外部腔室的两端处。
进一步地,所述泵送层(3)在所述液体腔室(8)的上方设置有上部腔室(15),所述液体腔室(8)连通所述上部腔室(15),所述气体驱动层(4)在所述上部腔室(15)的上方设置有充气腔室(18),所述充气腔室(18)与所述上部腔室(15)之间通过薄膜分隔,通过所述充气腔室(18)的进气口(19)对所述充气腔室(18)周期性地充气,驱动所述薄膜向所述上部腔室(15)施加周期性外力,以在所述液体腔室(8)中产生周期性变化的压力,从而驱动所述流体回路中的流体流动。
进一步地,所述气体驱动层(4)设置有与所述流体流动层(2)的进液口(13、14)相对应的贯穿孔(20-23),以及与所述流体流动层(2)的进液口(10、11)相对应连通的贯穿孔(24、25),所述泵送层(3)设置有与所述流体流动层(2)的进液口(13、14)相对应的贯穿孔(16),以及与所述流体流动层(2)的进液口(10、11)相对应连通的贯穿孔(17)。
进一步地,所述微血管腔室(7)中的所述防溢出微柱阵列为等腰梯形圆角微柱阵列(12)。
进一步地,所述等腰梯形圆角微柱的间隔在60~90μm之间,微柱长边宽度为120-160μm,短边宽度为30-70μm,优选地,间隔在70-80μm,微柱长边宽度为140μm,短边宽度为50μm。
进一步地,所述单向阀(9)由pp材料薄圆片和pdms材料混合浇注制作而成。
进一步地,所述支撑层(1)为玻璃材料。
进一步地,所述流体流动层(2)、所述泵送层(3)、所述气体驱动层(4)为pdms材料。
进一步地,所述支撑层(1)、所述流体流动层(2)、所述泵送层(3)、所述气体驱动层(4)通过基于等离子清洗技术的键合工艺组装成一体。
本发明具有如下有益效果:
本发明提出一种仿生血管网络肿瘤细胞外渗迁移的装置,该装置提供了一种基于微流控芯片的类心脏驱动的血管网络自循环系统中研究肿瘤细胞外渗的模型,由下而上依次叠加有支撑层、流体流动层、泵送层、气体驱动层,通过设置腔室和流道,模拟人体血液循环和微血管网络,在周期性外力作用下产生流动,并在微血管区域灌注肿瘤细胞,从而能够实现在具有符合人生理状态的流动条件的系统中研究肿瘤细胞外渗过程,为癌症转移相关研究提供新的手段。其中微血管腔室可以接种不同组织正常细胞及人脐静脉内皮细胞(huvecs)、纤维蛋白原、凝血酶混合溶液,例如骨组织正常细胞、肺部正常细胞等,凝胶成微血管后灌注不同的癌细胞,通过不同的组合,观察同一种癌细胞在不同组织中的迁移能力以及不同的肿瘤细胞在同种组织中的迁移能力。并可研究不同剪切应力下肿瘤细胞动态外渗。
与现有的技术相比,本发明的实施例具有以下优点:
在功能上,本装置更符合人体生理状态模型,其含有自组织生成的微血管网络,并实现了更符合人体生理学状态流动条件下的类心脏泵送驱动血液循环的肿瘤细胞外渗模型,更具有生理学意义。同时可以用于进行抗癌药物筛选、观察并量化同一种癌细胞在不同组织中的转移能力以及不同的癌细胞在同种组织中的转移能力。本装置四层芯片的设计结构制作简单,可以实现批量化制作。
附图说明
图1为本发明一种实施例的仿生血管网络肿瘤细胞外渗迁移的装置的结构示意图;
图2a和图2b分别为图1所示的pdms流体流动层的结构示意图和局部a的放大图;
图3为图1所示的pdms泵送层下面向上翻转后的结构示意图;
图4为图1所示的pdms气体驱动层下面向上翻转后的结构示意图。
具体实施方式
以下对本发明的实施方式作详细说明。应该强调的是,下述说明仅仅是示例性的,而不是为了限制本发明的范围及其应用。
参阅图1至图4,在一种实施例中,一种仿生血管网络肿瘤细胞外渗迁移的装置,包括由下而上依次叠加的支撑层1、流体流动层2、泵送层3、气体驱动层4;其中,所述流体流动层2设有串联连接形成循环流体回路的第一主流道5、微血管腔室7、第二主流道6和液体腔室8,所述微血管腔室7、所述第一主流道5和所述第二主流道6内分别设有单向阀9,所述气体驱动层4通过所述泵送层3向所述液体腔室8施加周期性外力,以驱动流体在所述流体回路中单向流动,模拟人体血液循环,其中所述第一主流道5和所述第二主流道6用于模拟人体血液循环中的动脉和/或静脉,所述微血管腔室7用于模拟人体的微血管网络,在周期性外力作用下产生流动,从而模拟人体血液流动;所述微血管腔室7与所述第一主流道5和所述第二主流道6通过防溢出微柱阵列隔开,所述微血管腔室7设置有用于注入正常组织细胞混合液的进液口10、11,正常组织细胞混合液被所述防溢出微柱阵列限制在所述微血管腔室7内,凝胶并自组织生成微血管网络,所述第一主流道5和/或所述第二主流道6上设置有用于先后注入培养液和肿瘤细胞悬液的进液口13、14,凝胶后,培养液注射至主流道,待微血管生成后,将系统中的培养液换成新鲜的肿瘤细胞悬液,肿瘤细胞通过所述防溢出微柱阵列间隙的微血管开口处进入所述微血管腔室7中,并参与到系统循环中。本装置提供了用于研究肿瘤细胞外渗的类心脏驱动的血管网络自循环系统。
其中进液口10、11优选设置多个,可以只从其中一个口加入混合液,例如,从进液口10加入混合液,此时进液口11可以当做通气孔,并且凝胶成功后还可以在孔中储存培养液,达到充分供液的目的。
使用本装置时,所述微血管腔室7可以通过进液口10接种不同组织正常细胞及人脐静脉内皮细胞huvecs、纤维蛋白原、凝血酶混合溶液,例如骨组织正常细胞、肺部正常细胞等,而培养液由进液口13、14加载至主流道,进液口13、14也作为后续灌注肿瘤细胞悬液的进液口,待微血管生成后,将系统中的培养液换成新鲜的肿瘤细胞悬液,肿瘤细胞会在微柱阵列间隙的微血管开口处进入微血管中,并参与到系统循环中。在本装置中,第一主流道5可用于模拟人体血液循环中的动脉,第二主流道6可用于模拟人体血液循环中的静脉,在流体压力作用下,两个单向阀选择性地被动开启或关闭,产生由第一主流道5—微血管腔室7—第二主流道6—液体腔室8—第一主流道5单向流动。利用本装置,可以灌注不同的正常组织细胞混合液凝胶成微血管,也可灌注不同的癌细胞,并研究不同剪切应力下肿瘤细胞动态外渗。通过不同的组合,可观察同一种癌细胞在不同组织中的迁移能力以及不同的肿瘤细胞在同种组织中的迁移能力。
本装置在操作上控制简单,周期性外力可以采用可编程的流体程控仪施加,接种细胞、配制纤维蛋白原和凝血酶混合液、加载培养液、灌注肿瘤细胞简单易行,肿瘤细胞的外渗情况和微血管生成情况可借助显微镜和活细胞工作站实现静态和动态观察,芯片可进行高温灭菌处理并可直接放到二氧化碳培养箱中培养,进而保证无菌的细胞生长环境。
本装置提供了符合人体生理学状态的研究肿瘤细胞外渗的体外模型,通过给予系统不同的周期性外力,可改变系统中液体流动速度,进而改变剪切应力,从而可研究不同流动条件下的肿瘤细胞外渗情况,为癌症治疗寻找新的突破点。本装置也可用于抗癌药物的筛选,尤其是抗癌症转移的药物。本装置还可以用于观察并量化同一种癌细胞在不同组织中的转移能力以及不同的癌细胞在同种组织中的转移能力。
在优选的实施例中,所述第一主流道5和所述第二主流道6与所述微血管腔室7相连的部位分别形成有相对于主流道的横向尺寸扩大的外部腔室,所述进液口13、14分别设置所述外部腔室的两端处。
在优选的实施例中,所述泵送层3在所述液体腔室8的上方设置有上部腔室15,所述液体腔室8连通所述上部腔室15,所述气体驱动层4在所述上部腔室15的上方设置有充气腔室18,所述充气腔室18与所述上部腔室15之间通过薄膜分隔,通过所述充气腔室18的进气口19对所述充气腔室18周期性地充气,驱动所述薄膜向所述上部腔室15施加周期性外力,以在所述液体腔室8中产生周期性变化的压力,从而驱动所述流体回路中的流体流动。
在优选的实施例中,所述气体驱动层4设置有与所述流体流动层2的进液口13、14相对应的贯穿孔20-23,以及与所述流体流动层2的进液口10、11相对应连通的贯穿孔24、25,所述泵送层3设置有与所述流体流动层2的进液口13、14相对应的贯穿孔16,以及与所述流体流动层2的进液口10、11相对应连通的贯穿孔17。
在优选的实施例中,所述微血管腔室7中的所述防溢出微柱阵列为等腰梯形圆角微柱阵列12。
在更优选的实施例中,所述等腰梯形圆角微柱的间隔在60~90μm之间,微柱长边宽度为120-160μm,短边宽度为30-70μm,优选地,间隔在70-80μm,微柱长边宽度为140μm,短边宽度为50μm。
在优选的实施例中,所述单向阀9由pp材料薄圆片和pdms材料混合浇注制作而成。具体地,可由pp材料薄圆片和pdms材料混合浇注,后通过打孔、开半月键、切割、封装等加工工艺制作而成。其结构可以使得液体单向流动。
在优选的实施例中,所述支撑层1为玻璃材料。
在优选的实施例中,所述流体流动层2、所述泵送层3、所述气体驱动层4为pdms材料。
在优选的实施例中,所述支撑层1、所述流体流动层2、所述泵送层3、所述气体驱动层4通过基于等离子清洗技术的键合工艺组装成一体。
本装置可直接放到二氧化碳培养箱中进行培养,从而保证稳定无菌的细胞生长环境。
本装置可用于模拟不同流动速度条件下,肿瘤细胞的外渗能力和死亡率,其更符合人体癌细胞转移的生理学状态;可以在此装置下进行抗癌症药物的筛选,进而筛选出针对抗癌症转移的药物,进而更精准地治疗癌症;可用于高通量地观察并量化同一种癌细胞在不同组织中的转移能力以及不同的癌细胞在同种组织中的转移能力。
下面结合具体实施例对本发明详细说明。
如图1所示,仿生血管网络肿瘤细胞外渗迁移的装置包括四层芯片结构,由下而上依次为玻璃片支撑层1、pdms流体流动层2、pdms泵送层3、pdms气体驱动层4。
微血管腔室7相对的两侧连接主流道5、6,另外相对的两侧设置进液口10、11。微血管腔室7进液时,混合溶液可由进液口10进入,并从另一个进液孔11排出微血管腔室7的空气,从而混合液可以充分灌注微血管腔室7。在等腰梯形圆角微柱阵列12的作用下,混合液被限制在微血管腔室内,而不会进入主流道5、6。混合液凝胶后,培养液从进液口13、14先后注射至主流道6、5。在所有的口灌注相应的液体后,可在与外界空气联通的每个口上都滴上培养液。所述微血管腔室7尺寸为3.8mm×1.1mm×0.25mm(长×宽×高),主流道5、6的尺寸为0.6mm×0.25mm宽×高。微血管腔室7中设置等腰梯形圆角微柱阵列12,在微流体表面张力作用下,将微血管区域水凝胶溶液阻隔在微血管腔室7内部,而不会进入流道5和6。液体腔室8用于存储培养液,并连接上部腔室15,通过在腔室15上部施加周期性外力,从而在液体腔室8与上部腔室15中产生周期性变化的压力,从而驱动液体流向主流道5。所述液体腔室8尺寸为5.5mm×4.5mm×0.25mm(长×宽×高)。pdms泵送层3的厚度为0.4mm,其中腔室15尺寸与其下部液体腔室8尺寸一致,为5.5mm×4.5mm×0.25mm(长×宽×高)。pdms气体驱动层4的进气孔19直径为2-3mm。在pdms气体驱动层4的进气口19周期性地充气,由于充气腔室18密闭,故充气腔室18也产生周期性变化的压力;在充气腔室18周期性压力下,上部腔室15上层的pdms薄膜周期性下压,上部腔室15在周期性外力作用下给予液体腔室8周期性的压力,从而周期性地驱动主流道5单向阀打开,液体流向主流道5。
芯片的加工组装通过以下步骤实现:
首先,芯片制作。玻璃片支撑层1选用常用的光学玻璃51mm×21mm×1mm(长×宽×高),在芯片组装前,必须对玻璃片进行清洗并烘干。其次,pdms流体流动层2、pdms泵送层3、pdms气体驱动层4的模具采用软光刻的加工方法,用su-8光刻胶旋涂在硅片上,放置上预先设计好的掩膜板,并在光刻机下对准曝光,显影后得出模具,后在模具上浇注pdms液体,固化后揭下即得到带有微结构的芯片。最终加工出pdms流体流动层2、pdms泵送层3、pdms气体驱动层4的外形尺寸分别为48mm×18mm×1mm(长×宽×高)、48mm×18mm×0.4mm(长×宽×高)、48mm×18mm×1mm(长×宽×高)其中,单向阀单独制作好后对称放置在pdms流体流动层2的主流道5和6上。
微流控芯片的前处理操作:先将微流控芯片置于浓度为75%的乙醇中进行初步消毒;再用pbs磷酸缓冲液,ph值为7.4通入芯片的腔室和流道,清洗3遍,去除酒精消毒时的残留酒精;然后将微流控芯片放入高压灭菌锅进行杀菌处理;再将微流控芯片放入80℃烘箱中24h进行疏水处理。最后,将微流控芯片置于紫外线下照射1h,再次杀菌处理。
其次,微血管生成。如图2a至2b所示,pdms流体流动层2的上所有结构深度为250μm。首先,可堵住进液口24/25其中的一个,在另一个口的缓慢加载人脐静脉内皮细胞huvecs、纤维蛋白原、凝血酶混合溶液,防止溢出微柱阵列12。在湿度盒中凝胶15分钟后,由培养液进液口20加载液体,堵住其他三个孔21、22、23,直至液体加载至微血管腔室7与主流道之间的腔室的中线处,后堵住20、22、23,从进液口21加载培养液直至与中线液体汇合,并继续填充主流道6,在液体压力作用下单向阀打开,液体可以填充液体腔室8,在液体压力作用下进一步打开单向阀,填充主流道5,并填充微血管腔室与主流道5之间的空腔,空气由进液口22、23排出。加载好培养液后,将装置放入培养箱中培养或活细胞工作站中实现动态实时观察微血管形成过程。装置每24h换液,3-4天后微血管生成,挑选出微柱之间有50%微血管开口的可灌注肿瘤细胞装置,并准备灌注肿瘤细胞。
其中人脐静脉内皮细胞huvecs终浓度为12×106个/ml,凝血酶为4u/ml,纤维蛋白原为6mg/ml。因纤维蛋白原加入凝血酶后在30秒内凝胶,故三者混合后应立即加入微血管腔室7,并且即时混合溶液,有剩余也不能重复利用,纤维蛋白原和凝血酶应分装好,现用现配。
最后,灌注肿瘤细胞并产生流动。灌注肿瘤细胞的浓度为0.5×106个/ml,首先,缓慢吸取装置中的旧培养液,将配制好的肿瘤细胞悬液从进液口22、23用同样的方法加载至主流道56、液体腔室8和微血管腔室7的微血管中。堵住进液口20、21、22、23、24、25,将钢针插入进气孔19并确保过盈配合,腔室密封。钢针外接可编程流体程控仪,改变气体泵送的周期,从而增大腔室18的压强,进而增大腔室8的压强,主流道5的单向阀打开,液体实现了流动,流动速度由腔室的压强决定。启动流体程控仪后,在活细胞工作站动态观察肿瘤细胞外渗过程,并选取合适的时间节点进行量化记录,总结不同剪切应力对肿瘤细胞外渗的影响。
其中,血流动力学剪切应力,由于血液流动而对血液中的细胞施加的物理力。单位:达因/cm2。计算方式:剪切应力等于流体粘度(μ)和剪切速率dγ/dt(dγ/dt=8vav/d)的乘积,其中vav为平均血流速度,d为血管直径,血液粘度μ约为4cp(厘泊)。
若研究不同肿瘤细胞在同种组织中的迁移能力,需更换灌注肿瘤细胞的种类。若研究同种肿瘤细胞在不同组织中的迁移能力,需要在微血管腔室中加载混合液时多加一种正常组织细胞。若进行抗癌药物筛选,只需将药物加载到肿瘤细胞悬液中。
以上内容是结合具体/优选的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,其还可以对这些已描述的实施方式做出若干替代或变型,而这些替代或变型方式都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!