一种DNA纳米结构修饰的微流控芯片用于光学生物传感及其制备和应用的制作方法
本发明涉及一种生物技术领域,具体涉及一种dna纳米结构修饰的微流控芯片用于光学生物传感及其制备和应用及其制备方法和用途。
背景技术:
恶性肿瘤在国内外都是一种死亡率很高的疾病,对社会经济发展的不良影响越来越显著。目前传统的肿瘤诊断和监控手段主要有影像学检查、穿刺病理学活检及传统的血液肿瘤标记物检测等。但是影像学检查对操作者有较高的要求,且通常仅对1cm以上的肿瘤才具有较好的区分能力;细胞学或组织学穿刺活检具有创伤性,导致患者接受度低;传统的血液肿瘤标记物检测由于缺乏可靠的标志物,导致结果准确性不高。
循环肿瘤细胞(circulatingtumorcells,ctcs)是由来自实体瘤原发灶火转移灶的肿瘤细胞,自发或由于诊疗操作导致脱离基底膜从而进入外周血或骨髓的肿瘤细胞与肿瘤早期筛查、辅助分期、个性化用药、预后评估及复发转移预警等有密切联系,但血液中ctcs的极低含量带来了捕获检测的极大困难。免疫亲和捕获主要是利用抗原与抗体相结合的方法,对ctc进行染色标记和捕获,具有简单、快捷、富集效率较高的优势,是未来ctc捕获技术的发展趋势。近年来科研人员尝试了许多方法用于ctcs免疫亲和分离,如微流控技术,生物纳米技术等,目的是增加特定捕获单元与目标细胞的接触程度,提高捕获性能。
微流控芯片是把生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺度的芯片上,通过可控流体,完成全分析过程的一种微技术平台。具有较大表面积体积比的微流控芯片是亲和性分选方法的一个强有力工具。传统的微流控亲和反应直接将抗体结合在通道内,而不制作特殊的内结构,由于微流控芯片中的样品多处于层流状态,使得只有靠近壁面的细胞才能被捕捉,而处于样品流内部的细胞没有与抗体相接触的机会,导致捕获效率较低。通过对芯片进行内部微结构构型设计是提高ctcs与芯片捕获单元结合能力的策略之一。
随着纳米技术的发展,通过表面修饰的不同尺寸、形貌和构成的纳米材料构建的生物纳米界面已被用于发展各种生物纳米检测技术。dna不仅是遗传信息的承载者,还是天然的纳米材料和结构元件,具有超强的编码和自组装能力。dna四面体支架的刚性结构有助于顶端探针保持更好的竖直方向性,且四面体的存在使纵向和横向的距离可以通过四面体的大小进行简便的调控,许多研究都表明界面的调控对靶标的识别效率和速率都有着至关重要的作用,横向的距离可以减小探针之间相互缠绕,当连接抗体等较大识别分子时又可以保持一定的空间距离提高捕获分子的活性,有利于提升目标物的识别捕获效率;纵向的距离可以提高靶标扩散到电极界面的扩散速率,使在界面拥有类溶液的识别环境,加快目标物的识别捕获。
核酸适配体(aptamer),是一类由selex技术筛选出来的单链dna、rna,通过形成二级结构可以提高亲和力、高选择性结合许多种类的靶标(蛋白、小分子、细胞等)。aptamer通过人工合成,容易实现功能化修饰,比如修饰染料和其他生物分子耦合等。
杂交链式反应技术(hybridizationchainreaction,hcr)是一种体外核酸等温信号放大技术,是一个没有酶参与的过程。hcr元件包括两个部分:引发探针、两条可杂交互补的并带有粘性末端的发夹形dna(h1和h2),当不存在引发探针时,两条发夹探针稳定存在于溶液中。若存在引发探针,引发探针触发hcr反应开始,发夹探针h1和h2相继打开,形成具有多个重复单元的共聚物,直到发夹探针h1和h2消耗完为止,以此实现信号扩增的目的。
因此,提供一种全新的肿瘤细胞探针技术对于疾病的发现和治疗十分关键。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种dna纳米结构修饰的微流控芯片用于光学生物传感及其制备和应用及其制备方法和用途,用于解决现有技术中对于循环肿瘤细胞检测效率低、操作繁琐的问题。
用于捕获循环肿瘤细胞的dna纳米结构修饰的微流控芯片系统基本工作原理:
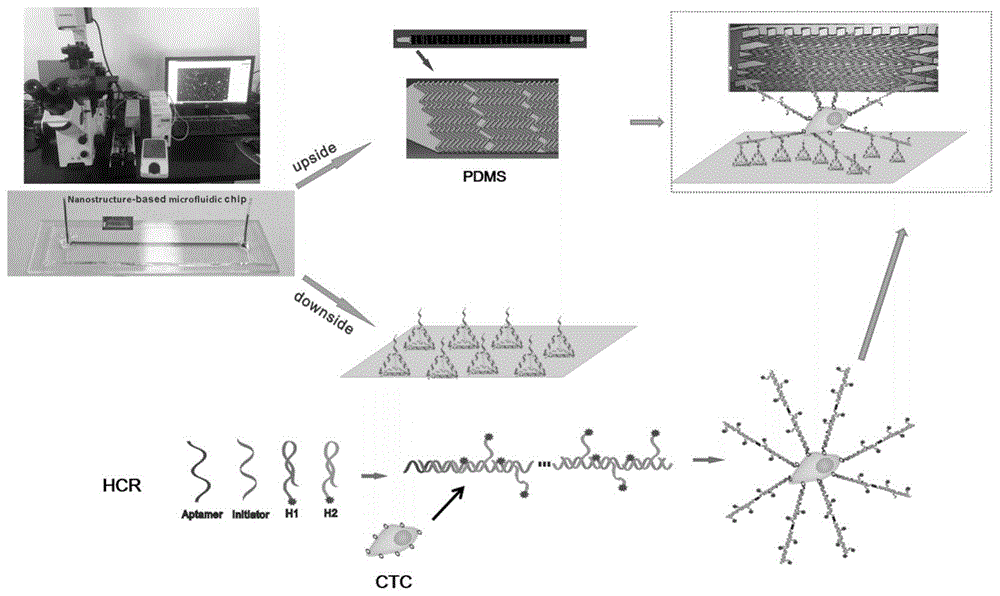
循环肿瘤细胞(ctcs)表面过表达上皮细胞粘附分子(epcam),该分子可以特异性结合抗体或核酸适配体(aptamer)来捕获肿瘤细胞。微流控芯片系统主要分为两部分,其一为微流控通道,其二为通道内部修饰的探针结构。具体而言,第一部分即微流控通道,由醛基修饰的微阵列基片(购于北京博奥晶典生物技术有限公司)与聚二甲基硅氧烷(pdms)通过等离子键合形成,为提高捕获效率,在pdms结构种引入鱼骨型结构,使样品流中诱导产生微漩涡,以此提高ctcs与结合探针的流道壁的接触;第二部分即探针结构,氨基修饰的dna四面体结构与微阵列基片上的醛基发生供价交联,形成dna四面体刚性支架结构,dna四面体顶端延伸链能可控连接aptamer,从而实现循环肿瘤细胞捕获,为提高捕获效率,在dna四面体与aptamer之间引入带有荧光基团的杂交链式反应(hcr)结构,达到放大信号的目的。
杂交链式反应(hcr)结构中包含引发链(i)和茎环(h1,h2)的序列,参见图7,引发链可以通过与h1一端tohold反应而打开h1,被打开的h1另一部分单链可以通过相同的方法打开h2,打开后的h2单链部分与i相同又可以打开h1,如此循环反复最终可形成一条线性的dna长双链结构。每个h1,h2末端修饰都有cy3荧光基团,当两个荧光基团之间的距离发生变化,就会引起荧光信号的变化,这一信号变化可在显微镜下输出荧光信号,而每个h2都有一段额外的dna序列,这段序列可以与微阵列基片上组装的dna四面体顶端探针杂交,从而实现循环肿瘤细胞在微流控通道内的捕获。aptamer一端部分碱基可以与引发链i杂交,其本身碱基特异性识别epcam分子。当aptamer特异性识别epcam分子后即可导致引发链i与h1一端的toehold反应,进而导致荧光信号的产生。
为实现上述目的及其他相关目的,本发明提供一种用于捕获循环肿瘤细胞的dna纳米结构修饰的微流控芯片系统,所述系统包括:微流控通道结构以及连接有aptamer的hcr结构,所述微流控通道结构包括上下两层,其中上层为pdms材料板,下层为微阵列基片,所述pdms材料板内部形成反应腔,所述微阵列基片表面修饰有dna四面体,所述dna四面体由a、b、c、d四条核苷酸单链形成,其中a链可以与hcr结构中h2链碱基互补配对连接,所述hcr结构包括引发链i和茎环,即h1链和h2链,所述h1链和h2链的5’端都修饰有荧光基团,所述引发链i与aptamer连接。
使用时,先将连接有aptamer的hcr结构与待检测样品混合,再加入微流控通道结构。实验证实,若先将连接有aptamer的hcr与修饰了四面体的微流控通道结构结合,再加入待检测样品,则连接有aptamer的hcr捕获的效率低。
dna四面体的制备和原理为现有技术。一般地,dna四面体包括a、b、c、d四条链,四条链通过碱基间的互补配对而形成四面体结构。每条链的碱基序列可以根据需要而设计。其中b、c、d四条链形成四面体的底座,而a链位于四面体的顶端且延伸出一段形成未结合的游离状态。在本申请中b、c、d链5’端与微阵列基片上的醛基共价结合,在本申请中dva四面体序列如下:
a链:agccgccatagtattttttttttgtatccagtggctca(seqidno.1)
b链:nh2-c6-tatcaccaggcagttgacagtgtagcaagctgtaatagatgcgagggtccaatac(seqidno.2)
c链:nh2-c6-tcaactgcctggtgataaaacgacactacgtgggaatctactatggcggctcttc(seqidno.3)
d链:nh2-c6-ttcagacttaggaatgtgcttcccacgtagtgtcgtttgtattggaccctcgcat(seqidno.4)在本申请中,hcr结构的h2链的部分片段(大写部分)与a链部分片段(大写部分)通过碱基互补配对连接,所述hcr结构序列如下:
i链:ctagagcacaatcacaggagccagtttacgtatgccgtaagctttgc(seqidno.5)
h1链:cy3-ttttttttttctggctcctgtgattgtgctctagtttacatcgctagagcacaatcacagg(seqidno.6)
h2链:cy3-ttttctagagcacaatcacaggagccagttacctgtgattgtgctctagcgatgttttttttgagccactggatac(seqidno.7)
在本申请中,aptamer部分片段(大写部分)与i链的部分片段(大写部分)通过碱基互补配连接,与aptamer序列如下:
aptamer:cactacagaggttgcgtctgtcccacgttgtcatggggggttggcctgtttgcaaagcttacggcatacgt(seqidno.8)
进一步地,所述反应腔为位于pdms材料板底面上微槽,所述底面是指与下层贴近的一面。
进一步地,所述反应腔呈鱼骨形结构。所述鱼骨形结构可使液体产生涡旋,呈螺旋向前,增加细胞与探针之间的碰撞概率。
进一步地,所述鱼骨形结构是指在上层pdms材料板上制作若干鱼骨形微槽,每个微槽包括长边和短边,所述长边和短边之间的夹角为80-90度,每10-15个鱼骨微槽依次平行排列形成一个周期。
进一步地,所述上层pdms材料板上包括10~20个不对称、互相错开的周期。
进一步地,每个微槽的宽度为40~55μm,一个周期内相邻两个微槽的宽度为40~55μm。
进一步地,所述微槽的两个边与芯片的前侧面和后侧面的夹角都是40-45度。
进一步地,微阵列基片修饰有活化的醛基基团,发明人利用等离子键合方式将pdms与微阵列基片进行等离子键合,形成不可逆封接。这是本领域技术人员所熟知的方法。
在制备上述微流控芯片系统时,不可避免的存在少部分的dna四面体结构没有与hcr结构连接。但是这只是极少数的部分,因此不会对本申请的方案产生影响。
进一步地,所述荧光基团选自cy2、cy3、cy5或cy7中的任意一种,优选为cy3。
本发明的第二方面提供了一种上述dna纳米结构修饰的微流控芯片系统的制备方法,所述方法包括以下步骤:
(1)分别制备dna四面体、hcr-aptamer以及微流控通道结构;
(2)将dna四面体加载至微流控通道结构中。
进一步地,所述dna四面体的制备方法为现有技术。具体地,可以采用以下方法:
将形成四面体纳米结构的四条单链等比例混合在缓冲液中,放入pcr仪中95℃持续5min,迅速降温到4℃,并在4℃中持续5min以上,即可得到四面体dna纳米结构。
进一步地,所述hcr-aptamer的制备方法为现有技术。具体地,可以采用以下方法:
在tm缓冲液中加入等比例的aptamer与引发链(i),此外将具有荧光分子的h1链、h2链分别加入tm缓冲液中,将配制好的各溶液放入pcr中升温到95℃保持10min,随后在30s内将温度降至4℃。aptamer/i混合溶液加入等比例混合的h1链,h2链溶液中,使将此混合溶液置于37℃恒温箱中过夜反应12h,反应过程中的震荡速度为300rpm。
进一步地,将dna四面体加载至微流控通道结构的制备方法包括以下步骤:
将带有鱼骨结构的下层与醛基修饰的微阵列基片经等离子处理30s后键合(此为现有技术),形成微流控芯片,以20ul/s的流速将10ul四面体dna溶液通入至通道中,室温过夜孵育。
本发明的第三方面提供了上述dna纳米结构修饰的微流控芯片系统用于非诊断性的捕获循环肿瘤细胞的用途。
本发明的第四方面提供了上述dna纳米结构修饰的微流控芯片系统在制备试剂盒中的用途,所述试剂盒具有捕获肿瘤细胞的功能。
进一步地,所述试剂盒具有对肿瘤的诊断、治疗评价以及预后评估功能。
如上所述,本发明的dna四面体修饰的微流控芯片用于光学生物传感及其制备和应用及其制备方法和用途,具有以下有益效果:
采用本申请中的捕获系统,能够快速的检测待测样品中的循环肿瘤细胞。灵敏度高,特异性好,操作方便,对于肿瘤的诊断和治疗具有十分积极的意义。
附图说明
图1显示为本发明dna四面体修饰的微流控芯片系统基本结构和检测原理图。
图2显示为本发明dna四面体中abcd四条链不同组合形成的凝胶电泳图。
图3a显示为多价aptamer的dna四面体对不同浓度mcf7细胞的亲和力。
图3b显示为多价aptamer的dna四面体对不同浓度hala细胞的亲和力。
图3c显示为不同浓度的aptamer的dna四面体与mcf7细胞孵育的平均荧光强度值。
图3d显示为不同时间下aptamer的dna四面体与mcf7细胞孵育的平均荧光强度值。
图3e显示为不同温度下aptamer的dna四面体与mcf7细胞孵育的平均荧光强度值。
图4显示为不同结构的芯片对循环肿瘤细胞的捕获效率图。
图5显示为本发明dna四面体修饰的微流控芯片系统在不同数量循环肿瘤细胞中捕获的细胞。
图6显示为本发明dna四面体修饰的微流控芯片系统在不同数量循环肿瘤细胞中捕获纯度。
图7显示为本发明中hcr结构示意图。
图8显示为芯片的上层结构和下层结构剖视图。
图9显示为鱼骨通道结构示意图。
图10显示为单个鱼骨通道结构放大图。
元件标号和说明
1上层
2下层
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
实施例1
(1)材料及设备
电泳装置均购自bio-rad;pcr仪是peltierthermalcyclerptc-200(mj.researchinc.,sa);紫外照胶仪器是g:box(genecompanylimitied);紫外可见分光光度计(hitachiu-3010);荧光分光光度计(hitachif-4500);hd-850桌上型水平流洁净工作台购买于上海苏净实业有限公司;荧光共聚焦显微镜(leical,sp8);全内反射荧光显微镜(leical);倒置荧光显微镜(leical);流式细胞仪(bdarray)。
(2)dna四面体修饰的微流控芯片系统的构建
构建思路:微流控芯片分为上下两层,芯片下层修饰有dna四面体结构,dna四面体结构可结合hcr杂交链式反应,实现信号放大,hcr结构中的引发链可以和aptamer杂交从而识别循环肿瘤细胞;上层芯片为鱼骨型结构,这种结构可使内部液体产生涡旋,增大液体中细胞与探针的接触机会,从而提高捕获效率。参考图1。
a.四面体dna纳米结构、hcr结构合成及验证
先将单链dna溶解,在紫外分光光度计下定量,摩尔消光系数从idtdna网站上获得,稀释至100μm.。将形成四面体纳米结构的四条单链等比例混合在tmbuffer,配成终浓度为1μm的四面体纳米结构。将配好的样品放入pcr仪中95℃持续5min,迅速降温到4℃,并在4℃中持续5min以上,即可得到四面体dna纳米结构。用8%聚丙烯凝胶电泳验证合成的结构,85v恒压跑240min,gelred染色,紫外照射,拍照。如图2,abcd代表四条链合成,abc/abd/bcd,ab/bc/cd,a/b/c/d分别代表三条、两条、一条dna链合成,根据琼脂糖凝胶电泳跑胶位置不同,可以判断四面体合成成功(如图2)。
对于hcr结合aptamer具体构建过程如下:在tm缓冲液中加入等比例的aptamer与引发链(i),控制最终浓度为5μm,此外将具有荧光分子的h1、h2(荧光dna链购于生工生物工程(上海)股份有限公司)分别加入tm缓冲液中,控制终浓度为20μm,将配制好的各溶液放入pcr中升温到95℃保持10min,随后在30s内将温度降至4℃。取100μl终浓度为5μm的aptamer/i混合溶液加入1ml等比例混合的h1,h2溶液中,使得各自的反应浓度约为0.5μm、0.5μm、5μm、5μm。将此混合溶液置于37℃恒温箱中过夜反应12h,反应过程中的震荡速度为300rpm。将形成好的1mlaptamer-hcr结构溶液加入105个细胞(mcf7、hela)在冰上孵育30min,再用bb洗三次,然后用流式细胞仪测定aptamer对目标循环肿瘤细胞的亲和性(3a和3b)。其中mcf7为目标细胞,aptamer及aptamer链接的hcr探针能识别细胞,荧光值增高(图3a),而hela为非目标细胞,无论aptamer是否存在,荧光值都无变化(图3b)。
利用不同浓度的aptamer的(0-5nm)分别与mcf7细胞结合孵育,探究最适aptamer反应浓度(如图3c)结果显示,其在1nm荧光值饱和;在不同的孵育时间下(10-60min)探究最适反应时间(如图3d),结果显示最佳杂交时间30min;以及在不同的孵育温度下(4℃,25℃,37℃)探究最适反应温度(如图3e)结果显示,最佳反应温度为37℃。
b.不同微流控芯片结构对循环肿瘤细胞捕获率的影响
设计并制作鱼骨型微流控芯片通道如图8-10。芯片总长度为38mm,其中鱼骨部分长度为32mm,通道上面加工有15个周期不对称、相互错开的鱼骨型微槽;每个周期包含20个微槽,一共有300个鱼骨型微槽,这种设计可保证液体充分混合;微槽a和间隙b的宽度均为50μm,与芯片的前、后侧面夹角α和β都为45°,两鱼骨侧壁之间的夹角γ=90°,每10个鱼骨一组;通道宽50μm;一个鱼骨微槽周期(鱼骨槽与鱼骨间隙的宽度和)的wt=100μm;微流控芯片内结构的总深度h=90μm。鱼骨结构的微流控通道材质为pdms,即为上层1,购买的修饰醛基的玻璃基片为下层2,二者通过等离子处理30秒键合在一起。
没有结构的平滑通道作为对照组,在不同的流速下捕获循环肿瘤细胞,计算捕获率。
结果如图4,图中较高位置的线为带鱼骨结构的微流控芯片通道,较低位置的线的为不带结构的平滑微流控芯片通道,同一流速下鱼骨型微流控芯片捕获效率更高,在2ul/min时,捕获效率为99.6%。
将带有鱼骨结构的pdms结构与醛基修饰的玻璃基片经等离子处理30后键合,形成微流控芯片,以20ul/s的流速将10ul四面体dna溶液通入至通道中,室温过夜孵育。然后组装好的aptamer-hcr结构同细胞(mcf7或hela)混合,37℃,轻微震荡30min。将该带有探针的细胞液通入微流控芯片中,并用pbs洗涤。
实施例2dna四面体修饰的微流控芯片检测限及线性范围
利用实施例1中制备的aptamer-hcr-dna四面体结构及鱼骨型微流控芯片,捕获不同数量的mcf7细胞(10,100,1000,10000,100000)。将不同量细胞加入到探针溶液中,冰上震荡孵育30min,再用bb洗涤三次,分别计算捕获率,得出检测限及线性范围。捕获率具体计算方法为:细胞结合hcr-aptamer探针孵育、洗涤,被称为原液;同样的细胞结合hcr-aptamer探针孵育、洗涤后通入微流控通道后收集捕获后液体,成为回收液,利用荧光显微镜观察并计算原液及回收液中细胞,捕获细胞量为原液细胞减回收液中细胞,从而可计算出细胞捕获率。
结果如图5所示,可见在细胞量为10个时,捕获率仍高达89.9%,不同细胞数目下,细胞捕获效率可成直线分布,r2高达0.99。
实施例3dna四面体修饰的微流控芯片检测纯度
将1ml两种细胞(mcf7、hela)等量混匀,加入探针溶液中,冰上震荡孵育30min,再用bb洗涤三次。在不同细胞数量下(100,1000,10000),利用实施例1中优化后aptamer-hcr-dna四面体结构探针及鱼骨型微流控芯片通道进行捕获及计算捕获纯度。纯度具体计算的方法为:mcf7/hela细胞结合hcr-aptamer探针孵育、洗涤,被称为原液;同样的mcf7/hela细胞结合hcr-aptamer探针孵育、洗涤后通入微流控通道后收集捕获后液体,成为回收液,利用荧光显微镜观察并计算原液及回收液中mcf7细胞数量,捕获细胞量为原液细胞减回收液中细胞,从而可计算出纯度。
结果如图6,可见当检测100000个细胞时,细胞纯度高达96.4%。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
序列表
<110>一种dna纳米结构修饰的微流控芯片用于光学生物传感及其制备与应用
<120>一种dna纳米结构修饰的微流控芯片用于光学生物传感及其制备和应用
<160>8
<170>siposequencelisting1.0
<210>1
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>1
agccgccatagtattttttttttgtatccagtggctca38
<210>2
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>2
tatcaccaggcagttgacagtgtagcaagctgtaatagatgcgagggtccaatac55
<210>3
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>3
tcaactgcctggtgataaaacgacactacgtgggaatctactatggcggctcttc55
<210>4
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttcagacttaggaatgtgcttcccacgtagtgtcgtttgtattggaccctcgcat55
<210>5
<211>47
<212>dna
<213>人工序列(artificialsequence)
<400>5
ctagagcacaatcacaggagccagtttacgtatgccgtaagctttgc47
<210>6
<211>61
<212>dna
<213>人工序列(artificialsequence)
<400>6
ttttttttttctggctcctgtgattgtgctctagtttacatcgctagagcacaatcacag60
g61
<210>7
<211>76
<212>dna
<213>人工序列(artificialsequence)
<400>7
ttttctagagcacaatcacaggagccagttacctgtgattgtgctctagcgatgtttttt60
ttgagccactggatac76
<210>8
<211>71
<212>dna
<213>人工序列(artificialsequence)
<400>8
cactacagaggttgcgtctgtcccacgttgtcatggggggttggcctgtttgcaaagctt60
acggcatacgt71
- 还没有人留言评论。精彩留言会获得点赞!