一种双取代苯乙烯类衍生物的制备方法与流程
本发明涉及一种双取代苯乙烯类衍生物的制备方法。
背景技术:
烯烃作为一种重要的基本有机化工原料,所参与的反应在有机合成的发展中占有极为重要的地位。烯烃化合物的价格便宜容易获得,且能进行较多化合物的官能团转化,因此发展烯烃官能团化作为新的转化途径具有至关重要的意义。针对该研究项目中烯烃双官能团化引入的硒(se)原子而言,且其在药物中的广泛应用,将其引入药物分子成为近年来研究的热点。而且硒作为人体不可或缺的元素,具有多样的生物性能以及医疗性能,可用于抗癌、抗菌以及抗氧化等。有机硒药物是一类新型化合物,由于其具有抗病毒、抗肿瘤以及治疗神经系统方面疾病的作用,已成为药物研究的热点。研究表明,有机硒类化合物还具有抗炎、抗衰老、防治心血管疾病及预防肝部疾病等药理作用。而且流行病学研究表明,血浆中硒含量过低是导致癌症、心脑血管疾病、骨关节炎及aids发生的危险因素。硒对人体健康有多种特殊的功能,被列为人体必需的微量元素之一。相比较无机硒化合物毒性较大、致死量相对较低,而有机硒生物利用度高、生物活性强、毒性低、环境污染小。因此,由于硒具有独特的生化性质和药理作用,开发含硒类药物极具意义,所以当代社会对于此类化合物的合成有着重要的研究价值。
目前,对于合成双取代烯烃类衍生物的报道很多,且大多是以热化学和重金属催化为条件的,在某种程度上,造成了经济效益的降低,同时对环境产生极大的污染和破坏,且步骤繁琐。所以,在能源危机、环境问题日趋严重的今天,将无污染、可再生的光能更高效地利用起来的需求变得更为迫切。在有机化学领域,发展以自然丰度大的可见光作为能源的可见光反应意义重大。光化学反应可以实现一些传统热化学无法完成的转化,其中可见光诱导的反应通常可以避免高温高压等强烈条件,且具有良好的反应活性与选择性。再者,目前对于烯烃取代的c-n和c-se键的建立很少。因此,寻求一种绿色高效、条件温和、方法简单且操作方便的方法是合成双取代n-(1-苯基-2-(苯硒基)乙基)苯胺衍生物亟待解决的关键问题。
技术实现要素:
本发明的目的是为了解决现有方法合成双取代苯乙烯类衍生物步骤繁琐、产率低且污染环境的问题,提供一种双取代苯乙烯类衍生物的制备方法。
本发明一种双取代苯乙烯类衍生物的制备方法包括如下步骤:
室温下,在氮气或者氧气气氛下,将苯乙烯衍生物,苯胺类化合物,二苯基二硒醚类化合物和光催化剂溶解在有机溶剂中,混合均匀,置于蓝色leds灯下进行反应,反应结束后,旋蒸溶剂,再经硅胶柱层析分离纯化,即可得到双取代苯乙烯类衍生物;其中苯乙烯类化合物、苯胺类化合物、二苯基二硒醚化合物和光催化剂的摩尔比为1:1.5:0.6:0.1;其中苯乙烯衍生物的化学结构式为:
苯胺类化合物的化学结构式为:
二苯基二硒醚类化合物的化学结构式为:
其中,r1、r2和r3为卤素、烷氧基或烷基。
本发明提供了一种简洁的一步法合成双取代n-(1-苯基-2-(苯硒基)乙基)苯胺衍生物的方法,该方法解决了现有双取代苯乙烯类衍生物合成需要加热和过渡金属催化体系导致的产率低、方法环保性差的问题,寻求到一条绿色高效、条件温和、方法简单且操作方便的合成双取代n-(1-苯基-2-(苯硒基)乙基)苯胺衍生物的路线,也为现代工业化的发展奠定了一定的基础,合成的衍生物具有潜在的催化性能、生物性能和巨大的研究价值。根据已有文献及专利报道,芳基硒基化胺类衍生物具有较多的生物活性,所以本发明提供的化合物具有较高的研究价值,可以用作药物先导化合物的筛选以及供生物活性测试研究等科研单位使用。本发明亦可以作为合成其他含有硒基化苯胺类衍生物的原料来使用。
附图说明
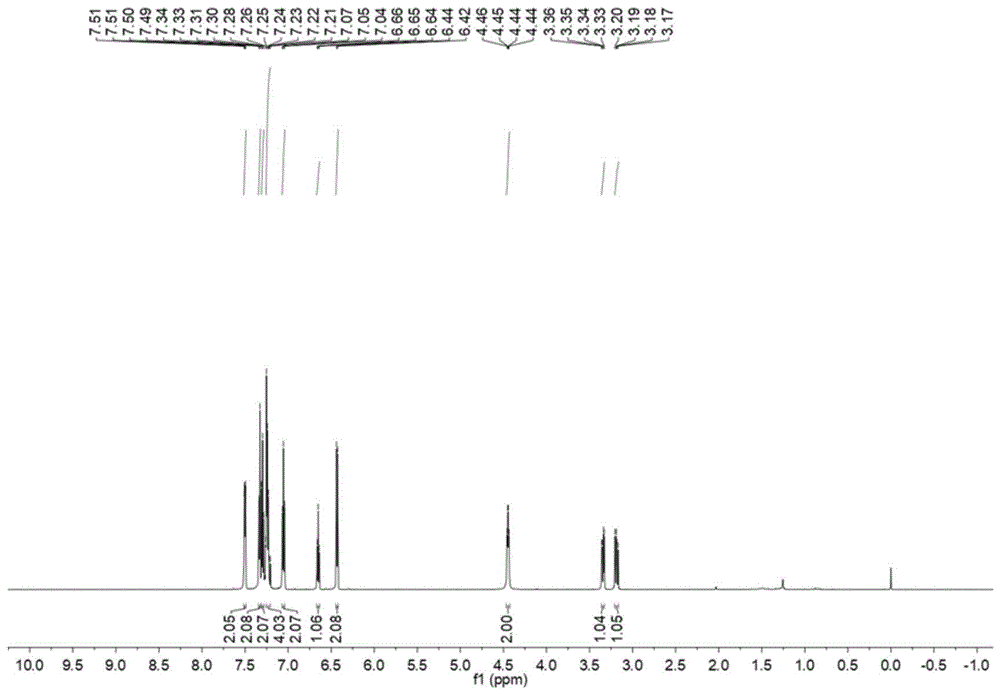
图1为实施例1所制双取代苯乙烯类衍生物的1hnmr谱图;
图2为实施例1所制双取代苯乙烯类衍生物的13cnmr谱图。
具体实施方式
具体实施方式一:本实施方式一种双取代苯乙烯类衍生物的制备方法包括如下步骤:
室温下,在氮气或者氧气气氛下,将苯乙烯衍生物,苯胺类化合物,二苯基二硒醚类化合物和光催化剂溶解在有机溶剂中,混合均匀,置于蓝色leds灯下进行反应,反应结束后,旋蒸溶剂,再经硅胶柱层析分离纯化,即可得到双取代苯乙烯类衍生物;其中苯乙烯类化合物、苯胺类化合物、二苯基二硒醚化合物和光催化剂的摩尔比为1:1.5:0.6:0.1;其中苯乙烯衍生物的化学结构式为:
苯胺类化合物的化学结构式为:
二苯基二硒醚类化合物的化学结构式为:
其中,r1、r2和r3为卤素、烷氧基或烷基。
本实施方式制得的衍生物的结构式如下:
其中,r1、r2、r3为取代芳香基或者烷基;所述取代芳香基为苯基或烷基,烷基通常包括但不限于:环己基。
其反应路线为:
本实施方式提供了一种简洁的一步法合成双取代n-(1-苯基-2-(苯硒基)乙基)苯胺衍生物的方法,该方法解决了现有双取代苯乙烯类衍生物合成需要加热和过渡金属催化体系导致的产率低、方法环保性差的问题,寻求到一条绿色高效、条件温和、方法简单且操作方便的合成双取代n-(1-苯基-2-(苯硒基)乙基)苯胺衍生物的路线,也为现代工业化的发展奠定了一定的基础,合成的衍生物具有潜在的催化性能、生物性能和巨大的研究价值。根据已有文献及专利报道,芳基硒基化胺类衍生物具有较多的生物活性,所以本发明提供的化合物具有较高的研究价值,可以用作药物先导化合物的筛选用以及供生物活性测试研究等科研单位使用。本实施方式亦可以作为合成其他含有硒基化苯胺类衍生物的原料来使用。
具体实施方式二:本实施方式与具体实施方式一不同的是:苯乙烯衍生物为苯乙烯、4-甲氧基苯乙烯、4-溴苯乙烯、2-氯苯乙烯或2-甲基苯乙烯。其他与具体实施方式一相同。
具体实施方式三:本实施方与具体实施方式一或二不同的是:所述苯胺类化合物为3-甲基苯胺、2-叔丁基苯胺、3-硝基苯胺、n-甲基苯胺或苯骈三氮唑。其他与具体实施方式一或二相同。
具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:所述二苯基二硒醚化合物为4-氯二苯基二硒醚或2-甲基二苯基二硒醚。其他与具体实施方式一至三之一相同。
具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:所述有机溶剂为二氯甲烷、二氯乙烷、乙腈、四氢呋喃、二甲基亚砜或乙酸乙酯,优选乙酸乙酯。其他与具体实施方式一至四之一相同。
具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:光催化剂为febr3。其他与具体实施方式一至五之一相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:置于蓝色leds灯下进行反应的时间为24h。其他与具体实施方式一至六之一相同。
具体实施方式八:本实施方式与具体实施方式一至七之一不同的是:硅胶柱层析分离纯化所用溶剂为石油醚与乙酸乙酯的混合溶剂。其他与具体实施方式一至七之一相同。
具体实施方式九:本实施方式与具体实施方式一至八之一不同的是:石油醚与乙酸乙酯的体积比为(100-50):1。其他与具体实施方式一至八之一相同。
具体实施方式十:本实施方式与具体实施方式一至九之一不同的是:苯乙烯衍生物和有机溶剂的摩尔体积比为1mmol:10ml。其他与具体实施方式一至九之一相同。
为验证本发明的有益效果进行了以下实验:
实施例1
向10ml光反应器皿(青霉素小瓶)中,加入10.4mg(0.1mmol)苯乙烯,13.95mg(0.15mmol)苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,3mg(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为82%。其1hnmr谱图见图1,13cnmr谱图见图2,核磁数据分析为:1hnmr(600mhz,chloroform-d)δh7.51(dd,j=7.5,2.0hz,2h),7.36–7.23(m,8h),7.06(dd,j=8.6,7.2hz,2h),6.66(t,j=7.3hz,1h),6.44(d,j=7.5hz,2h),4.53–4.40(m,2h),3.36(dd,j=12.6,4.5hz,1h),3.20(dd,j=12.6,9.0hz,1h).
13cnmr(101mhz,chloroform-d)δc147.09,142.70,133.57,129.33,129.30,129.10,128.86,127.58,127.55,126.34,117.82,113.74,57.85,36.51.
实施例2
向10ml光反应器皿(青霉素小瓶)中,加入13.4mg(0.1mmol)4-甲氧基苯乙烯,13.95mg(0.15mmol)苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为61%。核磁数据分析为:1hnmr(400mhz,chloroform-d)δh7.53–7.49(m,2h),7.27–7.24(m,5h),7.06(dd,j=8.6,7.4hz,2h),6.84(d,j=8.7hz,2h),6.65(t,j=7.3hz,1h),6.44(dd,j=8.6,1.1hz,2h),4.46–4.39(m,2h),3.77(s,3h),3.33(dd,j=12.5,4.7hz,1h),3.20(dd,j=12.5,8.6hz,1h).
13cnmr(101mhz,chloroform-d)δc159.00,147.15,134.64,133.51,129.46,129.25,129.07,127.45,127.43,117.77,114.21,113.77,57.28,55.27,36.58.
实施例3
向10ml光反应器皿(青霉素小瓶)中,加入18.1mg(0.1mmol)对溴苯乙烯,13.95mg(0.15mmol)苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为45%。核磁数据分析为:1hnmr(400mhz,chloroform-d)δh7.49(dd,j=7.6,1.8hz,2h),7.41(d,j=8.4hz,2h),7.24(dd,j=19.4,7.9hz,5h),7.09–7.04(m,2h),6.67(t,j=7.4hz,1h),6.40(d,j=7.8hz,2h),4.47–4.37(m,2h),3.31(dd,j=12.7,4.5hz,1h),3.15(dd,j=12.7,8.6hz,1h).13cnmr(101mhz,chloroform-d)δc146.78,141.78,133.71,131.93,129.34,129.14,129.00,128.14,127.69,121.28,118.13,113.79,57.36,36.32.
实施例4
向10ml光反应器皿(青霉素小瓶)中,加入13.8mg(0.1mmol)2-氯苯乙烯,13.95mg(0.15mmol)苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为44%。核磁数据分析为:1hnmr(400mhz,chloroform-d)δh7.53(dd,j=7.7,1.8hz,2h),7.49–7.45(m,1h),7.35–7.31(m,1h),7.27–7.23(m,3h),7.18–7.14(m,2h),7.07(dd,j=8.6,7.3hz,2h),6.66(t,j=7.3hz,1h),6.40–6.36(m,2h),4.87(dd,j=9.1,3.8hz,1h),4.53(s,1h),3.47(dd,j=12.7,3.8hz,1h),3.10(dd,j=12.7,9.1hz,1h).
13cnmr(101mhz,chloroform-d)δc146.43,139.19,133.60,132.40,129.61,128.97,128.89,128.42,127.44,127.40,127.14,117.78,113.38,54.16,33.79.
实施例5
向10ml光反应器皿(青霉素小瓶)中,加入11.8mg(0.1mmol)间甲基苯乙烯,13.95mg(0.15mmol)苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,3mg(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为63%。核磁数据分析为::1hnmr(600mhz,chloroform-d)δh7.54–7.47(m,2h),7.24(s,3h),7.19(t,j=7.6hz,1h),7.13(s,2h),7.05(d,j=7.8hz,3h),6.65(t,j=7.5hz,1h),6.44(d,j=7.1hz,2h),4.46–4.36(m,2h),3.33(d,j=12.8hz,1h),3.18(t,j=10.9hz,1h),2.30(s,3h).
13cnmr(151mhz,chloroform-d)δc147.24,142.73,138.51,133.58,129.43,129.30,129.13,128.76,128.42,127.53,126.99,123.44,117.79,113.75,57.95,36.52,21.61.
实施例6
向10ml光反应器皿(青霉素小瓶)中,加入10.4mg(0.1mmol)苯乙烯,16.05mg(0.15mmol)间甲基苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,3mg(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为30%。核磁数据分析为:1hnmr(600mhz,chloroform-d)δh7.51(d,j=7.5hz,2h),7.37–7.28(m,5h),7.26(d,j=11.1hz,4h),6.94(t,j=7.8hz,1h),6.49(d,j=7.5hz,1h),6.30(s,1h),6.22(d,j=8.1hz,1h),4.47(d,j=4.2hz,1h),4.39(s,1h),3.34(dd,j=12.6,4.8hz,1h),3.21(dd,j=12.7,8.7hz,1h),2.19(s,3h).
13cnmr(151mhz,chloroform-d)δc147.06,142.75,138.84,133.50,129.43,129.27,128.98,128.82,127.53,127.48,126.35,118.78,114.59,110.71,57.80,36.43,21.61.
实施例7
向10ml光反应器皿(青霉素小瓶)中,加入10.4mg(0.1mmol)苯乙烯,22.35mg(0.15mmol)邻叔丁基苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,3mg(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为41%。核磁数据分析为:1hnmr(600mhz,chloroform-d)δh7.48–7.46(m,2h),7.33(d,j=8.0hz,2h),7.29(t,j=7.3hz,2h),7.26–7.22(m,5h),6.88(t,j=7.7hz,1h),6.64(t,j=7.5hz,1h),6.26(d,j=8.1hz,1h),4.87(s,1h),4.56(dd,j=8.6,4.2hz,1h),3.45(dd,j=12.4,4.2hz,1h),3.32–3.28(m,1h),1.54(s,9h).
13cnmr(151mhz,chloroform-d)δc144.53,142.73,133.76,133.18,129.28,129.26,128.89,127.48,127.40,126.86,126.30,126.22,117.29,113.09,56.97,37.00,34.41,30.16.
实施例8
向10ml光反应器皿(青霉素小瓶)中,加入10.4mg(0.1mmol)苯乙烯,20.7mg(0.15mmol)间硝基苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,3mg(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为99%。核磁数据分析为:1hnmr(600mhz,chloroform-d)δh7.75–7.12(m,13h),6.66(d,j=9.0hz,1h),4.80(s,1h),4.47(s,1h),3.28(dd,j=13.3,7.1hz,2h).
13cnmr(151mhz,chloroform-d)δc149.06,147.70,141.30,133.65,129.58,129.38,129.01,128.65,127.93,127.80,126.08,119.19,112.36,107.69,57.75,36.00.
实施例9
向10ml光反应器皿(青霉素小瓶)中,加入10.4mg(0.1mmol)苯乙烯,16.05mg(0.15mmol)n-甲基苯胺化合物,18.78mg(0.06mmol)二苯基二硒醚,3mg(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为70%。核磁数据分析为:1hnmr(600mhz,chloroform-d)δh7.48(dd,j=7.1,2.3hz,2h),7.34–7.17(m,10h),6.75(t,j=8.4hz,3h),5.24–5.17(m,1h),3.61–3.48(m,2h),2.67(s,3h).
13cnmr(151mhz,chloroform-d)δc150.12,139.79,133.36,130.15,129.18,129.14,128.52,127.47,127.39,127.20,117.42,113.70,61.93,31.85,30.24.
实施例10
向10ml光反应器皿(青霉素小瓶)中,加入10.4mg(0.1mmol)苯乙烯,17.85mg(0.15mmol)苯骈三氮唑化合物,18.78mg(0.06mmol)二苯基二硒醚,3mg(0.01mmol)febr3和1ml乙酸乙酯,用胶塞和封口膜密封后,在室温条件下,置于15w蓝色leds灯下光照反应24h。用tlc监测反应进度。
后处理:反应结束后,反应溶剂经旋转蒸发仪浓缩旋干后,再以体积比100:1-50:1的石油醚:乙酸乙酯的混合溶液作为洗脱剂,进行硅胶柱层析纯化分离,得到相应的双取代n-(1-苯基-2-(苯硒基)乙基)苯胺类衍生物,其反应式为:
产物为无色粘稠状液体,纯度为99%,产率为60%。核磁数据分析为:1hnmr(600mhz,chloroform-d)δh8.04(d,j=8.2hz,1h),7.43(d,j=7.3hz,2h),7.38–7.29(m,6h),7.28(d,j=8.2hz,2h),7.24(d,j=7.5hz,3h),5.88–5.82(m,1h),4.29–4.23(m,1h),3.82(dd,j=13.0,5.5hz,1h).
13cnmr(151mhz,chloroform-d)δc146.11,138.40,133.71,133.08,129.30,129.02,128.93,128.76,127.75,127.30,126.90,124.00,120.09,109.56,63.60,32.55.
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
- 还没有人留言评论。精彩留言会获得点赞!