3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3H)-酮化合物的合成及应用的制作方法
本发明属于有机氟的化学合成技术领域,具体涉及一种铜催化合成3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物的方法,及其在杀虫杀菌中的应用。
背景技术:
杂环化合物在医药、农药以及多功能材料等领域有着广泛的应用。将三氟甲基引入到杂环分子中能增加其亲脂性,从而使其在生物体内对膜、组织的穿透能力增强,从而提高了其在生物体内的吸收和传输速度,这在药物分子设计中尤为重要。因此研究如何高效、选择性地往杂环分子中引入多氟烷基,成为有机合成氟化学的重要课题。往噁二唑酮类化合物上引入强脂溶性的多氟烷基,有可能明显改善该类分子的生物活性,表现出和非氟有机杂环分子不同的药理活性,具有重要的理论研究意义和实际应用价值。本发明提供了一种铜催化合成3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物的方法,及其在杀虫、杀菌中的应用。
技术实现要素:
本发明的目的在于提供一种铜催化合成3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物的方法,该方法步骤简便、原料易得,反应体系对n-芳基悉尼酮有广泛的适用范围和丰富的官能团容忍性。所得含氟化合物对小菜蛾、桃蚜、松材线虫等具有很好的杀灭活性,对小麦白粉病菌具有良好的杀菌活性,可作为一种潜在的杀虫、杀菌剂。
为实现上述目的,本发明采用如下技术方案:
一种铜催化合成3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物的方法,其是以铜盐为催化剂,双氮化合物为配体,n-芳基悉尼酮为原料,多氟烷基羧酸酐为多氟烷基源,在氧化剂存在的条件下经反应制得所述3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物;其反应式为:
其中,所述铜盐为cui、cubr、cuscn、cu(otf)2、cu(oac)2中的任意一种,优选为cui。
所述双氮化合物为2,2-联吡啶、邻菲罗啉、四甲基乙二胺中的任意一种。
所述n-芳基悉尼酮为下述式1-式29中的任意一种:
所述多氟烷基羧酸酐为三氟乙酸酐、二氟乙酸酐、五氟丙酸酐中的任意一种。
所述氧化剂为二乙酸碘苯、对苯醌、2,3-二氯-5,6-二氰对苯醌、四氯苯醌、过氧叔丁醇中的任意一种。
进一步地,当rf=cf3,所述3-芳基-5-多氟甲基-1,3,4-噁二唑-2-(3h)-酮化合物为下述式1-式29中的任意一种:
当rf=cf2h,所述3-芳基-5-多氟甲基-1,3,4-噁二唑-2-(3h)-酮化合物为下述式1-式9中的任意一种:
当rf=c2f5,所述3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物为下述式1-式3中的任意一种:
所述3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物的合成方法具体步骤如下:在氮气气氛中,向带有磁力搅拌装置的容器中加入铜盐、双氮化合物、n-芳基悉尼酮、多氟烷基羧酸酐、氧化剂以及溶剂,混合均匀后关好塞子,将其于100-120℃下搅拌反应1-12小时后,用100-200目硅胶过滤,二氯甲烷冲洗,合并有机相,然后旋蒸除去有机溶剂;得到的粗产物以正戊烷-二氯甲烷(20:1,v/v)或正戊烷-乙酸乙酯(80:1,v/v)为洗脱剂进行洗脱进行硅胶柱层析分离,得到所述3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物。
所用铜盐、双氮化合物、n-芳基悉尼酮、多氟烷基羧酸酐、氧化剂、溶剂的摩尔比为(0.01-0.1):(0.01-0.1):(0.1-1):(0.35-3.5):(0.2-2):(9-100);其中,所述溶剂为甲苯、二甲基甲酰胺、二甲基亚砜、二恶烷中的任意一种,优选为甲苯。
所制备的3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物对小麦白粉病菌及小菜蛾、桃蚜、松材线虫等具有很好杀灭活性,可用于作为潜在的含氟杀虫杀菌剂。
本发明的有益效果在于:
本发明以简单易得的n-芳基悉尼酮化合物等为原料,廉价的铜盐为催化剂,2,2-联吡啶等双氮化合物为配体,通过反应合成3-芳基-5-多氟烷基-1,3,4-噁二唑-2-(3h)-酮化合物。该方法步骤简便、原料易得,反应体系对n-芳基悉尼酮底物具有广泛的官能团容忍性和良好的化学选择性。所得多氟烷基化合物对小菜蛾、桃蚜、松材线虫等具有很好杀灭活性,在600mg/l剂量下,对害虫的死亡率高达100%,且在200mg/l剂量下对小麦白粉病的杀菌活性高达100%,可作为一种潜在的含氟杀虫、杀菌剂。
附图说明
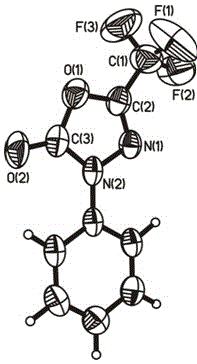
图1为实施例14制得的3-芳基-5-三氟甲基-1,3,4-噁二唑-2-(3h)-酮的单晶结构图。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
实施例1
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率86%)。1hnmr(400mhz,cdcl3)δ7.70(d,j=7.2hz,2h),7.29(d,j=7.7hz,2h),2.41(s,2h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f).13cnmr(101mhz,cdcl3)δ148.7(s),143.9(q,j=46.3hz),137.4(s),132.5(s),129.9(s),118.6(s),115.3(q,j=271.3hz),20.9(s)。
实施例2
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于55%。nmr数据见实施例1。
实施例3
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol醋酸铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于60%。nmr数据见实施例1。
实施例4
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol硫氢酸亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于80%。nmr数据见实施例1。
实施例5
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol三氟甲烷磺酸铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于80%。nmr数据见实施例1。
实施例6
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol醋酸铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、12mmol二恶烷,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于90%。nmr数据见实施例1。
实施例7
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol醋酸铜、0.01mmol邻菲罗啉、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于80%。nmr数据见实施例1。
实施例8
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol醋酸铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于85%。nmr数据见实施例1。
实施例9
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmol(4-甲基苯基)悉尼酮,0.01mmol醋酸铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、13mmoln,n-二甲基甲酰胺,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得3-(4-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于90%。nmr数据见实施例1。
实施例10
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-甲基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(2-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率80%)。1hnmr(400mhz,cdcl3)δ7.56–7.11(m,4h),2.35(s,1h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f).13cnmr(101mhz,cdcl3)δ150.1(s),144.5(q,j=46.1hz),135.1(s),132.6(s),131.7(s),130.3(s),127.1(s),126.4(s),115.3(q,j=271.4hz),17.8(s)。
实施例11
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-甲基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol二乙酸碘苯、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得3-(2-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于85%。nmr数据见实施例10。
实施例12
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-甲基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol二乙酸碘苯、12mmol二恶烷,于100℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得3-(2-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于80%。nmr数据见实施例10。
实施例13
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-甲基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol二乙酸碘苯、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得3-(2-甲苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于85%。nmr数据见实施例10。
实施例14
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-芳基悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-芳基-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率90%)。1hnmr(400mhz,cdcl3)δ7.78(d,j=8.0hz,2h),7.44(t,j=7.9hz,2h),7.32(t,j=7.4hz,1h).19fnmr(376mhz,cdcl3)δ-68.5(s,3f).13cnmr(101mhz,cdcl3)δ148.5(s),144.0(q,j=46.3hz),135.0(s),129.3(s),127.1(s),118.3(s),115.4(q,j=271.2hz)。
实施例15
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-芳基悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol对苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得3-芳基-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于95%。nmr数据见实施例14。
实施例16
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-芳基悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol二乙酸碘苯、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得3-芳基-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮的19f产率大于75%。nmr数据见实施例14。
实施例17
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3,4-二甲基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于85%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(3,4-二甲基苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率70%)。1hnmr(400mhz,cdcl3)δ7.59(s,1h),7.54(d,j=8.2hz,1h),7.24(d,j=8.2hz,1h),2.35(s,3h),2.32(s,3h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ148.8(s),143.9(q,j=46.4hz),138.1(s),136.2(s),132.7(s),130.4(s),119.9(s),116.3(s),115.3(q,j=271.4hz),19.9(s),19.3(s)。
实施例18
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-氰基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol邻菲罗啉、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于110℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到4-(2-氧代-5-(三氟甲基)-1,3,4-恶二唑-3(2h)-基)苯甲腈(分离产率95%)。1hnmr(400mhz,cdcl3)δ8.05(d,j=7.4hz,2h),7.82(d,j=8.4hz,2h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ148.0(s),144.9(q,j=46.6hz),138.2(s),133.7(s),118.5(s),117.8(s),115.1(q,j=272.1hz),111.0(s)。
实施例19
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-氰基苯基)悉尼酮,0.01mmol硫氢酸亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol苯醌、13mmoln,n-二甲基甲酰胺,于100℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(2-氧代-5-(三氟甲基)-1,3,4-恶二唑-3(2h)-基)苯甲腈(分离产率90%)。1hnmr(400mhz,cdcl3)δ8.18(d,j=11.9hz,2h),7.66(s,2h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ148.2(s),144.8(q,j=46.7hz),135.7(s),130.7(s),130.6(s),122.2(s),121.5(s),117.5(s),115.1(q,j=272.0hz),113.8(s)。
实施例20
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-氰基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol过氧叔丁醇、13mmoln,n-二甲基甲酰胺,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到2-(2-氧代-5-(三氟甲基)-1,3,4-恶二唑-3(2h)-基)苯甲腈(分离产率80%)。1hnmr(400mhz,cdcl3)δ8.13(d,j=7.1hz,2h),7.68–7.60(m,2h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f).13cnmr(101mhz,cdcl3)δ148.2(s),144.7(q,j=46.8hz),135.7(s),130.7(s),130.6(s),122.3(s),121.5(s),117.5(s),115.1(q,j=271.9hz),113.8(s)。
实施例21
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-硝基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol四甲基乙二胺、0.35mmol三氟乙酸酐、0.2mmol2,3-二氯-5,6-二氯对苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(3-硝基苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率93%)。1hnmr(400mhz,dmso)δ8.54(s,1h),8.26(d,j=8.1hz,1h),8.18(d,j=8.2hz,1h),7.89(t,j=8.2hz,1h).19fnmr(376mhz,dmso)δ-68.0(s,3f).13cnmr(101mhz,dmso)δ149.3(s),148.6(s),143.7(q,j=45.6hz),136.2(s),131.9(s),125.1(s),122.1(s),115.7(q,j=270.7hz),113.5(s)。
实施例22
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-甲氧基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应8h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-甲氧基苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率82%)。1hnmr(400mhz,cdcl3)δ7.71(d,j=8.7hz,2h),7.00(d,j=8.7hz,2h),3.87(s,3h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ158.8(s),148.9(s),143.9(q,j=46.1hz),128.0(s),120.8(s),115.3(q,j=271.5hz),114.6(s),55.5(s)。
实施例23
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-氟苯基)悉尼酮,0.01mmol硫氢酸亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应7h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-氟苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率93%)。1hnmr(400mhz,cdcl3)δ7.82(dd,j=7.2,4.7hz,2h),7.20(t,j=8.0hz,2h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f),-113.5–-113.6(m,1f).13cnmr(101mhz,cdcl3)δ161.3(d,j=248.1hz),148.6(s),144.2(q,j=46.4hz),131.0(d,j=3.1hz),120.7(d,j=8.5hz),116.4(d,j=23.3hz),115.2(q,j=271.6hz)。
实施例24
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-氯苯基)悉尼酮,0.01mmol醋酸铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(2-氯苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率93%)。1hnmr(400mhz,cdcl3)δ7.58(d,j=7.8hz,1h),7.51(t,j=8.0hz,2h),7.44(dd,j=15.6,8.1hz,1h).19fnmr(376mhz,cdcl3)δ-68.5(s,3f).13cnmr(101mhz,cdcl3)δ149.6(s),144.7(q,j=46.4hz),132.0(s),131.8(s),131.2(s),130.9(s),128.8(s),128.0(s),115.2(q,j=271.5hz)。
实施例25
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-氯苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol醋酸银、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-氯苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率95%)。1hnmr(400mhz,cdcl3)δ7.79(d,j=8.9hz,2h),7.45(d,j=8.5hz,2h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f).13cnmr(101mhz,cdcl3)δ148.4(s),144.3(q,j=46.5hz),133.4(s),133.0(s),129.6(s),119.7(s),115.2(q,j=271.7hz)。
实施例26
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-氯苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol醋酸铜、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(3-氯苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率93%)。1hnmr(400mhz,cdcl3)δ7.88(s,1h),7.78(d,j=8.2hz,1h),7.43(t,j=8.1hz,1h),7.34(d,j=8.0hz,1h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f).13cnmr(101mhz,cdcl3)δ148.27(s),144.38(q,j=46.6hz),135.84(s),135.42(s),130.57(s),127.48(s),118.62(s),116.33(s),115.18(q,j=271.8hz)。
实施例27
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-氯-4-甲基苯基)悉尼酮,0.01mmol三氟甲烷磺酸铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于110℃油浴条件下在密闭体系中搅拌反应9h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(3-氯-4-甲基苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率72%)。1hnmr(400mhz,cdcl3)δ7.86(s,1h),7.66(d,j=8.3hz,1h),7.35(d,j=8.4hz,1h),2.43(s,3h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ148.4(s),144.2(q,j=46.6hz),135.5(s),135.3(s),133.5(s),131.5(s),119.1(s),116.6(s),112.5(q,j=271.8hz),19.7(s)。
实施例28
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-氯-3-氟苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-氯-3-氟苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率86%)。1hnmr(400mhz,cdcl3)δ7.74(d,j=10.9hz,1h),7.66(d,j=8.9hz,1h),7.53(t,j=8.2hz,1h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f),-109.0–-113.4(m,1f).13cnmr(101mhz,cdcl3)δ158.2(d,j=250.5hz),148.1(s),144.5(q,j=46.7hz),134.4(d,j=9.5hz),131.5(d,j=0.5hz),119.8(d,j=17.7hz),115.1(q,j=271.9hz),114.4(d,j=4.0hz),107.3(d,j=27.3hz)。
实施例29
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-溴苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol对苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(2-溴苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率80%)。1hnmr(400mhz,cdcl3)δ7.76(d,j=8.0hz,1h),7.50(dt,j=15.9,7.9hz,2h),7.42(t,j=7.5hz,1h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f).13cnmr(101mhz,cdcl3)δ149.6(s),144.6(q,j=46.4hz),134.1(s),132.8(s),132.1(s),129.2(s),128.7(s),121.7(s),115.2(q,j=271.6hz)。
实施例30
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-溴苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol对苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-溴苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率72%)。1hnmr(400mhz,cdcl3)δ7.76(d,j=8.8hz,1h),7.63(d,j=8.9hz,1h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ148.4(s),144.3(q,j=46.6hz),134.0(s),132.6(s),120.9(s),120.0(s),115.2(q,j=271.7hz)。
实施例31
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-溴苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(3-溴苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率90%)。1hnmr(400mhz,cdcl3)δ8.04(s,1h),7.84(d,j=8.1hz,1h),7.50(d,j=7.8hz,1h),7.38(t,j=8.0hz,1h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ148.3(s),144.4(q,j=46.6hz),135.9(s),130.8(s),130.5(s),123.2(s),121.5(s),116.9(s),115.2(q,j=271.8hz)。
实施例32
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-叔丁基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于120℃油浴条件下在密闭体系中搅拌反应12h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-叔丁基苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率70%)。1hnmr(400mhz,cdcl3)δ7.75(d,j=7.7hz,2h),7.53(d,j=8.1hz,2h),1.39(s,9h).19fnmr(376mhz,cdcl3)δ-68.37(s,3f).13cnmr(101mhz,cdcl3)δ150.7(s),148.8(s),144.0(q,j=46.3hz),132.4(s),126.3(s),118.5(s),115.4(q,j=271.3hz),34.6(s),31.2(s)。
实施例33
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-甲氧基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(2-甲氧基苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率69%)。1hnmr(400mhz,cdcl3)δ7.50(t,j=8.0hz,1h),7.41(d,j=8.1hz,1h),7.09(t,j=7.3hz,2h),3.91(s,3h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f).13cnmr(101mhz,cdcl3)δ155.0(s),150.3(s),144.4(q,j=46.0hz),132.0(s),128.2(s),122.3(s),120.9(s),115.4(q,j=271.3hz),112.5(s),56.0(s)。
实施例34
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-甲基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol四甲基乙二胺、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(3-甲基苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率72%)。1hnmr(400mhz,cdcl3)δ7.64(d,j=9.8hz,1h),7.38(t,j=7.8hz,1h),7.18(d,j=7.5hz,1h),2.45(s,1h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ148.7(s),144.0(q,j=46.3hz),139.7(s),134.8(s),129.3(s),128.2(s),119.2(s),115.8(s),115.3(q,j=271.4hz),21.46(s)。
实施例35
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-硝基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于85%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(12:1,v/v)洗脱,得到3-(4-硝基苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率91%)。1hnmr(400mhz,cdcl3)δ8.38(d,j=9.0hz,2h),8.11(d,j=9.0hz,2h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f).13cnmr(101mhz,cdcl3)δ148.0(s),146.0(s),145.0(q,j=46.8hz),139.65(s),125.3(s),118.4(s),115.1(q,j=272.1hz)。
实施例36
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-氟苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(3-氟苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率80%)。1hnmr(400mhz,cdcl3)δ7.68(d,j=8.3hz,1h),7.63(d,j=9.9hz,1h),7.48(dd,j=14.5,8.1hz,1h),7.07(td,j=8.6,2.0hz,1h).19fnmr(376mhz,cdcl3)δ-68.4(s,3f),-109.6–-109.7(m,1f).13cnmr(101mhz,cdcl3)δ162.9(d,j=247.8hz),148.3(s),144.3(q,j=46.6hz),136.1(d,j=10.7hz),131.0(d,j=9.0hz),115.2(q,j=271.6hz),114.3(d,j=21.2hz),113.8(d,j=3.3hz),106.2(d,j=27.7hz)。
实施例37
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2-氟苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(5:1,v/v)洗脱,得到3-(2-氟苯基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率40%)。1hnmr(400mhz,cdcl3)δ7.51(dt,j=13.1,7.6hz,2h),7.34–7.25(m,2h).19fnmr(376mhz,cdcl3)δ-68.6(s,3f),-119.8–-119.9(m,1f).13cnmr(101mhz,cdcl3)δ156.4(d,j=255.7hz),149.5(s),144.9(q,j=46.5hz),131.7(d,j=7.8hz),127.0(s),124.9(d,j=4.0hz),121.7(d,j=11.8hz),117.2(d,j=18.9hz),115.2(q,j=271.5hz)。
实施例38
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(萘-1-基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(萘-1-基)-5-(三氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率93%)。1hnmr(400mhz,cdcl3)δ7.95(dd,j=12.5,8.1hz,2h),7.83(d,j=8.0hz,1h),7.63(d,j=7.6hz,1h),7.58(dd,j=10.5,6.1hz,2h),7.50(t,j=7.8hz,1h).19fnmr(376mhz,cdcl3)δ-68.2(s,3f).13cnmr(101mhz,cdcl3)δ150.7(s),144.7(q,j=46.2hz),134.3(s),130.9(s),129.7(s),128.5(s),128.4(s),127.7(s),127.0(s),124.9(s),124.8(s),121.9(s),115.4(q,j=271.5hz)。
实施例39
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(萘-2-基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应5h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(萘-2-基)-5-(三氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率93%)。1hnmr(400mhz,cdcl3)δ8.21(s,1h),7.87(dd,j=15.8,9.3hz,4h),7.58–7.50(m,2h).19fnmr(376mhz,cdcl3)δ-68.2(s,3f).13cnmr(101mhz,cdcl3)δ148.6(s),144.0(q,j=46.4hz),133.0(s),132.3(s),131.8(s),129.6(s),128.1(s),127.7(s),127.2(s),126.6(s),116.8(s),116.3(s),115.4(q,j=271.4hz)。
实施例40
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-苄基悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应11h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-苄基-5-三氟甲基-1,3,4-噁二唑-2-(3h)-酮(分离产率45%)。1hnmr(400mhz,cdcl3)δ7.42(s,5h),4.97(s,2h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ151.5(s),143.7(q,j=46.3hz),133.5(s),129.1(s),129.0(s),128.6(s),115.2(q,j=271.0hz),50.6(s)。
实施例41
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(2,5-二甲基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(2,5-二甲基苯基)-5-三氟甲基-1,3,4-噁二唑-2-(3h)-酮(分离产率70%)。1hnmr(400mhz,cdcl3)δ7.25(d,j=8.2hz,2h),7.20(s,1h),2.39(s,3h),2.30(s,3h).19fnmr(376mhz,cdcl3)δ-68.3(s,3f).13cnmr(101mhz,cdcl3)δ150.1(s),144.4(q,j=46.2hz),137.2(s),132.3(s),131.8(s),131.5(s),131.2(s),126.8(s),115.3(q,j=271.4hz),20.7(s),17.4(s)。
实施例42
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-([1,1'-联苯]-4-基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3–([1,1'-联苯]-4-基)-5-(三氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率90%)。1hnmr(400mhz,cdcl3)δ7.68–7.59(m,1h),7.58–7.51(m,3h),7.48–7.37(m,3h),7.30(d,j=7.1hz,2h).19fnmr(376mhz,cdcl3)δ-68.5(s,3f).13cnmr(101mhz,cdcl3)δ150.1(s),144.1(q,j=46.2hz),140.8(s),140.4(s),137.5(s),131.4(s),131.3(s),130.8(s),128.7(s),128.3(s),128.1(s),127.6(s),115.2(q,j=271.4hz)。
实施例43
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-([1,1'-联苯]-2-基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于80%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,3-([1,1'-联苯]-2-基)-5-(三氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率64%)。1hnmr(400mhz,cdcl3)δ7.68–7.59(m,1h),7.58–7.51(m,3h),7.48–7.37(m,3h),7.30(d,j=7.1hz,2h).19fnmr(376mhz,cdcl3)δ-68.5(s,3f).13cnmr(101mhz,cdcl3)δ150.1(s),144.1(q,j=46.2hz),140.8(s),140.4(s),137.5(s),131.4(s),131.3(s),130.8(s),128.7(s),128.3(s),128.1(s),127.6(s),115.2(q,j=271.4hz)。
实施例44
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(9h-芴-2-基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol三氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(9h-芴-2-基)-5-三氟甲基-1,3,4-噁二唑-2(3h)-酮(分离产率90%)。1hnmr(400mhz,cdcl3)δ7.99(s,1h),7.86–7.78(m,3h),7.58(d,j=7.3hz,1h),7.43(t,j=7.3hz,1h),7.37(t,j=7.4hz,1h).19fnmr(376mhz,cdcl3)δ-68.2(s,3f).13cnmr(101mhz,cdcl3)δ148.8(s),144.5(s),144.0(q,j=46.3hz),143.4(s),141.0(s),140.4(s),133.5(s),127.3(s),127.0(s),125.1(s),120.5(s),120.1(s),117.6(s),115.6(s),115.3(q,j=271.5hz),37.1(s)。
实施例45
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-苯基悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到5-(二氟甲基)-3-苯基-1,3,4-噁二唑-2(3h)-酮(分离产率90%)。1hnmr(400mhz,cdcl3)δ7.84(d,j=8.0hz,2h),7.49(t,j=7.7hz,2h),7.35(t,j=7.4hz,1h),6.56(t,j=51.6hz,1h).19fnmr(376mhz,cdcl3)δ-122.0(d,j=51.6hz,2f).13cnmr(101mhz,cdcl3)δ149.3(s),147.7(t,j=30.6hz),135.2(s),129.4(s),127.1(s),118.5(s),105.5(t,j=241.1hz)。
实施例46
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-氟苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到5-(二氟甲基)-3-(4-氟苯基)-1,3,4-噁二唑-2(3h)-酮(分离产率85%)。1hnmr(400mhz,cdcl3)δ7.87–7.72(m,2h),7.17(t,j=7.9hz,2h),6.56(t,j=51.6hz,1h).19fnmr(376mhz,cdcl3)δ-113.6–-114.7(m),-122.2(d,j=51.5hz,2f).13cnmr(101mhz,cdcl3)δ161.1(d,j=247.4hz),149.3(s),147.8(t,j=30.7hz),131.3(d,j=2.9hz),120.5(d,j=8.4hz),116.3(d,j=23.2hz),105.4(t,j=241.2hz)。
实施例47
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-氯苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-氯苯基)-5-(二氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率85%)。1hnmr(400mhz,cdcl3)δ7.77(d,j=7.5hz,2h),7.43(d,j=7.5hz,2h),6.56(t,j=51.5hz,1h).19fnmr(376mhz,cdcl3)δ-122.2(d,j=51.4hz,2f).13cnmr(101mhz,cdcl3)δ149.0(s),147.9(t,j=30.8hz),133.7(s),132.6(s),129.5(s),119.6(s),105.4(t,j=241.4hz)。
实施例48
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-溴苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、9.5mmol甲苯,于100℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(3-溴苯基)-5-(二氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率86%)。1hnmr(400mhz,cdcl3)δ7.98(s,1h),7.79(d,j=8.0hz,1h),7.44(d,j=7.8hz,1h),7.33(t,j=8.1hz,1h),6.57(t,j=51.5hz,1h).19fnmr(376mhz,cdcl3)δ-122.3(d,j=51.6hz,2f).13cnmr(101mhz,cdcl3)δ148.9(s),148.0(t,j=30.8hz),136.2(s),130.7(s),130.0(s),123.0(s),121.2(s),116.7(s),105.4(t,j=241.5hz)。
实施例49
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-溴苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于100℃油浴条件下在密闭体系中搅拌反应5h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(20:1,v/v)洗脱,得到3-(4-溴苯基)-5-(二氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率85%)。1hnmr(400mhz,cdcl3)δ7.68(t,j=8.5hz,2h),7.55(dd,j=8.7,7.1hz,2h),6.57(t,j=51.5hz,1h).19fnmr(376mhz,cdcl3)δ-122.3(d,j=51.5hz,2f).13cnmr(101mhz,cdcl3)δ149.0(s),147.9(t,j=30.7hz),134.2(s),132.4(s),120.3(s),119.8(s),105.4(t,j=242.5hz)。
实施例50
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-氯-3-氟苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(4-氯-3-氟苯基)-5-(二氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率88%)。1hnmr(400mhz,cdcl3)δ7.73(d,j=10.0hz,1h),7.65(d,j=8.9hz,1h),7.51(t,j=8.0hz,1h),6.57(t,j=51.5hz,1h).19fnmr(376mhz,cdcl3)δ-111.3(dd,j=18.0,8.9hz,1f),-122.28(d,j=51.4hz,2f).13cnmr(101mhz,cdcl3)δ158.2(d,j=249.9hz),148.7(s),148.1(t,j=30.9hz),134.7(d,j=9.4hz),131.4(s),119.4(d,j=17.5hz),114.3(d,j=4.0hz),107.2(d,j=27.2hz),105.3(t,j=241.9hz)。
实施例51
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-([1,1'-联苯]-4-基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-([1,1'-联苯]-4-基)-5-(二氟甲基)-1,3,4-噁二唑-2(3h)-酮(分离产率88%)。1hnmr(400mhz,cdcl3)δ7.92(d,j=7.2hz,2h),7.72(d,j=7.2hz,2h),7.63(d,j=7.6hz,2h),7.49(t,j=7.2hz,2h),7.45–7.35(m,1h),6.58(t,j=51.6hz,1h).19fnmr(376mhz,cdcl3)δ-121.9(d,j=51.6hz,2f).13cnmr(101mhz,cdcl3)δ149.3(s),147.8(t,j=30.6hz),140.0(s),139.7(s),134.3(s),129.0(s),128.0(s),127.8(s),127.0(s),118.8(s),105.5(t,j=241.2hz)。
实施例52
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-氰基苯基)悉尼酮,0.01mmol碘化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于95%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(5-(二氟甲基)-2-氧代-1,3,4-噁二唑-3-(2h)-基)苯甲腈(分离产率80%)。1hnmr(400mhz,cdcl3)δ8.26–8.08(m,2h),7.69–7.55(m,2h),6.60(t,j=51.5hz,1h).19fnmr(376mhz,cdcl3)δ-122.4(d,j=51.6hz,2f).13cnmr(101mhz,cdcl3)δ148.8(s),148.4(t,j=30.9hz),135.9(s),130.6(s),130.3(s),122.1(s),121.3(s),117.6(s),113.8(s),105.3(t,j=242.0hz)。
实施例53
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-甲酸甲酯基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol二氟乙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(5-(二氟甲基)-2-氧代-1,3,4-噁二唑-3-(2h)-基)苯甲酸甲酯(分离产率85%)。1hnmr(400mhz,cdcl3)δ8.40(s,1h),8.03(d,j=8.2hz,1h),7.96(d,j=7.7hz,1h),7.53(t,j=7.9hz,1h),6.59(t,j=51.5hz,1h),3.94(s,3h).19fnmr(376mhz,cdcl3)δ-122.3(d,j=51.5hz,3f).13cnmr(101mhz,cdcl3)δ165.9(s),149.1(s),148.0(t,j=30.8hz),135.4(s),131.6(s),129.6(s),127.9(s),122.3(s),119.3(s),105.5(t,j=241.3hz),52.5(s)。
实施例54
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(萘-2-基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol五氟丙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(萘-2-基)-5-(五氟乙基)-1,3,4-噁二唑-2(3h)-酮(分离产率85%)。1hnmr(400mhz,cdcl3)δ8.31(s,1h),7.96(d,j=9.3hz,2h),7.90(t,j=7.8hz,2h),7.63–7.51(m,2h).19fnmr(376mhz,cdcl3)δ-83.1(s,3f),-118.4(s,2f).13cnmr(101mhz,cdcl3)δ148.9(s),143.9(t,j=32.7hz),133.0(s),132.3(s),131.94(s),129.7(s),128.2(s),127.8(s),127.3(s),126.7(s),116.9(s),116.6(s),117.5(qt,j=287.0,34.7hz),106.1(tq,j=257.9,41.7hz)。
实施例55
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(3-硝基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol五氟丙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(3-硝基)-5-(五氟乙基)-1,3,4-噁二唑-2(3h)-酮(分离产率80%)。1hnmr(400mhz,cdcl3)δ8.70(s,1h),8.27(d,j=8.2hz,1h),8.21(d,j=8.2hz,1h),7.75(d,j=8.2hz,1h).19fnmr(376mhz,cdcl3)δ-83.3(s,3f),-118.8(s,2f).13cnmr(101mhz,cdcl3)δ148.8(s),148.3(s),144.6(t,j=32.9hz),135.8(s),130.7(s),123.7(s),121.9(s),117.3(qt,j=287.0,34.5hz),113.5(s),106.0(tq,j=258.8,42.0hz)。
实施例56
氮气保护气氛下,在一个置有聚四氟乙烯磁力搅拌子的5ml反应管中,加入0.1mmoln-(4-叔丁基苯基)悉尼酮,0.01mmol溴化亚铜、0.01mmol2,2’-联吡啶、0.35mmol五氟丙酸酐、0.2mmol四氯苯醌、14mmol二甲基亚砜,于110℃油浴条件下在密闭体系中搅拌反应10h后冷却至室温,以三氟甲氧基苯为内标,测得19f产率大于90%。合并有机相,用100-200目硅胶过滤,二氯甲烷冲洗,旋蒸除去有机溶剂得到粗产物,粗产物采用硅胶柱层析,以正戊烷和二氯甲烷(10:1,v/v)洗脱,得到3-(4-叔丁基)-5-(五氟乙基)-1,3,4-噁二唑-2(3h)-酮(分离产率80%)。1hnmr(400mhz,cdcl3)δ7.76(d,j=7.4hz,2),7.53(d,j=7.5hz,1h),1.39(s,5h).19fnmr(376mhz,cdcl3)δ-83.3(s,3f),-118.5(s,2f).13cnmr(101mhz,cdcl3)δ150.8(s),148.9(s),117.5(qt,j=286.8,32.6hz),132.4(s),126.3(s),118.5(s),106.1(tq,j=257.7,41.8hz),34.6(s),31.2(s)。
杀虫活性试验
应用实施例1:杀桃蚜的测定方法
在培养皿(ф=6cm)底覆一层滤纸,滴加适量自来水保湿,备用。从培养桃蚜的甘蓝植株上剪取大小适宜且长有30-50头桃蚜的甘蓝叶片,去除翅蚜及正面的蚜虫,叶背向上置于培养皿内,作为测定寄主和靶标。按试验设计,用airbrush手持式喷雾设备将600mg/l化合物3-(3-氯苯基)-5-三氟甲基-1,3,4-噁二唑-2-(3h)-酮待测液(溶剂和0.1%的吐温-80自来水配制)均匀喷雾于叶片正反面(喷雾压力:0.7kg/cm2,喷液量:0.5ml;喷雾距离:15-20cm),另设清水处理作为空白对照。将培养皿移至标准观察室内(温度为23-25℃,rh=40-60%,l/d为13h/11h)培养,72h后进行调查,记录试虫的死虫与活虫数。结果显示化合物组死亡率为100%。
应用实施例2:杀小菜蛾的测定方法
在培养皿(ф=6cm)底覆一层滤纸,滴加适量自来水保湿,备用。取温室培养的甘蓝叶片,除去表面蜡质层,用打孔器制成甘蓝叶碟(ф=3cm),叶背向上置于培养皿中。按试验设计,用airbrush手持式喷雾设备将600mg/l化合物3-(4-氯-3-氟苯基)-5-三氟甲基-1,3,4-噁二唑-2-(3h)-酮待测液(溶剂和0.1%的吐温-80自来水配制)均匀喷雾于叶片正反面(喷雾压力:0.7kg/cm2,喷液量:0.5ml;喷雾距离:15-20cm),另设清水处理作为空白对照。待叶片自然阴干后,接入小菜蛾3龄幼虫。将培养皿移至标准观察室内(温度为23-25℃,rh=40-60%,l/d为13h/11h)培养,72h后进行调查,记录试虫的死虫与活虫数。结果显示化合物组死亡率为70%。
应用实施例3:杀线虫的测定方法
将松材线虫从培养基中分离出来,浓度以200-300条/ml为宜。一般先吸取50μl的线虫分离液,于显微镜下观察数其数量,50μl中线虫数量控制在10-15条,若不是该浓度则做相应调整。
用20ml乙酸乙酯,80ml蒸馏水,100μl曲拉通配成3-(4-氯苯基)-5-三氟甲基-1,3,4-噁二唑-2-(3h)-酮溶液后稀释待测液,再进一步稀释成5-6个不同浓度梯度的供试药液,备用。在96孔板的每孔中加入100μl松材线虫悬浮液,再分别加入10μl不同浓度的供试药液,每组3个重复。对照组则加10μl空白溶液。封上封口膜,做好标记,将96孔板置于30℃恒温箱中。24h后,在体视镜下对松材线虫的存活和死亡情况进行记录(线虫死亡、存活的判定方法:凡虫体呈波浪形、卷曲形、“s”形、螺旋形,在运动的均视为存活。凡虫体僵直呈针状或呈“j”形或“c”形或者虫体壁无折光性,且不运动的均视为死亡)。结果显示,对照组线虫基本能正常生长,在样品浓度为10mg/l时,杀虫死亡率为40%。
应用实施例4:杀线虫的测定方法
将松材线虫从培养基中分离出来,浓度以200-300条/ml为宜。一般先吸取50μl的线虫分离液,于显微镜下观察数其数量,50μl中线虫数量控制在10-15条,若不是该浓度则做相应调整。
用20ml乙酸乙酯,80ml蒸馏水,100μl曲拉通配成3-(3-溴苯基)-5-三氟甲基-1,3,4-噁二唑-2-(3h)-酮溶液后稀释待测液,再进一步稀释成5-6个不同浓度梯度的供试药液,备用。在96孔板的每孔中加入100μl松材线虫悬浮液,再分别加入10μl不同浓度的供试药液,每组3个重复。对照组则加10μl空白溶液。封上封口膜,做好标记,将96孔板置于30℃恒温箱中。24h后,在体视镜下对松材线虫的存活和死亡情况进行记录(线虫死亡、存活的判定方法:凡虫体呈波浪形、卷曲形、“s”形、螺旋形,在运动的均视为存活。凡虫体僵直呈针状或呈“j”形或“c”形或者虫体壁无折光性,且不运动的均视为死亡)。结果显示,对照组线虫基本能正常生长,在样品浓度为10mg/l时,杀虫死亡率为55%。
应用实施例5:杀小麦白粉病的测定方法
取温室内培养的生长一致的两叶期小麦编号后备用。准确称取3-(4-甲氧基苯基)-5-三氟甲基-1,3,4-噁二唑-2-(3h)-酮,加入溶剂和0.1%的吐温-80自来水后,配制成400mg/l的药液20ml,用于杀菌活性测定。采用作物喷雾机对上述试验材料进行喷雾处理(喷雾器类型为立体作物喷雾机,喷雾压力为1.5kg/cm2,喷液量约为675l/hm2),处理后,自然风干,24h后接种病原菌,即将小麦白粉病菌孢子抖落在小麦上,并在温室内培养,5-7d后调查化合物的杀菌活性。
根据对照的发病程度,采用目测方法,调查试验样品的杀菌活性,结果用100-0来表示,以“100”级代表无病,“0”级代表最严重的发病程度。结果显示杀菌活性100%。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!