抗生素筛选HEK细胞的方法与流程
本发明涉及一种抗生素筛选hek细胞的方法,尤其涉及一种通过抗生素筛选经过基因工程改造的hek细胞的方法,以及一种根据该方法构建hek细胞池的方法,以稳定地表达目的蛋白。
背景技术:
在重组蛋白质药物生产领域,cho细胞一直是主流细胞系。由于cho细胞稳定细胞株的构建工艺比较成熟,其安全性得到保证,因此被广泛使用。根据有关数据显示,截至2017年,现有上市的抗体药物中有46个(59%)采用cho细胞表达,其中,fc融合蛋白是100%通过cho细胞表达。在2017年销售额最高的前10个药物(humira、enbrel、eylea、revlimid、rituxan、remicade、herceptin、eliquis、avastin、xareltotm)中,herceptin、humira、avastin、rituxan等药物都由cho细胞生产。
近年来,利用hek细胞进行产物制备也在生物医药领域中逐渐引起更多的关注。hek细胞为人源性细胞,其表达产物的折叠修饰与糖基化修饰等在翻译后修饰加工更接近人源化蛋白,利用hek细胞进行医用重组蛋白表达,具有一定的优势。然而,与cho细胞相比,hek细胞用于重组蛋白药物生产的频率较低。到2014年为止,只有drotrecoginalfa(2011年撤回)、rfviiifc(重组八因子fc)、rfixfc(重组九因子fc)、dulaglutide被fda批准上市。此应用推广的局限性在一定程度上源于由hek细胞株自身特性而给hek细胞株的构建工艺带来的困难,例如:hek293e细胞在培养的过程中易结团,并且具有较长的倍增时间(约为24h),这均使得筛选细胞株的过程相较于cho细胞来说较复杂。因此,如何解决hek细胞细胞株构建问题,对于使用hek细胞作为宿主细胞生产药物蛋白具有重大意义。
构建稳定细胞池的方法包含多种,如通过重组酶的介导实现目的基因与宿主细胞基因组的重组、杆状病毒介导的基因整合、链霉菌噬菌体介导的基因整合、基于转座子技术的基因整合等。其中,基于转座子技术的基因整合技术通过转座酶的作用,将目的基因插入至基因组的高表达区域,既实现了基因的整合,又可避免“基因沉默”带来的问题,大大地提升了所构建的细胞株的稳定性。近些年在哺乳细胞中运用最广泛的转座系统包括piggybac(pb)、sleepingbeauty(sb)和tol2。其中,piggybac转座系统由于其广泛的宿主性,及高效的基因整合效率,备受人们青睐。
为了获得稳定的细胞池,在现有的通过piggybac转座系统构建技术构建细胞系或者细胞池的方法中,大部分的技术改进都集中在质粒的改造上。例如,在专利号cn105154473a的专利中提出基于piggybac转座子的整合系统构建,即基于piggybac转座子构建合适的核酸载体,使外源基因在宿主细胞中高效安全表达;在专利号cn105255895a的专利中提出将mar-一种dna顺式调控元件-与睡美人转座载体结合,以提高基因的表达水平和蛋白质的翻译水平;在专利号cn105073995a的专利中发明涉及提供参与或作用于介导或影响细胞代谢的代谢途径的核酸构建体和蛋白质以及影响细胞代谢的方法。可见,提供一种高效的建立hek细胞稳定细胞池构建方法是大势所趋,并为进一步从稳定细胞池里筛选得到优质的hek细胞单克隆打下坚实基础。
技术实现要素:
本发明的目的在于建立一种抗生素筛选hek细胞的方法,该方法能够使经过基因工程改造的hek细胞避免因无法直接耐受高浓度的抗生素而活率下降乃至最终死亡,此外,还能够使得该细胞提前进入细胞活率的持续增长期,并使得细胞提前进入较稳定的蛋白表达期,从而缩短研发周期。
本发明的目的还在于建立一种高效地构建hek细胞稳定细胞池的方法,用于稳定地表达目的蛋白。
为了实现上述目的,本发明提供了一种抗生素筛选hek细胞的方法,用于筛选经过基因工程改造的hek细胞,该方法至少包括如下的步骤,即:在所述经过基因工程改造的hek细胞中,先后分次地加入至少具有第一浓度和第二浓度的至少一种抗生素,该第一浓度小于该第二浓度,抗生素的该第一浓度能够富集细胞,抗生素的该第二浓度能够筛选细胞,并且加入该第一浓度与加入该第二浓度所间隔的时间包括细胞培养时间。
在本发明的一个实施例中,该经过基因工程改造的细胞可以为经过转染的hek细胞,尤其是基于piggybac转座系统经过基因重组的hek细胞。
在本发明的一个实施例中,该抗生素可以是嘌呤霉素、氨甲喋呤、潮霉素b、霉酚酸、g418或其组合。
在这里,本领域技术人员应该知晓,分次加入的抗生素浓度范围可以根据所使用的抗生素而有不同。在本发明的一个实施例中,共分两次加入抗生素嘌呤霉素,其中,嘌呤霉素的第一浓度范围为1~9μg/ml,第二浓度范围为10~15μg/ml。在本发明的一个优选实施例中,作为抗生素的嘌呤霉素的浓度加入顺序为:先加入1μg/ml,然后加入10μg/ml的嘌呤霉素。
在本发明的一个实施例中,加入该第一浓度与加入该第二浓度所间隔的时间为24~72小时。
本发明还提供了一种hek细胞的稳定细胞池的构建方法,包括如下步骤:
1)提供具有目的基因的转座子供体质粒;
2)提供hek细胞;
3)将步骤1)中的所述转座子供体质粒转染入步骤2)中所述的hek细胞,并基于piggyback转座系统,获得经过基因重组的hek细胞;
4)通过抗生素筛选经过转染的hek293细胞:在步骤3)中获得的经过转染的hek293细胞中,先后分次地加入至少具有第一浓度和第二浓度的至少一种抗生素,该第一浓度小于该第二浓度,抗生素的该第一浓度能够富集细胞,抗生素的该第二浓度能够筛选细胞,并且加入该第一浓度与加入该第二浓度所间隔的时间包括细胞培养时间。
在本发明的一个实施例中,该抗生素可以是嘌呤霉素、氨甲喋呤、潮霉素b、霉酚酸、g418或其组合。
在本发明的一个实施例中,在步骤4)中,共分两次加入抗生素嘌呤霉素,其中,加入的嘌呤霉素的第一浓度范围为1~9μg/ml,第二浓度范围为10~15μg/ml。在本发明的一个优选实施例中,依次加入作为抗生素的嘌呤霉素的浓度顺序为:先加入1μg/ml,然后加入10μg/ml的嘌呤霉素。
在本发明的一个实施例中,在步骤4)中,加入该第一浓度与加入该第二浓度所间隔的时间为24~72小时。
本发明的技术方案实现了如下的有益效果:
1)由于相较于cho细胞,hek细胞具有较长的倍增时间(约为24h),在进行hek细胞池的抗生素筛选时,如果直接使用高浓度的抗生素进行筛选,细胞会因无法直接耐受高浓度的抗生素而活率下降最终死亡。本发明通过先后分次加入不同浓度的筛选抗生素的方式,成功地构建了表达绿色荧光蛋白和抗体蛋白的hek细胞稳定细胞池。本发明首次发现,通过根据本发明的抗生素筛选方法,能够使得该细胞提前进入细胞活率的持续增长期,进而使得细胞提前进入较稳定的蛋白表达期,从而提前获得可用于蛋白表达的细胞池,缩短研发周期,进而推进实现hek细胞表达重组蛋白药物的愿景。
2)通过根据本发明的方法,利用piggybac转座系统构建了hek稳定细胞池。使用piggybac转座子系统可在3个星期之内完成稳定细胞池构建,经过抗生素筛选后细胞阳性率在99%以上。相比传统的方法,获得细胞池的时间大大缩短。通过piggybac转座子系统产生的重组细胞,由于目的基因靶向整合至宿主细胞基因组高表达区,从而可实现目的基因的高表达。
综上可见,可通过本发明的方法高效地获得高产量、高质量的hek细胞池,实现通过无血清培养悬浮hek293细胞池来稳定表达蛋白质。此外,根据本发明的hek稳定细胞池构建方法,扫除了使用hek细胞作为宿主细胞进行药物研发的障碍,为药物研发开发过程提供更多可能性。
附图说明
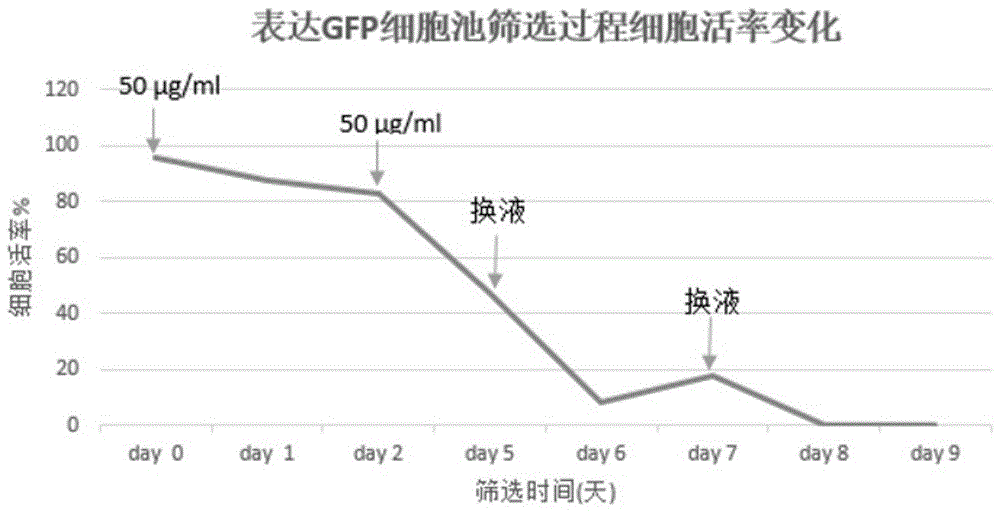
图1为用于表达gfp的hek细胞池筛选过程细胞活率变化的示意图,其中筛选时使用的方法是实施例1中的方法一。
图2为用于表达gfp的hek细胞池筛选过程细胞活率变化的示意图,其中筛选时使用的方法是实施例1中的方法二。
图3为用于表达gfp的hek细胞池筛选过程细胞活率变化的示意图,其中筛选时使用的方法是实施例1中的方法三。
图4为用于表达gfp的hek细胞池筛选过程细胞活率变化的示意图,其中筛选时使用的方法是实施例1中的方法四。
图5为质粒酶切图,其中,a表示重组gfp质粒经限制性内切酶酶切后样品。
图6为质粒酶切图,其中,b表示重组抗体a质粒未经限制性内切酶样品。
图7为用于表达抗体a的hek细胞池筛选过程细胞活率变化的示意图。
图8为流式细胞仪检测结果图,示出了用于表达gfp的hek细胞池筛选过程转染效率检测结果,其中,a表示用于表达gfp的hek细胞池筛选5天所取样品经流式细胞仪检测后结果;b表示用于表达gfp的hek细胞池筛选7天所取样品经流式细胞仪检测后结果;c表示用于表达gfp的hek细胞池筛选10天所取样品经流式细胞仪检测后结果;d表示用于表达gfp的hek细胞池筛选12天所取样品经流式细胞仪检测后结果。
图9为用于表达gfp的hek细胞池筛选过程转染效率变化的示意图。
图10为hek细胞池筛选10天后sds-page电泳图,其中,a泳道表示还原条件下抗体a蛋白质样品;b表示非还原条件下抗体a蛋白质样品。
图11为hek细胞池筛选14天后sds-page电泳图,其中,a泳道表示还原条件下抗体a蛋白质样品;b表示非还原条件下抗体a蛋白质样品。
图12为用于表达gfp的hek细胞池筛选过程转染效率变化的示意图,用于比较本发明实施例中的方法三与方法四的转染效率变化。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下通过实施例,并结合附图,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
实施例1
在实施例1中,对需要较长倍增时间(约为24h)的hek293细胞进行了抗生素筛选,具体而言,对在使用piggybac转座系统构建无血清悬浮培养hek293细胞稳定细胞池过程中获得的经转染的hek239细胞进行了如下四种方法的抗生素筛选:
抗生素筛选方法一:将经过转染(48h)的hek293-e细胞的细胞密度调整至0.5*106cells/ml,加嘌呤霉素至50μg/ml后进行培养。观察并记录其细胞活性变化,结果参见图1。
抗生素筛选方法二:将经过转染(48h)的hek293-e细胞的细胞密度调整至0.5*106cells/ml,加嘌呤霉素至10μg/ml后进行培养。观察并记录其细胞活性变化,结果参见图2。
抗生素筛选方法三:将经过转染(48h)的hek293-e细胞的细胞密度调整至0.5*106cells/ml,加1μg/ml嘌呤霉素,培养48~72h,此后每2~3天进行一次换液操作,并将细胞密度调整至0.5*106cells/ml,其中,进行换液时,加入的嘌呤霉素浓度为10μg/ml。观察并记录其细胞活性变化,结果参见图3。
抗生素筛选方法四:将经过转染(48h)的hek293-e细胞的细胞密度调整至0.5*106cells/ml,不加嘌呤霉素,培养48小时换液,并在此后每2~3天进行一次换液操作,且将细胞密度调整至0.5*106cells/ml,其中,进行换液时,加入的嘌呤霉素浓度为10μg/ml。观察并记录其细胞活性变化,结果参见图4。
以上方法中,获得经转染的hek239细胞的方法相同,具体参见实施例2中的相关描述。
实验结果:比较图1~图4所示出的细胞活性变化曲线图,可以看出:
1)整体而言,经过转染的hek细胞的成活率与抗生素的初始浓度密切相关,即:当所加入的抗生素的浓度过高时(例如本实施例方法一(图1)中,当加入50μg/ml嘌呤霉素后),会导致转染细胞的最终全部死亡;
2)对于经过抗生素筛选可以最终达到稳定的细胞活率的情况(例如本实施例方法二(图2)或者方法三(图3)中,即:当加入浓度为10μg/ml或者先1μg/ml后10μg/ml的嘌呤霉素后),经过转染的hek细胞的细胞活率总是在经过两次的下降期后才能够达到持续增长的成活期(参见图2和3),例如,在本实施例中,方法二的hek细胞活率下降期分别为第6天和第13天(如图2),而方法三的hek细胞活率下降期分别为第6天和第10天(如图3);
3)在抗生素筛选过程中,分次地以先低浓度(能够富集细胞的浓度)后高浓度(能够筛选细胞)的顺序加入同一种抗生素(如本实施例中的方法三),能够有效地缩短转染细胞进入持续增长的成活期所需的时间,例如,在本实施例中,经过方法三(分次地以先低后高的顺序加入同一种抗生素)筛选的hek293细胞比方法二(一次性加入抗生素)提前3天进入持续增长的成活期,从而有效地缩短研发周期;此外,在这里值得一提的是,虽然本实施例中只示例性地示出了“分次地以先低浓度后高浓度的顺序加入同一种抗生素”的实验结果,然而,本领域技术人员完全可以合理地预期,“分次地以先低浓度后高浓度的顺序加入多种抗生素”亦是可行且有效的;
4)此外,为了验证方法三中首次加入低浓度抗生素的必要性,发明人还进行了比较试验,即比较了方法四的筛选方法:先不添加抗生素,培养48小时后,再加入10μg/ml的嘌呤霉素。结果表明,细胞在筛选前期,细胞活率随时间筛选增加而下降;在筛选第5~7天,细胞活率逐渐上升;然而到了第10天细胞活率为0%,即细胞全部死亡(如图4)。
综上可见,使用方法三更适用于hek细胞池的筛选。此外,基于上述结果,在下面的实施例中,将使用方法三进行转染细胞的抗生素筛选。
实施例2
在实施例2中,利用piggybac转座系统(由蛋白表达中心实验室馈赠),并结合实施例1中的方法三,高效地建立悬浮适应培养hek293细胞稳定细胞池。其具体步骤包括:
1、重组质粒转化大肠杆菌
重组抗体a和重组gfp质粒由本公司创始人赠送。将重组质粒分别转化感受态dh5α细胞(购买于全式金),转化后菌液涂于含有抗生素的平板上,获得单菌落。挑1~2个单菌落于1ml含抗生素的lb培养基中,37℃培养3h,在培养菌液加入50%甘油,混匀后保存在-80℃。
2、hek293-e细胞培养
准备好37℃水浴,提前将excell293sfm(sigma-aldrich货号14571c)培养基预热至37℃。从液氮罐内取出冻存hek293-e细胞(由蛋白表达中心实验室馈赠),将冻存管置于37℃水浴中一边摇动一边融解,在无菌操作台内将其吸取到50mltpp管中,并加入37℃预热的10mlexcell293sfm培养液,使培养液与细胞混匀以降低dmso(fisherscientific)的浓度。室温1300rpm,离心5min,弃上清。加入10mlexcell293sfm新鲜培养液重悬细胞混匀后酒精消毒培养瓶外周后置于以设置参数为180rpm,37℃,5%co2,湿度75%的科耐摇床培养。每2天传代一次,传代密度为0.5*106cells/ml。
培养1周后可进行转染实验。
3、质粒提取
将保存的菌种从-80℃取出进行平板划线,平板放置于37℃培养箱培养过夜。从平板上挑取单菌落,接种于25mllb培养基中,于37℃摇床培养过夜。使用plasmidmidi试剂盒(qiagen)抽提质粒,步骤如下:
(1)25ml过夜振荡培养菌液,在4℃,6000×g离心15min,倒掉培养上清液;
(2)收集菌体重悬在4ml溶液p1;
(3)加入4ml溶液p2,颠倒管子4~6次,室温(15~25℃)孵育5min。
(4)加入4ml4℃预冷溶液p3,颠倒管子4~6次,冰上孵育15min。
(5)4℃,20000×g,离心30min;
(6)将上清转移至另一干净50ml管,4℃,20000×g,离心15min。离心后上清转移至另一干净的50ml管;
(7)加入4ml溶液qbt平衡qiagen-tip,通过重力流过柱子;
(8)将步骤(6)的上清倒入qiagen-tip,通过重力流过柱子;
(9)用10ml溶液qc洗qiagen-tip2次;
(10)用5ml溶液qf洗脱dna到干净的15ml管中;
(11)加入3.5ml室温异丙醇至洗脱dna中,混匀。4℃,15000×g,离心30min。小心将上清吸出来;
(12)用2ml70%乙醇洗dna沉淀,4℃,15000×g,离心10min。小心将上清吸出来;
(13)晾干5~10min,再溶解于一定体积的纯水中,-20℃保存。
4、重组质粒酶切鉴定
在无菌条件下,取2μg提取质粒dna进行酶切反应,反应体系见表1。
表1:限制性内切酶反应体系
将以上酶切反应体系放置于37℃水浴中反应30min,取5μl样品进行琼脂糖凝胶电泳实验,通过凝胶成像系统记录实验结果。
实验结果:重组gfp质粒经过限制性酶酶切后,在500bp和750bp大小之间可见到与gfp碱基对大小相符的条带,由此可见,所构建的重组质粒与预期相符(如图5)。同理,在图6中可以见到重组抗体a质粒经过单限制性酶酶切后,条带大小与预期相符。
5、gfp及抗体a稳定表达
在本步骤中,通过转染hek-293e细胞表达gfp及抗体a。转染前将细胞密度调整为0.5×106cells/ml,在培养24h后进行新鲜培养基的更换,细胞继续培养24h,此时可进行转染操作。转染时将质粒与pei(聚醚酰亚胺,polyetherimide)以质量比1:2的比例预混,质粒终浓度为1.5μg/106cells,pei终浓度为3μg/106cells。转染时将细胞密度调整至20×106cells/ml,将细胞重悬至新鲜rpmi1640培养基(购买于gibco)中。将重悬好的细胞加入预混质粒与pei混合物中,迅速混匀,放入37℃摇床孵育3h。加入新鲜excell293培养基,稀释细胞密度至1.0×106cells/ml,放于37℃摇床培养48h。
6、gfp及抗体a细胞池筛选
重组gfp及抗体a质粒转染hek293-e细胞48h后,分别将细胞密度调整至0.5*106cells/ml,加嘌呤霉素至1μg/ml,培养48~72h。此后每2天进行一次换液操作,并将细胞密度调整至0.5*106cells/ml,此时嘌呤霉素浓度加至10μg/ml。经过14天筛选,可获得阳性细胞池。筛选过程中,gfp细胞池活率变化如图3。筛选过程中,抗体a细胞池活率变化如图7。由结果可知,细胞池在筛选14天后,细胞活率均达到90%以上。
7、gfp及抗体a细胞池表达验证
gfp细胞池在筛选过程中,分别取筛选5天、7天、10天、12天的样品在贝克曼细胞流式仪上进行转染效率检测。
实验结果:
1)通过流式细胞仪检测发现,gfp细胞池在筛选5天,gfp阳性细胞率已达91%,说明gfp成功在hek细胞内表达。随着筛选时间的延长,gfp细胞阳性率依然保持在90%以上,后期甚至可达100%,结果见图8。图中显示的数据为表达gfp细胞占总细胞的百分比。百分比越高,表示细胞池中阳性细胞的占比越高。由此说明gfp在hek293e细胞中稳定表达。
2)将细胞转染效率数据进行统计,转化成直方图,结果如图9。由图可知,随着时间的延长,gfp阳性细胞率也在增加。
抗体a细胞池在筛选过程中,分别取筛选10天和14天后细胞培养液上清,进行sds-page电泳实验。
实验结果:从实验结果看,抗体a细胞池在筛选10天后(见图10),经sds-page电泳检测后可见完整形式的抗体a。在还原条件下,可见明显的重链和轻链。在经过14天的筛选后(见图11),依然清晰可见完整形式的抗体a。并且细胞池产生的抗体a纯度较高,占总蛋白的90%以上。
实施例3:
在本实施例3中,对使用了方法二的样本和使用了方法三的样本在细胞池筛选过程中(即实施例2中的步骤7)时的gfp表达情况进行了比较。
实验结果(图12)表明,在筛选第5天,使用方法三进行筛选的这组(图12中gfp-1-101/10pbase)表达gfp细胞占比(大约90%),多于使用方法二组(图12中gfp-10-101/10pbase)(小于60%);在第10天时,细胞池中的细胞绝大多数为阳性细胞,但此时,方法三筛选组的细胞活率为77%(参见图3),之后细胞活率处于上升状态,此状态的细胞可用于蛋白表达实验;与之相比,方法二筛选组,在筛选10天后,细胞活率会经过一个下降的过程(参见图2),此细胞不能用于蛋白表达过程。通过此实施例中的比较结果可以证明,使用方法三进行的筛选方法,可以使得细胞提前进入较稳定的蛋白表达期,从而提前获得可用于蛋白表达的细胞池,有效地缩短了后续工业操作的等候时间,以及节约方法开发时间,进而推进实现hek细胞表达重组蛋白药物的愿景。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!